ТОЗОС часть2. Учебнометодические разработки для самостоятельной работы студентов по курсу
 Скачать 7.02 Mb. Скачать 7.02 Mb.
|
|
Глава 2. Явление осмоса и его использование при очистке сточных вод 2.1. Осмотическое давление Ряд животных и растительных тканей (например, кожа, свиной пузырь, пергамент) обладает свойством свободно пропускать воду и задерживать растворенные в ней вещества. Такие полупроницаемые перегородки можно изготавливать и искусственным путем, например, из коллоидных пленок, целлофана. Если раствор отделен от чистого растворителя полупроницаемой перегородкой, то растворитель просачивается через нее в раствор. Это явление называется осмосом. Гидростатическое давление, которое нужно приложить к раствору, чтобы задержать осмос, называется осмотическим давлением раствора. Оно наблюдается также на границе двух растворов разной концентрации, разделенных полупроницаемой перегородкой. В этом случае растворитель течет от более разбавленного раствора к более концентрированному, т.е. в направлении уравнивания их концентраций. Можно непосредственно наблюдать осмос и измерять осмотическое давление в осмометре, простейшая форма которого изображена на рис.2.1. Принцип работы осмометра следующий. Сосуд А наполнен раствором и закрыт внизу полупроницаемой перегородкой, например свиным пузырем. Если его опустить в сосуд В с чистым растворителем (или с менее концентрированным раствором), то растворитель проникает вследствие осмоса в сосуд А и уровень жидкости в нем поднимается до тех пор, пока избыточный столб жидкости высотой h не уравновесит осмотического давления. 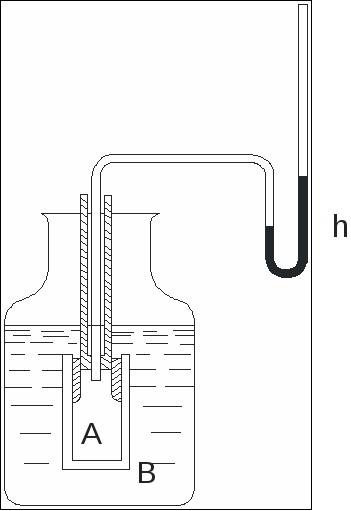 Рис.2.1. Принципиальная схема осмометра Пленки из некоторых нерастворимых солей образуют отличные полупроницаемые перегородки, особенно для водных растворов веществ с высоким молекулярным весом, как тростниковый сахар, с которым было сделано очень много измерений. Наилучшими являются пленки из железистоцианистой меди, примененные в исследованиях Пфефера. Следует подчеркнуть, что осмотическое давление возникает лишь на границе между раствором и растворителем (или раствором другой концентрации), если эта граница образована полупроницаемой перегородкой. Раствор, налитый в обыкновенный сосуд, не оказывает на его стенки никакого иного давления, кроме обычного гидростатического. Поэтому правильнее рассматривать осмотическое давление не как свойство растворенного вещества, или растворителя, или даже самого раствора, а как свойство системы из растворителя и раствора с полупроницаемой перегородкой между ними. Величина осмотического давления раствора изменяется в зависимости от концентрации второго граничащего с ним раствора. Наибольшее значение ее, получаемое на границе с чистым растворителем, и есть то, что обычно называют осмотическим давлением данного раствора. В известной степени аналогом осмометра является прибор Рамзая, примененный им в ряде исследований для измерения парциального давления водорода в газовой смеси. Изготовленный из палладиевой жести и наполненный смесью водорода и азота под атмосферным давлением, прибор Рамзая работает на следующем принципе. Палладиевая жесть, нагретая выше 300 °С, служит отличной полупроницаемой перегородкой, свободно пропускающей водород и задерживающей остальные газы. Парциальное давление водорода в нем меньше 1 атм. на величину парциального давления азота. Если прибор опустить в чистый водород с давлением 1 атм., то последний будет диффундировать в сосуд до тех пор, пока парциальное давление водорода внутри сосуда также не станет равным 1 атм. Манометр, очевидно, покажет приращение давления, равное парциальному давлению азота. Если рассматривать водород как растворитель, а азот как растворенное вещество, то будет наблюдаться довольно большое сходство с тем, что происходит в осмометре, наполненном раствором и погруженном в растворитель. Руководствуясь подобными аналогиями, Вант-Гофф и Нернст природу осмотического давления объяснили односторонними ударами растворенных частиц о полупроницаемую перегородку, вызывающими ее перемещение в сторону растворителя, если она способна двигаться, и, наоборот, течение растворителя в раствор, если она закреплена неподвижно. Такое объяснение сути осмотического давления было до недавнего времени очень распространенным. В действительности это неверно. В опыте Рамзая ничего не изменится от удаления азота из сосуда, и азот не играет никакой роли в перемещении водорода. Последнее объясняется тем, что число ударов молекул водорода о полупроницаемую стенку больше с той стороны, где его парциальное давление выше, и поэтому больше водорода переходит через эту стенку в направлении от большего давления к меньшему, чем обратно. Сходным образом осмос можно приписать тому, что концентрация молекул растворителя и число их встреч с полупроницаемой перегородкой больше в чистом растворителе, чем в растворе, и это вызывает течение первого в последний. До сих пор нет вполне достоверной и общепризнанной кинетической теории осмотического давления, что связано с отсутствием такой же теории для растворов вообще. Это не мешает тому, что осмотическое давление может быть связано точными термодинамическими зависимостями с другими измеримыми свойствами растворов, так как выводы термодинамики вообще не зависят от внутренних механизмов явлений. 2.2. Биологическая роль осмотического давления Живая клеточная протоплазма представляет собой хорошую полупроницаемую перегородку для водных растворов. На этом основаны простые и довольно точные биологические методы сравнения осмотического давления растворов, часто применявшиеся тогда, когда не ставилась задача измерения его абсолютной величины. Типичные клетки образованы из протоплазменных мешочков, наполненных водными растворами разных веществ (клеточный сок), осмотическое давление которых на границе с водой обыкновенно лежит в пределах 4÷20 атм. Эти клетки представляют собой микроскопические осмометры. Если они погружены в воду или раствор имеет меньшее осмотическое давление, чем их содержимое, то вода проникает в протоплазменный мешочек, создавая в нем гидростатическое давление, называемое тургором. Это давление сообщает живым растениям прочность и упругость их тканей. Если клетка отмирает, то протоплазма теряет свойство полупроницаемости, тургор исчезает и растение вянет. То же осмотическое давление играет роль механизма, подающего клеткам питательные растворы и воду. В высоких деревьях они этим путем поднимаются на десятки метров вверх от корней, что отвечает осмотическому давлению в несколько атмосфер. Если клетка погружена в раствор с более высоким осмотическим давлением, чем ее содержимое, то вода выходит из протоплазменного мешочка, который сморщивается. Это явление, называемое плазмолизом, легко наблюдать под микроскопом. Особенно пригодны для этого большие клетки эпидермиса листа традесканции (Tradescantia discolor). Таким путем Де-Фриз (1884) определял концентрации разных растворов, имеющих одинаковое осмотическое давление (изотоничных) с клеточным соком этих клеток (около 4,5 атм.). В исследованиях вместо растительных клеток удобно применять красные кровяные шарики, отделенные от кровяной сыворотки центрифугированием. В отличие от растительных клеток они не имеют прочной оболочки. Поэтому если они помещены в растворы с меньшим осмотическим давлением, чем их содержимое, то они увеличиваются в объеме и разрываются (гемолиз), окрашивая раствор находящимся в них гемоглобином. У высокоорганизованных животных осмотическое давление в разных органах и тканях приблизительно одинаково и устойчиво сохраняет величину около 8 атм. Изменения его быстро устраняются разными регулировочными механизмами: изменением количества и состава, выделяемых слюны, пота, мочи и количеством выдыхаемых водяных паров. Чувство жажды от соленой пищи вызывается потребностью организма восстановить введением воды нормальное осмотическое давление после того, как оно было повышено введением соли. Этим же объясняется действие больших доз солей как слабительного: в кишечнике создается повышенное осмотическое давление, что увеличивает всасывание воды, разжижающей его содержимое. Травмированные ткани промывают не чистой водой, а «физиологическим» раствором (например, 0,9 %-ным водным раствором NaCl), изотоничным с клеточными растворами. Это предохраняет клетки от набухания и разрушения. 2.3. Законы осмотического давления Измерения Пфефера и Де-Фриза легли в основу работы Ван-Гоффа, где были выведены общие закономерности для осмотического давления и связь его с другими свойствами растворов. Осмотическое давление разбавленного раствора пропорционально его концентрации. Эту закономерность подтверждают данные для водных растворов тростникового сахара, приведенные в табл. 2.1, где концентрации выражены как в моль/1000 г воды (m), так и в моль/л раствора (с). Таблица 2.1 Осмотическое давление растворов тростникового сахара в воде при 20°C
В сильно разбавленных растворах осмотическое давление Р пропорционально обоим, но в более концентрированных отношение Р/mболее постоянно, чем Р/c. Так как концентрация с (в моль/л) обратна молярному объему (в л/моль), то можно сделать вывод, что в разбавленных растворах осмотическое давление подчиняется закону Бойля: оно при данной температуре обратно пропорционально молярному объему растворенного вещества. Осмотическое давление разбавленных растворов подчиняется также закону Гей-Люссака: оно при данной концентрации пропорционально абсолютной температуре. Подтверждением этого могут служить данные табл.2.2, в которой приведены измерения с 1%-ным водным раствором тростникового сахара. Кроме того, оказалось, что осмотическое давление разбавленного раствора подчиняется также закону Авогадро: разные вещества при одинаковой температуре и одинаковой концентрации имеют одно и то же осмотическое давление. Таблица 2.2 Осмотическое давление 1 %-ного водного раствора тростникового сахара (с=0,0292)
Тем же путем, как это было сделано для газов, можно все три закона объединить одним общим уравнением состояния для осмотического давления РV=RT, совпадающим с уравнением состояния идеального газа. Вводя в него молярную концентрацию с=1/V, получаем P = RTс. (2.1) Сходство с газами этим не ограничивается. Ван-Гофф установил, что R численно равна газовой постоянной. Например, по данным табл. 2 P/T=0,002385 для c=0,0292 моль/л (1 %-ный раствор сахара). Подставив эти числа в (2.1), получаем тогда как для газов R=0,08206. Вант-Гофф объединил все эти закономерности в закон: растворенное вещество содержит в разбавленном растворе столько же молекул, сколько оно имело бы их в состоянии газа при той же температуре в том же объеме и при газовом давлении, равном осмотическому давлению раствора. Для ориентировки в величинах осмотического давления можно отметить, что раствор из 1 моль в 22,41 л при 0° имеет осмотическое давление 1 атм. Из аналогии законов осмотического давления с газовыми законами, однако, не следует делать вывод, что растворенное вещество ведет себя в растворе подобно газу и что осмотическое давление подобно газовому вызвано ударами растворенных частиц. В частности, законы осмотического давления нельзя вывести кинетическим путем так просто, как это может быть сделано для газовых законов, основываясь лишь на статическом рассмотрении беспорядочных движений молекул, поскольку растворенные молекулы движутся не в пустоте, а между тесно взаимодействующими с ними молекулами растворителя. Если растворенное вещество испытывает в растворе изменения, приводящие к изменению числа его молекул (например, ассоциацию или диссоциацию), то истинная концентрация в растворе не равна аналитической, т.е. вычисленной из навески или из анализа раствора без учета этих превращений. Поэтому применение аналитической концентрации при вычислении осмотического давления приводит к результатам, не совпадающим с измеренными. Из таких кажущихся нарушений законов осмотического давления могут быть сделаны важные заключения о превращениях, испытываемых молекулами в растворе. В частности, этим путем Аррениус пришел к теории электролитической диссоциации. Наконец, следует отметить, что при вычислении осмотического давления в растворах электролитов должно быть учтено взаимодействие электрических полей свободных ионов. 2.4. Термодинамика осмотического давления Независимо от каких-либо допущений и представлений о механизме осмотического давления и о поведении частиц в растворе термодинамическим путем может быть найдено общее и точное соотношение между осмотическим давлением раствора и понижением давления пара растворителя над ним. Пусть раствор отделен от чистого растворителя полупроницаемой перегородкой, способной перемещаться, и пусть количество раствора столь велико, что прибавление к нему или отнятие от него одного моля растворителя не изменяет заметным образом его концентрации. Можно двояким путем обратимо и изотермически перевести один моль растворителя из чистого растворителя в раствор. а) Испарим 1 моль растворителя из чистого растворителя под давлением его насыщенного пара р0, расширим его до давления р над раствором и под этим давлением сконденсируем пар в раствор. Работы испарения и конденсации, при постоянном давлении, равные RT и –RT, взаимно сокращаются, и остается работа обратимого изотермического расширения. б) Такой же перенос можно совершить передвиганием полупроницаемой перегородки в направлении от раствора к чистому растворителю до тех пор, пока через нее не пройдет раствор объемом V растворителя, отвечающий одному молю его в парообразном состоянии. Это утверждение можно принять лишь в первом приближении, т.к. из-за ассоциации или диссоциации один моль пара может быть не равен по массе одному молю в жидком состоянии. При этом приближенно получается работа за счет осмотического давления P, так как оно остается постоянным. Работа обратимого изотермического процесса не зависит от пути. Поэтому Это соотношение между осмотическим давлением и давлением пара растворителя верно для любых растворов, как идеальных, так и неидеальных, независимо от концентрации. Ему можно придать другую, тождественную, но более удобную для применения форму, заменив объем V 1 моля растворителя его плотностью ρ. Если его молекулярный вес (в парообразном состоянии) равен M0, то M0 граммов занимают объем 1000 см3, откуда плотность ρ=M0/1000 V, что с (2.2) дает С помощью этого уравнения (2.3) осмотическое давление может быть вычислено с большой точностью даже в очень концентрированных растворах, где оно достигает сотен атмосфер. Из (2.3) легко получить уравнение (2.2) Ван-Гоффа для сильно разбавленных растворов. Последние подчиняются закону Рауля, согласно которому ln p0/p = –lnN0 = –ln(1–N), где N и N0 - молярные доли растворенного вещества и растворителя. Если раствор сильно разбавлен, то достаточно положить - ln(1–N) равным N и последний, согласно (2.3), равным cM0/1000ρ. Делая эти замены в (2.3), получаем уравнение Ван-Гоффа P = RTc, где c - концентрация в моль/л. Более точные соотношения для идеальных растворов, справедливые и при более высоких концентрациях, получаются, если не делать указанных упрощений. Из (2.3) и (2.2) получаем Заменив –ln(1–N) через N, получаем для разбавленных растворов уравнение значительно более точное, чем уравнение Ван-Гоффа: Наконец, легко найти также приближенное уравнение для осмотического давления как функции от концентрации m в молях на 1000 г растворителя. В разбавленном растворе из n молей растворенного вещества и n0 молей растворителя можно положить N= n/(n+n0) равным n/n0 (так как n мало по сравнению с n0). Заметив, что n0 молей растворителя имеют объем n0V литров и массу n0V1000ρ граммов и содержат n молей растворенного вещества, получаем, что 1000 г его содержат m=1000n/1000ρn0V молей. Окончательно: n/n0=N=mVρ, что с (4) дает (4б). Что объясняет постоянство отношения P/m в разбавленных растворах. Уравнение (2.4б) менее точно, чем (2.4а), и еще менее, чем (2.4), но оно точнее, чем (2.1). Контрольные вопросы
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
