ТОЗОС часть2. Учебнометодические разработки для самостоятельной работы студентов по курсу
 Скачать 7.02 Mb. Скачать 7.02 Mb.
|
|
3.2. Электрокапиллярные явления 3.2.1. Зависимость поверхностного напряжения от заряда Ртуть на границе с водой образует выпуклый мениск из-за поверхностного натяжения. Сообщая ртути заряд, можно изменить ее поверхностное натяжение и кривизну мениска. Это явление легко наблюдать в простом приборе, называемом капиллярным электрометром (рис. 3.3). 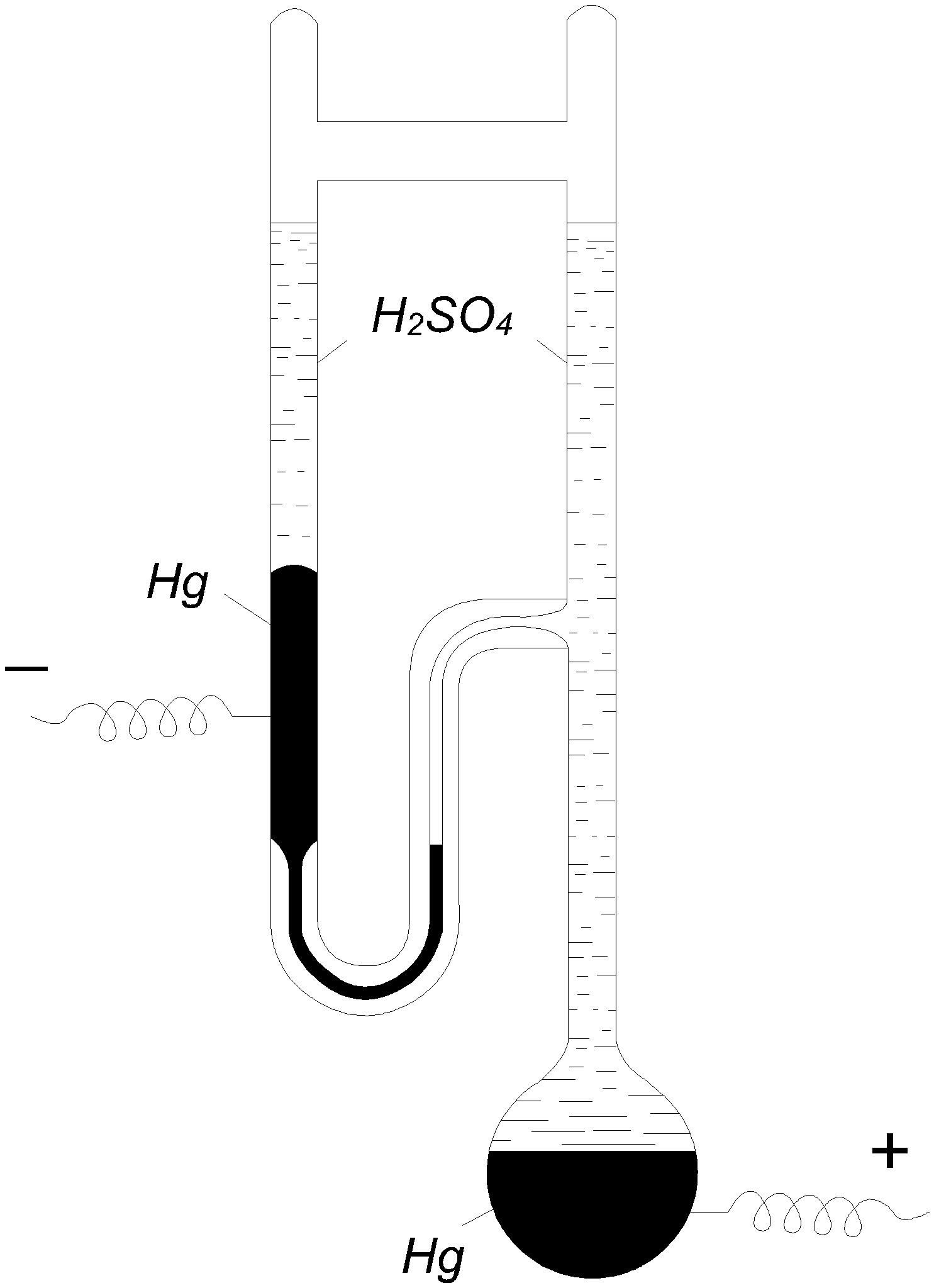 Рис. 3.3. Капиллярный электрометр В U-образную трубку и в шарик прибора наливают ртуть и вводят в них электроды. Поверх ртути наливают раствор электролита, лучше всего 2н. серную кислоту. При соединении обоих электродов с источником тока ртуть получает заряд, ее поверхностное натяжение изменяется, и мениск в капилляре U-образной трубки перемещается. Этим прибором раньше часто пользовались при измерении электродвижущих сил в качестве нулевого инструмента, но для точных измерений он не годится, так как его чувствительность не превосходит 0,5÷1 мВ. Изменение поверхностного натяжения ртути с величиной заряда связано с образованием двойного электрического слоя на ее границе с раствором. Поверхность ртути на границе с ним заряжается положительно. Этот заряд ей сообщают ионы ртути, переходящие на нее из раствора, даже если их концентрация в растворе ничтожна, так как электролитическая упругость растворения ртути очень мала. Положительные заряды на поверхности ртути друг от друга отталкиваются, что уменьшает ее поверхностное натяжение по сравнению с тем, которое она имела бы в отсутствие заряда. Если сообщить ртути извне отрицательный потенциал (катодная поляризация), то число положительных зарядов на ее поверхности уменьшится, и поверхностное натяжение растет до тех пор, пока потенциал не дойдет до величины, отвечающей компенсации всего заряда с поверхности. В этой точке поверхностное натяжение ртути достигает максимума. Дальнейшее повышение отрицательного потенциала сообщает ртути отрицательный заряд, и поверхностное натяжение ее снова начинает падать из-за взаимного отталкивания перешедших на ее поверхность отрицательных зарядов. Описанные явления, называемые электрокапиллярными, были впервые изучены Липманом (1873). Приведенное выше их объяснение было дано Нернстом (1894), подтвердившим его прибавлением к раствору возрастающих количеств CN, связывающих Hg2++ в прочный комплекс. Уменьшение концентрации последних в растворе сдвигало потенциал ртути в отрицательную сторону и вызывало те же изменения в поверхностном натяжении, как и катодная поляризация внешним током. Описанная зависимость поверхностного натяжения ртути или другого материала от приложенного поляризующего потенциала E изображается электрокапиллярной кривой, близкой к параболе. Типичный пример ее дан на рис. 3.4 (ртуть на границе с чистой водой). 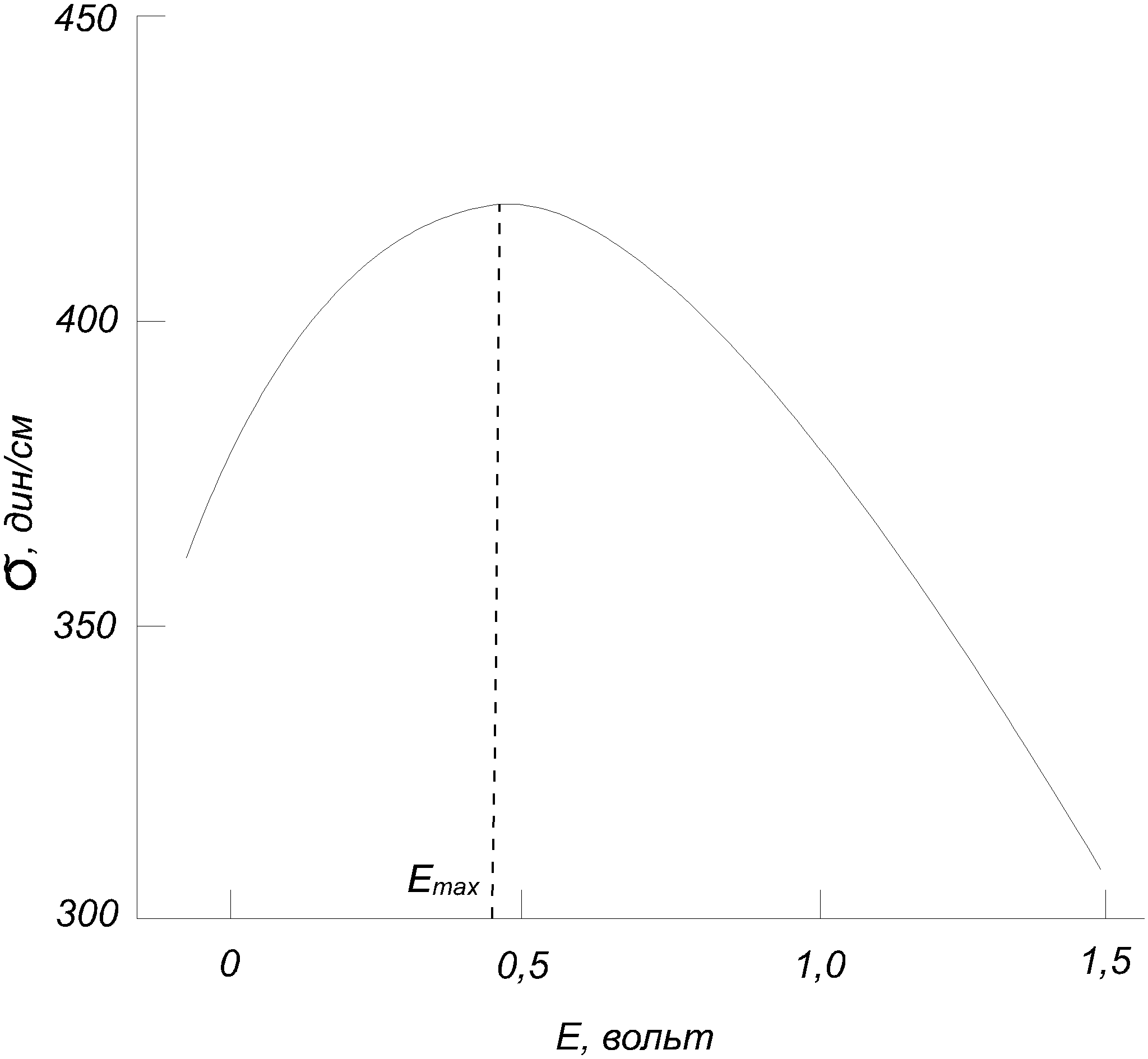 Рис. 3.4. Электрокапиллярная кривая Максимум ее отвечает максимальной величине поверхностного натяжения, когда заряд поверхности ртути равен нулю. Он наступает при некотором потенциале Emax. Изучение электрокапиллярных кривых в разных растворах велось Гюи (1903 – 1906) и рядом других авторов. Для получения электрокапиллярных кривых обычно пользуются капиллярным электрометром Липмана (рис.3.5). Прибор представляет собой наполненную ртутью суженную внизу трубку капилляра, опущенную в раствор. Его соединяют с отрицательным электродом поляризующего источника тока, положительный электрод которого соединяют с неполяризующимся вспомогательным электродом, например каломельным, опущенным в тот же раствор. Смещенный при поляризации мениск в конце капилляра возвращают в прежнее положение поднятием или опусканием резервуара со ртутью. Поверхностное натяжение измеряют высотой столба ртути, поддерживаемого мениском.  Рис. 3.5. Схема капиллярного электрометра Липмана Электрокапиллярная кривая выражается уравнением где ε - заряд, преходящий (в виде ионов) из раствора на ртуть при увеличении ее поверхности на 1 см2 при постоянном потенциале E. Уравнение (3.2) может быть выведено из уравнения адсорбции Гиббса и уравнения для зависимости электродного потенциала от концентрации ионов. В более общем виде уравнение электрокапиллярной кривой было получено А.Н. Фрумкиным (1922). Им же (1919) была выполнена проверка уравнения (3.2). Величина Таблица 3.1 Проверка уравнения электрокапиллярной кривой
3.2.2. Влияние адсорбции на электрокапиллярную кривую Прибавление к воде поверхностно-активных веществ, склонных адсорбироваться на границе с ртутью, понижает электрокапиллярную кривую и смещает ее максимум. На рис.3.6, приведены данные для ртути в 1н. NaCl с добавлением разных количеств третичного амилового спирта. 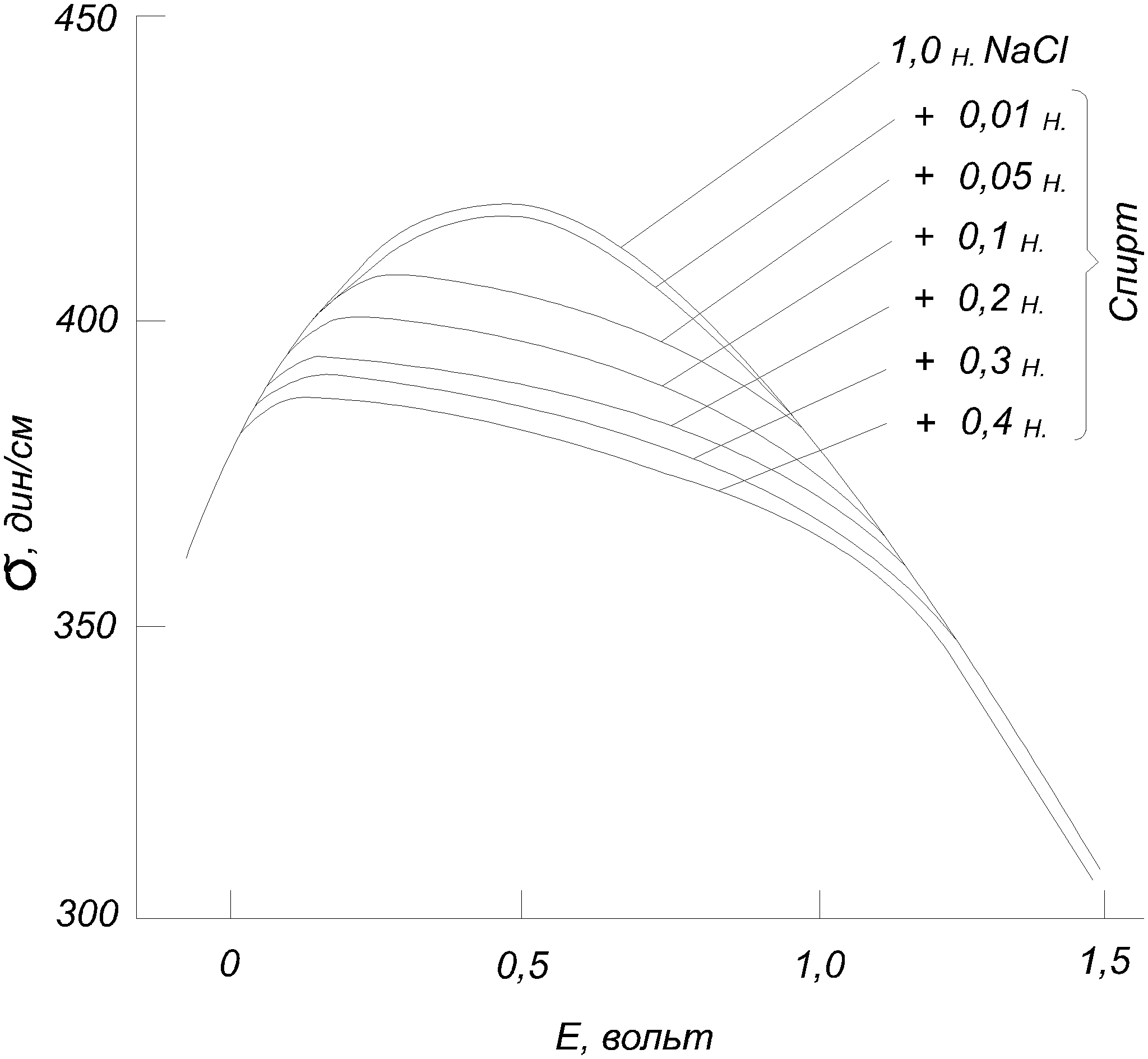 Рис. 3.6. Электрокапиллярные кривые ртути в присутствии поверхностно-активных веществ Такие изменения вызываются не только нейтральными молекулами, но и некоторыми склонными к адсорбции ионами. При этом анионы, например Cl, Br, I, HS, понижают левую ветвь электрокапиллярной кривой, где ртутная поверхность заряжена положительно, и смещают Emax в сторону более отрицательных потенциалов, а некоторые катионы, как Tl+, N(C3H7)4+, понижают правую ветвь, где ртуть заряжена отрицательно, и смещают Emax в обратную сторону. В 0,5н. KI смещение Emax достигает 0,32 В в отрицательную сторону. Все эти изменения, как показал А.Н. Фрумкин, вызываются специфической адсорбцией молекул или ионов под действием адсорбционных сил. На ионы эти силы действуют одновременно с электростатическими силами их зарядов, так что, например, положительный заряд ртутной поверхности содействует адсорбции анионов, но она возможна также на незаряженной поверхности и даже при небольшом отрицательном ее заряде. Адсорбируемые молекулы и ионы внедряются в двойной слой и изменяют его строение, что вызывает смешение Emax. Вместе с тем их адсорбция уменьшает поверхностное натяжение и понижает электрокапиллярную кривую. Адсорбируются специфически также и молекулы растворителя, что объясняет влияние его природы на электрокапиллярные кривые. Поверхностно-неактивные ионы, например Na+, K+, SO4 , H2PO4, участвуют в образовании двойных слоев лишь своими зарядами и потому мало влияют на форму и положение электрокапиллярной кривой. В растворах Na2SO4, KH2PO4 и других Emax остается таким же, как в чистой воде: на 0,48 В более отрицательным, чем потенциал нормального каломельного электрода. Природа металла сильно влияет на электрокапиллярную кривую. Например, для 33%-ной амальгамы таллия смещение Emax равно 0,45 В, а для жидкого галлия в щелочном растворе - 0,4 В в отрицательную сторону по сравнению со ртутью. Значительные разницы Emax были также установлены для жидких Pb, Sn, Cd, Tl и других веществ в расплавленных электролитах. Определение изменений поверхностного натяжения жидких металлов с зарядом можно производить не только с помощью капиллярного электрометра, но также по величине или форме вытекающих капель. Для этой же цели может служить измерение краевого угла пузырька газа или капли органической жидкости, находящихся в растворе на поверхности металла. Последний способ был применен и для получения электрокапиллярных кривых твердых тел. В точке Emax, где поверхностное натяжение максимально, вода плохо смачивает металл, но смачиваемость растет с удалением от этой точки как в сторону положительных, так и в сторону отрицательных потенциалов. Поэтому, если металлу, опущенному в щелочной раствор, сообщить сильный отрицательный заряд, то вода вытесняет жир с его поверхности. Этим можно объяснить процесс катодного обезжиривания металлов. По этой же причине в щелочном растворе, где потенциал водорода высок, а кислорода невелик, первый выделяется в виде мелких легко отрывающихся пузырьков, а второй - в виде крупных, сильно прилипающих к электроду пузырьков. Из влияния заряда на смачиваемость можно сделать ряд других практических выводов. Для определения точки Emax твердых поверхностей может служить также адсорбционный метод: при достижении этого потенциала электрод, заряд которого становится равным нулю, перестает адсорбировать неспецифические адсорбируемые ионы данного знака заряда, что может быть обнаружено аналитическим путем. Принципиально новый способ получения электрокапиллярных кривых твердых тел был дан в работах П.А. Ребиндера и Е. Венстрем, показавших, что твердость поверхности пирита и пластическая деформация олова на границе с растворами изменяются при катодной поляризации по кривой, точно повторяющей электрокапиллярную кривую. Объясняется это тем, что адсорбция одинаково влияет на поверхностное натяжение и на твердость. Эти же исследователи установили, что шлифование пирита карборундом в растворе NaCl идет на 17% быстрее при катодной поляризации до 1,6 В, отвечающей точке Emax. 3.2.3. Проблема абсолютных потенциалов Современная наука не предлагает ни экспериментальных, ни теоретических путей для определения абсолютных величин потенциалов отдельных электродов. С этим связана неразрешимость важного вопроса о распределении электродвижущей силы гальванического элемента на границах раздела фаз, в частности на границах металл-металл и металл-раствор. Рассмотрим эти вопросы в свете новых данных об электрокапиллярных явлениях. Если бы можно было построить электрод, потенциал которого заведомо равен нулю, и пренебречь при этом скачками потенциала на границах металлическими проводниками, то задача определения абсолютных потенциалов была бы решена, так как измеренная электродвижущая сила такого электрода в комбинации с любым другим электродом была бы просто равна потенциалу последнего. Долгое время считали это возможным. В точке максимума электрокапиллярной кривой заряд ртути равен нулю. По классическим представлениям теории гальванических элементов Нернста отсутствию зарядов на поверхности металлов отвечают отсутствие двойного слоя и нулевая разность потенциалов между металлом и раствором. Поэтому ртуть в максимуме электрокапиллярной кривой считали нулевым электродом, а потенциал нормального каломельного электрода относительно нее (–0,48 В) - абсолютным потенциалом. Тот же результат давали капельные электроды в виде тонкой струйки ртути, вытекающей из капилляра в раствор (образующиеся капли уносят ионы ртути из раствора до тех пор, пока их концентрация не достигнет величины, при которой они перестают переходить на постоянно возобновляющуюся у отверстия капилляра поверхность ртути, заряд которой таким образом автоматически падает до нуля). А.Н. Фрумкин доказал ошибочность всех этих предположений. Отсутствие заряда на поверхности металла вовсе не означает отсутствия двойного слоя и разности потенциала между металлом и раствором. Адсорбированные из раствора молекулы и ионы или разрядившиеся атомы образуют около поверхности металла двойные слои адсорбированного происхождения, целиком лежащие в жидкости и дающие свои собственные скачки потенциала даже тогда, когда заряд на поверхности металла отсутствует. Для образования таких двойных слоев достаточно наличия молекул самого растворителя. Таким образом, максимуму электрокапиллярной кривой, так же как и другим случаям, где металл не заряжен, вовсе не отвечает отсутствие разности потенциала между металлом и раствором. Эти положения подтверждаются экспериментальными данными, изложенными в предыдущем параграфе. Положение максимума электрокапиллярной кривой зависит от состава раствора и природы металла, а не остается постоянным. Ясно, что это было бы невозможным, если бы в Emax потенциал равнялся нулю. Один и тот же каломельный электрод имеет –0,48 В против ртути и –0,9 В против жидкого галлия, если оба металла поляризованы до максимума. Оба эти потенциала не имеют ничего общего с абсолютным потенциалом каломельного электрода, и все литературные данные относительно абсолютных потенциалов электродов лишены смысла. 3.3. Электрокинетические явления 3.3.1. Диффузионный двойной слой и электрокинетический потенциал При движении раствора электролита относительно граничащей с ней твердой поверхности и, наоборот, при движении этой поверхности относительно раствора возникают рассматриваемые ниже электрокинетические явления. Они зависят от особенностей строения двойного электрического слоя на границах раздела фаз. Гельмгольц считал, что двойной электрический слой имеет плоское строение и образован подобно очень тонкому плоскому конденсатору, из двух прилегающих друг к другу слоев противоположных зарядов, разделенных расстоянием порядка атомных диаметров, т.е. 108см (рис. 3.7,а). 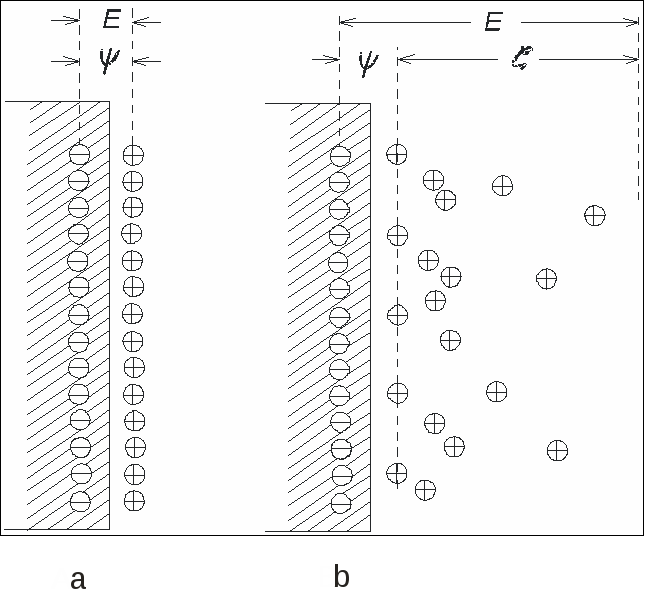 Рис. 3.7. Плоский (а) и диффузионный (б) двойной слой На самом же деле, как показал Гюи (1906), двойной слой имеет диффузное строение, так как тепловые движения растворенных ионов нарушают их плоское расположение в обкладке двойного слоя, обращенной к раствору, вследствие чего она размывается и проникает в раствор на некоторую глубину, причем плотность ее заряда быстро убывает с расстоянием от границы раздела (рис. 3.7,б). Это диффузное распределение зарядов было уже рассмотрено в виде ионных атмосфер теории электролитов Дебая и Гюккеля. В диффузном двойном слое согласно современным представлениям часть зарядов плоско прилегает к твердой поверхности, прочно с ней связана и не размывается тепловыми движениями. Это плоская часть двойного слоя, отвечающая представлениям Гельмгольца. Скачок потенциала в ней обозначим через ψ. Вторая, диффузная часть двойного слоя, отвечающая представлениям Гюи, более или менее далеко проникает в глубь жидкости и увлекается с нею при ее движении. Скачок потенциала в ней обозначим через ξ. Его называют электрокинетическим или ξ (дзета)-потенциалом. Сумма обоих E=ψ +ξ есть обыкновенный «нернстовский» потенциал, измеряемый в гальваническом элементе или вычисляемый из термодинамических данных уже известными нам способами. До тех пор, пока речь шла о таких измерениях при вычислениях, строение двойного слоя и распределение его потенциала между обоими слагаемыми не было существенным, но при движении жидкости относительно твердой поверхности и в некоторых других случаях это распределение играет решающую роль. Три типичных случая распределения скачка потенциала в двойном слое изображены на рис. 3.8. Общий скачок потенциала E во всех этих случаях один и тот же, но он различно распределен между обоими слагаемыми. Кривая в левой части рисунка отвечает плоскому двойному слою, когда ξ =0 и E=ψ; верхняя кривая в правой части рисунка относится к случаю, когда E и ξ одного знака, а нижняя - когда они различны. Потенциал ψ плоской части двойного слоя быстро падает по линейному закону плоского конденсатора, а электрокинетический потенциал диффузной части двойного слоя падает гораздо медленнее, по показательному закону, как в ионной атмосфере. 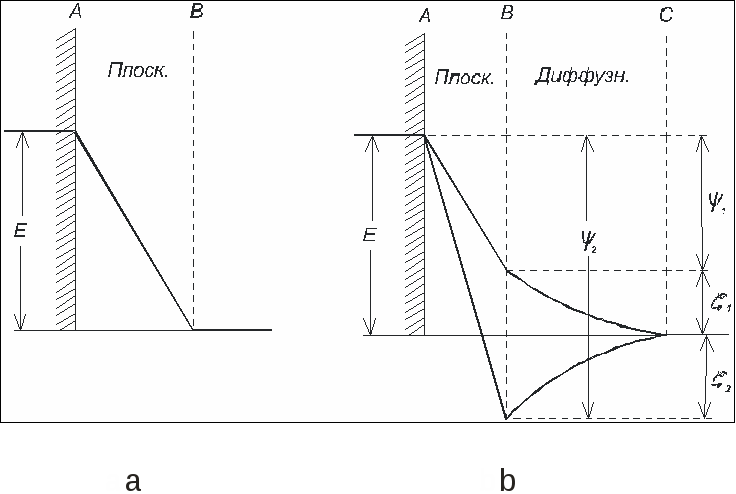 Рис. 3.8. Распределение скачка потенциалов в двойных слоях Строение двойного слоя сильно изменяется при добавлении электролитов к раствору, в особенности, если ион, знак заряда которого противоположен знаку заряда твердой поверхности, имеет высокую валентность. Еще сильнее влияние поверхностно-активных веществ, адсорбирующихся на твердой поверхности. Они располагаются на ней тонким слоем толщиной в одну или несколько молекул. Поэтому очень небольшие количества адсорбируемых веществ достаточны для того, чтобы строение двойного слоя и величина ξ-потенциала сильно изменились. Адсорбция вызывается специфическими адсорбционными силами. Адсорбированные вещества сосредоточиваются в плоской части двойного слоя. Роль адсорбции в строении двойного слоя была детально изучена в ряде новых работ А.Н. Фрумкина с сотрудниками, применившими разные методы. Эти работы легли в основу современных представлений о двойном слое и о природе электрических явлений на границах фаз. При движении жидкости относительно твердой поверхности плоская часть двойного слоя остается с ней связанной, тогда как диффузная часть увлекается жидкостью. Поэтому электрокинетические явления определяются не общим скачком потенциала E, а электрокинетическим потенциалом ξ. Это объясняет сильное влияние на них электролитов, особенно адсорбируемых веществ. В работе Фрейндлиха и Рона, изменявших одновременно E и ξ, было впервые показано, что обе величины не тождественны и даже могут иметь разные знаки. Согласно теории, плотность заряда в плоской части двойного слоя пропорциональна концентрация электролита, если последняя не очень велика. В диффузной части двойного слоя, как следует из теории Дебая и Гюккеля, плотность заряда пропорциональна корню квадратному из концентрации. Таким образом, в сильно разбавленных растворах большая часть заряда двойного слоя сосредоточена в его диффузной части, а в более концентрированных - в плоской. Иначе говоря, с увеличением концентрации ионов они все ближе подтягиваются к твердой поверхности, диффузная часть двойного слоя становится меньше, и ξ-потенциал падает. В достаточно концентрированных растворах он близок к нулю, и электрокинетические явления становятся малозаметными. 3.3.2. Емкость двойного слоя Подобно конденсатору двойной слой имеет электрическую емкость, зависящую от его строения. Ее можно в принципе, измерять так же, как и обыкновенный конденсатор: по количеству электричества, необходимому для увеличения потенциала на единицу. Другой способ основан на получении электрокапиллярной кривой, из кривизны которой может быть найдена емкость С Изучение емкости двойных слоев, особенно в комбинации с адсорбционными измерениями, дает детальные сведения об их строении. При уменьшении степени диффузности емкость растет, так как заряды сближаются. В согласии с этим А.Н. Фрумкин, М.Н. Проскурин и М.И. Ворсина (1939) установили, что повышение концентрации раствора KCl и других электролитов (вызывающее, как было указано, уменьшение диффузии) увеличивает емкость двойного слоя ртути. При данной концентрации кривая зависимости емкости от поляризующего потенциала имеет минимум точно при том потенциале, который отвечает максимуму электрокапиллярной кривой. В этой точке поверхность ртути не заряжена и поэтому двойной слой наиболее диффузен, а емкость наименьшая. Минимум исчезает в 0,1н. и более концентрированных растворах KCl, где двойной слой становится плоским. Эти исследования позволили получить экспериментальные доказательства диффузного строения двойных слоев. Из измеренных емкостей были вычислены ξ-потенциалы в удовлетворительном согласии с тем, что предлагает теория. Другой, не зависящий от часто противоречивых электрокинетических измерений способ вычисления ξ-потенциала основан на измерении перенапряжения η в функции от концентрации электролитов. При постоянной плотности тока и постоянной концентрации теория дает η = const - ξ. Величины ξ, вычисленные из измеренных η, хорошо согласуются с результатами предыдущего метода и с теорией. Величину const можно найти из предельного η при больших добавках электролитов, когда ξ→0. 3.3.3. Электроосмос В электрическом поле возникает движение жидкости относительно твердой поверхности. Это явление называется электроосмосом (рис. 3.9). 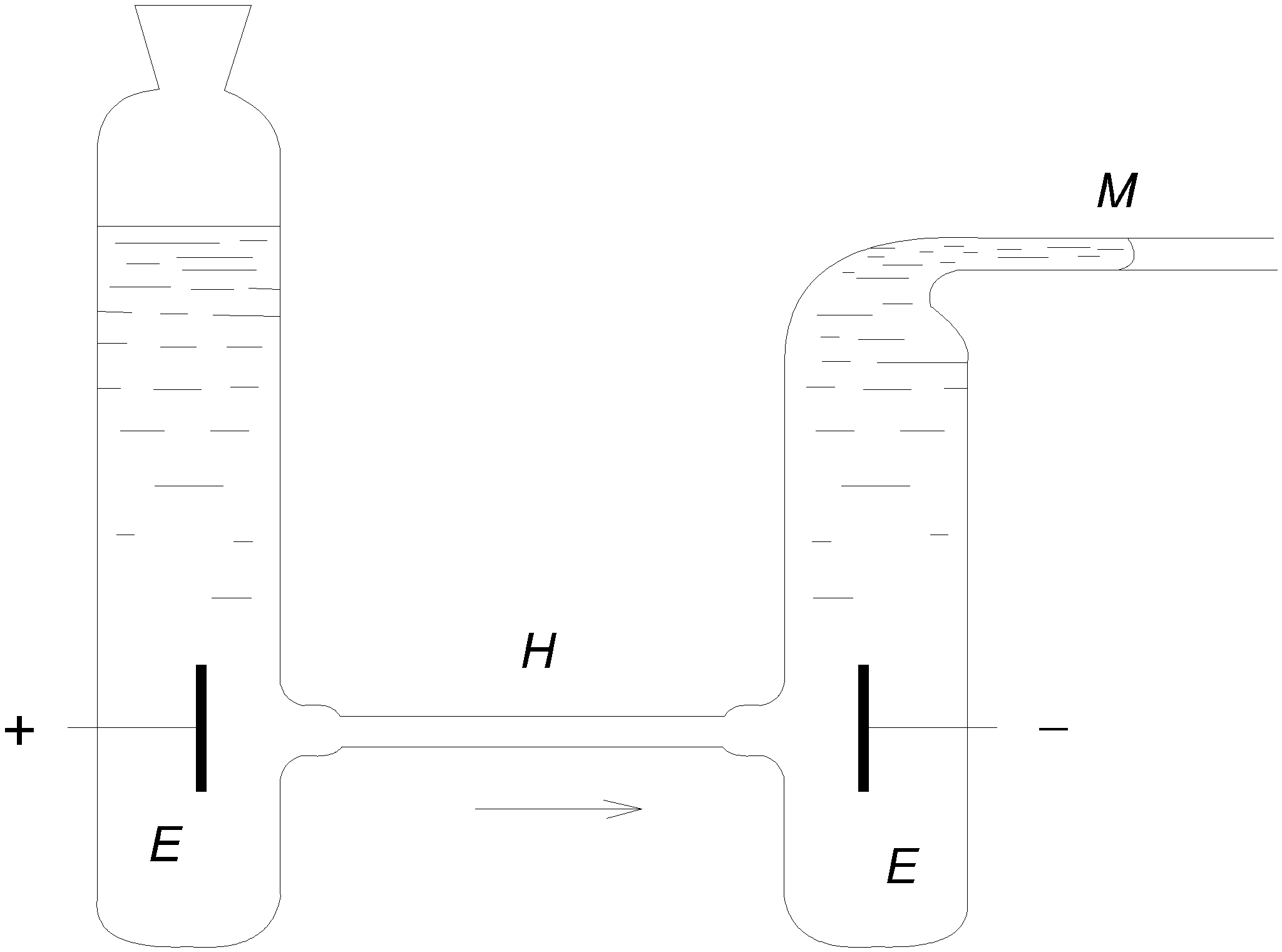 Рис. 3.9. Схема измерения электроосмоса Капилляр К соединяет два сосуда, наполненные жидкостью, с введенными в них электродами Е, соединенными с источниками тока. Скорость течения жидкости через капилляр может быть измерена по перемещению ее мениска в трубке М. Капилляр может быть заменен пористой перегородкой. Направление течения зависит от материала твердой поверхности и от состава жидкости. Например, вода в стеклянном капилляре заряжается относительно его стенок положительно, потому и течет в направлении к отрицательному электроду. Электроосмос, так же как и рассматриваемый ниже электрофорез, был открыт в России Ф.Ф. Рейсом (1809). Его теория была разработана Гельмгольцом (1879) и дополнена Смолуховским (1903), Перреном (1904) и др. Это явление обусловлено образованием двойного электрического слоя на границе твердого тела с жидкостью. В случае диэлектрика он возникает из-за неодинаковой адсорбции ионов обоих знаков. Благодаря этому двойному слою твердая поверхность и прилегающая к ней тонкая пленка жидкости с плоской частью двойного слоя заряжаются одним знаком, а остальной объем жидкости, содержащий диффузную часть двойного слоя, - другим знаком, что вызывает его движение в электрическом поле. Таки образом, это явление существенно зависит от знака и величины электрокинетического потенциала ξ. Обозначив приложенную электродвижущую силу Е, сечение капилляра (или сумму сечений пор) q, расстояние между электродами l, диэлектрическую постоянную жидкости D и ее вязкость равна η, можно согласно теории записать скорость течения жидкости: Уравнение (3.3) получается из условия равенства силы трения и приложенной электродвижущей силы. Оно не совсем точно из-за изменения электропроводности жидкости в капилляре вследствие адсорбции ионов его стенкам и переноса их движущейся жидкостью. Так как в (3.3) все величины, кроме ξ, известны или могут быть изменены, то из наблюдений электроосмоса можно найти величину электрокинетического потенциала большей частью в удовлетворительном согласии с величиной, получаемой из других рассматриваемых ниже электрокинетических явлений. Она обычно не превышает 0,05÷0,1 В. Поэтому для получения заметных скоростей электроосмоса приложенное поле Е должно иметь большое напряжение порядка десятков и сотен В. Например, при градиенте потенциала в 1 В/см и ξ=0,05 В скорость u равна лишь 1·10-3 см/сек при q=0,01 см2. Элктроосмос имеет ряд технических применений. Например, помещая водные гали (глину, силикагель, клей и др.) между сетчатыми электродами, можно их обезвоживать. Дубление кожи сильно ускоряется электроосмотическим прониканием дубящего раствора в ее поры, если ее поместить в этом растворе между двумя электродами. Электроосмосом воды через ряд пористых диафрагм можно ее очистить от большинства взвешенных и растворенных примесей; этот способ очистки мало уступает дистилляции. Большинство твердых поверхностей (стекло, глина, асбест, благородные металлы, шерсть и др.) заряжается отрицательно относительно воды. Неблагородные металлы, ряд окислов, сульфидов и других неорганических соединений, наоборот, заряжаются положительно. Прибавление электролитов, особенно поливалентных, сильно влияет на величину ξ-потенциала, вплоть до перемены его знака, что сопровождается переменой направления электроосмоса. Пример довольно сложных соотношений между ξ-потенциалом, концентрацией и валентностью ионов показан на рис.3.10, относящийся к границе воды со стеклом. 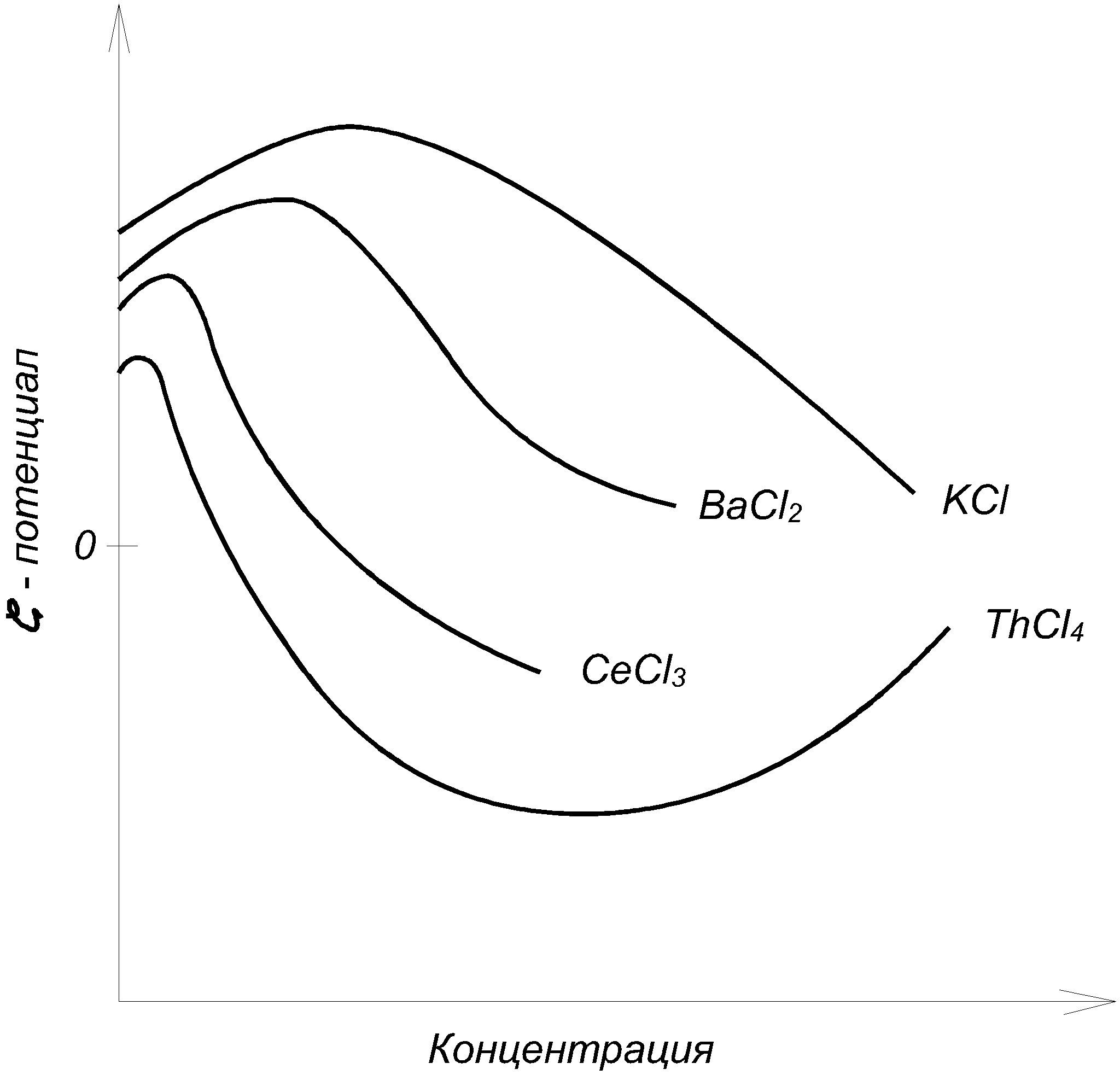 Рис.3.10. Зависимость ξ -потенциала то концентрации электролита Прибавление 0,2 мг/л изменяет его направление потенциала на обратное. Как уже указывалось, в более концентрированных растворах ξ-потенциал приближается к нулю, и электроосмос прекращается. Еще большее влияние, чем электролиты, оказывают сильно поверхностно-активные вещества, хорошо адсорбируемые стенкой Часто незначительные их количества оказывают огромное влияние на величину ξ-потенциала и на скорость элетроосмоса, а также на другие электрокинетические явления. 3.3.4. Потенциал течения Данное явление обратно электроосмосу: при продавливании жидкости через капилляр или пористую перегородку прибора, изображенную на рис.3.9, между электродами возникает разность потенциалов, для которой теория дает где P - гидростатическое давление, χ - удельная электропроводность жидкости, а остальные значения те же, что в (3.3). Потенциалы течения чаще всего применяют для нахождения величин электрокинетического потенциала ξ. В частности, этим путем было выполнено уже упоминавшееся исследование Фрейндлиха и Рона, в котором было экспериментально доказано, что ξ-потенциал не тождествен с общему скачку потенциала во всем двойном слое. 3.3.5. Электрофорез Если твердая фаза образована частицами, взвешенными в жидкости, то в электрическом поле возникает явление, обратное электроосмосу: взвешенные твердые частицы вместе с прилегающими к ним тонкими пленками жидкости движутся от одного электрода к другому в неподвижной жидкости или же движущейся в обратном направлении, но гораздо медленнее. Такое движение называют электрофорезом или катафорезом. Его можно наблюдать в приборах, похожих на те, которые применяют для измерения чисел переноса ионов по Гитторфу, например, в U-образной трубке с электродами на обоих ее концах. Скорость электрофореза подсчитывается по тому же уравнению, что и скорость электроосмоса: Примечательно, что в это уравнение не входят ни заряд, ни величина частиц. Действительно опыт подтверждает, что частицы разных размеров и зарядов движутся почти одинаково быстро. Скорость электрофореза так же зависит от концентрации электролита, валентности его ионов и присутствия поверхностно-активных веществ, как скорость электроосмоса. Электрофоретические измерения широко применяют при изучении коллоидов, так как они дат сведения о величинах ξ-потенциалов на поверхности коллоидных частиц, от которых зависит стабильность коллоидных растворов. Заряд коллоидной частицы в диспергирующей среде зависит как от ее строения, так и от присутствия электролитов и поверхностно-активных веществ в растворе. Они могут изменить величину ξ-потенциала, а следовательно, скорость и направление электрофореза. При ξ=0 последний прекращается. Это изоэлектрическая точка, около которой легче всего происходит коагуляция коллоидных частиц в более крупные агрегаты и выпадение коллоида из раствора. Чем выше валентность иона, вводимого в раствор, тем меньшая его концентрация нужна для достижения изоэлектрической точки и коагуляции коллоида (правило Гарди-Шульца, 1882). Дальнейшее увеличение концентрации электролита может изменить знак ξ-потенциала на обратный. Электрофорез получил ряд технических применений, например, для выделения торфа, каучука из суспензии или эмульсии, в методе электрофоретического анализа сложных, главным образом белковых смесей. Он основан на том, что при электрофорезе каждый компонент коллоидного раствора образует свою независимо движущуюся границу раздела. С помощью специальных оптических приспособлений можно фотографировать эти границы и находить количественные соотношения между составными частями смеси. Можно легко показать связь между уравнением (3.3) для скорости электрофореза крупных коллоидных частиц и уравнением для скорости движения ионов, полученным из закона Стокса. Различие между ионом и более крупной коллоидной частицей заключается в том, что около первого отсутствует плоская часть двойного слоя: ионная атмосфера вокруг иона целиком диффузна. Поэтому скачок потенциала между ионом и раствором отвечает величине ξ. Если ион имеет заряд ze и радиус r, то по формуле для потенциала шара что с (3.3) дает Так как, очевидно, действующая на заряд иона электрическая сила К= zе·Е/l (произведение из заряда на градиент потенциала приложенного поля), то это выражение совпадает с формулой Стокса. 3.3.6. Потенциалы осаждения Если заряженные частицы движутся в жидкости, то в последней в направлении этого движения возникает электрическое поле. Это движение можно, например, наблюдать при оседании взвешенного осадка в жидкости, наполняющей вертикальную трубку, если вверх и вниз ее ввести электроды. Возникающая между последними разность потенциалов называется потенциалом осаждения. Это явление, открытое Дорном (1878), обратно электрофорезу и подчиняется тем же законам. Оно не нашло еще интересных применений. 3.4. Электрохимические методы очистки сточных вод Для очистки сточных вод от различных растворимых и диспергированных примесей применяют процессы анодного окисления, катодного восстановления, электрокоагуляции, электрофлотации и электродиализа. Все эти процессы протекают на электродах при пропускании через воду постоянного электрического тока. Электрохимические методы позволяют извлекать из сточных вод ценные продукты по относительно простой автоматизированной технологической схеме очистки без использования химических реагентов. Эффективность электрохимических методов оценивается рядом факторов: плотностью тока, напряжением, коэффициентом полезного использования напряжения, выходом по току, выходом по энергии. Напряжение в электролизе складывается из разности электродных потенциалов и падением напряжения в растворе: где Падение напряжения в электролите (сточной воде) при отсутствии пузырьков определяется по закону Ома: где i - плотность тока в сточной воде, А/см2; р - удельное сопротивление, Ом·см; При выделении газовых пузырьков, вследствие удлинения потока между электродами Выход по току - это отношение теоретически необходимого количества (Закон Фарадея) к практически затраченному , которое выражают в долях единицы или в процентах. 3.4.1. Анодное окисление и катодное восстановление На первый взгляд этот процесс тривиален. На положительном электроде - аноде ионы отдают электроны, т.е. протекает реакция электрохимического окисления, на отрицательном электроде катода происходит присоединение электронов, т.е. протекают реакции восстановления. Эти процессы используются для очистки сточных вод от растворимых примесей - роданидов, цианидов, аминов, спиртов, альдегидов, нитросоединений, азотокрасителей, сульфидов, меркиптанов и др. В результате электрохимического окисления вещества, находящиеся в сточных водах, полностью распадаются с образованием СО2, NH3 и воды, т.е. более простых нетоксичных вещества, которые удаляются более простыми методами. В качестве анода используют различные нерастворимые электролитические материалы - графит, магнетит, диоксиды свинца, марганца, рутения, которые наносят на катоды, изготавливаемые из молибдена, сплава вольфрама с железом, никелем, из графита нержавеющей стали и др. материалов покрытых молибденом, вольфрамом или их сплавами. Процесс, как правило, проводят в электролизерах с диафрагмой или без нее. Кроме основных процессов электроокисления и восстановления одновременно может протекать электрофлотация, электрофорез, электрокоагуляция. Сточные воды, содержащие цианиды - это продукты черной, цветной металлургии и химической промышленности. В состав вод простых цианидов (KCN, NaCN) входят комплексные цианиды (Zn, Cu, Fe). рH таких растворов равен 8÷12. Анодное окисление протекает по схеме: Окисление может быть проведено и с образованием азота: Обычно дня повышения электропроводности сточных вод и снижения энергии к водам добавляют Получаем Роданиды разрушаются по схеме. Сульфид-ионы при рН= 7 окисляются до сульфатов. При РН<7 может образоваться элементарная сера. Окисление фенолов в присутствии хлоридов в сточной воде протекает по реакции Катодное восстановление применяют для удаления из сточных вод ионов металлов с получением осадков для перевода загрязняющего компонента в менее токсичные соединения или в легко выводимую из воды форму (осадок). Его можно использовать для очистки сточных вод от ионов тяжелых металлов Pb2+, Sn2+, Ng2+, Cu2+, As3+, Cr6+. Катодное восстановление металлов происходит по схеме: При этом металлы, осаждающиеся на катоде, могут быть рекуперированы. Например, при восстановлении соединений Сг была достигнуты высокая степень очистки - концентрация снижалась с 1000 до 1 мг/л. При электролизе сточных вод, содержащих Н2СrO7 оптимальное значение pН=2, а плотность тока 0,2÷2 а/дм2. Реакция восстановления протекает следующим образом: Очистку сточных вод от ионов Hg2+, Pb2+, Cd2+, Cu2+ проводят на катодах, состоящих из смеси угольного и сернистого порошков в соотношении C:S от 80:20 до 20:80 при pН < 7. Примером реакции, обеспечивающей удаление загрязнения в газовую фазу, является очистка от нитратов аммония: восстановление нитрата аммония на графитовом электроде, который разлагается при нагревании до элементарного азота: Повышенная токсичность органических веществ, как правило, связана с наличием в молекуле атомов галогенов, альдегидной, аминной, нитратной, нитритной групп. Таким образом, продукты восстановления (например, альдегидов и кетонов) - спирты и углеводороды будут менее токсичны. Потеря атома галогена приводит к тому же результату: Рассмотрим процесс анодного растворения, на примере железа. В щелочной среде реакция идет в две стадии: 1) 2) На первой стадии, включающей адсорбцию гидроксида на железном электроде и потерю первого электрона, образуется промежуточное кислородосодержащее соединение одновалентного железа. На второй стадии реакция протекает по двум возможным направлениям и завершается образованием двух- или трехвалентного железа. Общая скорость процесса анодного растворения лимитируется второй стадией (рис.3.11). 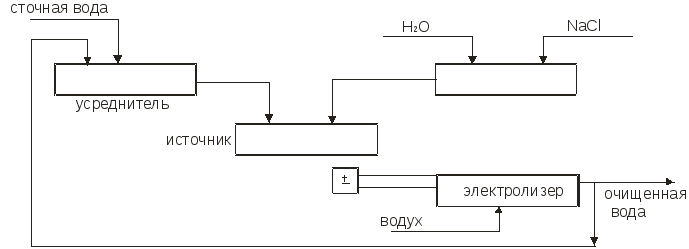 Рис. 3.11. Схема установки химической очистки воды Рис. 3.11. Схема установки химической очистки водыВ кислой среде протекает следующая реакция: Лимитирующей стадией является предпоследняя реакция. Скорость электрохимического растворения металла определяется величиной тока, которая зависит от приложенного напряжения (потенциала анода) 3.4.2. Электрокоагуляция При прохождении сточной воды через межэлектродное пространство электролизера происходит электролиз воды, поляризация частиц, электрофорез, окислительно-восстановительные процессы, взаимодействие продуктов электролиза друг с другом. При использовании нерастворимых электродов коагуляция может происходить в результате электрофоретических явлений и разряда заряженных частиц на электродах, образованных в растворах веществ (Сl, О2), которые разрушают сольватные соли на поверхности частиц. Такой способ применяется для очистки сточных вод при невысоком содержании коллоидных частиц и низкой устойчивости загрязнений. Для очистки промышленных сточных вод содержащих высокоустойчивые загрязнения проводят электролиз с использованием растворимых стальных или алюминиевых анодов. Под действием тока происходит растворение металла в результате чего в воду переходят катионы железа или алюминия, которые, встречаясь с гидроксидными группами, образуют гидроксиды металлов в виде хлопьев - наступает интенсивная коагуляция. На процесс электрокоагуляции оказывает влияние материал электродов, расстояние между ними, скорость движения сточной воды между электродами, ее температура и состав, плотность тока. Достоинство метода коагуляции -компактность установок, простота управления, отсутствие потребности в реагентах, малая чувствительность к изменениям условий проведения процесса очистки.(температура, pН среды, присутствие токсичных веществ) - получение материалов с хорошими структурно-механическими свойствами. Недостаток метода - повышенный расход металла и электроэнергии. Элекрокоагуляция находит применение в пищевой, химической, целлюлозно-бумажной промышленности. 3.4.3. Электрофлотация В процессе электрофлотации очистка сточных вод происходит при помощи пузырьков газа, образующихся при электролизе воды. На аноде возникают пузырьки кислорода, а на катоде - водорода. Поднимаясь в сточной воде, эти пузырьки флотируют взвешенные частицы. При использовании растворимых электродов происходит образование хлопьев коагулянтов и пузырьков газа, что способствует более эффективной флотации. Основную роль при электрофлотации играют пузырьки, образующиеся на катоде. Размер пузырьков значительно меньше, чем при других методах флотации. Он зависит от краевого угла смачивания и кривизны поверхности электрода. Диаметр пузырьков меняется от 20 до 100 мкм. Мелкие пузырьки водорода обладают большой растворимостью, чем крупные. Как правило, из пересыщенных растворов мельчайшие пузырьки выделяются на поверхности частичек загрязнений и тем самым способствуют эффекту флотации. Для получения пузырьков требуемого размера необходим правильный подбор материала, диаметр проволоки катода и плотности тока. Оптимальное значение плотности тока 200-260 а/м2, газосодержание около 0,1%. 3.4.4. Электродиализ Процесс очистки сточных вод электродиализом основан на разделении ионизированных веществ под воздействием электродвижущей силы, создаваемой в растворе по обе стороны мембран. Процесс проводят в электродиализаторах. В среднюю камеру заливают раствор, а в боковые, где расположены электроды, - чистую воду. Анионы током переносятся в анодное пространство, на аноде выделяется кислород и образуется кислота. Одновременно катионы переносятся в катодное пространство, на катоде выделяется водород и образуется щелочь. Контрольные вопросы
|
