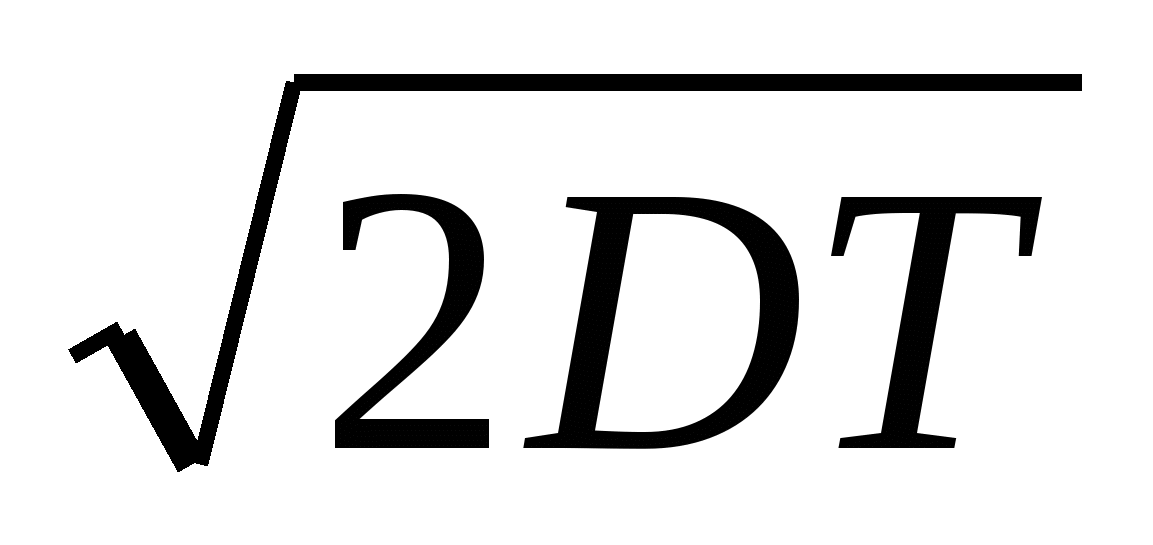 . .
ΔХ = 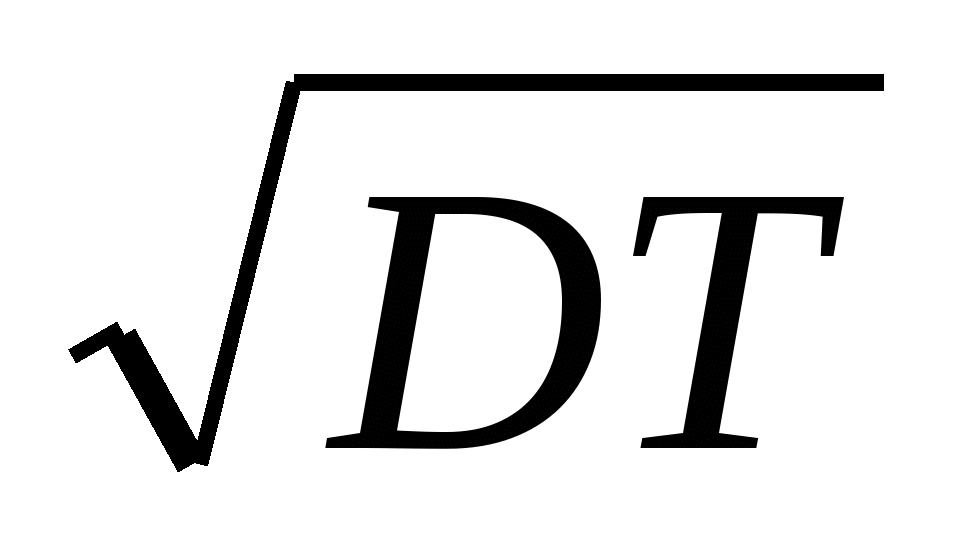 . .
ΔХ = 2DT.
ΔХ = – 2DT.
ΔХ =  . .
Мелкие частицы могут сталкиваться друг с другом за счет:
сил трения.
броуновского движения.
диффузионного механизма.
гравитационных сил.
сил взаимного притяжения.
Энергия взаимодействия под действием сил Ван-дер-Ваальса определяется некой формулой, в которой один из членов определяется как (P12d2 + P22d1) и называется:
ориентационное слагаемое.
индукционное слагаемое.
дисперсионное слагаемое.
дипольный момент молекулы.
поляризуемость.
Характерной особенностью сил Ван-дер-Ваальса является то, что они:
самые прочные.
самые слабые.
не насыщаются.
насыщаются.
среди ответов нет правильного.
Закон изменения сил Ван-дер-Ваальса для двух шаров одинаковой формы имеет вид:
U = - AR/12H2.
U = AR/12H2.
U = - AR*12H2.
U = - AR/10H2.
U = - AR/12H.
Энергия взаимодействия частиц конечного размера примерно вдвое меньше энергии взаимодействия двух бесконечных полупространств, если:
δ = 0.
δ = H.
δ = ∞.
H = 0.
среди ответов нет правильного.
На границе раздела твердое тело - жидкость возникает:
двойной электрический слой.
гидростатические силы.
разность потенциалов.
поверхностное натяжение.
силы взаимного притяжения.
Главной особенностью электростатических сил является то, что:
радиус их действия является функцией концентрации электролита.
они самые прочные.
они самые слабые.
они возникают за счет двойного электрического слоя.
вопрос некорректен.
Сила коагулирующего действия электролитов в большей мере определяется:
размером частиц.
видом вспомогательных веществ.
валентностью ионов.
пористостью.
среди ответов нет правильного.
Коагуляционный механизм наблюдается при:
добавлении вспомогательных веществ.
сгущении суспензии.
добавлении электролита.
применении высокомолекулярных полимерных веществ.
искусственной гидрофобизации.
Флокуляция наблюдается при:
добавлении вспомогательных веществ.
сгущении суспензии.
добавлении электролита.
применении высокомолекулярных полимерных веществ.
искусственной гидрофобизации.
Мостиковый механизм наблюдается при:
добавлении вспомогательных веществ.
сгущении суспензии.
добавлении электролита.
применении высокомолекулярных полимерных веществ.
искусственной гидрофобизации.
Знаком и величиной заряда поверхности минеральных частиц определяется:
величина адсорбции молекул.
величина абсорбции молекул.
величина сил Ван-дер-Ваальса.
производительность.
вопрос некорректен.
Селективная флокуляция наблюдается:
в условиях селективной адсорбции.
в условиях селективной абсорбции.
при нормальных условиях.
при добавлении вспомогательных веществ.
среди ответов нет правильного.
Под процессом поглощения одного или нескольких компонентов из газовой смеси или раствора твердым веществом, понимают процесс:
абсорбции.
фильтрации.
коагуляции.
адсорбции.
осаждения.
При небольших концентрациях поглощаемого вещества в исходной смеси применяется процесс:
сгущения.
фильтрации.
коагуляции.
адсорбции.
осаждения.
Пористые твердые вещества применяют в качестве:
вспомогательных веществ.
адсорбентов.
абсорбентов.
флокулянтов.
электролитов.
Для сушки газа применяются:
иониты.
цеолиты.
силикагели.
активные угли.
фильтровальные перегородки.
Процесс извлечения адсорбированного вещества из твердого поглотителя называется процессом:
сгущения.
фильтрации.
коагуляции.
адсорбции.
десорбции.
Основными методами десорбции являются:
вытеснение.
испарение.
а и б.
сгущение.
испарение.
Метод разделения материалов, основанный на различии физико-химических свойств поверхности материалов, называется процесс:
флотации.
фильтрации.
коагуляции.
адсорбции.
осаждения.
Флотируемость различных материалов зависит от:
способности поверхности материалов смачиваться водой.
размера частиц.
вида вспомогательных веществ.
валентности ионов.
пористости.
На молекулу внутри жидкости действуют силы:
взаимного притяжения.
Ван-дер-Ваальса.
гидростатические.
взаимного отталкивания.
вопрос некорректен.
Уравнение адсорбции Гиббса имеет вид:
Г = - (dσ/dC)/(C/RT).
Г = (dσ/dC)*(C/RT).
Г = - (dσ/dC)/(CRT).
Г = (dσdC)/(C/RT).
Г = - (σ/C)*(C/RT).
Уравнение адсорбции Ленгмюра имеет вид:
Г = Г∞ = bC/(1+bC).
Г = Г0 = bC/(1+bC).
Г = Г∞ = bC*(1+bC).
Г = Г∞ = bC/(1-bC).
Г =1/ Г∞ = bC/(1+bC).
Уравнение адсорбции Фрейндлиха в логарифмической форме имеет вид:
lgГ = lgq + (1/n)lgC.
lgГ = lgk + (1/n)lgC.
lgГ = lgk - (1/n)lgC.
lgГ = lgq - (1/n)lgC.
lgГ = - lgk - (1/n)lgC.
Отставание периметра смачивания от изменения краевого угла называется:
гистерезисом смачивания.
флотацией.
флокуляцией.
коагуляцией.
среди ответов нет правильного.
Реагенты-регуляторы применяются для:
изменения флотируемости материалов.
увеличении скорости процесса флотации.
изменения щелочности.
устранения гистерезиса смачиваемости.
повышения устойчивости воздушных пузырьков.
Регуляторы среды применятся для:
изменения флотируемости материалов.
увеличения скорости процесса флотации.
изменения щелочности.
устранения гистерезиса смачиваемости.
повышения устойчивости воздушных пузырьков.
Регуляторы-пенообразователи применяются для:
изменения флотируемости материалов.
увеличения скорости процесса флотации.
изменения щелочности.
устранения гистерезиса смачиваемости.
повышения устойчивости воздушных пузырьков.
Процессом извлечения одного или нескольких компонентов из растворов или твердых тел с помощью избирательных растворителей называется процесс:
экстракции.
фильтрации.
коагуляции.
адсорбции.
осаждения.
Коэффициент распределения определяется выражением:
m = y* - x.
m = y*+ x.
m = y*/x.
m = -y*/x.
m = y**x.
Процессы массо- и теплообмена одновременно протекают при:
сушке.
экстракции.
фильтрации.
коагуляции.
адсорбции.
Практически нейтральными считаются воды, имеющие:
pH < 6.5.
pH = 6.5 ÷ 7.
pH = 7 ÷ 10.
pH = 6.5 ÷ 8.5.
pH = 6.5 ÷ 10.
Если на предприятии имеются кислые и щелочные воды, не загрязненные другими компонентами, то применяется метод:
нейтрализации смешиванием.
нейтрализации добавления реагентов.
нейтрализации кислыми газами.
окисления и восстановления.
среди ответов нет правильного.
Для нейтрализации каких сточных вод используют гидроксид кальция (известковое молоко):
щелочных.
кислых.
нейтральных.
радиоактивных.
вопрос некорректен.
Количество кислого газа, необходимого для нейтрализации, определяется по формуле:
M = χ·β·F·Δc.
M = χ·β·F·c.
M = χ·β·F/Δc.
M = - χ·β·F·Δc.
M = χ·F·Δc.
При введении Cl2 в воду образуется:
хлорноватистая кислота.
соляная кислота.
оксид хлора.
а и б одновременно.
реакция не пойдет.
Как называется сумма Cl2 + HOCl + OCl-
известковое молоко.
доломит.
свободный активный хлор.
магнезит.
сжиженный хлор.
Потребность реагентов Xi (кг/сутки) для окисления рассчитывается по формуле:
Xi = XClQ/a.
Xi = XNaQn/a.
Xi = XClQn/a.
Xi = XClQna.
Xi = - XClQn/a.
При очистке воды от железа используют:
известковое молоко.
доломит.
свободный активный хлор.
кислород.
пероксид водорода.
Если раствор отделен от чистого растворителя полупроницаемой перегородкой, то растворитель просачивается через нее в раствор. Такое явление называется:
нейтрализация.
осмос.
фильтрация.
электролиз.
электрофорез.
Согласно закону Гей-Люссака осмотическое давление:
при данной концентрации пропорционально абсолютной температуре.
при данной температуре пропорционально концентрации.
при данном объеме пропорционально температуре.
при данной температуре пропорционально объему.
закон Гей-Люссака не применим к осмотическому давлению.
Общее уравнение состояния для осмотического давления выглядит следующим образом:
P = - RTc.
P = R + Tc.
P = RTc.
P = RT/c.
P = R/Tc.
Согласно закону Вант-Гоффа: растворенное вещество содержит в разбавленном растворе столько же молекул, сколько оно имело бы их в состоянии …. При той же температуре, в том же объеме и при газовом давлении, равном осмотическому давлению раствора. Вставьте пропущенное слово:
воды.
газа.
пара.
невесомости.
здесь нет пропущенных слов.
Химические процессы на электродах, сопровождающие пропускание тока через раствор электролита, называются:
нейтрализация.
осмос.
фильтрация.
электролиз.
электрофорез.
Электрод, соединенный с отрицательным электродом источника тока называется:
катодом.
анодом.
катионом.
анионом.
вопрос некорректен.
Электрод, соединенный с положительным электродом источника тока называется:
катодом.
анодом.
катионом.
анионом.
вопрос некорректен.
При электролизе на катоде идут процессы …, а на аноде - процессы ….
восстановления и окисления соответственно.
окисления и восстановления соответственно.
обезвоживания и сушки соответственно.
нейтрализации и окисления соответственно.
среди ответов нет правильного.
Закон Ома для явления электролиза выглядит следующим образом:
E + Ep = iw.
E – Ep = i/w.
E = iw - Ep.
E – Ep = i.
E – Ep = iw.
Кривая силы тока в функции от электродвижущей силы называется кривой:
тока.
электродвижущей силы.
напряжения.
разности потенциалов.
электрокапиллярной.
Изменения, происходящие в гальванической цепи при прохождении через нее тока, называется:
поляризация.
электродвижущая сила поляризации.
электродвижущая сила разложения.
концентрационная поляризация.
среди ответов нет правильного.
Электролиз сопровождается изменением концентрации электролита около электродов, что ведет к появлению обратной электродвижущей силы. Это явление называется:
поляризацией.
электродвижущей силой поляризации.
электродвижущей силой разложения.
концентрационной поляризацией.
среди ответов нет правильного.
Уменьшение обратной электродвижущей силы поляризации путем более или менее полного устранения ее причин называется:
перенапряжением.
деполяризацией.
электроосмосом.
электродвижущей силой разложения.
электрофорезом.
Если потенциал выделения отличается от термодинамического обратимого электродного потенциала, то имеет место:
перенапряжение.
деполяризация.
электроосмос.
возникновение электродвижущей силы разложения.
электрофорез.
Какого вида мениск образует ртуть на границе с водой вследствие поверхностного натяжения?
вогнутый.
прямой.
выпуклый.
мениск не образуется.
вопрос некорректен.
Зависимость поверхностного натяжения от приложенного поляризующего потенциала изображается …. кривой:
тока.
электродвижущей силы.
напряжения.
разности потенциалов.
электрокапиллярной.
Электрокапиллярная кривая выражается уравнением:
δσ/δЕ = -ε.
δσ*δЕ = -ε.
δσ/δЕ = ε.
δσ/Е = -ε.
σ/δЕ = -ε.
При движении раствора электролита относительно граничащей с ним твердой поверхности и, наоборот, при движении этой поверхности относительно раствора возникает:
электрокинетические явления.
деполяризация.
электроосмос.
электродвижущая сила разложения.
электрофорез.
Из каких частей состоит диффузный двойной слой?
плоской поверхности.
диффузной поверхности.
а и б.
электрических поверхностей.
в и г.
Сумма скачков потенциалов в обеих частях диффузного двойного слоя определяется формулой:
E = ψ – ξ.
E = ψ + β.
E = ψ + ξ.
E = χ + ξ.
E = ψ / ξ.
Движение жидкости в электрическом поле относительно твердой поверхности называется:
перенапряжением.
деполяризацией.
электроосмосом.
электродвижущей силой разложения.
электрофорезом.
Скорость движения жидкости определяется по формуле:
u = (q ξDE)/ 4πηl.
u = q ξDE4πηl.
u = (q ξDE)/ πηl.
u = (q ξDE)/ 4ηl.
u = (q DE)/ 4πηl.
Потенциал течения определяется по формуле:
E = ξDP/4πηχ.
E = ξDP4πηχ.
E = ξDP/4πη.
E = ξDP + 4πηχ.
E = ξDP/πηχ.
Как называется явление, обратное электроосмосу:
перенапряжением.
деполяризацией.
электроосмосом.
электродвижущей силой разложения.
электрофорезом.
Скорость электрофореза подсчитывается по формуле:
u = ( ξDE)/ 4πηl.
u = q ξDE4πηl.
u = (q ξDE)/ πηl.
u = (q ξDE)/ 4ηl.
u = (q DE)/ 4πηl.
Процесс очистки сточных вод, при котором используют нерастворимые электроды, называется
электрокоагуляция.
электродиализ.
электрофлотация.
дробление.
вопрос некорректен.
Процесс очистки сточных вод, происходящий при помощи пузырьков газа, образующихся при электролизе воды, называется:
электрокоагуляция.
электродиализ.
электрофлотация.
дробление.
вопрос некорректен.
Процесс очистки сточных вод, основанный на разделении ионизированных веществ под воздействием электродвижущей силы, называется:
электрокоагуляция.
электродиализ.
электрофлотация.
дробление.
вопрос некорректен.
Количественная характеристика процесса, показывающая, во сколько раз уменьшился размер кусков или частиц материала при дроблении, называется:
грохочением.
стадиональностью.
избирательным дроблением.
степенью дробления.
дренированием.
Степень дробления определяется по формуле:
i = Dmax/dmax.
i = Dmax*dmax.
i = Dmax + dmax.
i = Dmax - dmax.
i = Dmin/dmin.
Конструктивная степень дробления определяется по формуле:
i = B*b.
i = B + b.
i = B – b.
i = B/b.
i = b/B.
Степень дробления, достигаемая в каждой отдельной стадии, называется:
первичной.
суммарной.
частной.
циклической.
общей.
Последовательность операций при дроблении называется:
стадией дробления.
правилом дробления.
принципом дробления.
схемой дробления.
способом дробления.
Площадь поверхности диспергированного материала, состоящего из отдельных кусков, зависит от их:
количества.
веса.
крупности.
формы.
массы.
Дефекты кристаллической структуры подразделяют на:
средние.
частичные.
точные.
точечные.
линейные.
Удельный расход энергии определяется как:
Еуд = - Е/Q.
Еуд = Е*Q.
Еуд = Q/E.
Еуд = - Q/Е.
Еуд = Е/Q.
Рассев сыпучего материала с целью определения его гранулометрического состава называется:
гранулированным анализом.
общим анализом.
ситовым анализом.
дисперсным анализом.
фотолитографией.
Графическое изображение гранулометрического состава сыпучего материала является характеристикой:
сыпучести.
скорости осаждения.
дробления.
крупности.
пористости.
Уравнение Годэна-Андреева имеет вид:
F(x) = (x/xmax)k.
F(x) = (x/xmax)x.
F(x) = (x*xmax)k.
F(x) = (x/xmin)k.
F(x) = (x/xmax)x.
Какое уравнение наиболее применимо для описания полимодальных распределений:
Розина-Раммлера.
Годэна-Андреева.
Харриса.
Лапласа.
среди ответов нет правильного.
Для количественной оценки полноты отделения мелкого материала от крупного при грохочении введено понятие:
грохочение.
эффективность грохочения.
избирательное дробление.
степень дробления.
дренирование.
Характеристика, выраженная в процентах или в долях единицы, отношение массы подрешетного продукта к массе нижнего класса в исходном материале называется:
грохочением.
эффективностью грохочения.
избирательным дроблением.
степенью дробления.
дренированием.
Эффективность грохочения определяется формулой:
E = (C*Qa)*104.
E = (C + Qa)*104.
E = (C/Qa)*104.
E = (C - Qa)*104.
E = (C/Qa)/104.
Зерна, диаметр которых меньше трех четвертей отверстия сита, называются:
трудными.
затрудняющими.
легкими.
тяжелыми.
крупными.
Зерна, диаметр которых более трех четвертей отверстия сита, называются:
трудными.
затрудняющими.
легкими.
тяжелыми.
крупными.
Зерна, диаметр которых более полуторного размера отверстия частиц, называются:
трудными.
затрудняющими.
легкими.
тяжелыми.
крупными.
Вероятность прохождения зерна через отверстие сита определяется по формуле:
P = (1 – d*l)2.
P = (1 + d/l)2.
P = (1 – d/l)3.
P = 1 – (d/l)2.
P = (1 – d/l)2.
Угол над горизонтом определяется по формуле:
cosθp = (1 - (1 + 8k2)1/2)/4k.
cosθp = (1 + (1 + 8k2)1/2)/4k.
cosθp = (1 + (1 + 8k2)2)/4k.
cosθp = (1 + (1 - 8k2)1/2)/4k.
cosθp = (1 + (1 + 8k2)1/2)/k.
Возможно ли грохочение каменных углей при их влажности более 6%?
да.
нет.
практически невозможно.
вопрос поставлен некорректно.
процесс грохочения не зависит от влажности материала.
Как зависит производительность грохота от ширины сита?
практически прямо пропорциональна.
обратно пропорциональна.
равна.
не зависит.
вопрос некорректен.
Сколько областей можно выделить на поверхности сита, различающиеся скоростью прохождения частиц?
2.
3.
4.
5.
1.
Диаметр свободно проходящего через отверстия зерна, определяется по формуле:
d = lcosα – hsinα.
d = lcosα + hsinα.
d = lcosα – hcosα.
d = lsinα + hsinα.
d = lsinα – hcosα.
Сила, с которой магнит действует на другой магнит или на любое другое магнитное вещество, называется:
силой притяжения.
магнитной.
гравитационной.
трения.
вопрос некорректен.
Напряженность магнитного поля определяется по формуле:
H = m*r2.
H = m + r2.
H = m/r2.
H = m - r2.
H = r2/m.
Магнитная проницаемость тела определяется по формуле:
μ = B/H.
μ = B*H.
μ = B+H.
μ = B – H.
μ = H/B.
Магнитная восприимчивость тела определяется формулой:
χ = (μ + 1)/4π.
χ = (μ – 1)*4π.
χ = (μ – 1)/4π.
χ = (1 - μ)/4π.
χ = (μ – 1)/π.
Магнитное сопротивление определяется по формуле:
R = l*μcS.
R = l/μcS.
R = l+μcS.
R = l - μcS.
R = μcS.
Магнитный силовой поток определяется выражением:
Ф = F*R.
Ф = F+R.
Ф = F – R.
Ф = F/R.
Ф = R/F.
Минералы, отталкивающиеся при любом знаке заряда, называются:
реверсивно положительными.
нереверсивными.
реверсивно отрицательными.
немагнитными.
сильномагнитными.
Комбинированный процесс магнитного обогащения, основанный на использовании различий в магнитной восприимчивости, называется:
электрокоагуляцией.
электродиализом.
электрофлотацией.
дроблением.
электродинамической сепарацией.
Содержание цветных металлов в ТБО составляет около:
100%.
50%.
0,7%.
70%.
0%.
Процесс разделения материалов, основанный на различии в величине коэффициентов трения, называется:
обогащением по трению.
электродиализом.
электрофлотацией.
дроблением.
электродинамической сепарацией.
Сила трения при обогащении по трению определяется по формуле:
F = fPsinα.
F = f/Pcosα.
F = fAcosα.
F = fPcosα.
F = fqcosα.
Процесс обогащения в движущейся газовой среде, основанный на использовании различий в плотности компонентов и их скорости витания, называется:
обогащением по трению.
электродиализом.
электрофлотацией.
дроблением.
аэросепарацией.
Литература
Кольцов В.Б., Рябышенков А.С., Филимоненко О.П. Процессы и аппараты защиты окружающей среды, - М.: МИЭТ, 2000.
Родионов А.И., Клушин В.М., Ситер В.Г. Технологические процессы экологической безопасности, - Калуга: Изд. Бочкаревой, 2000.
Касаткин А.Г. Основные процессы и аппараты химической технологии, - М.: Химия, 1971.
Раков Э.Г., Хаустов С.В. Процессы и аппараты производства радиоактивных и редких металлов, - М.: Металлургия, 1993.
Коган В.Б. Теоретические основы типовых процессов в химической технологии, - М.: Химия, 1977.
Андреев С.Е., Зверевич В.В., Перов В.А. Дробление, измельчение и грохочение полезных ископаемых, - М.: Недра, 1966.
Оглавление
Введение 3
Глава 1. Химические методы очистки сточных вод 6
1.1 Нейтрализация 6
1.1.1. Нейтрализация смешиванием 6
1.2.2. Нейтрализация добавлением реагентов 7
1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы 8
1.2. Нейтрализация кислыми газами 8
1.2.1. Окисление и восстановление 11
1.2.2. Окисление пероксидом водорода 13
1.2.3. Окисление кислородом воздуха 14
1.2.4. Озонирование 15
Глава 2. Явление осмоса и его использование при очистке сточных вод 20
2.1. Осмотическое давление 20
2.2. Биологическая роль осмотического давления 23
2.3. Законы осмотического давления 25
2.4. Термодинамика осмотического давления 28
Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
3.1. Явления электролиза, поляризации и перенапряжения 31
3.1.1 Электролиз 31
3.1.2. Кривая напряжения 33
3.1.3. Электродвижущие силы разложения 36
3.1.4. Потенциал разложения 37
3.1.5. Концентрационная поляризация 39
3.1.6. Деполяризация 40
3.1.7. Перенапряжение 41
3.2. Электрокапиллярные явления 43
3.2.1. Зависимость поверхностного напряжения от заряда 43
3.2.2. Влияние адсорбции на электрокапиллярную кривую 47
3.2.3. Проблема абсолютных потенциалов 50
3.3. Электрокинетические явления 52
3.3.1. Диффузионный двойной слой и электрокинетический потенциал 52
3.3.2. Емкость двойного слоя 55
3.3.3. Электроосмос 56
3.3.4. Потенциал течения 60
3.3.5. Электрофорез 60
3.3.6. Потенциалы осаждения 62
3.4. Электрохимические методы очистки сточных вод 63
3.4.1. Анодное окисление и катодное восстановление 64
3.4.2. Электрокоагуляция 68
3.4.3. Электрофлотация 69
3.4.4. Электродиализ 70
Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
4.1. Процессы измельчения и дробления 73
4.1.1. Назначение операций дробления и измельчения 73
4.1.2. Степень дробления и измельчения 74
4.1.3. Стадиональность и схемы дробления и измельчения 77
4.1.4. Удельная поверхность диспергированного материала 80
4.1.5. Современные представления о разрушении твердого материала 81
4.1.6. Механические свойства твердых тел при простых видах деформации 87
4.1.7. Законы дробления 96
4.1.8. Способы дробления, классификация машин для дробления и измельчения 100
4.2. Процесс грохочения 103
4.2.1. Основные понятия и назначение грохочения 103
4.2.2. Просеивающая поверхность 107
4.2.3. Способы определения гранулометрического состава 126
4.2.4. Ситовый анализ 129
4.2.5. Характеристики крупности 135
4.2.6. Аналитическое представление характеристик крупности 139
4.2.7. Дифференциальные функции распределения по крупности 147
4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности 149
4.2.9. Эффективность процесса грохочения 150
4.2.10. «Легкие», «трудные» и «затрудняющие» частицы 153
4.2.11. Вероятность нахождения частиц через отверстия сита 156
4.2.12. Факторы, влияющие на процесс грохочения 159
4.3. Электромагнитная сепарация. Физические основы процесса 169
4.4. Электростатическая сепарация. Физические основы процесса 183
4.5. Электродинамическая сепарация 191
4.6. Сепарация твердых материалов по коэффициенту трения 192
4.7. Сепарация на основе явления смачиваемости 197
4.8. Аэросепарация 200
4.9. Составление балансной схемы переработки твердого сырья 205
4.9.1. Баланс материалов при переработке твердых отходов 205
4.9.2. Технологические и технико-экономические показатели переработки твердых отходов 208
Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды» 217
Примеры выполнения домашнего задания 230
Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды» 233
Пример выполнения курсовой работы 234
Тесты 240
Литература 294
|
 Скачать 7.02 Mb.
Скачать 7.02 Mb.