ТОЗОС часть2. Учебнометодические разработки для самостоятельной работы студентов по курсу
 Скачать 7.02 Mb. Скачать 7.02 Mb.
|
|
Министерство образования и науки Российской Федерации Федеральное агентство по образованию Московский государственный институт электронной техники (технический университет) Кольцов В.Б. Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды» Часть II Специальные методы очистки сточных вод и основные методы сепарации твердых отходов Москва 2007 УДК 658.362.3 Рецензенты: д.х.н., проф. Минаев В.С., д.х.н., проф. Потемкин А.Я. канд.т.н., доц. Девисилов В.А. Учебно-методическая разработка для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды», часть II (Специальные методы очистки сточных вод и основные методы сепарации твердых отходов). - М.: МИЭТ, 2007.-400 с: ил. Учебно-методическая разработка для самостоятельной работы студентов. Рассмотрены фундаментальные проблемы специальных методов очистки сточных вод (химические и электрохимические методы, методы очистки на основе осмотических явлений), а также описаны теоретические концепции переработки твердых отходов (дробления, измельчения, сепарации и классификации материалов различными современными физическими методами). Разработка предназначена для студентов, обучающихся по специальности 28020265 «Инженерная защита окружающей среды». Она может быть также полезно студентам и аспирантам других технических специальностей вуза. © МИЭТ, 2007 Введение Данное учебное пособие рассматривает различные аспекты в области обязательного экологического образования инженера по специальности 28020265 - «Инженерная защита окружающей среды», что обеспечивает стабильный минимально необходимый уровень природоохранной подготовки специалистов по всем отраслям науки, техники, производства, строительства и т.д. с учетом новых концепций управления техносферным развитием на локальном, региональном и глобальном уровнях. Вместе с тем данное пособие ориентированно на подготовку инженеров-экологов по защите окружающей среды в области микроэлектроники и электронной техники, которая обладает определенными специфическими особенностями. В современной твердотельной электронике, как известно, используется большое количество различных материалов, как простых, так и сложных, состоящих из многих компонентов. Непрерывно возрастают требования к получению материалов с точно заданным составом, когда изменение в содержании компонента в пределах одного грамма на тонну материала (10-4 %) может резко повлиять на его свойства. Жесткие требования предъявляются к структурному совершенству монокристаллов. Наличие дефектов в пластине полупроводника при изготовлении на ней интегральной микросхемы может вызвать брак, при котором размер дефекта сопоставим с размером элементов микросхемы. Переход к субмикронным размерам элементов ужесточает требования к структурному совершенству материала. Кроме того, в электронной технике широко применяются керамические материалы, а следовательно, получили широкое распространение методы и приемы порошковой металлургии. Высокие требования к получению материалов электронной техники приводят к образованию сложного спектра промышленных отходов: газообразных, жидких и твердых, которые нередко попадают в среду обитания человека. Вторая часть данного пособия по «Теоретическим основам защиты окружающей среды» посвящена специальным методам очистки сточных вод (химическая, электрохимическая очистка, очистка с использованием осмоса), а также методам переработки твердых отходов, включая процессы дробления и измельчения материалов, классификации и сепарации различными современными физическими методами. В задачу курса входит ознакомление студентов с теорией и методами расчета процессов, рассмотренных в вышеперечисленных разделах. В настоящее время всему человеческому сообществу ясно, что время «покорения природы» безвозвратно прошло, и начался период глубокого заинтересованного познания ее законов. Однако на практике объем отходов в мире растет в 2÷3 раза быстрее, чем объект производства и численность населения. Лавина отходов загрязняет природу, их вредные токсические компоненты отравляют землю, воздух, реки, моря и озера. Разумный человек не должен считать выгодой уничтожение всего живого (и себя в том числе) и бесконтрольное использование ресурсов, не только своих, но и принадлежащих будущим поколениям. Пришло время коренным образом изменить свой подход к понятию выгодности, когда речь идет о природопользовании. Человечество должно перейти к рациональному природопользованию, т.е. к планомерному научно обоснованному преобразованию окружающей среды по мере совершенствования материального производства на основе комплексного неиспользования невозобновимых ресурсов в цикле производство - потребление - вторичные ресурсы при условии сохранения и воспроизводства возобновимых природных ресурсов. Важнейшая проблема, стоящая перед инженером - правильная постановка и решение задачи аппаратно-технического оформления процесса. В связи с огромным и непрерывно расширяющимся ассортиментом продукции решение задачи возможно лишь на основе углубленного изучения типовых процессов химической технологии (сюда же относятся процессы, проводимые для защиты окружающей среды). Зная эти закономерности и умея анализировать и рассчитывать отдельные типовые стадии процессов в химической технологии, можно строить из них любой производственный процесс, реализуя на практике малоотходную технологию производства продуктов потребления. Авторы считают своим долгом выразить благодарность своим рецензентам профессору доктору химических наук Минаеву В.С., профессору доктору химических наук Потемкину А.Я. и доценту кандидату технических наук Девисилову В.А. за ценные рекомендации при подготовке пособия, а также аспирантам кафедры ПЭ Вахрамеевой М.Г., Майер Т.Ю. и студентам группы ЭТМО-42 за подготовку и редактирование пособия в электронном виде. Глава 1. Химические методы очистки сточных вод К химическим методам очистки сточных вод относят такие процессы, как нейтрализация, окисление и восстановление. Все эти методы связаны с расходом различных реагентов и поэтому очень дороги. Их применяют для удаления растворимых веществ в замкнутых системах водоснабжения. Химическая очистка в ряде случаев проводят иногда как предварительным этапом перед биологической очисткой или завершающим, например, метод доочитски сточных вод. 1.1 Нейтрализация Сточные воды, содержащие минеральные кислоты или щелочи перед сбросом их водоемы или перед использованием в технологических процессах предварительно нейтрализуют. Практически нейтральными считаются воды имеющие рН = 6,5 – 8,5. Нейтрализацию можно проводить различными способами: смешиванием кислых и щелочных сточных вод, добавлением реагентов, фильтрованием кислых вод через нейтрализующие материалы, абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. 1.1.1. Нейтрализация смешиванием Этот метод применяют, если на одном предприятии имеются кислые и щелочные воды, не загрязненные другими компонентами. Кислые и щелочные воды смешивают в емкости с мешалкой или без нее. В последнем случае перемешивание ведут потоком воздуха при его скорости в линии подачи 20÷40 м/с. Если концентрация сточных вод переменна, то в схеме предусматривают установку усреднителя или обеспечивают автоматическое усреднение сточных вод, направляемое в камеру смешивания. Установка схематично представлена на рис.1.1 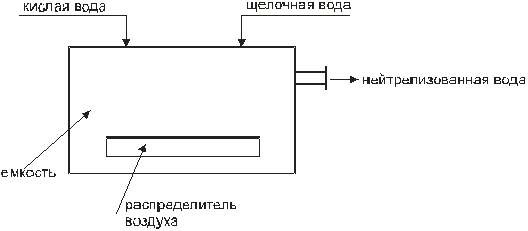 Рис.1.1. Схема установки для нейтрализации смешиванием. Нейтрализованную воду используют в производстве, а осадок обезвоживают на шламовых площадках и вакуум-фильтрах. 1.1.2. Нейтрализация добавлением реагентов Для нейтрализации кислых вод обычно используют NaOH, KOH, Na2CO3, NH4OH (аммиачная вода), CaCO3, MgCO3 доломит (CaCO3, MgCO3) цемент. Однако наиболее дешевым реагентом является гидрооксид кальция (известковое молоко) с содержанием активной извести Ca(OH)2 5-10% . Воду и гидрооксид натрия следует использовать, если они являются отходами производства. Следует отметить, что шлаки сталеплавильного, феррохромного и доменного производства используют для нейтрализации вод, содержащих серную кислоту. Известь для нейтрализации вводят в сточную воду в виде гидрооксида кальция (известкового молока) мокрое дозирование или в виде сухого порошка (сухое дозирование). При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопровода и забивка последнего. Для устранения забивки трубопровода необходимо промывать их чистой водой и добавлять в сточные воды специальные умягчители, например, гексаметафосфорит. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода. 1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы Нейтрализацию кислых вод проводят фильтрованием через слой магнезита, доломита, известняком твердых отходов (шлак, зола). Процесс ведут в фильтрах-нейтрализаторах, которые могут быть горизонтальными и вертикальными. Для вертикальных фильтров используют куски известняка или доломита размером 30÷80 мм. При высоте слоя материала 0,85÷1,2 м скорость должна быть не более 5 м/с, а продолжительность контакта не менее 10 мин. У горизонтальных фильтров скорость течения 1÷3 м/с. 1.2. Нейтрализация кислыми газами Для нейтрализации щелочных сточных вод в последнее время используют отходящие газы, содержащие CO2, SO2, NO2, N2O3. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно проводить высокоэффективную очистку газов от вредных компонентов. Процесс нейтрализации газов может быть проведен в реакторах с мешалкой (рис.1.2). 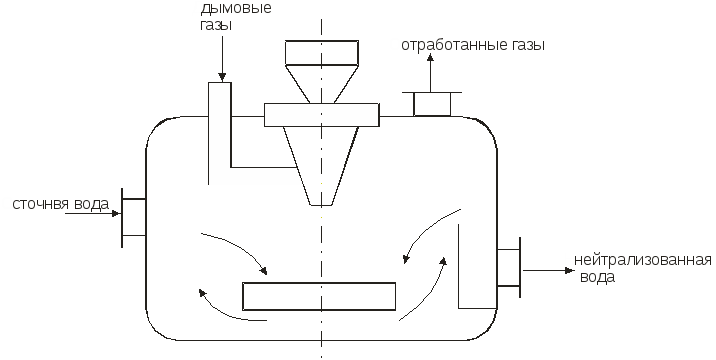 Рис. 1.2. Схема установки для нейтрализации кислыми газами Рис. 1.2. Схема установки для нейтрализации кислыми газамиДымовые газы вентилятором подают в кольцевое пространство вокруг вала мешалки и распределяют мешалкой в виде пузырьков и струй в сточной воде, поступающей внутрь реактора. Благодаря большой поверхности контакта между водой и газами происходит быстрая нейтрализация сточной воды. Количество кислого газа необходимого для нейтрализации может быть определено по уравнению массоотдачи: где Коэффициент Сточная вода из усреднителя должна поступать в смеситель, где предварительно нейтрализуется частью воды, выходящей из абсорбера (рис.1.3). . 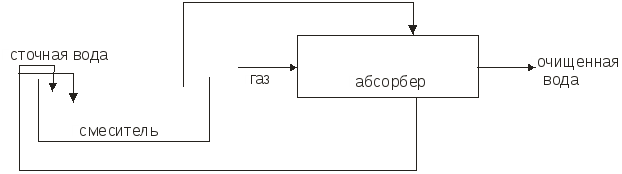 Рис.1.3. Схема установки для нейтрализации с абсорбером В смесителе протекают следующие реакции: OH-+HCO3-H2O+CO32-, Cu2++CO32-CaCO3. Осаждение происходит в циркуляционной емкости. Предварительную нейтрализацию сточной воды проводят с целью получения на входе в абсорбер смеси с таким водородным показателем, при котором смесь при окончательной нейтрализации в абсорбере дымовыми газами не образует карбонатных отложений. При этом в абсорбере протекают следующие реакции: 2OH+CO2H2O+CO32-, CO32-+CO2+H2O2HCO3-. Отношение объемных расходов циркулирующей и сточной воды, при которой образуется смесь, не выделяющая карбонатных отложений, зависит от состава сточной воды и составляет от 2,5 до 4. Для нейтрализации применяют абсорбент с крупнодырчатыми провальными тарелками и большим свободным сечением. Нейтрализации сточных вод дымовыми газами является примером ресурсосберегающей технологии. 1.2.1. Окисление и восстановление Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др. В процессе окисления токсичные загрязнители, содержащиеся в сточных водах, переходят в менее токсичные и которые удаляют из воды. Хлор и вещества, содержащие активный хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений фенолов, цианидов и др. При введении Cl2 в воду образуется хлорноватистая кислота и соляная кислота. Cl2+H2O=HOCl+HCl. Затем происходит диссоциация хлорноватистой кислоты, причем степень ее диссоциации зависит от рH среды. При рH=4 молекулярный Cl практически отсутствует: HOCl=H++OCl-. Сумма Cl2+HOCl+OCl- называется свободным активным хлором. В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2Cl и дихлорамин NH4Cl2. Хлор в виде хлорамина называется связанный активным хлором. Процесс хлорирования происходит в хлораторах периодического и непрерывного действия (в кислородных и вакуумных). Хлорирование происходит в емкостях, включенных в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода удаляется. Например, при обезвреживании сточных вод от цианидов процесс проводят в щелочной среде (рH=9). Цианиды можно окислить до элементарного азота и диоксида углерода по уравненеиям: CN- + 2OH + Cl2 → CNO-- + 2Cl-- + H2O, 2CNO + 4OH + 3Cl2 → CO2 + 6Cl-- + N2 + 2H2O. Источниками активного хлора может быть также хлорат кальция, гипохлориты, хлораты и диоксид хлора: CaOCl2; Ca(ClO)2. Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением ClO2. При окислении цианидов активным хлором процесс можно проводить в одну ступень до получения цианидов: CN + OCl-CNO- + Cl-, CNO- + 2H2OCO32- + NH4-. Скорость процесса зависит от рН среды. При рН=5,3 за сутки обезвреживается 80% цианидов. На второй стадии процесса вводят дополнительное количество окислителя и реакция протекает по уравнению: 2CNO + 3OCl- + H2O2CO2 + N2 + 2OH + 3Cl. Во время второй стадии РН поддерживается 5-10 . Потребность реагентов Xi (кг/сутки) для окисления рассчитывается по формуле: Xi=XClQn/a, где XCl - расход активного хлора, необходимого для окисления нужного количества цианидов [кг/м3]; Q - расход воды, м3/сут; n - коэффициент избытка реагента (n = 1.2 ÷ 1.3); а - содержание активного хлора в реагенте, доли единицы. Схема установки хлоратора представлена на рис. 1.4. 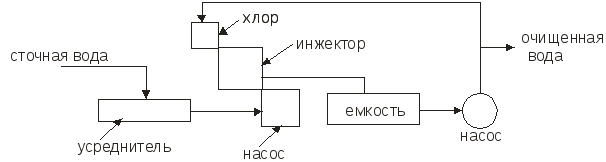 Рис.1.4. Схема хлоратора 1.2.2. Окисление пероксидом водорода Пероксид водорода является бесцветной жидкостью и в любых соотношениях смешивается с водой. Он может быть использован для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам: 2H++H2O2+2C2H2O, 2OH-+H2O2+2C2H2O+2O2-. В кислой среде более отчетливо выражена окислительная функция, а в щелочной - восстановительная. В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту - в азотную, сульфиды - в сульфаты. Цианиды и цианиты окисляются в щелочной среде при рН=9 ÷ 12. В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы: ионы металлов переменной валентности (Fe2+, Cu2+, Mn2+, Co2+, Cr2+, Ag+). Например, процесс окисления пероксидом водорода с солями Fe протекает весьма эффективно при рН=3 ÷ 4,5. Продуктами окисления являются муконовая и леиновая кислоты. В процессах водообработки используют не только окислительные, но и восстановительные свойства H2O2. В нейтральной и слабощелочной средах он легко взаимодействует с хлором и гипохлоридом, переводя их в хлориды: H2O2+Cl2O2+2HCl, NaClO + H2O2NaCl+O2+H2O. Эти реакции используют при дехлорировании воды. Избыток пероксида водорода можно удалять, обрабатывая его диоксидом марганца: MnO2+ H2O2+2HClMnCl2+2H2O+O2. 1.2.3. Окисление кислородом воздуха Кислород воздуха используют при очистке воды от железа, для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроксида железа. Реакция окисления в водном растворе протекает по схеме: 4Fe2++O2+2H2O=4Fe3++4OH-, Fe3++3H2O=Fe(OH)3+3H+. Окисление проводят при аэрировании воздуха через сточную воду в башнях с хордовой посадкой. Образующийся гидроскид железа отстаивают в контактном резервуаре, а затем отфильтровывают. Использование колонн с кусковой посадкой нецелесообразно, т.к. происходит зарастание насадки. Возможен процесс упрощенной аэрации. В этом случае под поверхностью фильтра разбрызгивают воду, которая падает на поверхность фильтрующей загрузки. При контакте капель воды с воздухом происходит окисление железа. Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Процесс окисления серы, гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с –2 до +6. S2-S1SnO62-S2O32-SO42-. Необходимо отметить, что при окислении гидросульфида и сульфида до тиосульфата рН раствора повышается, при окислении гидросульфида до сульфита и сульфата рН раствора понижается, а при окислении сульфида до сульфита и сульфата рН раствора не изменяется. С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличивается. Теоретически на окисление 1 г сульфидной серы расходуется 1 г кислорода воздуха. Принципиальная схема очистки приведена на рис.1.5. 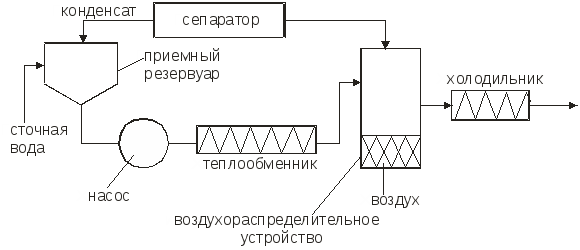 Рис.1.5. Схема установки для окисления кислородом воздуха 1.2.4. Озонирование Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранить привкусы и запахи, а также провести обеззараживание. Озонированием можно очистить сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др. Озон - газ бледно-фиолетового цвета. В природе он находится в верхних слоях атмосферы. При температуре -111,9 ºС озон превращается в нестойкую жидкость темно-синего цвета. Физико-химический состав озона: относительная молекулярная масса 48, плотность при температуре 0 ºС и давлении 0,1 МПа 2,154 г/л, температура плавления 192,5 С, теплота образования 143,64 кДж/моль. Коэффициент растворимости в воде при 0 °С 0,49, при 20 °С 0,29. Окислительно-восстановительный потенциал 2,07 В. Чистый озон взрывоопасен, так как при его разложении высвобождается значительное количество тепла, очень токсичен. Максимально допустимая концентрация в воздухе рабочей зоны 1·10-4 мг/м3. Обеззараживающее действие озона основано на высокой окислительной способности, обусловленной легкостью отдачи им активного атома кислорода (О3=О2+О). Озон окисляет все металлы, кроме золота, превращая их в оксиды. В водном растворе озон диссоциирует быстрее, чем в воздухе. Очень быстро диссоциирует в слабощелочных растворах. В кислотных растворах озон проявляет большую стойкость. В чистом сухом воздухе он разлагается очень медленно. При обработке воды озоном происходит разложение органических веществ и обеззараживание воды; бактерии, например, погибают в несколько тысяч раз быстрее, чем при обработке воды хлором. Растворимость озона в воде зависит от РН и наличия в воде растворимых веществ. Небольшое содержание кислот и нейтральных солей увеличивает растворимость озона, присутствие щелочей - снижает. Действие озона в процессе окисления может происходить в трех различных направлениях: -непосредственное окисление с участием одного атома кислорода; -присоединение целой молекулы озона к окисляемому веществу с образованием озонидов; -каталитическое усилие окисляющего воздействия кислорода, присутствующего в озонированном воздухе. Механизм реакции разложения озона довольно сложен, на что влияет множество факторов - условия перехода озона из газовой фазы в жидкость, соотношения между парциальным давлением газа и его растворимостью в водном растворе, кинетика окисления озона и находящихся в воде загрязнений. При диспергировании озона в воду идут два основных процесса: окисление и дезинфекция, кроме того, происходит значительное обогащение воды растворимым кислородом. Окисление веществ может быть прямым и непрямым. Оно также может осуществляться катализом и озонолизом. Примером прямых реакций может являться окисление ряда органических и минеральных веществ (Fe2+, Mn2+), которые после озонирования осаждаются в форме нерастворимых гидроксидов или переводятся в диоксиды и перманганаты. Непрямое окисление осуществляется радикалами, например, группой ОН и другими, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения. Интенсивность непрямого окисления прямо пропорциональна количеству разложившегося озона и обратно пропорциональна концентрации присутствующих загрязнителей. Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются. Каталитическое воздействие озонирования заключается в усилении окислительной способности кислорода, который присутствует в озонированном воздухе. Озон получают из кислорода воздуха под воздействием электрического тока в генераторах. Озон подается в воду в виде озоно-воздушной смеси - около 3% О3. Для усиления процесса окисления смесь диспергируют в сточной воде на мельчайшие пузырьки газа. Озонирование представляет собой процесс абсорбции, сопровождаемой химической реакцией в жидкой фазе. Примерная схема установки для очистки сточных вод озоном приведена на рисунке 1.6.: 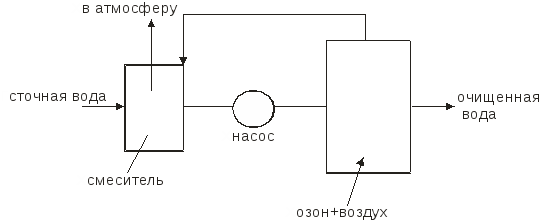 Рис.1.6. Схема очистки сточных вод озоном Поскольку озон по своим свойствам приближается к сильным отравляющим веществам и превосходит синильную кислоту, то есть разбавляют до безопасных концентраций, деструкцию озона или его утилизацию. Необходимо отметить высокую перспективность методов озонирования с обработкой воды ультразвуком или ультрафиолетовым облучением, что приводит к усилению его окислительной способности. Контрольные вопросы 1. Какие основные методы очистки сточных вод применяются в настоящее время? 2. Какие типы процессов можно выделить при описании процесса нейтрализации сточных вод? 3. Как и где применяется процесс нейтрализации смешиванием? 4. Как и где применяется процесс нейтрализации с добавлением реагентов? 5. Как и где применяется процесс нейтрализации кислых вод через нейтрализующие материалы? 6. Как и где применяется процесс нейтрализации кислыми газами? 7. Как и где применяются процессы окисления и восстановления при очистке сточных вод? 8. В чем заключается особенность окисления сточных вод пероксидом водорода? 9. В чем заключается особенность окисления сточных вод кислородом воздуха? 10. В чем заключается особенность очистки сточных вод методом озонирования? |
