portal.guldu.uz-БИОКИМЁ (1). Учебнометодический комплекс по "Биохимия" подгатовленной на основе современной педтехнологии. Настоя щ ий комплекс подготовлен
 Скачать 4.32 Mb. Скачать 4.32 Mb.
|
|
Муҳокама учун саволлар: 1.1 Ёғ кислоталар алмашинуви ҳақида маълумот беринг. 1.2. Ёғлар алмашинуви йўлларини изоҳлаб беринг. Мавзу бўйича ечимини кутаётган илмий муаммолар. 1. Липидлар алмашинувининг биологик аҳамиятини ўрганиш. 2. Ёғ кислоталар алмашинувининг биологик ролини ўрганиш. Фойдаланилган дарслик ва ўқув қўлланмалар рўйхати: Асосий: 1.Тўрақулов Ё.Х. Биохимия. Тошкент. «Ўзбекистон», 1996. 2.Ленинжер А. Основы биохимии. 3-жилдли, М., Мир, 1984. 3.Филипович Ю. Основы биохимии. М., Высшая школа, 1985. 4.Қосимов А. ва бошқалар. Биохимия. Тошкент. Ўқитувчи, 1987. Қўшимча 1. Николаев А.Н., Султанов Р.Г. «Биохимиядан амалий машғулот». Т. 1989. 2. Алейникова Т.Л. «Руководство к практическим занятиям по биохимии». М. 1987. 3. Шапиро Д.К. «Практикум по биологической химии», М., Высшая школа. 1976. 4 . www. Referat. Ru; 11-мавзу: Оқсиллар алмашинуви Фанни ўқитиш технологияси: “Оқсиллар алмашинуви ” мавзусидаги маруза машғулотининг технологик харитаси
Асосий саволлар: Оқсиллар алмашинуви хакида умумий маълумот. Аминокислоталар алмашинуви ва унинг аҳамияти. Аминокислоталар ҳосил бўлиши. Мавзуга оид таянч тушунчалар ва иборалар: оқсил, аминокислота, простогландин, ошқазон, ичак, ингичка ичак, амилаза, пепсин. Мавзуга оид муаммолар: 1. Оқсиллар алмашинувининг биологик аҳамиятини ўрганиш. 2. Аминокислоталар алмашинувининг биологик ролини ўрганиш. 1- савол бўйича дарс мақсади: Оқсиллар алмашинуви ҳақида умумий маълумот беради. Идентив ўқув мақсадлари. 1.1 Оқсиллар алмашинуви аҳамиятини тушинтириб бера олади. 1.2 Оқсилларнинг ошқозон ва ичакларда алмашинуви жараёнини айтиб бера олади. Биринчи савол баёни: Узоқ вақтларгача организмда оқсилларнинг парчаланиши фа-қат гидролиз реакциясн орқалн амалга ошади деб келинган. Бироқ бир неча йил аввал оқсил таначаларннинг парчаланишининг принципиал янги йўли очилган, хусусан, аденозинтрифосфат иш-тирокида улардан нуклеотидпептидлар ҳосил бўлиши аниқланган. Оқсилларнинг гидролитик парчаланиши ўсимлик ва ҳайвонлар организмида кенг тарқалган бўлиб, бу процессда қатор гидроли-тик ферментлар иштнрок этади. Усимликлар организмида оқсил-ларнинг парчаланиши протеолнтик ферментлар таъсирида амино-кислоталар ҳосял бўлишидан бошланади. Бундай процесс ўсим-ликлар уруғи унаётганда жуда интенсив бўлиб, эндосперма ва барг, уруғпалла оқсиллари парчаланиб аминокислоталар ҳосил қи-лади. Қейинчалик ҳосил бўлган эркин аминокислоталар ўсаётган •муртакнннг озиқланиши учун ва ёш ниҳол органларинянг тузили-шнга сарфланади. Уруғ унаётган даврда протеиназа ферментлари-нннг актнелнги 8 кунда 40 мартағача ортади. Жуда ҳам актив протеолитик ферментлар ачитқиларда ва моғорларда бўладн, Шундай қилиб, юқори ўсимликларда ва мнкроорганизмларда протеолитик ферментлар таъсирида оқсиллар ўзининг қурилиш материали — аминокислоталаргача парчаланар экан. Усимликлар томонидан анорганик моддалардан синтез қи-линган ва оддий оқсиллар парчаланишндан ҳосил бўлган эркин аминокислоталар ^атор ферментативўзгаришларгаучрайди.Амино-кислоталарнинг ферментатив ўзгариш реакциялари устида кейин-роқ батафсил тўхталамиз. Ҳайвонлар организмида оддий оқсиллар қисман ёки тўла гид-ролизланганда, ундан мос равишда пептидлар ёки амннокислота-лар ҳосил бўладн. Оқсил протеолитнк ферментлар таъсирида чала гидролизланганда, молекуласидаги айрим пептид боғлари узилн-ши натижасида пептидлар ҳосил бўлнб, улар ўз навбатида қатор пептидгидролаза ферментлари таъсирида аминокислоталарга пар-чаланади. Ҳайвон организми оқсилга бўлган эҳтиёжинв кундалик ознқ моддалар ҳисобига таъминлаб туради. Юқорида айтганимиздек, организмда доим оқсилларнинг пар-чаланиш ва янгидан хрсил бўлиш процесси тўхтовсиз боради. Оқ-сил азот тутувчи бирдан-бир модда бўлганлиги учун, бошқа азот тутмайдиган моддалар унинг ўрнини боса олмайди. Оқсиллар парчаланганда ҳосил бўладиган азот ташқарига чиқарилнб тура-ди. Шуни таъкидлаш керакки, организм қанча оқсил қабул қилса, шунча парчаланиб туради. Азот балансига қараб оқсиллар алмашинуви тўғрисида хулоса-га келиш мумкин. Ҳаквонлар организмидаги озиқ модда сифатида қабул қилинадиган оқсилларнинг бир цатор протеолитнк фермент-лар таъсирида гидролитик парчаланишн ошқозон-ичак йўлида боради. Ошқозон-ичак йўлида юқори молекулали оқсиллар ферментлар таъсирида бирин-кетин кичик молекулали бирикмаларга ва охири аминокислоталаргача парчаланади. Аминокислоталар қонга сўрилнб, организмда янги оқсиллар ҳосил бўлишида ва оқсил та-биатли актив моддалар (гормонлар, ферментлар) биосинтезида сарфланади. Организмда оқсиллар гидролизининг умумий схема-сини қуйидагича ифодалаш мумкин: 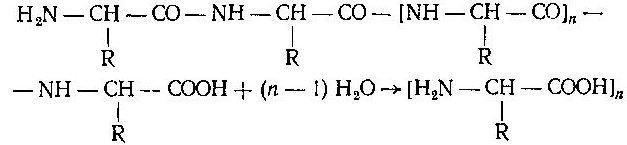 Оқсилларнинг парчаланиши ошқозонда ошқозон суюқлиги ферментлари таъсирида бошланади. Ошқозон суюқлигини ошқоэон деворининг шиллиқ қаватидаги безлар ажратади. Унинг таркиби 99% сув, эркин хлорнд кислота ва пепсин ферментидан иборат бўлади. ёш ҳайвонлар ошқозонининг суюқлигида яна бош-қа протеолитик фермент — хнмозин бўлади. Пепсин актив бўлма-ган профермент пепсиноген шаклида ажралиб, хлорид кислота таъсирида ундан полипептид ажралади ва натижада оцсилларни гидролитик парчалаш қобилиятига эга бўлган актив пепсин ҳосил бўлади. Пепсин фақат эркин хлорид кислота томонидан ҳосил қи-линадиган кучли кислотали муҳитда (рН=1,5—2} оптимал актив хрлатда бўлади. Пепсин ферменти таъсирида оқсиллар қисман гидролизланади ва натижада пептонлар ва протеозлар ҳосил бў-лади. Пептонлар оқсилларга ўхшаш специфик реакцияларга кири-шади ва кислота, тузлар таъсирида чўкади. Пептон ва протеозлар аралашмаси кейинчалик ўникки бармоқ ичак орқали ингичка ичак-ка келади ва ферментатив парчаланишда давом этади. Панкреатик шнра проферментлардан трипсиногеи ва химотрип-синогенларни тутади. Трипсиноген энтерокиназа таъсирида актив трипсинга айланади, трипснн эса ўз навбатида актив бўлмаган химотрипсиногенни актив химотрипсинга айлантиради. Трипсин ва химотрипсинлар таъсирида пептонлар кичик молекулали полипептидларгача парчаланади. Полипептидлар нчак ширасидаги амино-пептидаза, карбоксипептидаза ва дипептидаза ферментлари таъ-сирида парчаланади. Карбоксипептидаза полипептид занжирининг эркин карбоксил группаси томопидан, аминопептидаза эркин ами-ногруппаси томонидан парчаланади. Гндролиз натижасида ҳосил бўлган дипептидлар дипептидаза ферментлари таъсирида амнно-кислоталар ҳосил қилади. Шундай қилиб, ов^ат моддаси сифатида қабул цилинган оқсил-лар ошқозон-ичак йўлида ферментатнв гидролнзга учраб, амино-кислоталаргача парчаланар экан. Аминокислоталар ингичка ичак оркали сўрилиб, моддалар алмашинувида актив иштирок этади. В. Кошшсбергер ва бошқалар оцсилларнинг гядролитик парча-ланишидан ташқари, иккинчи хил — бошқача парчаланиш йўли борлигини аниқлаганлар. Унда специфик ферментлар ва АТФ иш-тирокида оқсиллар, аввало, нуклеотидпептидларга парчаланади ва улар яна оқснлларнинг қайта синтезида тайёр пептид блоклари сифатида ишлатилади. Лекин оқсилларнинг бу йўл билан парча-ланиш механизминннг барча деталлари тўлиқ аницланмаган. Юқорида таъкидлаб ўтилганидек, оқсиллар ошқозон-ичак йў-лида парчаланишидан ҳосил бўладиган аминокислоталарнинг асо-сий қисмн қонга сўрилса, маълум қисми турли ўзгариш реакция-ларига учрайди ва ўзлаштирилмай қолган қисми ичакдаги микро-флора томонидан фойдаланилади. Муҳокама учун саволлар: 1.1 Оқсилларнинг ошқозон ичак йўлида алмашинуви ҳақида маълумот беринг. 1.2. Оқсилларнинг жигирда алмашинуви йўлларини изоҳлаб беринг. Фойдаланилган дарслик ва ўқув қўлланмалар рўйхати: Асосий: 1.Тўрақулов Ё.Х. Биохимия. Тошкент. «Ўзбекистон», 1996. 2.Ленинжер А. Основы биохимии. 3-жилдли, М., Мир, 1984. 3.Филипович Ю. Основы биохимии. М., Высшая школа, 1985. 4.Қосимов А. ва бошқалар. Биохимия. Тошкент. Ўқитувчи, 1987. Қўшимча 1. Николаев А.Н., Султанов Р.Г. «Биохимиядан амалий машғулот». Т. 1989. 2. Алейникова Т.Л. «Руководство к практическим занятиям по биохимии». М. 1987. 3. Шапиро Д.К. «Практикум по биологической химии», М., Высшая школа. 1976. 4 . www. Referat. Ru; 2- савол бўйича дарс мақсади: Аминокислоталар алмашинуви ҳақида умумий маълумот беради. Идентив ўқув мақсадлари. 1.1 Аминокислоталар алмашинуви аҳамиятини тушинтириб бера олади. 1.2 Аминокислоталарнинг ошқозон ва ичакларда алмашинуви жараёнини айтиб бера олади. Иккинчи савол баёни: Аминокислоталар алмашинуви Кўпчилик аминокислоталар оқсил синтезида иштирок этишидан ташқари моддалар алмашинуви реакцияларида турли ўзгаришлар-га учрайди. Баъзи бир аминокислоталар ферментатив реакциялар давомида физиологик активликка эга бўлган моддаларга айла-ниши мумкин. Масалан, тирозин буйрак ости безида адреналин гормонига, қалқонсимон безида эса тироксин гормонига айланиши мумкин, триптофан эса марказий нерв системасининг қатор функциясини регуляция қилувчи серотоиин ҳосил бўлишида асосий хомашё ҳисобланадя. Усимликлар организмида барча зминокислоталар синтезланса, ҳайвонлар организмида айримларн синтезланмайди. Шунинг учун улар икки группага: алмашинадиган ва алмашинмайдиган амнно-кислоталарга бўлинади. Алмашннадиган, яъни организмда синтез-ланадиган аминокислоталарга: глицин, аланин, серин, аспарагин кислота, аспарагин, глютамин кислота, цистеип, цистин, пролин, тирозин ва алмашинмайдиган амилокислоталарга: треопин, метио-нин, валин, изолейқин, фенилаланин, гистидин, триптофан, лизин, лейцин, аргинин киради. Оқсил молекуласида битта алмашинмай-диган аминокислота етишмаса ҳам, у тўла қимматга эга бўлмайди. Аминокислоталар тўқималарда дезаминланиш, қайта аминла-ниш ва қисман декарбоксилланишга учрайди. Аминокислоталарнвнг дезаминланиши. Организмда аминокис-лоталар дезаминланиши натижасида ўзидаги аминогруппани йўқо-тади. Бу реакция дегидрогеназа ёкн аминокислоталарнинг оксидаза ферментлари иштирокида борадн. Дезаминланишнннг бир қанча йўллари бор: I. Оксидланиш билан бораДИган дезаминланиш. 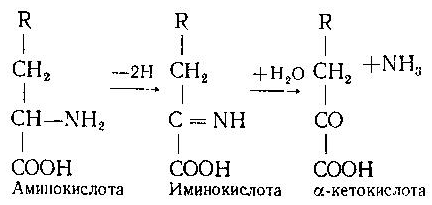 Глютамин кислотани дезаминлаш орқали сс-кетоглютаратга айлантирувчи дегидрогеназа тўқималарда айниқса активдир. Бошқа амннокислоталар глютамин кнслотага иисбатан бир ҳанча секинро^ дезаминланади. Дезаминланиш реакциясини катализловчи дегидрогеназалар-нинг актнв қисмини НАД+ ташкил қилади: 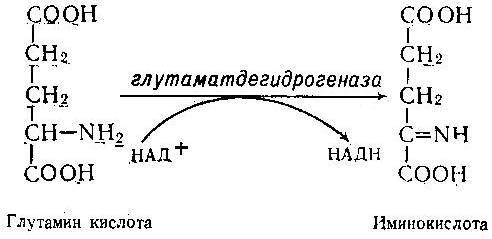 Бу реакцияда оралиқ маҳсулот сифатида ҳоснл бўладиган ими-нокислота беқарор бўлганлиги туфайли сув бириктириб, а-кето-кислота ва аммиакка парчаланади: 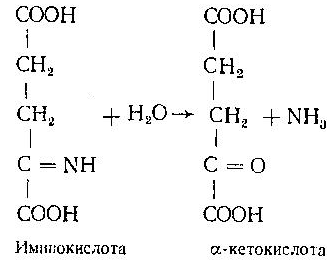 Бу реакцияни ҳужайралар митохондриясидаги глютаматдегид-рогеназа катализлайди. Оксидланишли дезаминланиш биринчи навбатда жигарда боради, бироқ аммиакнинг ажралиш прои.ессй бошқа органларда учрайди. Шунинг учун организмдан аммиакни чнқариб ташлаш муҳим аҳамиятга эга. Аммиакнинг кўп қисми организмда специфик реакциялар да-вомида индеферент бирикмага айланнб, ташқарига чиқарилади. Шундай реакциялардан бири аминокислоталар амидларининг ҳо-сил бўлншидир: 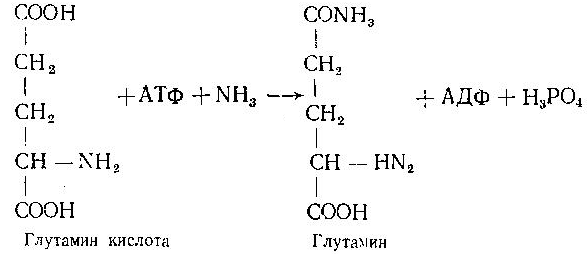 Шу йўл билан организмлардан аммиакнинг маълум миқдори ташқарига чиқарилади ва унинг бир қисми моддалар алмашину-вининг кислотали хусусиятига эга бўлган маҳсулотлари билан аммонийли туз ҳосил қилади, улар эса сийдик бнлая ташқарига чиқарилади. Аминокислоталарнинг ўсимликлар организмида дезаминланиши ҳайвонлар организмидаги, бактериялар ва замбуруғлардагн дезаминланишга қараганда бошқачароқ боради. Усимликларда В. И. Палладин кўрсатган «нафас хромогенлари» ва уларни окснд-ловчи полифенолоксндаза катта роль ўйнайди. Юксак ўсимликлар организмнда аминокислоталарнинг дезаминланиш схемасини шун-дай кўрсатиш мумкив (Кретович бўйича). 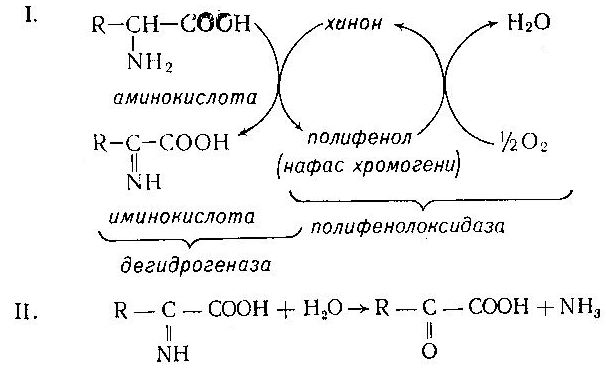 Аминокислоталар дезаминланишидан ҳосил бўладиган аммиак юксак ўсимликлар организмнда тезда азотли бирикмаларга айлан-тириш йўли билан зарарсизлантирилади. Агар тўқималарда угле-водлар кўп бўлса, улардан ^осил бўладиган кетокислоталар бири-киб, аминокислоталар ҳосил қилзди. Баъзи бнр ўсимликларда кўп миқдорда малат, оксалат ва цитрат кислоталар бўлнб, улар аммиак билан бирикиб, аммонийли тузлар ҳосил қилади. Кўпчи-лик ўсимликларда аминокнслоталарннг дезаминланишидан ҳосил бўладиган аммиакнинг зарарсизлантнрилиши аспарагин ва глю-таминлар ҳосил қилиш йўли билан амалга оширилади. Аспарагин ва глютаминлар аммиакни зарарсизлантиришдан ташқари, улар-нинг ферментатив қайта амннланиши учун зарур бўлган карбон кислоталарни резерв ҳолда сақлашда ва уларни оксидланишдан сақлашда муҳим аҳамнятга эга. Тўқималарда аминокислоталарнинг дезаминланишидан ҳоснл бўладиган кетокислота ва аммиакдан қайтадан аминокислоталар синтезланиши кузатилади: 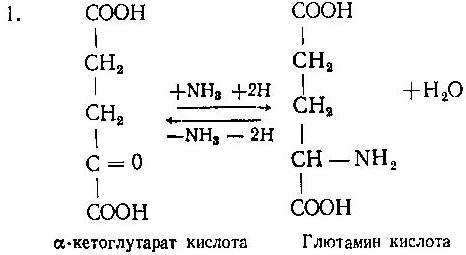 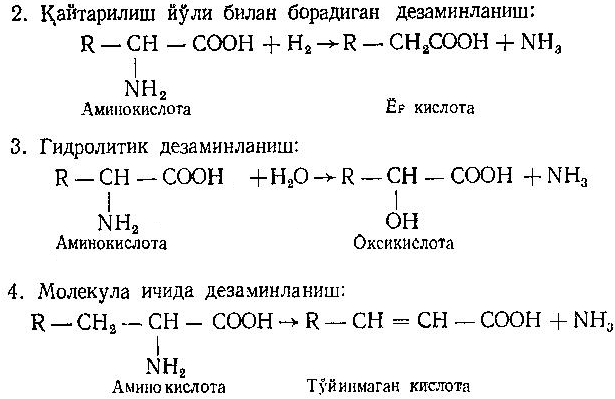 Қайта аминланиш реакцняси. Озиқ билан организмга киргак ва оқсиллар биосинтезида сарфланмаган амннокислоталар қайтэ аминланишга учрайди. Бу реакқия 1937 йили совет биохимиклари А. Е. Броунштейн ва М. Г. Крнцманлар томонидан очнлган. Қай-та аминланиш реакцияларида аминокислоталар билан кетокисло-талар орасида оралиқ аммиак ажралмасдан аминогруппалар кў-чирилади. Бундай типдаги реакция ҳар хил ҳужайра ва тўқнма-ларда кенг тарқалган. Кўпчилик ҳолларда қайта аминланиш реак-циясида иштирок этадиган а-кетокислота ва а-аминокислоталар-дан бири дикарбон кислота шаклида бўлиши керак. Бунга қуйи-даги реакқияни мисол қилиб келтираш мумкин: 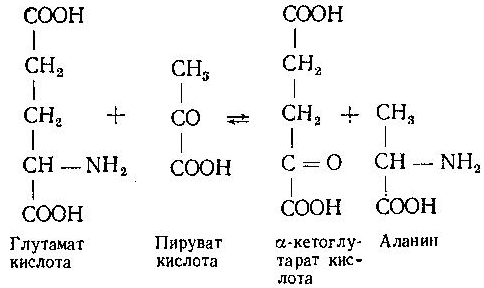 Кўпчилик аминокислоталар қайта аминланиш реакцнясида иштирок этса ҳам, лекин аспарагин, айниқса, глутамин кислота асосий роль ўйнайди. Қайта аминланиш реакцияларида иштирок этувчи ферментлар трансаминазалар ёки аминотраксферазалар дейилади. Асосий трансаминазалар сифатида глутамат-пируваттрансами-наза, глутамат-оксалоацетаттрансаминазалар хизмат қилади. Ҳайвонларнинг турли тўқималарида бошқа кўп трансаминазалар учрайди. Трансаминазалар икки компоиентлн ферментлар бўлнб, уларнинг кофактори сифатнда гшридоксальфосфат хизмат қилади. Пиридоксалли коферментларнинг тузилиши ва таъсир механнзми VIII бобда келтирилган. Аминокислоталарнинг декарбоксилланиши. Декарбоксилланиш процессида аминокислоталар карбоксил группаларини йўқотиб, тегишли аминлар ҳосил қилиши уларнинг кўпчилиги учун хос ху-сусиятдир. Аминокислоталарнинг декарбоксилланиш реакциялари декарбоксилаза ферментлари иштирокида амалга оширилади. Ҳайвонлар организмида баъзи бир аминокислоталарнинг де-карбоксилланнши натижасида биологик актив бирикмалар ҳосил бўлади: 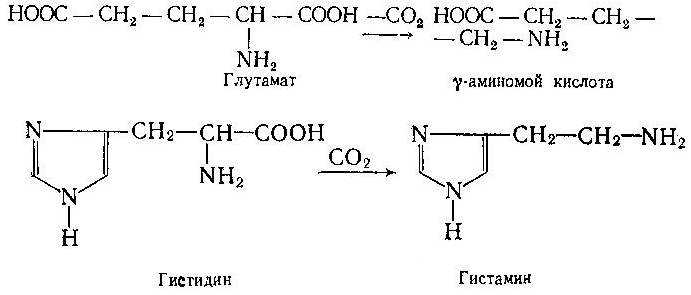 Ҳосил бўлгак моноаминлар оксидланншли дезамннланиш реак-цияси орқали альдегид ва аммиак ҳоснл қилади: 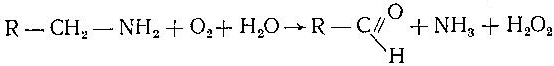 Альдегид оксидланиб, тегишли еғ кислота ҳосил қилади, у эса трикарбон кислоталар циклида сув ва карбонат ангидридга пар-чаланади. Аммиакнинг зарарсизлантирилишн ва мочевина синтези Организмда аминокислоталар, пурин асослари, амидлар ва бошқа азот тутувчи моддалар дезаминланишидан аммиак ҳосил бўлади. У заҳарли бўлганлиги учун организм томонидан мочевина ҳосил қилиш системаси орқали бартараф қилинади. Сут эмизувчи ҳайвонларда аммиакнинг бартараф этилиши мураккаб процесс бўлиб, у мочевина сифатяда чиқариб ташлана-ди. Бнроқ у НН3 сифатида қонда учрамасдан, балки свйдикда уч-райдн. Қон аммиакнн глутамат ва ундан ҳосил бўлган глутамин сифатида ташийди. АТФ нштнрокида глутаматсинтетаза ферменти таъсирида бу реакция тез боради: 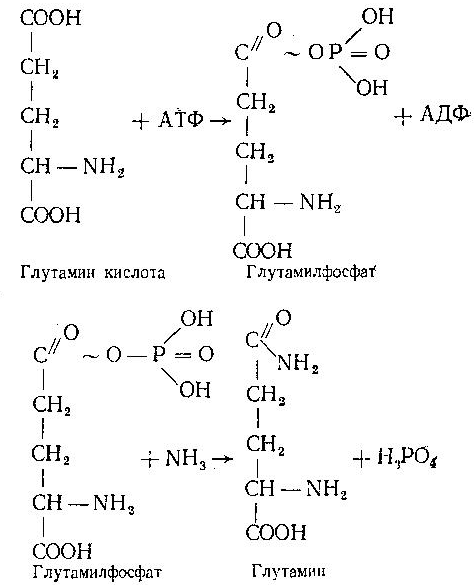 Глутамин аммиакнн ташиш функциясини бажаради. Глутамин глютамат кислотага нисбатан ҳужайралар мембранасидан осон ўтади, шу сабабли у, эҳтимол, глутамат кислотанинг ҳужайралар мембранаси орқали ўтишида муҳим роль ўйнашн мумкин. Тўқималарда, айниқса, буйракда аммиакнинг ажралишини таъ-минловчн глутаминаза ферменти учрайди: 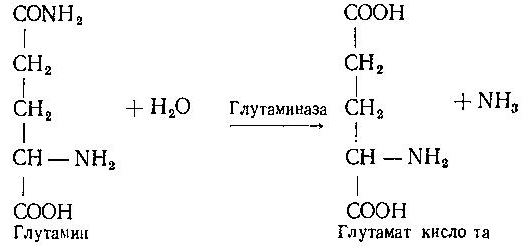 ШундаЙ қилиб, турли реакциялар натижасида ҳосил бўладиган аммиак қуйидаги процесслар орқали бартараф этилиши ёки орга-низмдан ташқарига чиқарилиши мумкин. 1. Сийдик билан чиқарилади, бу процесснинг ўзнга хос хусу-сияти шундан иборатки, аммиак ^Н*+ шаклида чиқарилади: Кўрсатилган процесс ёрдамида турли моддалар алмашинуви реак-цияларида ҳоьил бўладиган Н+ иони хам организмдан ташқарига 'чи-қарилади. 2. Глутаматдегидрогеназа фэрменти иштирок этадиган глутамат кислота ва бошқа аминокислоталар синтези учун ишлатилади. 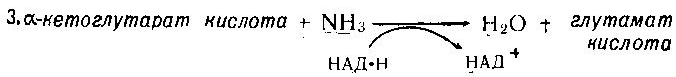 4. Глутамин-мочевина ва пиримндин нуклеотидлар биосинтезида асоеий бошланғич хомашё сифатида ишлатилади. |
