2312увцфв. Методичка патофизиология органов и систем. Учебное пособие для студентов высших медицинских учебных заведений ivуровня аккредитации
 Скачать 1.54 Mb. Скачать 1.54 Mb.
|
|
Типовые виды нарушений и реактивных изменений в системе эритроцитов Выделяют две основные группы типовых видов нарушений и реактивных изменений в системе эритроцитов: анемии и эритроцитозы. АНЕМИИ. ОБЩАЯ ХАРАКТЕРИСТИКА. КЛАССИФИКАЦИЯ Анемия (малокровие) — состояние, характеризующееся уменьшением общего объема эритрона, протекающее с понижением в единице объема крови количества эритроцитов и (или) Нb, нередко сопровождающееся их качественными изменениями. Это в большинстве случаев синдром, развивающийся при различных заболеваниях, иногда являющийся основным, центральным проявлением болезни. Истинные анемии представляют собой олигоцитемические гипо- или нормоволемии, характеризующиеся снижением гематокрита. От них следует отличать ложные анемии, относящиеся к олигоцитемическим гиперволемиям, которые также протекают с пониженным гематокритом и являются следствием гипергидратации и гемодилюции (разведения крови). При анемии страдает основная функция эритроцитов — перенос кислорода к тканям организма, что вызывает нарушение окислительных процессов и развитие гипоксии. Больше всего гипоксия отражается на функциях центральной нервной системы и сердца: быстро наступает утомляемость, наблюдаются слабость, головокружение, ухудшается память и развивается дистрофия миокарда. На развитие гипоксии влияют степень малокровия и скорость его развития, а также степень и скорость адаптации организма к изменившимся условиям существования. Последнее достигается включением компенсаторных механизмов, направленных на обеспечение физиологической потребности тканей в кислороде. В борьбу с анемическим состоянием включаются нервные, сердечнососудистые, дыхательные, гемические и тканевые компенсаторные приспособления. Существует множество классификаций анемий, основанных на различных принципах. Широко используемой является классификация по патогенетическому принципу. Виды анемий
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ОТДЕЛЬНЫХ ФОРМ АНЕМИЙ Постгеморрагические анемии Острая постгеморрагическая анемия Возникает в результате острой массивной потери крови в объеме от 5 мл/кг массы тела и выше (травма, хирургическое вмешательство, желудочные, маточные, кишечные кровотечения, разрыв фаллопиевых труб, нарушение гемостаза и др.). Сразу после потери крови вследствие уменьшения ее массы появляется общеанемические признаки — тахикардия, одышка, бледность кожных покровов и слизистых оболочек, падение АД. Содержание эритроцитов и гемоглобина снижается равномерно (нормоцитемическая гиповолемия), развивается нормохромная анемия. Изменения периферической крови носят стадийный характер. На 2–3-е сутки после кровотечения в кровь поступает тканевая жидкость, масса ее восстанавливается (гидремическая фаза), а количество эритроцитов и гемоглобина снижается, падает гематокрит, но в связи с выходом эритроцитов из депо цветовой показатель сохраняется в норме (нормохромная анемия), развивается лейкопения (утрата лейкоцитов во время кровотечения, гемодиллюция), тромбоцитопения (утрата тромбоцитов при потере крови, потребление при образовании тромба). Наблюдается умеренный анизоцитоз и пойкилоцитоз эритроцитов. Возникшая гипоксия ведет к повышению уровня эритропоэтина и на 4–5-е сутки после кровотечения активируется функция костного мозга (костномозговая фаза компенсации) появляются регенеративные формы эритроцитов — полихроматофилы, единичные нормобласты (полихроматофильные, оксифильные), ретикулоцитоз. Анемия приобретает гипохромный характер, т. к. ускоренная регенерация опережает созревание эритроцитов из-за возникшего дефицита железа. Развивается нейтрофильный лейкоцитоз со сдвигом влево по регенеративному типу. Данные нарушения обусловлены уменьшением объема циркулирующей крови и гипоксией. В ответ на кровопотерю включаются механизмы компенсации, направленные на восстановление утерянного объема крови и на борьбу с анемическим состоянием (гипоксией). Хроническая постгеморрагическая анемия. Развивается в результате длительно повторяющихся небольших кровотечений. Является вариантом железодефицитных анемий, патогенез и проявления обусловлены нарастающим дефицитом железа. Дизэритропоэтические анемии (вследствие нарушения эритропоэза) К данной группе заболеваний относятся анемии: а) объединенные общим механизмом возникновения, связанным с нарушением или прекращением эритропоэза в результате дефицита веществ, необходимых для нормального кроветворения — дефицитные анемии (В12-, В6-, В2-фолиеводефицитные, железо-медь-кобальтдефицитные, белководефицитные), а также анемии, возникающие при неспособности костного мозга усваивать гемопоэтические факторы — ахрестические анемии (сидероахрестические, В12-ахрестические и др.); б) вызванные поражением костного мозга токсическими и лекарственными веществами, ионизирующим излучением (апластические анемии); в) при лейкозах, метастазах опухолей в костный мозг (метапластические анемии). Железодефицитная анемия (ЖДА) Железо — один из важнейших микроэлементов, входящих в состав организма человека. Взрослому человеку требуется 15–18 мг/сут железа, из которых всасывается 2–2,5 мг. Основные депо железа: печень (гепатоциты и макрофаги), костный мозг, селезёнка, мышцы. ЖДА составляет около 80–90 % всех случаев анемий и является одной из самых распространенных ее форм. Женщины страдают данным заболеванием чаще, чем мужчины, поскольку запасы железа у последних значительно превышают (на 100–200 %) таковые у женщин. Железодефицитные анемии встречаются во всех возрастных группах. Различают «истинные» ЖДА — при абсолютном дефиците железа и «ложные» — при нарушении включения железа в гем, в отсутствие первичного истинного железодефицита. Причиной развития ЖДА могут быть: 1) хронические, даже необильные и скрытые кровопотери (маточные, желудочно-кишечные, почечные, легочные, носовые, десневые и пр.); 2) недостаточное поступление железа с пищей (у детей — при искусственном вскармливании коровьим или козьим молоком; у новорожденных является следствием дефицита железа у матери во время беременности, у недоношенных, при многоплодии); 3) усиленный расход железа в период роста и созревания, в период беременности, лактации; 4) пониженное всасывание железа после резекции желудка, части тонкого кишечника, заболеваниях кишечника, синдроме мальабсорбции; 5) нарушение обмена и утилизации железа при инфекциях, интоксикациях, глистных инвазиях); 6) обширные хронические очаги инфекции, быстро растущие опухоли (перераспределительный дефицит железа); 7) нарушение транспорта железа (гипо-, атрансферринемия). Нередко действуют комбинации указанных факторов, вызывающих отрицательный баланс железа. Примером ЖДА, развивающейся вследствие комплексного влияния нескольких факторов, является хлороз (от греч. «хлорос» — бледно-зеленый, или «бледная немочь»). Название связано со специфическим цветом лица таких больных. При ЖДА уменьшается содержание железа в плазме крови, костном мозге и в тканевых депо. Содержание Нb колеблется в зависимости от тяжести анемии от 30 до 100–110 г/л. Количество эритроцитов снижено в меньшей степени, чем уровень Hb (но может быть даже нормальным). Снижение количества эритроцитов объясняют снижением пролиферативной активности эритрона, возрастанием интенсивности неэффективного эритропоэза, некоторым укорочением продолжительности жизни эритроцитов. ЦП резко снижен (0,6–0,3), наблюдаются гипохромия, микроцитоз, анизо- и пойкилоцитоз эритроцитов. Нередко развивается нейтропения (в результате уменьшения содержания железосодержащих ферментов в лейкоцитах). СОЭ незначительно увеличена. Содержание железа в сыворотке снижено (сидеропения) до 2,0–5,0 мкМ/л (норма — 12–32 мкМ/л). Уровень тромбоцитов может быть незначительно повышен (на фоне кровотечений). Ретикулоцитарный индекс чаще соответствует гипорегенеративному состоянию. Клиническая картина складывается из двух основных синдромов: общеанемического и сидеропенического. Общеанемический синдром проявляется симптомами, характерными для всех видов анемии: бледность, общая слабость, быстрая утомляемость, обмороки, одышка, тахикардия, систолический шум. Сидеропенический синдром характеризуется рядом трофических нарушений. Отмечаются: сухость и трещины кожи, преждевременные морщины, ломкость ногтей, койлонихия (катлонихия) — ложкообразные ногти, ангулярный стоматит, атрофия слизистых оболочек рта, пищевода, желудка, дыхательных путей. Нарушается иммунитет, что приводит к хронизации инфекций, частым ОРЗ; развивается мышечная слабость, нарушается память, концентрация внимания. При дефиците железа резко усиливается абсорбция свинца, и у детей на этом фоне развивается необратимая задержка интеллектуального развития. Нарушение проницаемости мелких сосудов ведет к отекам лица. Иногда возникает «сидеропенический субфебрилитет». Железонасыщенная (сидероахрестическая, сидеробластная, железо-рефрактерная) анемия Объединяет группу наследственных или приобретенных анемий, при которых нарушается активность ферментов, участвующих в синтезе порфиринов и гема. Количество эритроцитов снижается в меньшей степени, чем содержание Нb. ЦП достигает 0,6–0,4. Имеет место выраженная гипохромия, базофильная пунктация цитоплазмы, анизоцитоз, пойкилоцитоз эритроцитов. Содержание железа в сыворотке крови значительно увеличено (60–90 мкмоль/л). Содержание лейкоцитов, тромбоцитов, лейкоцитарная формула остаются нормальными, если не нарушается функция печени. Увеличивается количество сидеробластов в костном мозге. Анемии, связанные с дефицитом витамина В12 и фолиевой кислоты Объединяют обширную группу наследственных, врожденных и приобретенных анемий, развивающихся в результате нарушения синтеза нуклеиновых кислот, общим признаком их является появление в костном мозге и периферической крови мегалобластов. Чаще наблюдаются анемии вследствие дефицита витамина В12, реже — фолиевой кислоты. У детей чаще встречается дефицит фолиевой кислоты. Анемии вследствие комбинированного дефицита витамина В12 и фолиевой кислоты встречаются редко. В12-дефицитная анемия. Классическая разновидность — анемия при болезни Аддисона–Бирмера (злокачественная, пернициозная), проявляется триадой симптомов: 1) нарушением процесса кроветворения; 2) атрофическими изменениями слизистой желудочно-кишечного тракта; 3) нарушениями со стороны нервной системы. Этиология. Экзогенная недостаточность витамина В12 встречается редко. Эндогенная недостаточность может возникнуть при уменьшении или полном подавлении выработки гастромукопротеина париетальными клетками желудка, что обусловлено: а) наследственным дефектом, передающимся аутосомно-рецессивно (выявляется у 1/3 больных); б) иммунными механизмами (у 50 % больных обнаруживаются антитела против внутреннего антианемического фактора или париетальных клеток желудка); в) токсическим воздействием на слизистую желудка; г) гастроэктомией; д) раком желудка и пр. Эндогенная недостаточность возникает и при нарушении процесса всасывания витамина В12 в кишечнике (резекция тонкого кишечника, энтеропатии и пр.), при повышенном расходовании витамина В12 (беременность, инвазия лентеца широкого). Патогенез. В норме витамин В12 (внешний антианемический фактор) образует комплекс с гастромукопротеином (внутренним антианемическим фактором), который взаимодействует со специфическими рецепторами в нижней и средней частях подвздошной кишки, что обеспечивает всасывание витамина В12. Около 1 % витамина В12 может всосаться независимо от внутреннего фактора. Один из коферментов витамина В12 — метилкобаламин участвует в нормальном кроветворении. С его участием из уридинмонофосфата образуется тимидинмонофосфат, входящий в состав ДНК. Для синтеза тимидинмонофосфата необходима также фолиевая кислота. При отсутствии метилкобаламина ДНК не образуется, нарушаются процессы деления активно регенерирующих клеток, наиболее резко проявляющиеся со стороны эритропоэза; нормобластический тип кроветворения переходит в мегалобластический. Для последнего характерны сравнительно меньшее число митозов , удлинение времени митотического цикла, ранняя гемоглобинизация мегалобластов, снижение осмотической резистентности мегалоцитов, сокращение продолжительности их жизни, увеличение неэффективного эритропоэза, сокращение продолжительности жизни эритроцитов, повышение активности гемолитических свойств плазмы крови, что ведет к развитию билирубинемии. Появляются экстрамедуллярные очаги мегалобластического кроветворения. Нарушается также лейко- и тромбоцитопоэз. Второй кофермент — дезоксиаденозилкобаламин участвует в обмене жирных кислот, в превращении метилмалоновой кислоты в янтарную. При дефиците витамина В12 в организме накапливается метилмалоновая кислота, вызывающая дистрофию заднебоковых столбов спинного мозга, развитие фуникулярного миелоза, нарушение функции центральной нервной системы. Картина крови характеризуется резко выраженной гиперхромной анемией (ЦП > 1,0). Количество эритроцитов снижается в большей степени, чем Нb, обнаруживают лейкопению с нейтропенией, относительный лимфоцитоз, тромбоцитопению. В мазке выявляют мегалобласты, мегалоциты, анизоцитоз, пойкилоцитоз, макроцитоз, эритроциты с тельцами Жолли, кольцами Кабо, базофильной зернистостью, гигантские полисегментоядерные нейтрофилы, снижается число ретикулоцитов , СОЭ увеличивается. В костном мозге иногда отсутствуют оксифильные мегалобласты, преобладают базофильные формы («синий костный мозг»). В клетках отмечаются дегенеративные изменения. Нарушения в желудочно-кишечном тракте и нервной системе усугубляют течение анемии. Развиваются глоссит Гунтера (воспаление с последующим формированием «лакированного» языка в связи с атрофией его сосочков), стоматит, гастроэнтероколит. Неврологический синдром проявляется психическими расстройствами (бред, галлюцинации), шаткой походкой, парестезиями, болевыми ощущениями, онемением конечностей, парапарезами, возникновением патологических рефлексов и др. Фолиеводефицитная анемия. Причиной развития данного заболевания является недостаточное поступление в организм фолиевой кислоты с пищей (голодание, особенно в детском возрасте при одностороннем вскармливании козьим молоком; часто встречается в жарких странах); нарушение всасывания (кишечная мальабсорбция, алкоголизм, энтериты, энтеропатии, применение некоторых лекарственных препаратов); повышенные потребность в фолиевой кислоте и расходование её (беременность, лактация, состояние напряжённой адаптации и др.). Недостаточность фолиевой кислоты в организме вызывает нарушения процесса синтеза и структуры ДНК, что обусловливает переход нормобластического типа кроветворения к мегалобластическому со всеми вытекающими отсюда последствиями. Картина крови и клинические проявления данного заболевания аналогичны таковым при В12-дефицитной анемии, однако отсутствуют гастроэнтероколитический и неврологический синдромы. В12-ахрестическая анемия При данной анемии процесс выработки внутреннего антианемического фактора не нарушается, отсутствуют изменения со стороны пищеварительной и нервной систем. Развитие этой анемии связывают с нарушением метаболизма метилкобаламина, в результате чего костный мозг утрачивает способность утилизировать гемопоэтические вещества, возникает мегалобластический эритропоэз. Картина крови, как при В12- и фолиеводефицитной анемиях. Содержание витамина В12 в плазме крови бывает нормальным или повышенным. Картина крови аналогична таковой при В12 и фолиеводефицитных анемиях. Апластические анемии. Синдром костномозговой недостаточности Анемии этой группы могут быть приобретенными (вторичными) и наследственными, врожденными (первичными). Приобретенные формы могут развиться под влиянием физических (ионизирующее излучение), химических (бензол, мышьяк и пр.) факторов, лекарственных препаратов (некоторые антибиотики — левомицетин, сульфаниламиды, антиметаболиты — метотрексат и пр.), а также вследствие недостатка гормонов (микседема, гипофизарная недостаточность); возникновения злокачественных опухолей; вирусных инфекций (острый вирусный гепатит, ВИЧ-инфекция, миллиарный туберкулез и др.); действия аутоантител. При данном заболевании преимущественно повреждаются стволовые клетки или клетки-предшественницы миелопоэза. Высокие дозы ионизирующего излучения приводят к гипоплазии костного мозга, необратимому повреждению и гибели стволовых клеток, вплоть до их полного исчезновения. Химические факторы, лекарственные препараты могут нарушать синтез нуклеиновых кислот и белка в стволовых клетках, их клеточное и (или) физико-химическое микроокружение, обусловливать расстройство механизма их пролиферации, вызывать повреждение и гибель стволовых клеток в связи с образованием иммунных лимфоцитов и (или) антител. Наследственная апластическая (конституциональная, анемия Фанкони) передается по аутосомно-рецессивному типу. Апластические анемии являются главным проявлением синдрома костномозговой недостаточности. Для такого состояния характерны: - уменьшение объема гемопоэтической ткани; - замещение костного мозга жировой тканью; - панцитопения в периферической крови (выраженная анемия, Нb — 20–30 г/л; нормохромия, макроцитоз, сниженное количество ретикулоцитов, повышенное содержание HbF, лейкопения, абсолютная нейтропения, относительный лимфоцитоз, тромбоцитопения, повышенная СОЭ); - общеанемический синдром (бледность, вялость, одышка и др.); - иммунодефицитный синдром (инфекции, сепсис); - геморрагический синдром (петехии, кровоподтеки, кровотечения); - гемолитический синдром (короткоживущие эритроциты); - увеличение содержания железа в сыворотке крови как следствие нарушения включения железа в гемоглобин (насыщение им трансферрина достигает 100 %); - высокий уровень эритропоэтина в крови при сниженной эффективности его действия на костный мозг. В таких случаях повреждаются клетки-предшественницы миелопоэза. Иногда формируются антитела к клеткам красного ряда, что дает основа-ние предполагать аутоиммунный механизм развития такого рода анемий. Метапластическая анемия Данная патология возникает при разрастании в костном мозге клеток, не имеющих отношения к эритропоэзу (острый лейкоз, множественная миелома, миелофиброз, остеомиелосклероз, метастазы опухолей). Картина крови определяется основным заболеванием. Гемолитические анемии (ГА) Группа анемий, наследственно обусловленных (40 %) или приобретенных (60 %), общим признаком которых является укорочение жизни эритроцитов. При этом имеет место стойкое (хроническая ГА) или массированное (острая ГА) преобладание разрушения эритроцитов над их обра-зованием. Проявляется заболевание синдромами усиленного гемолиза и компенсаторного усиления эритропоэза. Усиление гемолиза (гемолитические кризы) наблюдается при всех ГА и нередко развивается после интеркуррентных заболеваний, большой физической нагрузки, в результате стрессов, интоксикаций и т. д. В ряде случаев провоцирующий агент установить не удается. Наследственно-обусловленные гемолитические анемии (первичные) Эритроцитопатии. Наиболее часто встречается наследственный семейный сфероцитоз (микросфероцитоз, болезнь Минковского–Шоффара, белковозависимая мембранопатия). Заболевание наследуется аутосомно-доминантным путем. В основе его развития лежит дефект структуры мембраны эритроцитов, что приводит к изменению их формы с дискоидной на сферическую. Такие эритроциты не деформируются и при прохождении через узкие капилляры теряют часть мембранного вещества, уменьшаются в размерах, разрушаются. Их мембрана становится высокопроницаемой для ионов натрия и воды.  Основными клиническими проявлениями заболевания являются периодические гемолитические кризы, анемия, желтуха, спленомегалия, уробилинемия, уробилинурия, повышение температуры, трофические язвы голени в результате микротромбоза. При этом содержание Нb и эритроцитов в крови уменьшается, развивается нормохромия, микросфероцитоз, ретикулоцитоз (10 % и более), снижается осмотическая резистентность эритроцитов. Во время гемолитических кризов наблюдается нейтрофильный лейкоцитоз. Ферментопатии (энзимопатии). Данные заболевания объединяют группу ГА, которые проявляются недостаточностью активности ферментов эритроцитов, участвующих в процессе их энергетического обеспечения - анемия, вызванная дефицитом активности глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) эритроцитов. Для болезни характерно раннее проявление, нередко в период новорожденности. Она может сочетаться с гемофилией и дальтонизмом и клинически проявляется главным образом у мужчин. У женщин яркая клиника возможна только в случае наличия у них гомозиготности по данному гену. При недостаточной активности Г-6-ФДГ в эритроцитах нарушается аэробное окисление глюкозы, что ослабляет процессы образования восстановленного НАДФ и восстановления глютатиона, необходимого для защиты Нb и мембраны эритроцитов от окислителей, в том числе и лекарственных веществ. Встречается при приеме обычных лечебных доз лекарств — окислителей (противомалярийных препаратов, сульфаниламидов, производных салициловой кислоты и др.), при приеме с пищей конских бобов (фавизм — «багдадская весенняя лихорадка», иногда при вирусных инфекциях, гиповитаминозах Р, С, Е, отравлениях анилином, бензолом, фенилгидразином, в результате приема с пищей в больших количествах голубики, черники, вдыхания пыльцы трав, деревьев и т. д. Для гемолитических кризов характерны: высокая температура, головная боль, адинамия, гемоглобинурия, желтуха, гепатомегалия. Эти явления обусловлены освобождающимися при повреждении эритроцитов медиаторами воспаления, в том числе и пирогенными цитокинами. В картине крови отмечаются: анемия тяжелой степени, ретикулоцитоз, эритроциты с тельцами Гейнца, анизоцитоз, пойкилоцитоз, шизоциты, базофильная пунктация эритроцитов, нормобластоз, нейтрофильный лейкоцитоз со сдвигом влево (до миелоцитов). Гемоглобинопатии (гемоглобинозы). Возникают в результате наследственных нарушений синтеза глобина. Они могут быть качественные, обусловленные изменением первичной структуры Нb (серповидноклеточная анемия), и количественные, обусловленные нарушением скорости процесса синтеза одной из цепей глобина (талассемии). Большинство гемоглобинопатий наследуется аутосомно-доминантно. Серповидноклеточная анемия (гемоглобинопатия S, дрепаноцитоз). Наиболее частая форма патологии, связанная с аномалией структуры Нb. Распространена она во многих тропических районах Африки, где малярия носит эндемический характер. Возникает эта патология, когда в β-цепи Нb глютаминовая аминокислота заменяется на валин, что ведет к изменению физико-химических свойств молекулы гемоглобина (HbS). В восстановленном состоянии растворимость НbS резко снижается, молекулы агрегируют, и в результате образуется гель и кристаллы. Появляющиеся при этом полимеры представляют собой длинные нити, группирующиеся в так называемые тактоиды. Последние изменяют форму эритроцита, в результате чего формируются серповидные эритроциты (дрепаноциты), которые легко подвергаются гемолизу. Для картины крови данного заболевания характерны анемия со значительным снижением числа эритроцитов и Нb, гипо- или нормохромия, анизоцитоз, пойкилоцитоз, базофильная пунктация эритроцитов, наличие дрепаноцитов, ретикулоцитоз, иногда нормобластоз, во время гемолитического криза — нейтрофильный лейкоцитоз со сдвигом влево, тромбоцитоз. Талассемии (болезнь Кули, средиземноморская анемия). Объединяют группу наследственных анемий, при которых наличие мутантного гена приводит к торможению синтеза цепей глобина, дефициту НbА. В картине крови отмечаются гипохромная анемия (ЦП = 0,5–0,4), анизоцитоз, микроцитоз, пойкилоцитоз, гипохромия, большое количество мишеневидных эритроцитов (тороцитов), базофильная пунктация эритроцитов, ретикулоцитоз (5–10 %), умеренный нейтрофильный лейкоцитоз со сдвигом влево, повышение уровня сывороточного железа. Приобретенные гемолитические анемии Возникают при появлении аутоантител к собственным эритроцитам организма (аутоиммунные); воздействии изоиммунных антител (переливание несовместимой крови, гемолитическая болезнь новорожденных); лекарственных веществ (сульфаниламиды и пр.); механическом повреждении эритроцитов (протезирование клапанов сердца, маршевая гемоглобинурия и пр.); вирусных инфекциях; действии химических и физических факторов (соли свинца, яды змей, ожоги, ультрафиолетовое облучение и пр.). Общий механизм гемолиза эритроцитов заключается в дезорганизации фосфолипидно-белковой структуры их мембраны. В картине крови в первые часы развития анемии отмечается кратковременная «ложная» гиперхромия, затем развивается анемия нормохромная или гипохромная, нормобластическая, регенераторная или гиперрегенераторная с полихроматофилией, ретикулоцитозом, нормобластозом, иногда с пойкилоцитозом, лейкоцитоз. В крови увеличивается содержание непрямого билирубина. Синдром усиленного гемолиза сочетается с синдромом усиления эритропоэза. В костном мозге увеличивается число клеток эритроидного ростка. Эритроцитоз Эритроцитоз — состояние, характеризующееся увеличением количества эритроцитов и Нb в единице объема крови, повышением гематокрита. Различают эритроцитозы абсолютные (истинные) и относительные (ложные). Абсолютные эритроцитозы возникают в результате усиления эритропоэза и сопровождаются увеличением массы циркулирующих эритроцитов. Они бывают первичными и вторичными. Первичные эритроцитозы представляют собой самостоятельные нозологические формы — болезни. К ним относятся: 1) эритремия (истинная полицитемия, болезнь Вакеза) — злокачественное заболевание, рассматриваемое в группе гемобластозов; при этой патологии усиленная пролиферация клеток эритрона не связана с повышением концентрации эритропоэтина, а является результатом «внутреннего» дефекта, позволяющего пролиферирующим клеткам ускользать от нормальных регулирующих воздействий или избегать апоптоза; 2) «семейные» (наследуемые) эритроцитозы, проявляющиеся неопухолевой активацией пролиферации эритроидных клеток костного мозга. Эти формы мало изучены. Вторичные эритроцитозы являются симптомом того или иного заболевания. Чаще всего они развиваются при гипоксии и усилении процесса выработки эритропоэтинов (заболевания органов дыхания, сопровождающиеся дыхательной недостаточностью, врожденные пороки сердца, рак паренхимы почки и др.). При этом имеют место умеренная полицитемическая гиперволемия, повышение гематокрита, вязкости крови, артериального давления, может развиться гипертрофия миокарда, нарушение ритма и сократительной функции сердца, кожный зуд, тромбогеморрагический синдром. Кроме эритроцитоза в периферической крови отмечается ретикулоцитоз. Относительные эритроцитозы (ложные) развиваются вследствие уменьшения объема плазмы и сгущения крови без усиления эритропоэза. Причины относительного эритроцитоза: обезвоживание организма при усиленном потоотделении, ожогах, профузных поносах, рвоте и пр. При ложных эритроцитозах ухудшаются реологические свойства крови, нарушается микроциркуляция, что способствует развитию стаза и тромбоза. Все перечисленные эритроцитозы являются патологическими. К физиологическим эритроцитозам относятся эритроцитоз у жителей высокогорья, у альпинистов в период акклиматизации на больших высотах и после них, а также в других аналогичных ситуациях адаптации к хронической гипоксии. Система лейкоцитов (лейкон) и ее нарушения Лейкон (белая кровь) представляет собой совокупность белых клеток крови, находящихся на всех стадиях развития, а также механизмы их образования и разрушения. Белые кровяные клетки — лейкоциты — представляют собой гетерогенную популяцию ядросодержащих клеток, отличающихся морфологически и функционально, они делятся на гранулоциты и агранулоциты. Гранулоциты содержат цитоплазматические гранулы, хорошо различимые в световом микроскопе. По цвету гранул гранулоциты подразделяются на нейтрофилы, эозинофилы, базофилы. Агранулоциты подразделяются на лимфоциты и моноциты. В норме число лейкоцитов у человека составляет 4–9×109/л. Процентное соотношение отдельных их видов называется лейкоцитарной формулой. Абсолютное количество лейкоцитов каждого вида в единице объёма крови называется лейкоцитарным профилем Патологические формы лейкоцитов: - Нейтрофил с гиперсегментацией ядер - Нейтрофил с гипосегментацией ядра - Лейкоцит с токсической зернистостью - Лейкоциты с вакуолизацией ядра и цитоплазмы - Гранулоциты с кольцевыми ядрами. Образуются при хроническом алкоголизме. - Лейкоциты с тельцами Князькова–Деле ( при инфекционных заболеваниях в сочетании с токсической зернистостью или цитоплазматическими вакуолями). - Тельца Боткина–Гумпрехта–Клейна (клеточные тени). Раздавленные при приготовлении мазков неполноценные, хрупкие лимфоциты или лимфобласты. Обнаруживаются при хроническом лимфолейкозе (изредка и при остром). - Клетки Риддера. Представляют собой лимфоциты с почкообразным или двухдольчатым ядром. Встречаются при лимфолейкозах. Симптоматические изменения системы лейкоцитов К таковым изменениям количества лейкоцитов в единице объема крови относятся лейкопении и лейкоцитозы. Они не являются самостоятельными заболеваниями, а представляют собой симптомы различных болезней, патологических процессов, состояний, имеют определенное диагностическое значение. Лейкопении Лейкопения — это снижение количества лейкоцитов в единице объема крови менее 4×109/л. Лейкопения бывает: - абсолютная (уменьшение абсолютного числа отдельных видов лейкоцитов) и относительная (уменьшение процентного содержания отдельных видов лейкоцитов за счет увеличения других их видов); - физиологическая и патологическая. Физиологическая (конституциональная безвредная лейкопения) встречается в 2–12 % у практически здоровых людей европейской расы. У таких людей содержание лейкоцитов не превышает 2×109/л при отсутствии признаков подавления лейкопоэза или иммунодефицита. Физиологической является перераспределительная лейкопения, возникающая при перемещении значительной части лейкоцитов в какие-либо участки сосудистого русла. Патологические лейкопении бывают первичные (врожденные, наследственные) и вторичные (приобретенные). К первичным лейкопениям (главным образом к нейтропениям) относятся лейкопении при синдромах «ленивых» лейкоцитов и Чедиака–Хигаси, а также семейные нейтропении, хроническая гранулематозная болезнь и др. Вторичные лейкопении развиваются вследствие действия ионизирующего излучения, некоторых лекарственных средств (сульфаниламиды, барбитураты, левомицетин, циклофосфан и другие цитостатики) при длительном их применении. Они могут развиться и при болезнях иммунной аутоагрессии, генерализованных инфекциях (брюшной тиф, паратиф, грипп, корь, гепатит), при кахексии и др. В основе патогенеза лейкопении лежат процессы: нарушения и/или угнетение лейкопоэза; чрезмерного разрушения лейкоцитов в сосудистом русле или органах гемопоэза; перераспределения лейкоцитов в сосудистом русле (носит временный характер); наблюдается при шоке, тяжёлой, длительной мышечной работе, развитии феномена «краевого стояния» лейкоцитов; повышенная потеря лейкоцитов организмом наблюдается при хронической кровопотере, плазмо- и лимфорее. При выраженной лейкопении снижается противоопухолевая и противоинфекционная резистентность, поскольку лейкоциты участвуют в реализации гуморального и клеточного звеньев иммунитета. В таких случаях часто отмечается генерализация септического процесса, инфицирование организма, могут развиться новообразования. Агранулоцитоз — клинико-гематологический синдром, характеризующийся уменьшением или даже исчезновением из крови гранулоцитов, лейкопенией и появлением инфекционных осложнений («агранулоцитарная ангина», стоматиты, некротическая энтеропатия, уросепсис и др.). Поскольку агранулоцитоз чётко не отличается от гранулоцитопении, клинически протекающей бессимптомно, условно за данный синдром принимают состояние, при котором содержание в крови гранулоцитов менее 0,75×109/л, а общего числа лейкоцитов — менее 1,0×109/л. Основными формами агранулоцитоза являются миелотоксический и иммунный (гаптеновый). Причинами миелотоксического агранулоцитоза являются цитостатические препараты, алиментарные факторы (употребление в пищу перезимовавших на полях злаков), а также все виды ионизирующего излучения, подавляющего клетки-предшественницы миелопоэза вплоть до стволовой клетки, в связи с чем в крови уменьшается число не только гранулоцитов, но и эритроцитов, агранулоцитов, тромбоцитов. Причинами иммунного агранулоцитоза может являться необычная чувствительность организма к некоторым лекарствам (сульфаниламидам, амидопирину и его производным, барбитуратам и др.). При этом образуются антилейкоцитарные антитела. Они, фиксируясь на поверхности лейкоцитов, разрушают, главным образом, зрелые гранулоциты (иногда и ранние стадии гранулопоэза). Как правило, при иммунном агранулоцитозе снижается содержание только лейкоцитов. Панмиелофтиз (истощение костного мозга, «чахотка» костного мозга) — подавление всех функций костного мозга: эритро-, лейко- и тромбоцитопоэтической. При этом происходит тотальное опустошение костного мозга — в его пунктатах обнаруживаются лишь единичные ядерные элементы. В крови отмечаются нарастающая необратимая апластическая анемия гипо-, нормо- или гиперхромного характера, а также лейкопения с агранулоцитозом и тромбоцитопения. ЛЕЙКОЦИТОЗЫ Лейкоцитоз — состояние, характеризующееся увеличением числа лейкоцитов в единице объема крови выше нормы (более 9×109/л). Число лейкоцитов в крови не постоянно и зависит от функционального состояния организма. Оно возрастает во второй половине дня и снижается утром, возрастает в горизонтальном и уменьшается в вертикальном положении тела. Лейкоцитозы бывают физиологические и патологические, абсолютные и относительные. Физиологический лейкоцитоз наблюдается у здоровых новорожденных, при беременности, при физической нагрузке («миогенный»), пищеварении («пищеварительный»), при психических переживаниях («эмоциональный»), при смене часовых полюсов («акклиматизационный»). В большинстве случаев физиологический лейкоцитоз носит перераспределительный характер. Патологические лейкоцитозы имеют различную этиологию и встречаются при различных патологических процессах и заболеваниях. Они всегда вторичны по отношению к первичному заболеванию и не постоянны. Абсолютный лейкоцитоз проявляется увеличением абсолютного числа отдельных видов лейкоцитов, относительный — увеличением их процентного содержания за счет уменьшения других видов лейкоцитов. Установлено несколько механизмов развития лейкоцитозов. 1. Усиление нормального лейкопоэза под влиянием лейкопоэтинов (истинные, абсолютные лейкоцитозы). Это бывает при инфекциях, гнойно-септических процессах, при асептическом воспалении , кровотечениях, отравлениях, при облучении. 2. Перераспределение лейкоцитов в сосудистом русле (ложные, относительные лейкоцитозы). Может наблюдаться при травматическом, анафилактическом шоке. Это явление носит временный характер и не сопровождается увеличением молодых форм лейкоцитов. 3. Гиперпродукция лейкоцитов при опухолевом поражении гемопоэтической ткани (лейкозах) является результатом увеличения общего числа лейкоцитов за счет активации пролиферации опухолевых клеток и стимуляции деления и созревания нормальных лейкоцитов вследствие появления в организме опухолевых антигенов. 4. Гемоконцентрация ( её обусловливает гипогидратация организма с развитием гиповолемии ). При общем нормальном количестве лейкоцитов содержание их в единице объема крови увеличено; повышено также и количество других форменных элементов крови. При лейкоцитозах изменяется не только общее число лейкоцитов, но и лейкоцитарная формула. По морфологическим признакам различают нейтрофильный, эозинофильный, базофильный лейкоцитозы, лимфоцитоз и моноцитоз. Для большинства инфекций, в особенности кокковых, характерен нейтрофильный лейкоцитоз (нейтрофилия). Он развивается также при раковых метастазах в костный мозг, при инфаркте миокарда, острой кровопотере и др. Эта патология может сопровождаться ядерными сдвигами лейкоцитарной формулы. Различают следующие разновидности нейтрофильного лейкоцитоза. 1. Без ядерного сдвига — увеличение в крови количества зрелых сегментоядерных нейтрофилов на фоне общего лейкоцитоза. 2. С гипорегенеративным ядерным сдвигом влево (простой) — увеличение содержания палочкоядерных нейтрофилов (свыше 5 %) на фоне умеренного нейтрофильного лейкоцитоза. 3. С регенеративным ядерным сдвигом влево — на фоне нейтрофилии и увеличенного содержания палочкоядерных форм обнаруживаются метамиелоциты (юные). 4. С гиперрегенеративным ядерным сдвигом влево, характеризуется нарастанием числа палочкоядерных нейтрофилов, появлением метамиелоцитов, миелоцитов, отдельных промиелоцитов — крайняя степень напряжения гранулопоэза ( длительное течение септических заболеваний ). 5. С дегенеративным ядерным сдвигом влево — нарастание числа палочкоядерных нейтрофилов без сопутствующего увеличения юных форм; отражает угнетение гранулоцитопоэза после его предшествующей стимуляции; является неблагоприятным признаком. 6. С регенеративно-дегенеративным сдвигом влево — нарастание числа палочкоядерных гранулоцитов, метамиелоцитов, миелоцитов с признаками дегенерации (пикноз ядер, токсигенная зернистость, вакуолизация цитоплазмы и др.); является показателем угнетения функциональной активности костного мозга, может иметь место при тяжелом течении инфекционных заболеваний, эндогенной интоксикации и т. д. 7. Ядерный сдвиг нейтрофилов вправо — появление в крови большого количества полисегментированных (свыше 5 сегментов в ядре) нейтрофилов на фоне уменьшения или исчезновения молодых клеток; отражает картину крови, имеющую место при первичном угнетении гранулопоэза без предшествующей этому стимуляции; развивается при лучевой болезни, болезни Аддисона–Бирмера, цинге, фолиевом дефиците. Сдвиг лейкоцитарной формулы характеризуется индексом ядерного сдвига (ИЯС): 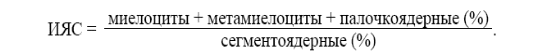 В норме ИЯС равен 0,05–0,1. Состояние, при котором абсолютное число нейтрофилов менее 2000 в 1 мкл крови, — нейтропения. Она может быть селективной (когда количество других лейкоцитов не изменяется) или как проявление панцитопении — дефицита всех форменных элементов крови. Селективная нейтропения бывает врожденной (наследственной) и приобретенной. Приобретенная нейтропения обусловлена угнетением процесса продуцирования нейтрофилов, ускорением их гибели, выраженной маргинацией и эмиграцией этих клеток; бывает при инфекциях (вирусные гепатиты, инфекционный мононуклеоз, краснуха, грипп, ОРВИ, ВИЧ-инфекция, коклюш, брюшной тиф, лейшманиоз и др.). При длительно протекающей инфекции (стрептококковой, туберкулезной, менингококковой) может развиться «нейтропения истощения». Это неблагоприятный прогностический признак. К нейтропении могут привести также аутоаллергия к нейтрофильным антигенам (системная красная волчанка, ревматоидный артрит и др.). Количество эозинофилов в соответствии с лейкоцитарной формулой составляет 2–5 %. Они функционируют главным образом в тканях. Увеличение в крови относительного содержания эозинофилов (выше 5 %) или абсолютное их содержание более 0,45×109/л — эозинофилия. Значительный эозинофильный лейкоцитоз (выше 15–20 %, абсолютное число выше 1,5×109/л) называется большой эозинофилией. Эозинофилия развивается при следующих состояниях: - аллергических процессах (бронхиальная астма, поллинозы, атипический дерматит, отек Квинке, крапивница, лекарственный анафилактический синдром); - паразитарных и глистных заболеваниях (трихинеллез, аскаридоз, эхинококкоз, дифиллоботриоз, цистицеркоз, лямблиоз, чесотка ); - инфекциях (период реконвалесценции) — «розовая заря выздоровления» (скарлатина, болезнь кошачьих царапин, безлихорадочные формы туберкулеза, тонзилогенная инфекция); - иммунопатологических заболеваниях (грибковый аллергический альвеолит, астмаподобные синдромы, развивающиеся в ответ на пенициллин, сульфаниламиды и прочие медикаменты, буллёзная пузырчатка, ревматоидный артрит); - иммунодефицитных состояниях (изолированный дефицит IgA, пневмоцистная пневмония, кокцидиомикоз); - эндокринопатиях (первичный гипокортицизм, болезнь Аддисона, пангипопитуиторизм); - хронических кожных болезнях (псориаз, ихтиоз, разноцветный лишай, рецидивирующий гранулематозный дерматит); - лейкозах и других неоплазмах; - изолированной семейной эозинофилии и наследственном мастоцитозе. Состояние, при котором снижается относительное содержание эозинофилов в крови (ниже 2 %) или их абсолютное число менее чем 0,09×109/л — эозинопения. Полное отсутствие эозинофилов называется анэозинофилией. Эозинопения и анэозинофилия бывают при агранулоцитозе (на фоне нейтропении), сепсисе, в начале развития острых инфекционных заболеваний. Снижение числа эозинофилов при нарастающем лейкоцитозе указывает на обострение процесса, анэозинофилия с лимфопенией является неблагоприятным признаком. На долю базофилов приходится 0–1 % в лейкоцитарной формуле. Они, как и эозинофилы, выполняют дезинтоксикационную функцию. Базофилы являются важным источником лейкотриенов . Гранулы базофилов содержат пероксидазу, гепарин, гистамин, калликреин, фактор хемотаксиса эозинофилов, фактор активации тромбоцитов. Базофилия может быть относительной и абсолютной. Относительная базофилия — увеличение в крови относительного содержания базофилов (более 1 % всех белых клеток). Абсолютная базофилия — состояние, при котором в крови обнаруживается более 0,15×109/л базофилов. Базофилия бывает при анафилактических, аллергических реакциях, при аутоиммунных заболеваниях (неспецифический язвенный колит, коллагенозы), некоторых гельминтозах (анкилостомидоз), ряде аутоиммунных эндокринопатий (микседема, тиреоидит, сахарный диабет первого типа), миелопролиферативных болезнях (эритремия, тромбоцитемия, миелоидная метаплазия, хронический миелолейкоз), гемофилии, пролиферативной фазе острого воспаления, вирусных заболеваниях (ветрянка, грипп), хронических инфекциях (туберкулез), дефиците железа в организме, при раке. Она может быть и у здоровых женщин в период лактации и в начале менструации, и у лиц, перенесших спленэктомию. Отсутствие базофилов в периферической крови (абазофилия) — обычное явление, не отклонение от нормы. Моноциты после выхода из костного мозга циркулируют в кровотоке в течение 20–40 часов, затем уходят в ткани, где происходит их окончательная специализация. Поступившие из кровяного русла в ткани моноциты представляют собой макрофаги (гистиоциты соединительной ткани, купферовские клетки печени, альвеолярные макрофаги, свободные и фиксированные макрофаги селезёнки, костного мозга, лимфоузлов, перитонеальные макрофаги, плевральные макрофаги, остеокласт, клетки микроглии нервной системы). В тканях длительность их жизни колеблется от нескольких месяцев до нескольких лет. Кроме фагоцитоза, моноциты выполняют секреторную и синтетическую функции. Они синтезируют и выделяют ряд медиаторов воспаления: интерлейкины (ИЛ-1, ИЛ-6), интерферон-α, ФНО-α, факторы ангиогенеза, роста фибробластов, ряд прокоагулянтов, белков системы комплемента и др. Увеличение количества моноцитов в крови: относительное (более 8 %, а для детей раннего возраста выше 10 %) или абсолютное (выше 0,800×109/л — у детей, 0,720×109/л — у взрослых) — моноцитоз. Основными этиологическими факторами моноцитоза являются: - бактериемия и инфекционное воспаление, вызванное возбудителями, фагоцитируемыми, главным образом, моноцитами (микобактериоз, бруцеллез, сифилис, брюшной тиф, протозойные инфекции , оспа, сыпной тиф, корь, малярия); - диссеминированный туберкулез, лепра. С лимфомоноцитарной реакцией протекают сифилис, туберкулез, гистоплазмоз, малярия, трипаносомозы (сонная болезнь). Неинфекционными причинами моноцитоза являются: неспецифический язвенный колит, хронический гранулематозный колит, некоторые формы аутоиммунного тиреоидита, иммунопатологического цирроза печени. С моноцитозом протекает ряд гемобластозов (хронический миелолейкоз, лимфогранулематоз, острый миелоидный лейкоз). Моноцитоз имеет место при врожденной нейтропении, состоянии регенерации костного мозга после его подавления, а также при действии некоторых лекарственных препаратов. Уменьшение в крови процентного содержания или абсолютного числа моноцитов — моноцитопении. Они бывают при всех заболеваниях и синдромах, при которых происходит депрессия миелоидного ростка кроветворения (лучевая болезнь, агранулоцитоз, сепсис и т. п.). Транзиторная моноцитопения сопровождает глубокие лейкемоидные сдвиги в картине крови. Лимфоциты — главные клетки иммунной системы. Они отвечают за формирование специфического иммунитета, осуществляют функцию иммунного надзора в организме, обеспечивают защиту от всего чужеродного, сохраняя генетическое постоянство внутренней среды. Лимфоциты — нефагоцитирующие лейкоциты, не имеют ферментативнорецепторного аппарата фагоцитоза, что используется для дифференцировки лимфоидных и миелоидных клеток-предшественниц. Различают В-, Т- и NK-лимфоциты. В-лимфоциты дифференцируются в костном мозге, являются предшественниками плазмоцитов — антителопродуцентов. Т-лимфоциты образуются из стволовых клеток костного мозга, дифференцируются в тимусе, в результате чего формируются зрелые функционально полноценные Т-клетки, осуществляющие клеточный иммунитет Выделяют следующие типы Т-лимфоцитов: - Т-киллеры (обусловливают реакцию отторжения трансплантата и играют определенную роль в противоопухолевом иммунитете); - Т-хелперы (принимают участие во всех иммунных реакциях — гуморальных и клеточных, продуцируют различные цитокины, необходимые как для гуморального, так и клеточного иммунного ответа, т. е. являются «помощниками» в иммунных реакциях, но сами антител не образуют); - регуляторные Т-лимфоциты (блокируют процесс продуцирования антител В-клетками, воздействуют на их рецепторы и препятствуют их контакту с антигенами); - NК-лимфоциты (естественные киллеры) образуются в костном мозге из предшественников лимфоидных клеток; участвуют в неспецифической цитотоксичности по отношению к внутриклеточно расположенным патогенам; проявляют цитотоксичность без предварительной антигенной стимуляции; атакуют аномальные клетки (поврежденные, инфицируемые вирусом, раковые); выделяют цитотоксические гранулы, способные убивать непосредственно или за счет антителозависимой клеточно-опосредованной цитотоксичности. Состояние, характеризующееся увеличением количества лимфоцитов в крови — абсолютного (более 3000×109/л) или относительного (свыше 40 %), — лимфоцитоз. Физиологический лимфоцитоз наблюдается на 4–5-й день после рождения (по количеству лимфоциты преобладают над гранулоцитами — «первый перекрест») и продолжается до 4–5 лет, когда происходит выравнивание относительного содержания лимфоцитов и нейтрофилов на уровне 40–45 % («второй перекрест»). Патологический лимфоцитоз обусловлен иммунным ответом на инфекционный или неинфекционный антиген либо иммуностимулятор. Наблюдается при вирусных инфекциях (герпес, ветряная оспа, свинка, коклюш, опоясывающий лишай, вирусный гепатит и др.), а также при невирусных (болезнь «кошачьих царапин» — доброкачественный лимфоретикулёз, листериоз, токсоплазмоз) и хронически протекающих инфекциях (туберкулёз, сифилис), при некоторых эндокринопатиях (тиреоидизм, микседема, евнухоидизм, акромегалия), при неврастении и других заболеваниях центральной нервной системы, при алиментарной дистрофии. Относительный лимфоцитоз отмечается при брюшном тифе, гриппе, иммунном агранулоцитозе, преимущественно углеводном питании. Состояние, при котором в периферической крови содержится менее 1,5×109/л лимфоцитов, — лимфопения. Если число лимфоцитов менее 1×109/л, говорят о выраженном иммунодефиците. Лимфопения развивается при угнетении лимфоцитопоэза, ускоренной гибели лимфоцитов, нарушении их миграции или при сочетании этих факторов. Ограничение процессов образования лимфоцитов наступает чаще всего при дефиците белков, например, при голодании, в частности, при квашиоркоре. |
