Общая микробиология. Виды микроскопии назначение и принципы применения
 Скачать 1.57 Mb. Скачать 1.57 Mb.
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ НАЦИОНАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ УКРАИНЫ Руководство к лабораторным занятиям по микробиологии для студентов фармацевтических вузов и фармацевтических факультетов Под редакцией доктора медицинских наук, профессора, академика АНТК Украины И.Л.Дикого Харьков – 2000 РАЗДЕЛ «МОРФОЛОГИЯ МИКРООРГАНИЗМОВ» Тема: Виды микроскопии: назначение и принципы примененияЦель: Ознакомиться с принципами и методами изучения морфологии микроорганизмов. Микроорганизмы можно увидеть при помощи оптического прибора – микроскопа. Микроскоп (от греч. micros – малый и scopeo – смотрю) служит для изучения малых объектов, невидимых невооруженным глазом. В микробиологии микроскоп используется для исследования как живых, так и убитых микробов, в окрашенном или неокрашенном виде. В микробиологической практике, в зависимости от целей объективов исследования, применяют различные виды микроскопий: светопольную, фазово-контрастную, аноптральную, люминисцентную, электронную. Вопросы для самоподготовки
Литература
Светопольная микроскопия. Устройство светопольного микроскопа ипорядок работы с ним Обычная светопольная (или световая) микроскопия предназначена для изучения окрашенных микроскопических препаратов, которые интенсивно поглощают свет. На рис. 1 изображен светопольный биологический микроскоп. Его механическая часть состоит из основания (или штатива), коробки с микромеханизмом, предметного столика, тубусодержателя, бинокуляра, револьвера с объективами. В штативе различают нижнюю часть (или ножку), и верхнюю часть (или колонку). К колонке, которая служит ручкой для переноса микроскопа, прикреплен подвижный предметный столик, на который помещается исследуемый объект. Он имеет центрировку и при помощи винтов передвигает препарат в двух взаимно перпендикулярных направлениях. Отсчет перемещения в обоих направлениях может производиться по шкалам и нониусу с точностью до 0,1 мм. К верхней части колонки присоединяется труба микроскопа – тубус. Тубус является подвижной трубкой, к которой прикрепляются линзы, служащие для увеличения исследуемого объекта. Тубус приводится в движение вверх и вниз двумя системами винтов: макровинтом и микровинтом для тонкой фокусировки. Для грубой наводки служит зубчатка, или кремальера, приводимая в движение макрометрическим винтом. Этим винтом пользуются при малых увеличениях, а также при больших увеличениях для грубой первоначальной установки. Перемещение тубуса рукояткой макровинта возможно в пределах 50 мм. Для более точной установки служит микрометрический винт. На правой рукоятке тонкой фокусировки закреплен барабан со шкалой, разделенной на 50 частей. Цена одного деления шкалы барабана 0,002 мм. Один оборот барабана соответствует перемещению тубуса на 0,1 мм. Общая величина перемещения тубуса от упора до упора равна 2,2-2,4 мм. Микрометрический винт является одной из наиболее хрупких частей микроскопа, и обращение с ним требует особой осторожности. Передвигая тубус при помощи этих двух винтов, его устанавливают так, чтобы получить наиболее ясную микроскопическую картину; это достигается, когда расстояние от рассматриваемого объекта до объектива равно фокусному расстоянию этого объектива. Верхняя часть тубусодержателя заканчивается головкой, служащей для крепления револьвера и тубуса. В верхней части тубуса расположен окуляр, а к нижней части его прикреплен револьвер, в гнезда которого ввинчиваются объективы. Револьвер вращается вокруг своей оси, что позволяет поставить тот или другой объектив при желании получить большее или меньшее увеличение. Оптическая часть микроскопа состоит из объективов, окуляра и осветительного устройства. Осветительное устройство находится под предметным столиком и состоит из зеркала и конденсора с диафрагмой. Зеркало служит для отражения световых лучей по направлению к объективу и через него внутрь микроскопа. Одна сторона зеркала плоская, другая вогнутая. Плоским зеркалом пользуются при дневном рассеянном свете, а вогнутым – при искусственном освещении. Конденсор представляет собой двояковыпуклую линзу, прикрепляемую снизу предметного столика с таким расчетом, чтобы линза конденсора располагалась под отверстием предметного столика. Конденсор служит для собирания (конденсации) пучка световых лучей, что обеспечивает наибольшее освещение исследуемого предмета. При микроскопировании с дневным светом конденсор необходимо поднять до уровня предметного столика; при искусственном освещении конденсор опускают до тех пор, пока при малом увеличении изображение источника света не появится в плоскости препарата. При микроскопии неокрашенных препаратов конденсор следует также опустить. Между зеркалом и конденсором помещается диафрагма, которая регулирует объем лучей, падающих на объектив. Она состоит из стальных лепестков и при помощи рычага может менять свой диаметр. Окрашенные препараты следует рассматривать при открытой диафрагме; при изучении неокрашенных препаратов необходимо открыть отверстие диафрагмы. Объективы представляют собой систему двояковыпуклых линз, заключенных в металлическую оправу. Передняя (фронтальная) линза объектива является главнейшей, производящей увеличение. Лежащие за ней линзы корригируют изображение и поэтому называются коррекционными. Степень увеличения исследуемого объекта зависит от кривизны линзы используемого объектива. Чем меньше кривизна линзы, тем меньше увеличение и, наоборот, чем больше кривизна линзы, тем больше увеличение. Обычно объективы микроскопа имеют цифровое обозначение длины фокусного расстояния, которое зависит от кривизны линзы: чем более выпукла поверхность линзы, тем меньше фокусное расстояние и тем больше получаемое увеличение. Характеристика объектива состоит из его собственного увеличения, фокусного расстояния, численной апертуры. Чем меньше фокусное расстояние, тем сильнее объектив, больше его собственное увеличение. На корпусе объектива выгравированы обозначения собственного увеличения (8, 20, 40, 90) и численная апертура. Численная апертура – произведение показателя преломления среды на синус половины отверстого угла – для объектива характеризует угол, под которым еще может входить в объектив наклонный луч. Кроме этих обозначений, на корпусе объективов апохроматов пишется «апохр» и на иммерсионных «ОИ» или «МИ» – объектив иммерсионный (масляный) или «ВИ» – водная иммерсия. Объективы бывают двух систем: ахроматы и апохроматы. Ахроматы устроены проще, но имеют ряд недостатков, которые устранены в более сложных апохроматических объективах. При применении объективов апохроматов достигается полная ясность изображения и устраняется хроматическая аберрация. Последнее особенно важно при микроскопии цветных объектов. Все объективы (ахроматы и апохроматы) разделяются на сухие и иммерсионные. Если между объективом и рассматриваемым препаратом находится воздух, то подобный объектив называется сухим. Если же объектив погружен в жидкость, заполняющую пространство между его фронтальной линзой и препаратом, то подобный объектив называется погруженным, или иммерсионным (immersio – погружаю). При исследовании микробов применяется исключительно иммерсионная, или погружная, система объективов. Иммерсионные объективы имеют преимущество перед сухими. Сравнительный ход световых лучей в сухой и иммерсионной системах представлен на рис. 2. При микроскопии с помощью сухой системы световые лучи, идущие от зеркала через конденсор в объектив, проходят через неоднородные среды, различающиеся показателями преломления. Так, из воздуха (показатель преломления 1,0) пучок световых лучей попадает в стекло (показатель преломления 1,5), затем опять в воздух и, наконец, во фронтальную линзу объектива. При каждом из этих переходов часть лучей, преломляясь на границе разнородных сред, отклоняется в сторону и не попадает в объектив. В результате поле зрения освещается недостаточно, что особенно важно при пользовании сильными увеличительными системами, где очень малы фронтальные линзы. Чтобы избежать этого, объектив погружают в каплю жидкости (иммерсионное масло, вода), показатель преломления которой близок к показателю преломления стекла. Вторую каплю этой же жидкости наносят на конденсор. Таким образом, конденсор, жидкость, препарат, жидкость и объектив представляют собой единую систему, не вызывающую отклонения светового луча. Окуляр (от латинского слова oculus – глаз) состоит из двух плосковыпуклых линз (собирающей и глазной). Он увеличивает изображение, получаемое с помощью объектива, в 7, 10 или 15 раз. Такие простые окуляры обычно применяют с ахроматическими объективами. При работе с апохроматами нужно использовать специальные, так называемые компенсационные, окуляры. В них линзы подобраны таким образом, что они дают хроматическую ошибку, обратную остаточному хроматизму апохромата и потому ее компенсирующую. Следует иметь в виду, что увеличивает объект только объектив, окуляр же увеличивает не исследуемый предмет, а только его изображение, получаемое в объективе. Общее увеличение микроскопа равняется произведению увеличения объектива на увеличение окуляра. Так, например, комбинация иммерсионного объектива Качество микроскопа зависит не только от увеличения исследуемого объекта, но и определяется его разрешающей силой. Под последней следует понимать то наименьшее расстояние между двумя точками препарата, изображения которых можно отчетливо различить под микроскопом. Чем меньше это расстояние, тем больше разрешающая сила. Разрешающая сила биологического микроскопа с иммерсионной системой равна 0,2 мкм. Следовательно, при пользовании таким микроскопом пределом видимости являются объекты размером не меньше 0,2 мкм. Нужно помнить, что иммерсионный объектив требует особого бережного обращения с ним. Опускать этот объектив нужно осторожно, чтобы не раздавить стекло препарата, что влечет за собой порчу фронтальной линзы. Погружать иммерсионный объектив в каплю масла на предметном стекле надо под контролем глаза, наблюдая сбоку, причем глаз должен находиться на уровне предметного столика. После погружения объектива в каплю масла, глядя в окуляр, при помощи макрометрического винта осторожно опускают тубус микроскопа, пока не находят в поле зрения контуры препарата. Затем с помощью микрометрического винта устанавливают точное изображение объекта. По окончании микроскопирования поднимают тубус микроскопа, а затем снимают препарат; фронтальную линзу осторожно вытирают мягкой тряпочкой, иногда смачивая ее спиртом, разведенным водой 1:1. Освещение. При работе с конденсором Аббе независимо от источника света нужно пользоваться только плоским зеркалом. Осветительное устройство (или осветительный аппарат Аббе) составляют зеркало, ирис-диафрагма и конденсор. Зеркало, благодаря тому, что его оправа вмонтирована в специальной вилке, может вращаться в двух взаимно перпендикулярных направлениях. Одна из отражающих поверхностей зеркала плоская, другая вогнутая. Современная ирис-диафрагма, сокращаясь по типу зрачка, позволяет регулировать величину светового пучка, поступающего в конденсор. Это важно потому, что светосила (апертура) конденсора всегда должна быть немного меньше, чем у объектива. Конденсор представляет собой систему линз, вмонтированных в коническую металлическую оправу. Чем больше линз, тем больше светосила конденсора. Для получения отчетливого изображения необходимо, чтобы препарат оказался в фокусе конденсора. С этой целью конденсор передвигается в вертикальном направлении в пределах 20 мм. Ход лучей. Пучок света, отраженный зеркалом, через диафрагму попадает в конденсор. Преломившись в его линзах, лучи попадают на препарат в виде конуса, вершина которого обращена к препарату. Пройдя сквозь препарат, лучи вновь расходятся в виде конуса и попадают в объектив. Преломившись в линзах объектива, лучи на выходе из него дают увеличенное, но обратное изображение. Это изображение строится лучами на некотором расстоянии от задней линзы объектива, на уровне диафрагмы окуляра, т. е. в финальной плоскости глазной линзы. Из окуляра лучи проходят в глаз, и на его сетчатке возникает мнимое, увеличенное, обратное изображение. Таким образом, объектив увеличивает рассматриваемый предмет, а окуляр увеличивает изображение. Следовательно, способность микроскопа к увеличению есть сумма увеличений, обеспечиваемых объективом и окуляром. Большинство объективов дает наилучшее изображение при длине тубуса 160 мм, а окуляры, как правило, рассчитаны на расстояние 250 мм, что соответствует расстоянию нормального невооруженного глаза от читаемого текста. Общее увеличение микроскопа (V) может быть определено с учетом этих данных по формуле: 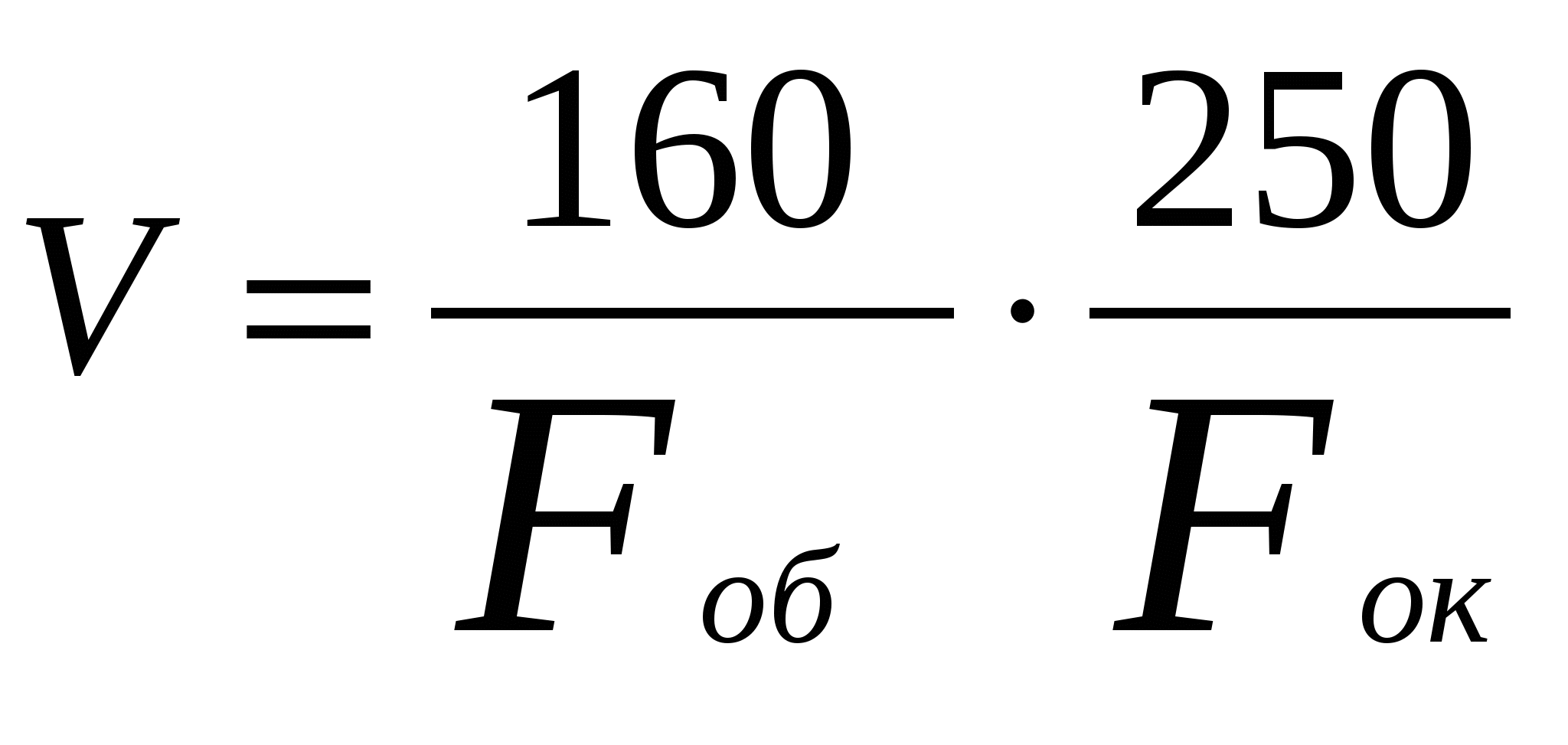 , ,где Fоб – фокусное расстояние объектива; Fок – фокусное расстояние окуляра. Хорошее освещение достигается при установке света по методу Келлера. Для этого устанавливают осветитель на расстоянии 30-40 см от микроскопа и, перемещая патрон с лампочкой или весь осветитель, добиваются четкого изображения нити накала лампы на закрытой полностью диафрагме конденсора так, чтобы это изображение полностью заполняло отверстие конденсора. Закрыв диафрагму осветителя, открывают диафрагму конденсора и, перемещая конденсор, добиваются резкого изображения диафрагмы осветителя в поле зрения микроскопа. С помощью зеркала изображение отверстия диафрагмы устанавливают в центре поля зрения, а диафрагму осветителя открывают так, чтобы было освещено все видимое поле зрения. Раскрывать больше диафрагму не нужно, так как это не усилит освещенности, а лишь уменьшит контрастность за счет рассеянного света. Общие правила работы с микроскопом. Современный микроскоп – это оптический прибор, требующий строгого соблюдения ряда правил при работе с ним. Они касаются обращения с прибором и ухода за ним, а также применения правильного освещения, выбора в каждом конкретном случае наилучшего варианта оптической системы (окуляр – объектив – конденсор) и т. п. Для защиты от пыли микроскоп нужно хранить под чехлом. Время от времени следует проверять чистоту и состояние оптики и протирать ее, но только снаружи. Для чистки оптики применяют волосяную кисточку или мягкую ткань, смоченные этиловым спиртом, разбавленным водой (1:1), но ни в коем случае не применяют бензин или ксилол во избежание расклеивания линз. Механические трущиеся части протирают ксилолом или бензином, а затем смазывают маслом. Темнопольная микроскопияДвижение бактерий и спирохет можно наблюдать в темнопольном, который отличается от обычного светового способом освещения препарата. В этом случае применяют боковое освещение, в силу чего получается изображение светящегося объекта на темном фоне. Принцип темного поля основан на том, что падающие сбоку световые лучи отклоняются плотными частицами (в частности, микробами) и последние благодаря этому представляются глазу наблюдателя ярко светящимися. Боковое освещение в микроскопе можно получить, заменив, обычный осветитель специальным конденсором с затемнением в центре. Такой конденсор задерживает все центральные лучи света и пропускает лишь периферические (рис.3). Вместо специального конденсора для темного поля можно пользоваться обычным осветителем, между двумя линзами которой вставляют кружок черной бумаги несколько меньшего диаметра, чем линза. Работать надо с сильным источником света (дуговой лампой или обычной лампочкой в 200-300 свечей). Техника исследований заключается в следующем. На предметное стекло наносят каплю материала и осторожно накрывают покровным стеклом, чтобы не было пузырьков газа. Затем на поверхность конденсора помещают каплю воды или кедрового масла, и предметное стекло с препаратом кладут на эту каплю. Препарат рассматривают либо через сильную сухую систему (объектив 40), либо через иммерсионную систему. В последнем случае на покровное стекло также наносят каплю кедрового масла, а к иммерсии привинчивают маленькую муфточку – диафрагму, чтобы сузить диаметр просвета объектива. При микроскопии этим методом лучи, освещающие объект, не попадают в объектив микроскопа, поле зрения остается темным, а объект на его фоне кажется светящимся (рис. 4). Эффект темного поля создается при помощи специального конденсора (параболоид или кардиоид) или обычного конденсора с прикрытой кружком черной бумаги центральной частью. Для наблюдения в темном поле свет устанавливают и центрируют, как для светлого поля, и, заменив конденсор специальным, прибавляют свет до максимума, раскрыв до отказа диафрагму и включив реостат осветителя. Препараты для исследования в темном поле должны быть приготовлены на очень чистых предметных и покровных стеклах определенной толщины: предметные – не более 1,2 мм, покровные – 0,17 мм. Готовят препарат по типу "раздавленной" или "висячей" капли (рис. 5). Между препаратом и конденсором помещают иммерсионное масло (каплю его наносят на верхнюю линзу конденсора). После этого, поднимая и опуская конденсор, добиваются появления в поле зрения светлого пятна, которое с помощью специальных регулировочных винтов конденсора выводят в середину поля зрения. Затем с помощью нужного увеличения переходят к наблюдению. Фазово-контрастная и аноптральная микроскопияФазово-контрастный микроскоп значительно повышает контрастность объектов, проницаемых для света, и в медицине используется для изучения нативных препаратов. С помощью этого метода могут быть исследованы без предварительной обработки бесцветные, прозрачные объекты, детали, строение которых оптически мало различаются между собой. Окрашенные препараты частично поглощают свет. Пучок света, проходящий через такой препарат, теряет в своей интенсивности, т.е. уменьшается амплитуда световой волны, и это легко улавливается глазом исследователя. Такие препараты контрастны даже в обычном микроскопе и называются “амплитудными”. Препараты, не поглощающие света, прозрачны. Пучок света, проходящий через такой препарат, не теряет своей интенсивности. Амплитуда световой волны не изменяется, а лишь изменяется фаза колебания, что не регистрируется человеческим глазом. Такие объекты называются фазовыми. К ним относятся живые, неокрашенные препараты. Чтобы повысить контрастность изображения, необходимо превратить фазовые изменения в амплитудные. Это достигается путем помещения в объективы фазовой пластинки в форме кольца и применением кольцевой диафрагмы. Каждому объективу соответствует своя диафрагма. Изображение этой диафрагмы совпадает с кольцом фазовой пластинки соответствующего объектива. Метод фазовых контрастов может быть положительным и отрицательным. В первом случае на светлом фоне поля наблюдается темное изображение объекта, а во втором фон темный, а объект светлый. Наилучшие результаты наблюдаются в случае положительного контраста. Распространение световых волн в прозрачных однородных объектах не сопровождается потерей интенсивности света. Меняется только скорость прохождения светового потока через объект по сравнению со скоростью распространения света в окружающей среде. Она будет большей или меньшей в зависимости от того, будет ли показатель светопреломления объекта соответственно меньше или больше, чем в окружающей среде. Эти изменения, называемые иначе фазовыми, так как при них меняются только фаза колебаний прошедшего света, характерны для большинства биологических объектов (живых клеток, срезов тканей и т. п.). Человеческий глаз хорошо определяет изменения интенсивности света, наступающие при прохождении через окрашенные (амплитудные) препараты, когда меняется амплитуда колебаний света. Однако глаз не способен воспринимать фазовые изменения света. Поэтому прозрачные неконтрастные (фазовые) объекты при обычном микроскопическом исследовании остаются невидимыми. Для работы по методу фазового контраста нужно, кроме обычного биологического микроскопа, иметь еще специальное устройство. Установку устройства производят следующим образом. Конденсор и объектив заменяют фазовыми. Фазовый конденсор поворотом револьверного диска устанавливают на 0. Это положение соответствует обычному светопольному конденсору. Затем, поместив на предметный столик препарат и сфокусировав его, приступают к наладке освещения. При исследовании методом фазового контраста основным условием является оптимальная освещенность, которая достигается установкой света по Келеру. После этого устанавливают револьверный диск на то число, которое соответствует выбранному объективу; например, при объективе 40 в окошечке также устанавливают цифру 40. Вынув окуляр, на его место устанавливают вспомогательный микроскоп и настраивают его на изображение двух колец (кольцевая диафрагма конденсора и фазовая пластинка). Центровочным устройством конденсора добиваются совмещения колец. Заменив вспомогательный микроскоп окуляром, можно производить исследование препарата. Метод аноптрального контраста является усовершенствованием метода фазового контраста. Теоретические обоснования и конструктивные особенности аноптрального устройства, в основном не отличаются от обычной фазово-контрастной установки (рис. 6). Принцип его устройства заключается в следующем. На верхнюю поверхность предпоследней линзы иммерсионного объектива наносится кольцо из сажи, пропускающей лишь около 10% проходящего света. В передней фокальной плоскости конденсора помещается кольцевая диафрагма, изображение которой должно полностью совпадать с кольцом сажи на объективе. Препарат освещается полным конусом лучей, проходящих через кольцевую диафрагму конденсора. При отсутствии объектов (например, микробов в препарате) в объектив попадают только недифрагированные лучи, амплитуда которых, после того как они пройдут через кольцо сажи, уменьшится на 90%. В то же время амплитуда лучей, дифрагированных частицами объекта, которые пройдут мимо кольца из сажи, не изменится и поэтому фон поля будет темный, а частицы объекта светлыми. Преимуществом метода аноптральной микроскопии является большая разрешающая способность объективов и возможность выявления минимальных оптических разностей плотности в неокрашенных препаратах. Чем больше оптическая плотность объекта, тем светлее его изображение. Методика использования устройства не отличается от фазово-контрастного. При помощи аноптрального микроскопа можно изучать морфологию и локализацию нуклеоидов (ядерный аппарат), наблюдать за изменениями морфологии бактерий в процессе нормального роста и размножения. Люминесцентная микроскопияЛюминесценция, т.е. свечение вещества, возникает в результате превращения энергии, поглощаемой веществом, в видимое излучение. Люминесценцией (или флуоресценцией) называют такое явление, когда некоторые вещества под влиянием падающего на них света испускают лучи с другой (обычно большей) длиной волны. Кроме того, вещества, имеющие определенный цвет при обычном освещении, при освещении ультрафиолетовыми лучами приобретают совершенно иной цвет. Объект, не видимый в ультрафиолетовом свете, может приобрести яркий блеск после обработки его флуоресцирующим веществом (флуорохромом). В таком препарате люминесцирующие объекты светятся различным цветом в темном поле зрения. Сила их света бывает различной, но чаще всего она невелика, поэтому люминесцентную микроскопию следует проводить в затемненном помещении. Разница между микроскопией в проходящем свете и флуоресценцией заключается в том, что в последнем случае препарат рассматривается в излучаемом им свете. При этом химический состав клеток и тканей влияет на качество люминесценции и люминесцентная микроскопия в определенной мере является гистохимическим исследованием. Существует первичная и вторичная флуоресценция. При первичной флуоресценции в самом объекте находятся вещества, способные флуоресцировать. Вторичная флуоресценция – наведенная, возникает при специальной обработке объекта веществами, способными флуоресцировать. Эти вещества называются флуорохромами (акридин оранжевый, флуоресцеин, родамин и др.). Для люминесцентной микроскопии применяется целый ряд устройств и микроскопов. Основной частью этих устройств является осветитель, имеющий лампу ультрафиолетового света, и система фильтров к нему. В зависимости от того, используется ли ультрафиолетовый или синий цвет для возбуждения люминесценции, между источником света и объектом помещаются соответствующие фильтры. Так как люминесценция микроскопического объекта энергетически слабее, чем возбуждающий свет, то она улавливается лишь в том случае, если излишек лучей, идущих от источника света, отсекается желто-зеленым фильтром, помещенным на окуляре микроскопа. Эффект люминесценции наиболее полно выражен в том случае, когда фильтр на окуляре микроскопа полностью отсекает лучи, идущие от источника света. При этом при отсутствии люминесцирующего препарата получается темное поле зрения.Установка для люминесцентной микроскопии в видимых лучах состоит из яркого источника света и биологического микроскопа (рис. 7). Между зеркалом микроскопа и источником света устанавливается сине-фиолетовый светофильтр (УФС-3, ФС-1 и т. п.). Желтый светофильтр (ЖС-3 или ЖС-18) надевают на окуляр микроскопа. С помощью этих светофильтров на препарат падает сине-фиолетовый свет, возбуждающий люминесценцию. Однако этот свет мешает видеть возбуждаемое им свечение препарата и поэтому по пути к глазу наблюдателя отсекается желтым светофильтром. Установку освещения производят по методу Келера, за одним исключением: диафрагма конденсора должна быть полностью открыта. Очень важно применение нефлуоресцирующего иммерсионного масла. С целью гашения собственной флуоресценции к кедровому или другому иммерсионному маслу добавляют на 1 г от 2 до 10 капель нитробензола. Люминесцентная микроскопия находит широкое применение в микробиологии (рис. 8). Ее преимуществами являются: 1) цветное изображение; 2) высокая степень контрастности самосветящихся объектов на черном фоне; 3) возможность исследования как прозрачных, так и непрозрачных живых объектов; 4) возможность исследования различных жизненных процессов в динамике их развития; 5) обнаружение и установление локализации отдельных микробов и вирусов; 6) развитие тончайших методов цито- и гистохимии и экспресс-диагностика. Электронная микроскопияВ 1932 г. был изобретен электронный микроскоп, в котором вместо световых лучей используется поток электронов, излучаемый особым источником – так называемой электронной пушкой. Оптические линзы в этом микроскопе заменены электромагнитными. В электронном микроскопе имеются следующие электромагнитные линзы: конденсорная, объективная и проекционная. Исследуемый объект, помещенный на пути электронов, отражается на люминесцирующем экране, воспринимающем поток электронов в виде густой тени, соответствующей контурам объекта (см. рис. 9). Препараты из исследуемых микробов готовят на тончайших коллоидных пленках и помещают в приемную камеру микроскопа. Конечную картину наблюдают на люминесцирующем экране. В электронном микроскопе можно рассматривать объекты, размеры которых в 50-100 раз меньше видимых в световом микроскопе (вирусы, ультраструктура клеточных форм микроорганизмов). Возможности оптических микроскопов ограничиваются не числом линз, а слишком большой длиной волны видимого света (600 нм). Объекты, диаметр которых меньше этой величины, или линии, разделенные расстоянием менее 200 нм, находятся за пределами разрешающей способности светового микроскопа. Применение вместо световых волн потока движущихся электронов позволило создать электронный микроскоп. Электронный поток вызывает свечение флуоресцирующего экрана. Если же на пути электронов поместить какой-либо объект, то в зависимости от его плотности электроны будут больше или меньше задерживаться, а соответствующие места на экране или фотопластинке окажутся более или менее затемненными. Этот простой принцип в современном электронном микроскопе дополнен принципом отклонения электронных лучей в магнитном поле подобно тому, как световые лучи отклоняются стеклянными линзами. Источником электронного потока служит катодная лампа с вольфрамовой нитью, которая разогревается до 2500°С. Освобождающиеся при этом электроны летят в вакууме с большей или меньшей быстротой по направлению к аноду. В этом движении быстроту определяет напряжение, существующее между анодом и катодом. Чем больше напряжение, тем выше разрешающая способность электронного микроскопа. Анод имеет в центре отверстие, через которое электроны летят в направлении к конденсору. Возле катода расположен отрицательно заряженный цилиндр, как бы сужающий пучок электронов, которые, будучи отрицательно заряжены, отталкиваются от стенок цилиндра в середину. Все это устройство в микроскопах большинства систем расположено наверху, и пучок электронов направляется вниз. Объект исследования находится на их пути и отклоняет электронный луч тем сильнее, чем толще и плотнее его структура. При напряжении около 200 000 В, если препарат тонкий, можно обнаружить самые нежные структуры, получить увеличение до 200000 раз и увидеть объекты размером 0,002 мкм. Путь электронного пучка от объекта до фотографической пластинки лежит вне электрических или магнитных полей, которые, подобно линзам в световом микроскопе, концентрируют и направляют электронные лучи. Наконец, после ряда увеличений, которое претерпевает изображение объекта, оно воспринимается на фотографической пластинке. Все виды фотопластинок чувствительны к электронному лучу. По пути прохождения электронного пучка он дважды может быть перехвачен и отброшен на поверхность экрана-пластинки, покрытой сульфидом цинка, где изображение объекта можно увидеть невооруженным глазом. В некоторых системах электронных микроскопов имеются дополнительные приспособления для стереоскопической микроскопии, для наблюдения в темном поле зрения. Различные системы дают разное увеличение – от 1000 до 500000 раз. Установки эти пока еще сложны и требуют квалифицированного обслуживания (рис. 10-12). Тема: Методы приготовления и окраски препаратов Цель: Ознакомиться с принципами и методами изучения морфологии микроорганизмов; освоить технику микроскопического исследования и окраски микроорганизмов. Вопросы для самоподготовки
Литература
Подготовка предметных и покровных стекол Предметные и покровные стекла, употребляемые для приготовления препаратов, должны быть чистыми и хорошо обезжиренными. Это может быть достигнуто разными способами. Стекла кипятят 15 мин в 1% растворе соды (или мыльной воде), споласкивают водой, кладут в слабую хлористоводородную кислоту и хорошо промывают водой. Или же сначала выдерживают стекла 2 ч в концентрированной серной кислоте, затем моют их в воде, кипятят в щелочи, вновь промывают водой. Стекла можно также обрабатывать жидкостью следующего состава (по Цеттнову): Kalii bichromici 20 г, Acidi sulfurici crudi 20 г, воды 200 мл. После 10 мин кипячения в этой смеси стекла промывают 5 мин в слабом растворе щелочи, а затем промывают водой и, наконец, спиртом. Хранят стекла в сосудах (банках) с притертыми пробками в смеси равных количеств спирта и эфира или в 96% спирте, либо промытыми и вытертыми досуха. Исследование микроорганизмов в живом состоянии Исследование микроорганизмов в живом состоянии применяется главным образом для изучения формы и подвижности бактерий, реже при реакции агглютинации. Для этих целей готовят препараты “раздавленная капля” и “висячая капля” (рис. 5). Препарат “раздавленная капля”. При приготовлении «раздавленной» капли жидкость с исследуемым материалом наносят на предметное стекло и сверху накладывают покровное. Капли материала надо брать такой величины, чтобы они заполняли все пространство между покровным и предметным стеклом и не выступали за края покровного. Препарат “висячая капля”. Для "висячей" капли необходимо иметь предметное стекло с луночкой. На покровное стекло предварительно наносят каплю жидкости с исследуемой культурой микроорганизмов. Затем на покровное стекло накладывают предметное стекло, с луночкой посередине, края которой предварительно смазаны вазелином. Предметное стекло слегка прижимают к покровному, в результате чего оба стекла склеиваются. После этого препарат перевертывают покровным стеклом кверху. Получается герметически закрытая камера, в которой капля долго не высыхает. Для предотвращения быстрого высыхания препараты рекомендуется помещать во влажную камеру (чашку Петри), на дно которой положено 2-3 влажных кружка фильтровальной бумаги, покрытых двумя сухими. При изучении препаратов «раздавленная» и «висячая капля» под световым микроскопом край капли сначала отыскивают со слабым увеличением и при суженой диафрагме, а потом исследуют препарат при помощи более сильного увеличения. Более удобными для их микроскопического изучения представляются такие виды микроскопии, как темнопольная, фазово-контрастная и аноптральная. Препараты фиксированных окрашенных клеток. Приготовление мазка и фиксация препарата Исследование бактерий в окрашенном препарате дает возможность не только изучить их морфологию, но и получить представление о некоторых деталях их химического строения. Это достигается применением специальных методов. Техника приготовления препаратов. В зависимости от характера исследуемого материала при его заборе используют бактериологическую петлю, пастеровскую пипетку или иглу. Петлю делают из платиновой или нихромовой нити длиной 5-6 см, закрепляют в петледержателе или впаивают в стеклянную палочку. Конец проволоки сгибают в виде плотно замкнутой петли размером 1x1,5 или 2x3 мм. Петлю держат как карандаш. Рабочую часть петли прожигают в пламени горелки в вертикальном положении, сначала конец петли, затем постепенно всю металлическую часть. Обезжиренное предметное стекло прожигают в пламени горелки. Пробирку с изучаемой культурой микроорганизмов держат между указательным и большим пальцами левой руки. Бактериологическую петлю берут правой рукой и прожигают ее в пламени горелки. Не выпуская петли из правой руки, мизинцем прижимают пробку к ладони и вынимают из пробирки. Во время манипуляции с пробиркой пробка находится в руке. Прожигают пробку и горло пробирки в пламени горелки. Вводят петлю в пробирку. Охлаждают петлю о стенку пробирки, чтобы горячая петля не убила выросшую культуру. Захватывают петлей культуру и выводят ее из пробирки, не касаясь стенок. Держа петлю с культурой, закрывают пробирку пробкой над пламенем горелки. Ставят пробирку в штатив. Из жидких культур каплю материала наносят на предметное стекло бактериальной петлей и равномерно распределяют по центру предметного стекла. Из культуры микроорганизмов на плотной среде бактериальной петлей делают забор микробной массы и размешивают в заранее нанесенной на предметное стекло капле водопроводной воды. Остатки культуры на петле, сжигают в пламени горелки. Мазок должен быть тонким, равномерно растертым и небольшим. Мазок высушивают на воздухе при комнатной температуре. Приготовление мазка из гноя или мокроты Материал забирают стерильной пипеткой или петлей и нанося на середину предметного стекла. Затем вторым предметным стеклом покрывают первое так, чтобы остались свободными треть первого и второго стекол. Стекла раздвигают в стороны и получают два отдельных больших мазка. Приготовление мазков из крови Каплю крови наносят на границу между левой и средней третью предметного стекла. Затем краем второго специально отшлифованного стекла прикасаются к капле крови, располагая стекло под углом в 45°. Прижимая отшлифованное стекло к предметному, продвигают его. Хорошо сделанный мазок имеет желтоватый цвет и просвечивает. Приготовление мазков-отпечатков из внутренних органов трупов и пищевых продуктов твердой консистенции Раскаленным скальпелем прижигают поверхность органа или пищевого продукта и из этого участка вырезают кусочек материала. Разрезанной поверхностью прикасаются к стеклу в 2-3 местах. Фиксация мазка После полного высыхания мазки фиксируют, чем достигается умерщвление микробов и прочное прикрепление их к стеклу. Фиксация резко улучшает окрашиваемость микробов, которые в живом виде слабо воспринимают краски. Самый простой и распространенный способ – фиксация жаром. Держа стекло мазком вверх, его трижды проводят через пламя газовой или спиртовой горелки (мазком вверх). Во избежание перегрева препарата время фиксации не должно превышать 5-6 с, а время прямого воздействия пламени – 2 с. Кроме жара, для фиксации могут быть применены следующие вещества: 1. Этиловый 95% спирт. Время фиксации 10-15 мин. 2. Смесь равных объемов абсолютного спирта и эфира (по Никифорову) – 10-15 мин. 3. Метиловый спирт – 5 мин. 4. Ацетон – 5 мин. 5. 1% раствор сулемы – 10-15 мин и затем промывание препарата раствором NaCI и водой. 6. 10% раствор AgNO3 – 10 мин. 7. Жидкость Буэна: формалина неразбавленного 10 мл, ледяной уксусной кислоты 2 мл и насыщенного водного раствора пикриновой кислоты 30 мл. 8. Жидкость Карнуа: ледяной уксусной кислоты 10 мл, хлороформа 30 мл и 96% спирта 60 мл. ОКРАСКА ПРЕПАРАТОВСпособность микроорганизмов к окрашиванию различными красителями определяет их тинкториальные свойства. Методы окраски микробов разнообразны и многочисленны. В бактериологической работе наиболее употребительны приводимые ниже рецепты красок и способы окраски препаратов, которые в основном можно разделить на две группы: ориентировочные простые окраски и окраски дифференциальные, выявляющие химические и структурные особенности бактерий. ВИДЫ КРАСИТЕЛЕЙКрасители, применяемые для бактериологических исследований, относятся к группе так называемых анилиновых. Они разделяются на «основные» и «кислые». Термины «кислые» и «основные» только определяют сродство краски к определенной части клетки. Основными красками хорошо окрашиваются ядерный хроматин и микробы. Кислые краски окрашивают микробов слабее, при окраске же тканей они окрашивают протоплазму клеток. Наиболее употребительны следующие краски: метиленовый синий, тионин (синие краски), основной фуксин, сафранин и эозин (красные), бисмарк-браун, или везувин (коричневая), метилгрюн (зеленая), метилвиолет, генцианвиолет, кристаллвиолет (фиолетовые). Из них только эозин – кислая краска; она употребляется для некоторых специальных целей. Все эти краски продаются в виде аморфных или кристаллических порошков, из которых готовят красящие растворы. Приготовление красящих растворов. Исходным материалом почти для всех необходимых рабочих красок являются насыщенные спиртовые растворы, которые следует иметь в запасе и сохранять в склянках с притертыми пробками. Насыщенные спиртовые растворы готовят следующим образом: 10 г сухой краски насыпают во флакон с притертой пробкой, наливают 100 мл 96º спирта (ректификата) и дают настояться в течение нескольких дней, каждый день, взбалтывая раствор. Из таких насыщенных растворов готовят спиртово-водные растворы, пригодные для окраски микробов. Наиболее часто употребляются следующие растворы: Карболовый фуксин (фуксин Циля) 10 мл насыщенного спиртового раствора фуксина 90 мл 5% карболовой кислоты Разведенный фуксин 10 мл карболового фуксина 90 мл дистиллированной воды Щелочной метиленовый синий 30 мл насыщенного спиртового раствора метиленового синего 100 мл дистиллированной воды 1мл 1% раствора щелочи Карболовый генцианвиолет 10 мл насыщенного спиртового раствора генцианвиолета 90 мг 5% карболовой кислоты. Растворы генцианвиолета дают осадок при окрашивании. Вместо генцианвиолета можно пользоваться насыщенными спиртовыми растворами метиленвиолета или кристаллвиолета. Растворы карболовой кислоты можно брать 1%, а не 5%. Кроме того, для окраски по Граму можно пользоваться 0,25% водным раствором метиленвиолета или кристаллвиолета без карболовой кислоты. Раствор стоек и осадка не дает. По методу Синева вместо раствора генцианвиолета применяют кусочки фильтровальной бумаги, предварительно пропитанной спиртовым раствором краски и затем высушенные. Для этого листы фильтровальной бумаги погружают на 1-2 минуты в 1-2% раствор краски в 96º спирте, бумагу высушивают и разрезают на кусочки величиной 24 см. Такие бумажки сохраняются в банках с притертой пробкой неограниченное время. МЕТОДЫ ОКРАСКИПРИЖИЗНЕННАЯ (ВИТАЛЬНАЯ) ОКРАСКА МИКРООРГАНИЗМОВОкрашивание живых микроорганизмов позволяет изучить характер и степень их подвижности. Применение этих методов ограничивается слабой восприимчивостью живых клеток к анилиновым красителям и нестойкой окраской препаратов. Следует также учесть, что при таких методах окраски микробы сохраняют жизнеспособность, и препараты могут являться инфекционным материалом. |
