71. Атомний абсорбційний спектрофотомер AAS-30
Зниження вмісту кальцію у сироватці крові — гіпокальцемія спостерігається при тривалому періоді нестачі кальцію в раціоні, порушенні засвоєння його внаслідок дефіциту вітаміну D і парат-гормону, при рахіті, остеодистрофії, післяродовій гіпокальцемії (родильному парезі). Хвороби печінки при хронічному перебігу (гепатит, гепатоз, цироз) також сприяють розвитку гіпокальцемії,
11. Вміст загального кальцію та неорганічного фосфору в сироватці крові
здорових тварин
оскільки в печінці знижується синтез першого біологічно активного метаболіту холекальциферолу — 25-лксихолекальциферолу (Левченко В. І., 1986), з якого потім в нирках утворюються інші метаболіти (1,25- та 24-, 25-дегідрохолекальциферол), відповідальні за синтез в ентероцитах кальційзв'язуючого білка. Крім того, при хворобах печінки зменшується виділення жовчі та синтез жовчних кислот, які сприяють всмоктуванню важкорозчинних солей кальцію та вітаміну D2.
Ураження нирок (нефрит, нефроз, нефролітіаз) також викликає гіпокальцемію. При нефриті й особливо нефрозі настає гіпо-протеїнемія внаслідок втрати з сечею альбумінів, з якими частково зв'язаний кальцій сироватки крові. Крім того, при нефропатії спостерігається зниження синтезу метаболітів холекальциферолу, рівня кальцію та неорганічного фосфору в сироватці крові (Апуховська Л. І., Івашкевич С. П, Ширанкова Т. Г., 1993).
Гіперкальцемія буває при гіперфункції паращитовидних залоз, гіпервітамінозі D, інколи остеодистрофії, артрозі бугаїв-плідників.
ВИЗНАЧЕННЯ НЕОРГАНІЧНОГО ФОСФОРУ В СИРОВАТЦІ КРОВІ
В організмі дорослих тварин міститься 0,6—0,75 % фосфору з розрахунку на свіжу тканину (у тілі корови масою 600 кг — 3,6— 4 кг). В середньому 83 % фосфору знаходиться у кістковій тканині в складі гідроксиапатиту. Вміст його в золі кісток досить постійний (18—19%). Фосфор міститься також в м'язовій тканині (8— 9 % від усього фосфору організму), нервовій тканині (до 0,7 %) і в крові (до 0,2 %).
Важко назвати в організмі фізіологічну функцію, в здійсненні якої сполуки фосфорної кислоти не брали б пряму або посередню участь. Завдяки фосфорилюванню відбувається кишкова абсорбція, гліколіз і пряме окислення вуглеводів, транспорт ліпідів, обмін амінокислот. Фосфорна кислота входить до складу багатьох ензимів. Макроергичні фосфорні сполуки, серед яких центральне місце належить АТФ, є універсальними акумуляторами й донаторами енергії, які забезпечують як створення її запасів, так і витрачання. Виняткову роль відіграє АТФ у м'язовій діяльності, в процесі якої хімічна енергія перетворюється у механічну. З сполуками фосфору пов'язані всі синтетичні процеси, спрямовані на ріст і утворення продукції. Фосфор входить до складу нуклеїнових кислот, які є носіями генетичної інформації, регулюють біосинтез білка.
В організм тварин фосфор надходить у вигляді одно-, дво- і тризаміщених неорганічних фосфатів, а також органічних сполук— фітатів, фосфоліпідів, фосфопротеїдів. У шлунку фосфати частково розчиняються, в тонкому кишечнику від'єднується фос-
272
форна кислота від органічних сполук. У жуйних тварин солі фітинової кислоти гідролізуються у передшлунках під дією бактерійних фітаз. Розчинні фітати легко всмоктуються у тонкому кишечнику, а важкорозчинні фосфорнокальцієві солі (вторинні й третинні фосфати) частково адсорбуються після утворення комплексів з жовчними кислотами.
З організму птиці, кролів, молодняка жуйних фосфор виводиться головним чином через нирки, у свиней — травний канал і нирки, у дорослих жуйних — травний канал, у лактуючих, крім того, з молозивом і молоком.
У крові фосфор міститься у вигляді органічних і неорганічних сполук (3—4: 1 у жуйних). Органічний фосфор зв'язаний з білками та ліпідами. В клінічній практиці діагностичне значення має визначення неорганічного фосфору, яке здійснюють реакціями з ванадат-молібденовим реактивом (за Пулсом в модифікації В. Ф. Коромислова і Л. А. Кудрявцевої, аскорбіновою кислотою у модифікації С. А. Івановського). При зберіганні сироватки крові органічний фосфор розкладається із збільшенням неорганічного. Щоб уникнути помилки при дослідженні, необхідно проводити аналіз лише свіжої сироватки або одержувати безбілковий фільтрат її після додавання трихлороцтової кислоти.
Зниження вмісту неорганічного фосфору в крові (гіпофосфате-мія) спостерігається при нестачі його в раціоні, недостатньому засвоєнні внаслідок розладів функцій травного каналу, дефіциті вітаміну D, а також при гіперфункції паращитовидних залоз (знижується реабсорбція фосфору в канальцях нирок і збільшуються втрати його з сечею), аліментарній остеодистрофії, рахіті та інших хворобах.
Збільшення рівня неорганічного фосфору — гіперфосфатемія — зустрічається при зменшенні секреції паратгормону і збільшенні кальцитоніну (стимулюється реабсорбція фосфору в нирках), прийманні великої кількості вітаміну D, нефриті, нефрозі.
У регуляції гомеостазу кальцію і фосфору важлива роль належить вітамінам групи D. Найбільш поширені вітамін D2 або ергокальциферол і вітамін D3 — холекальциферол. У печінці з них синтезується 25-гідроксихолекальииферол, активність якого в 1,5—2 рази вища порівняно з початковою, у нирках— 1,25- і 24-, 25-дигідроксихолекальциферол. Активність утворених у нирках метаболітів у 5—10 разів перевищує активність вихідного вітаміну. Під їх впливом у стінці тонкого кишечника синтезується каль-ційзв'язуючий білок, одна молекула якого зв'язує чотири іони кальцію. Посилення всмоктування неорганічного фосфору в кишечнику під впливом вітаміну D є вторинним ефектом, пов'язаним з адсорбцією кальцію. Є й дані про те, що всмоктування кальцію , та фосфору незалежні процеси. Вплив вітаміну D на гомеостаз фосфору може бути прямим і посереднім. Прямий вплив пов'яза-
273
ний з посиленням всмоктування фосфору з кишечника і реабсорбцією його в нирках. Посередній вплив повязаний із зниженням рівня паратгормону, що зменшує виділеная фосфатів з сечею.
ВИЗНАЧЕННЯ МАГНІЮ У СИРОВАТЦІ КРОВІ
Близько 65 % магнію в організмі' тварин міститься у кістковій тканині. В крові магній буває у двох формах: іонізованій (75 %) і зв'язаній з білками (25%). Гемеостаз магнію підтримується лише при систематичному надходженні його з кормом. Кількість магнію у сироватці крові визначають кольоровою реакцією з титановим жовтим (Кондрахін І. П. з співавторами, 1983), магоном (набір реактивів фірми «Лахема») або атомною абсорбційною спектрофотометрією. Вміст магнію у сироватці крові великої рогатої худоби і коней коливається в межах від 2 до 3 мг/100 мл (0,82—1,23 ммоль/л), овець — 2—3,5 (0,82—1,44), свиней — 2,5— 3,5 (1,03—1,44).
Гіпомагнемію спостерігають при пасовищній тетанії корів, гіпомагнієвій тетанії у телят, транспортній хворобі. Вона розвивається внаслідок недостатнього надходження магнію з кормом, що спостерігається у місцевостях, де грунти бідні на нього, або при використанні великих кількостей азотних добрив, особливо калійних, при вирощуванні кормових культур, оскільки іони калію та азоту зменшують засвоєння рослинами магнію. Гіпомагнемія буває наслідком порушення всмоктування магнію у тонкому кишечнику при згодовуванні зеленої маси, багатої на протеїн. У рубці жуйних тварин утворюється багато аміаку, надлишок якого інгібує засвоєння магнію, утворюючи з ним малорозчинні сполуки.
Гіпермагнемія буває рідко і зумовлена швидким надходженням іонів магнію при ін'єкціях. Відносна гіпермагнемія настає при післяродовій гіпокальцемії, коли іони магнію мають динамічну перевагу перед іонами кальцію.
ВИЗНАЧЕННЯ МІКРОЕЛЕМЕНТІВ
Мікроелементи, на відміну від макроелементів, містяться в організмі людей і тварин в невеликій кількості (10
3 і менше від маси тіла, в процентах), проте частина з них віднесена до життєво необхідних, або біотичних, оскільки при їх нестачі в раціоні виникають характерні симптоми хвороб (мікроелементозів) і відповідні біохімічні зміни в тканинах. До життєво необхідних мікроелементів віднесені цинк, марганець, залізо, мідь, кобальт, йод, селен, молібден. Існують певні труднощі у визначенні мікроелементів в організмі. Нині найчастіше їх визначають методом атомної абсорбційної спектрофотометрії або різними хімічними наборами реактивів фірми «Лахема»: мідь, залізо, цинк; йод — за ме-
274

тодом Л. С. Аброськіної і Ю. М. Кондратьєва (1985), селен — за В. В. Ковальським і А. Д. Голобовим з діамінобензидином.
Вміст основних мікроелементів в крові наведено в таблиці 12.
Зниження рівня мікроелементів у крові, як правило, спостерігається, при недостатньому надходженні їх з кормами, особливо в біогеохімічних зонах, грунти і води яких збіднені на рухомі форми мікроелементів (див. главу XI), або при надлишку в кормах їх антагоністів.
ВИЗНАЧЕННЯ В КРОВІ ГЛЮКОЗИ
Джерелом глюкози у моногастричних тварин і в молодняка жуйних у молочний період е різні вуглеводи корму, які в кишечнику гідролізуються до моноцукрів,— глюкози, фруктози, галактози. Останні два в стінці тонкого кишечника фосфорилюються і також перетворюються у глюкозу. У організмі молодняка моногастричних тварин целюлоза грубих кормів використовується за допомогою мікробів, які населяють ободову і сліпу кишки, а у жуйних більша частина вуглеводів корму ферментується у передшлунках до летких жирних кислот, з яких потім утворюється глюкоза. Найбільш виражену глюкогенну дію має пропіонова кислота, з якої у печінці та стінці передшлунків утворюється від 50 до 90 % глюкози (глюконеогенез). Решта глюкози утворюється з глюко-генних амінокислот.
Надлишок глюкози, який надходить у печінку, перетворюється в глікоген (глікогенез), але запаси його незначні і їх достатньо на задоволення потреби в енергії лише протягом доби. Глюкоза крові постійно обновлюється за рахунок надходження з тканин, печінки та кишечника. В регуляції її рівня (глікемії) беруть участь симпатичний відділ нервової системи та ендокринні залози: підшлункова (інсулін, глюкагон), гіпоталамус, гіпофіз (АК.ТГ),
275
наднирники (глюкокорти-костероїди, адреналін, но-радреналін), щитовидна залоза (тироксин, трийод-тиронін).
Вміст глюкози в крові визначають ортотолуїди-новим, ферментативним глюкозооксидазним методами або Сомоджі, Хаге-дорна-Ієнсена. Необхідною умовою точного визначення кількості глю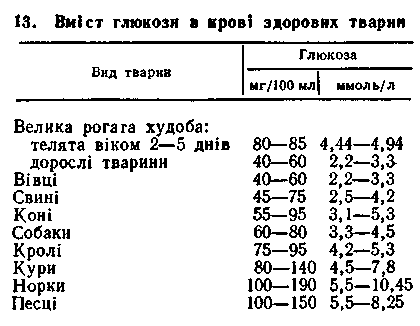 кози в крові є проведення аналізу не пізніше 2 год після взяття крові. Вміст глюкози в крові є відносно постійною величиною (табл. 13). кози в крові є проведення аналізу не пізніше 2 год після взяття крові. Вміст глюкози в крові є відносно постійною величиною (табл. 13).
Порушення вуглеводного обміну супроводжується підвищенням рівня глюкози в крові (гіперглікемія) або зниженням (гіпоглікемія). Розрізняють три основні форми гіперглікемії: аліментарну, яка виникає після згодовування тваринам з однокамерним шлунком великої кількості цукристих кормів, а у корів — після споживання 7 г цукру на 1 кг маси тіла (ознаки гіперглікемії настають через 2—4 год після надходження цукру в кров); симпатичну — внаслідок підвищення глікогенолізу — при стресах, різних захворюваннях центральної нервової системи (сказ, хвороба Ауєскі, Вргіповітаміноз), тиреотоксикозі (підвищується всмоктування вуглеводів з кишечника, посилюється розщеплення глікогену до глюкози, активізується інсуліназа, яка руйнує інсулін), гіперфункції наднирників (глюкокортикоїди посилюють глюконеоге-нез, адреналін активізує фосфорилазу печінки та м'язів, інгібує синтез глікогену); діабетичну, яка розвивається при недостатній секреції інсуліну, внаслідок чого порушується синтез глікогену, перетворення надлишку вуглеводів у жири, зменшується поглинання клітинами глюкози. Якщо вміст цукру в крові перевищує порогову величину її кількості в нирках, яка у тварин з-однокамерним шлунком становить 8,0—9,0 ммоль/л, а у дорослих жуйних 4,9—6 ммоль/л, то глюкоза переходить у сечу (глюкозурія; див. с. 226).
Гіпоглікемія спостерігається при недостатньому надходженні вуглеводів в організм і виснаженні легкомобілізованих запасів цукру при транспортному стресі, підвищеній витраті цукру на терморегуляцію, особливо у поросят-сисунів у перші дні життя (гіпоглікемія поросят), порушенні синтезу й обміну глюкози при ке-тозі, гепатозі, гепатиті, респіраторних та шлунково-кишкових хворобах. Гіпоглікемія буває внаслідок гіперінсулінемії, особливо
276
після ін'єкцій препарату на фоні низького рівня глюкози в крові. Гіпоглікемія у тварин супроводжується їх занепокоєнням, підвищеною подразливістю, атаксією, м'язовими судорогами, а при посиленні її може настати гіпоглікемічний шок, що характеризується коматозним станом. Якщо гіпоглікемія розвивається поступово, то організм тварини мобілізує резерви вуглеводів, що знижує функціональний стан органів, які містять ці резерви (печінка, м'язи, міометрій), порушує обмін ліпідів (кетонемія, жировий гепа-тоз) і білків (гіпопротеїнемія), знижує стійкість організму проти інфекції.
ВИЗНАЧЕННЯ КЕТОНОВИХ ТІЛ
Кетонові тіла (бета-оксимасляна та ацето-оцтова кислоти, ацетон) утворюються головним чином у печінці, менше в нирках, стінках передшлунків, молочній залозі. Вони є звичайними метаболітами обміну вуглеводів, жирів і деяких амінокислот, при розпаді яких утворюється оцтова кислота у вигляді сполуки з коферментом ацетилювання — ацетил
КоА. Активована оцтова кислота в подальшому окислюється у циклі трикарбонових кислот, початковим етапом якого є реакція конденсації з щавлевооцтовою кислотою (ЩОК). Окислення її блокується нестачею ЩОК, основним джерелом якої є глюкоза. В такому випадку дві молекули ацетил -
КоА конденсуються з утворенням ацетоацетил
КоА,. який є джерелом ацетону, ацетооцтової і бета-оксимасляної кислот.
У крові, сечі та молоці завжди є незначна кількість кетонових тіл. Підвищення їх рівня у крові (кетонемія) супроводжується посиленим виділенням їх через нирки (кетонурія), молочну (кето-нолактія) і потові залози та легені.
Вміст кетонових тіл у крові визначають йодометричним методом (за Енгфельдом у модифікації М. Лейтеса та А. І. Оди-нової), колориметричним методом Нейтельсона, а також експрес-методом з реактивом Лестраде. В нормі, за даними І. П. Кондра-хіна, у здорових тільних сухостійних корів вміст кетонових тіл становить 2,5—б мг/100 мл (0,4—1,03 ммоль/л), у корів через 2—5 днів після отелення — 6—8, а через ЗО днів — 5,5— 7 мг/100 мл. У високопродуктивних корів порівняно з низькопродуктивними вміст кетонових тіл вищий. Основна кількість їх у крові (82—87 %) припадає на частку бета-оксимасляної кислоти.
Експрес-методом з реактивом Лестраде кетонові тіла в крові визначають при їх мінімальному вмісті 10 мг/100 мл (1,72 ммоль/л). Швидкість появи забарвлення і його інтенсивність пропорціональні концентрації кетонових тіл у досліджуваній пробі. Якщо інтенсивне забарвлення з'являється негайно, то це є показником наявності в пробі 50—80 мг/100 мл і більше кетонових
27Г
тіл, через 1 хв — ЗО—50; ледь помітне забарвлення після 3 хв — 10—30 мг/100 мл.
Стійка кетонемія зустрічається у тварин при гострому та під-гострому перебігах кетозу, цукровому діабеті. При цьому змінюється співвідношення між окремими компонентами кетонових тіл у бік збільшення вмісту токсичніших продуктів — ацетону та аце-то-оцтової кислоти. Помірна кетонемія супроводжує різні хвороби: пневмонію, гепатоз і гепатит, міоглобінурію, гнійний мастит, ендометрит, причому підвищення концентрації кетонових тіл переважно відбувається за рахунок бета-оксимасляної кислоти.
ВИЗНАЧЕННЯ БІЛІРУБІНУ В СИРОВАТЦІ КРОВІ
Білірубін є одним з кінцевих продуктів пігментного обміну. Через ряд проміжних стадій з гему зруйнованих еритроцитів утворюється непрямий (вільний, некон'югований, непроведений через лечінку) білірубін, який е нормальною складовою частиною сироватки крові (див. главу VII). Він нерозчинний у воді і тому не виводиться з сечею. У клітинах печінки непрямий білірубін сполучається з глюкуроновою кислотою, утворюється прямий, зв'язаний (кон'югований), проведений через печінку білірубін (холебі-лірубін). Сума вільного та кон'югованого білірубіну становить загальний білірубін.
Вміст білірубіну та його фракцій у сироватці крові визначають за методом Ієндрашика, Клеггорна і Грофа. Проведений через печінку (кон'югований) білірубін реагує безпосередньо з діазо-реактивом (тому його ще називають прямим), а непроведений має аналогічну реакцію лише після дії прискорювачів, до яких •належать кофеїновий або інші реактиви.
Збільшення вмісту білірубіну в сироватці крові більше наведених у таблиці 14 показників називають білірубінемією.
Білірубінемія спостерігається при захворюваннях, які супроводжуються гемолізом еритроцитів за рахунок збільшення у крові яепрямого (вільного або непроведеного через печінку) білірубіну (піроплазмідози, лептоспіроз, отруєння гемолітичними отрутами).
Печінка в таких випадках не встигає переробити в прямий білірубін велику кількість непрямого, який утворився з гемоглобіну зруйнованих еритроцитів. Значне збільшення вмісту прямого білірубіну (проведеного через печінку, зв'язаного) в сироватці крові буває у випадку механічної жовтяниці, коли внаслідок порушення жовчовиділення нагромаджується жовч, підвищується тиск у жовчних шляхах, що зумовлює перехід жовчі в кров'яне русло.
Ураження гепатоцитів порушує перетворення непрямого білірубіну в прямий і подальше виділення останнього в жовчні капіляри, тому в крові підвищується вміст обох фракцій білірубіну (паренхіматозна жовтяниця).
ВИЗНАЧЕННЯ АКТИВНОСТІ ФЕРМЕНТІВ
За останні роки значного розвитку досягла клінічна ферментологія, одним з напрямків якої є визначення активності ферментів з метою діагностики різних хвороб. Основою для цього є органо-специфічність деяких ферментів, тобто локалізація їх лише в одному з органів. При запальних і дистрофічних процесах ферменти з клітин елімінуються (вимиваються) у кров, внаслідок чого активність їх в крові підвищується, що й дає змогу виявляти патологію даного органа. Підвищення активності органоспецифічного ензиму буде патогномічним показником патології. Так, органоспецифіч-ними ферментами печінки є сорбітолдегідрогеназа (СДГ), аргіна-за, орнітинкарбамілтрансфераза (ОКТ), глутаматдегідрогеназа (ГДГ), уроканіназа, п'ята фракція лактатдегідрогенази (ЛДГ5); див. главу VII).
Для міокарда органоспецифічним є перший ізофермент лактатдегідрогенази (ЛДГ), визначення якого можна з успіхом застосовувати для диференціації органічних і функціональних порушень міокарда.
Ряд ферментів локалізується в кількох органах і тому підвищення їх активності є типовим показником патології. Такі ферменти, як і органоспецифічні, називають індикаторними. До їх числа, наприклад, належать аспарагінова (АсАТ) і аланінова (АлАТ) трансамінази, альдолаза, холінестераза, лактатдегідрогеназа, гамма-глутамілтрансфераза, креатинкіназа. Виявивши, наприклад, підвищення активності АсАТ у сироватці крові великої рогатої худоби можна вести мову про порушення структури печінки, міокарда або скелетних м'язів. Активність креатинфосфо-кінази підвищується при білом'язовій хворобі молодняка та інфаркті міокарда.
Визначення активності ферментів дає змогу поставити діагноз на ранній стадії хвороби. Так, при патології печінки активність трансаміназ підвищується значно раніше, ніж з'являються зміни білкових фракцій, кількості білірубіну, а при D-гіповітамінозі най-
|
 Скачать 2.87 Mb.
Скачать 2.87 Mb.

 кози в крові є проведення аналізу не пізніше 2 год після взяття крові. Вміст глюкози в крові є відносно постійною величиною (табл. 13).
кози в крові є проведення аналізу не пізніше 2 год після взяття крові. Вміст глюкози в крові є відносно постійною величиною (табл. 13).