Инженерная химия (1-21 вопрос). Дисциплина Инженерная химия
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
                                                                                                                                                                                                  Дисциплина: Инженерная химия Дисциплина: Инженерная химия
1. Химико-технологический процесс (ХТП) закономерности их протекания, задачи анализа, синтеза и оптимизации химико-технологических систем, технологические принципы, создания химико-технологических систем. Любое химическое производство может быть представлено в виде химической системы, которая характеризуется входными параметрами, выходными параметрами и параметрами управления z. Z2 Z1 У1 Х1 У2 Х2 ХТС Х3 У3 Любое химическое производство можно представить в виде следующих стадий: Рассмотрим на примере реакции: А+В=С+Д Энергоснабжение 5 Энергоснабжение 6 1 2 3 4 АСУП А В Д А1, В1 С АСУП – автоматизированная система управления производством. 1 – стадия подготовки сырья; 2 – стадия синтеза; 3 – стадия выделения целевого продукта; 4 – стадия утилизации отходов; 5 – энергоснабжение; 6 – водоснабжение. На первой стадии проводят операции, необходимые для подготовки исходных реагентов к проведению химической реакции. Реагенты переводят, в частности, в наиболее реакционноспособное состояние. Например, известно, что скорость химических реакций сильно зависит от температуры, поэтому часто реагенты до проведения реакции нагревают. Газообразное сырье для повышения эффективности процесса и уменьшения размеров аппаратуры подвергают компримированию до определенного давления. Чтобы устранить побочные явления и получить продукт высокого качества, исходное сырье подвергают очистке от посторонних примесей, пользуясь методами, основанными на различии физических свойств (растворимость в различных растворителях, плотность, температуры конденсации и кристаллизации и т. д.). При очистке сырья и реакционных смесей широко применяют явления тепло- и массообмена, гидромеханические процессы. Могут быть использованы и химические методы очистки, основанные на химических реакциях, в результате которых ненужные примеси превращаются в легко отделимые вещества. Соответствующим образом подготовленные реагенты на следующей стадии подвергают химическому взаимодействию, которое может состоять из нескольких этапов. В промежутках между этими этапами иногда необходимо вновь использовать тепломассообменные и другие физические процессы. Например, при производстве серной кислоты диоксид серы частично окисляют до триоксида, затем реакционную смесь охлаждают, извлекают из нее путем абсорбции триоксид серы и вновь направляют ее на окисление. В результате химических реакций получают смесь продуктов (целевых, побочных, попутных) и не прореагировавших реагентов. Заключительные операции последней стадии связаны с разделением этой смеси, для чего вновь применяют гидромеханические, тепло- и массообменные процессы, например: фильтрование, центрифугирование, ректификацию, абсорбцию, экстракцию и т. д. Продукты реакции направляют на склад готовой продукции или на дальнейшую переработку; не прореагировавшее сырье вновь используют в процессе, организуя его рецикл. На всех этапах, а особенно на заключительных, проводят также рекуперацию вторичных материальных и энергетических ресурсов. Потоки газообразных и жидких веществ, попадающих в окружающую среду, подвергают очистке и обезвреживанию от опасных примесей. Твердые отходы либо направляют на дальнейшую переработку, либо размещают для хранения в безопасных для окружающей среды условиях. Любую сложную химическую систему можно представить в виде иерархической структуры. В основе иерархической структуры должен быть положен такой элемент, на основе которого можно выстроить всю иерархическую структуру. 1 – процесс; 2 – аппарат; 3 – узел (агрегат); 4 – химико-технолгический процесс (ХТП); 5 – химическое производство (ХП). Процессы бывают: механические (измельчение, дробление, гранулирование); физические (нагревание, охлаждение); физико-химические (конденсация, плавление); химические (химическая реакция). Аппарат – это устройство, предназначенное для проведения какого-либо процесса. Аппарат, в котором осуществляется процесс называется реактором. Узел (агрегат) – это совокупность аппаратов, предназначенная для проведения какого-либо процесса. ХТП – это совокупность узлов, предназначенная для получения какого-либо продукта (отдельный цех, установка). ХП – это совокупность ХТП, предназначенная для получения целевого продукта (цех, завод). Химический комбинат – это структурная единица отрасли химической промышленности. Классификация химических процессов и реакций, лежащих в основе промышленного производства: По фазному состоянию исходных веществ: гомо- и гетерофазные. Гомофазные процессы – это процессы, в которых реагирующие вещества находятся в одинаковых фазах. Гетерофазные процессы – вещества находятся в разных фазах. По месту протекания реакции: гомо- и гетерогенные процессы. Гомогенные процессы – реакции протекают в объеме фазы. Гетерогенные процессы – реакции протекают на границе раздела фаз. По химической схеме: простые: 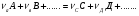 ; ;сложные: 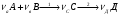  1,2 – последовательные реакции; 1,3 – параллельные реакции. Процессы пиролиза, крекинга нефтепродуктов описываются сложными химическими схемами: По механизму: элементарные: А+В=С+Д; неэлементарные:  . .По тепловому эффекту: эндо- и экзотермические реакции; По применению катализаторов: каталитические и некаталитические; По молекулярности: моно-, би-, тримолекулярные. По порядку: реакции 1,2,3, нулевого и дробного порядка. Важной подсистемой сложного химико-технологического процесса является химический процесс. Химический процесс представляет собой одну или несколько химических реакций, сопровождаемых явлениями переноса теплоты, массы и импульса, оказывающих влияние как друг на друга, так и на протекание химической реакции. Анализ единичных процессов, их взаимного влияния позволяет разработать технологический режим. Технологическим режимом называется совокупность технологических параметров (температуры, давления, концентраций реагентов и т. д.), определяющих условия работы аппарата или системы аппаратов (технологической схемы). Оптимальные условия ведения процесса – это сочетание основных параметров (температуры, давления, состава исходной реакционной смеси и т. д.), позволяющее получить наибольший выход продукта с высокой скоростью или обеспечить наименьшую себестоимость при соблюдении условий рационального использования сырья и энергии и минимизации возможного ущерба окружающей среде. Единичные процессы протекают в различных аппаратах – химических реакторах, абсорбционных и ректификационных колоннах, теплообменниках и т. д. Отдельные аппараты соединены в технологическую схему процесса. Технологическая схема – рационально построенная система единичных аппаратов, соединенных различными видами связей (прямых, обратных, последовательных, параллельных), позволяющая получить заданный продукт заданного качества из природного сырья или полуфабрикатов. Технологические схемы бывают открытыми и закрытыми, могут содержать байпасные (обводные) потоки и рециклы, позволяющие повышать эффективность функционирования химико-технологической системы в целом. Разработка и построение рациональной технологической схемы – важная задача химической технологии. |
