Патофизиология. 2 коллок по патофизе. 1. Гипоксия. Патогенетическая классификация гипоксий. Виды и причины дискапний. Гипоксия
 Скачать 4.44 Mb. Скачать 4.44 Mb.
|
|
Причины незавершенного фагоцитоза: 1. Дефицит белка. 2. Дефицит витаминов. 3. Наследственные ферментопатии. 4. Иммунодефициты. 5. Особенности возбудителя (его размеры значительно превышают размеры самого фагоцита). 6. Объектом фагоцитоза являются комплексы антиген-антитело, находящиеся на плоской поверхности сосудистого эндотелия. Как следствие, раздраженные мононуклеары выделяют монокины. Активированные хемоаттрактантами фагоциты способны высвобождать содержимое своих гранул не только внутрь фагосомы, но и во внеклеточное пространство. При этом содержимое гранул и продуцируемые фагоцитами активные метаболиты кислорода воздействуют и на объект атаки, и на ткани организма хозяина. 11. Пролиферация. Роль трефонов. Особенности хронического воспаления. Понятие гранулемы. Пролиферация— разрастание ткани организма путём размножения клеток делением. Важной ролью воспаления, как эволюционно сформировавшегося защитно-приспособительного процесса, является восстановление поврежденного участка ткани. Макрофаги, удаляя останки нейтрофилов и разрушенных тканей, выделяют монокины, стимулирующие пролиферацию. Основными клеточными элементами, ответственными за репаративные процессы в очаге воспаления, являются фибробласты. Они продуцируют основное межклеточное вещество - гликозаминогликаны, а также синтезируют и секретируют волокнистые структуры - коллаген, эластин, ретикулин. В свою очередь, коллаген является главным компонентом рубцовой ткани. Регуляция пролиферации.Процесс пролиферации находится под сложным гуморальным контролем. Решающее значениездесь имеютопять-таки макрофаги.Они являются основным источником фактора роста фибробластов - термолабильного белка, стимулирующего пролиферацию фибробластов и синтез коллагена. Макрофаги также усиливают привлечение фибробластов в очаг воспаления, секретируя ИЛ-1 и фибронектин. Макрофаги стимулируют пролиферацию эндотелиальных и гладкомышечных клеток сосудистой стенки, базальной мембраны и, таким образом, образование микрососудов. Угнетение или стимуляция системы мононуклеарных фагоцитов соответственно ослабляет или усиливает развитие грануляционной ткани в очаге гнойного воспаления. Факторы, стимулирующие деление клеток называются трефоны, а ингибирующие клеточное деление – кейлоны. К трефонам относятся: 1. Полиамины - путресцин, спермидин (продукты орнитиндекарбоксилазы). 2. Факторы роста фибробластов - тромбоцитарный и гипофизарный. 3. Эндотелиальный хемотаксический фактор (из макрофагов) - для врастания сосудов в грануляционную ткань. 4. Эндотелиальный фактор роста. 5. Лимфокины (из Т-лимфоцитов) участвуют в пролиферации лимфоцитов и макрофагов. 6. Монокины (из макрофагов). На пролиферацию влияют также гормоны: усиливают – альдостерон, андрогены (избыток андрогенов способствует развитию гипертрофического рубца); ослабляют – адреналин, глюкокортикоиды. Хроническое воспаление Хроническое воспаление может быть первичным и вторичным. Если воспаление изначально имеет персистирующее — вялое и длительное — течение, его называют «первично хроническим». Это связано с особенностями флогогенного агента: например, он не может быть поглощен и разрушен фагоцитами или наблюдается персистенция возбудителя, не произошла элиминация антигенного материала, появились неоантигены (инфекционный агент изменил антигенную структуру ткани, вызвал иммунопатологический процесс). Если воспаление после острого периода приобретает затяжной характер, то оно обозначается как «вторично хроническое», зачастую связанно с проблемами макроорганизма. Для хронического воспаления характерен ряд признаков: образование гранулём, капсулы, формирование некроза, преобладание моноцитарного и лимфоцитарного инфильтрата. Причины хронического воспаления • Персистирующая инфекция и/или интоксикация (например, хроническая микробная и/или грибковая инфекция нередко сочетается с аллергическими реакциями). • Повторное повреждение ткани или органа (например, лёгких компонентами пыли), сопровождающееся образованием чужеродных антигенов и развитием иммунопатологических реакций. • Длительный стресс и другие состояния, сопровождающиеся повышенной концентрацией в крови катехоламинов и глюкокортикоидов. Указанные группы гормонов подавляют процессы пролиферации, созревание и активность фагоцитов, потенцируют их разрушение. • Различные формы фагоцитарной недостаточности. • Длительная стимуляция макрофагов различными цитокинами, иммунными комплексами, продуктами распада микробов или клеток организма. • Миграция в очаг воспаления избыточного количества полиморфноядерных лейкоцитов. Они вызывают деструкцию матрикса соединительной ткани, секретируют большое количество БАВ, обусловливающих в свою очередь привлечение в зону повреждения мононуклеарных фагоцитов и их активацию. • Активация ангиогенеза в очаге хронического воспаления. Плазмолемма эндотелиальных клеток в новообразованных сосудах содержит адрессины, стимулирующие миграцию лимфоцитов и моноцитов в очаг хронического воспаления. • Названные выше и другие факторы приводят к накоплению в очаге воспаления большого числа активированных макрофагов. Эти клетки, в свою очередь, обеспечивают потенцирование процессов хронического воспаления. Развитию хронического воспаления способствуют также: слабая реактивность (например, у детей и стариков), слабые сосудистые реакции, нзавершённый фагоцитоз, особая устойчивость возбудителя (туберкулёз, проказа, вирус гепатита, паразиты), неперевариваемые объекты - инородные тела (металл, древесина, кремний, асбест, тальк и др.), аллергические и аутоиммунные болезни. Пути запуска и развития острого и хронического воспаления принципиально отличаются: 1. При остром воспалении процесс запускается «от сосудов», тогда как при хроническом воспалении - с территории соединительной ткани, где находятся активные макрофаги. 2. Ведущей клеткой острого воспаления (клеткой-эффектором) является нейтрофил, а хронического воспаления - активный макрофаг. Все другие клетки мезенхимы (тучные, лимфоциты, эозинофилы) тоже вносят свой вклад в реализацию процесса, модулируя реактивность нейтрофилов и макрофагов. 3. Острое воспаление заканчивается быстро, в считанные дни, если не возникнет осложнений в виде гнойной полости (абсцесса). 4. Хроническое воспаление не может закончиться быстро из-за избытка воспалительных цитокинов, продуцируемых раздраженными макрофагами. Макрофаги в очаге воспаления имеют длительный жизненный цикл, который исчисляется неделями, месяцами и даже годами. Нейтрофил, вышедший в ткани, живет несколько часов. Примером хронического продуктивного воспаления является гранулема. Вначале, на этапе зарождения, в гранулему приходят свежие моноциты с кровью, лимфоциты – с кровью и лимфой. Они еще не обладают достаточно высокой бактерицидной активностью. Затем гранулема постепенно зреет, и в ней накапливаются дифференцированные макрофаги, активно поглощающие патогены. Наконец, на заключительном этапе, в застарелой гранулеме число активно фагоцитирующих клеток уменьшается, но зато возрастает процент инертных в смысле фагоцитоза эпителиоидных и гигантских многоядерных клеток. Гранулема - это не «застывшее» образование. В нее постоянно поступают все новые и новые моноциты с кровью из костного мозга. Если в гранулеме много активированных макрофагов, приток будет превышать отток клеток из гранулемы. Дело в том, что раздраженные макрофаги усиленно вырабатывают особые гемопоэтины. Они стимулируют образование новых фагоцитов в костном мозге, поэтому пока раздраженные макрофаги функционируют, баланс будет смещен в сторону притока клеток в инфильтрат, и его рассасывание невозможно. Если макрофаги выделяют много биоокислителей в среду своего обитания, они могут не только санировать очаг, но и повредить собственные клетки организма. Морфогенез гранулемы складывается из 4 стадий: 1. Накопление в очаге повреждения ткани юных моноцитарных фагоцитов; 2. Созревание этих клеток в макрофаги и образование макрофагальной гранулемы; 3. Созревание и трансформация моноцитарных фагоцитов и макрофагов в эпителиоидные клетки и образование эпителиоидной клеточной гранулемы; 4. Слияние эпителиоидных клеток (или макрофагов) и образование гигантских клеток (клеток инородных тел или клеток Пирогова-Лангханса) и эпителиоидно-клеточной или гигантоклеточной гранулемы. Гигантские клетки характеризуются значительным полиморфизмом: от 2-3-ядерных до гигантских симпластов, содержащих 100 ядер и более. В гигантских клетках инородных тел ядра располагаются в цитоплазме равномерно, в клетках Пирогова-Лангханса - преимущественно по периферии. Диаметр гранулем, как правило, не превышает 1-2 мм; чаще они обнаруживаются лишь под микроскопом. Исходом гранулемы является склероз. Таким образом, гранулема характеризуется: 1. Скоплением макрофагов. 2. Скоплением эпителиоидных клеток. 3. Дополнительными признаками (могут отсутствовать): · инфильтрацией другими клетками (лимфоцитами, плазматическими клетками, нейтрофильными или эозинофильными гранулоцитами); · наличием фибробластов и развитием склероза; · развитием деструктивных изменений и некроза. Хроническое воспаление может продолжаться в течение всей жизни. Периодически оно обостряется, когда в очаг поступают свежие макрофаги с высокой провоспалительной активностью. В очаге мононуклеарной инфильтрации идет деструкция соединительной ткани. В ответ на это происходит разрастание волокнистых структур. В конечном счете, может развиться склероз с частичным или полным выключением специализированных функций органа. Этому способствует накопление в гранулеме особого класса макрофагов, секретирующих фибробласт-стимулирующие факторы. С такой ситуацией врачам приходится встречаться при циррозах печени после вирусных гепатитов, хронических гломерулонефритах и других хронически протекающих воспалительных заболеваниях. Блок 6. Принципы противовоспалительной терапии I. Симптоматическая терапия направлена на снятие основных классических признаков воспаления: обезболивающих - для снятия боли, сосудосуживающих - для уменьшения гиперемии и отека. II. Патогенетическая терапия включает подходы для уменьшения синтеза медиаторов воспаления (брадикинина, простагландинов, гистамина и др.) или блокаду рецепторов для этих медиаторов. Препараты глюкокортикоидов (преднизолон, гидрокортизон) тормозят синтез ферментов, необходимых прямо или косвенно для синтеза медиаторов воспаления (фосфолипаз, липооксигеназы и циклооксигеназы, гистидиндекарбоксилазы, калликреина и т.д.), мембраностабилизирующим эффектом из-за снижения образования фосфолипазы, сосудосуживающим действием (пермиссивный эффект на катехоламины). Также глюкокортикоиды уменьшают образование интерлейкинов, тормозят иммунные и аутоиммунные процессы. Но применение глюкокортикоидов опасно при инфекционном воспалении, т.к. ослабление экссудативной фазы снижает барьерную функцию воспаления и может способствовать распространению возбудителя. Нестероидные противовоспалительные средства, блокируют синтез простагландинов за счет угнетения циклооксигеназы (индометацин, вольтарен, ацетилсалициловая кислота). Ингибиторы синтеза лейкотриенов блокируют липоксигеназы, необходимые для синтеза лейкотриенов. Разрабатываются препараты, блокирующие лейкотриеновые рецепторы (сулотробан, зилеутин). Учитывая, что воспаление - не только патологический, но и адаптивный процесс, при некоторых вялотекущих (гипоэргических) воспалениях применяют приемы, активирующие данный процесс иным путем, например через усиление кровотока (местнораздражающие средства для включения кутано-висцеральных рефлексов), стимуляцию лейкопоэза и фагоцитоза (препараты, содержащие фрагменты нуклеиновых кислот и витамины), пирогенного действия. Фазу пролиферации можно усилить назначением препаратов, стимулирующих белковый синтез прямо (стероидные или нестероидные анаболики) или косвенно (витамины, препараты аминокислот). Но если при значительном повреждении тканей фаза пролиферации воспаления заканчивается избыточным развитием соединительной ткани, для рассасывания рубцов применяются ферментные препараты, вводимые путем инъекции или электрофореза (лидаза, ронидаза). 12. Нарушения температурного гомеостаза. Механизмы повышения температуры при лихорадке и непирогенных гипертермиях. Сходство и отличие лихорадки и перегревания. Температура тела является результатом всех биохимических процессов метаболизма первичных субстратов и макроэргических соединений (АТФ). Все процессы распада биологических субстратов приводят к выделению тепла. От температуры зависит изменение проницаемости клеточных мембран, возбудимости нервных и мышечных тканей. Постоянная температура тела может быть тогда, когда существует равенство между процессами теплопродукции и теплоотдачи. Образование тепла (теплопродукция) при химических процессах называется химической терморегуляцией, она включает в себя: 1. Несократительный термогенез Метаболизм (энергетический обмен) в тканях. Окислительные процессы (окисление жирных кислот) в бурой жировой ткани (скорость больше в 20 раз по сравнению с белой жировой тканью, активизируются при возбуждении b-адренорецепторов бурой жировой ткани). 2. Сократительный термогенез представляет собой термозависимое изменение тонуса и позы, а также мышечную дрожь. 3. Разобщение процессов окисления и фосфорилирования (мощный разобщитель – тироксин). Регуляция теплоотдачи – это физическая терморегуляция. Теплоотдача происходит главным образов за счет радиации (45-55% тепла при температуре комфорта), 15-30% тепла выводится конвекцией (нагреванием окружающего тело воздуха), испарение (пот с поверхности тела) и до 5% составляет кондукция или теплопроводность (передача тепла твердому тему при непосредственном контакте). Процессы теплоотдачи во многом определяются работой сердечно-сосудистой системы, потому что она приводит к перемещению потоков крови от глубоких тканей к поверхностным. Температура тела в разных его участках разная. Система терморегуляции поддерживает постоянство температуры ядра тела (то есть всех тканей глубже 2 см от кожи), которая приблизительно равна 37 градусам. Температура «оболочки» при этом (т.е. кожи и поверхностных тканей) колеблется в пределах 24,4°С – 36,7°С. Рецепторы терморегуляции расположены в организме фактически везде. Периферические рецепторы оценивают разнообразную информацию о температуре, причем холодовых, то есть активирующихся при понижении температуры рецепторов больше. Интерорецепторы также оценивают неодинаковые параметры в зависимости от функциональной активности органов. Центральные терморецепторы оценивают неодинаковую температуру, которая может меняться в пределах 1-2 градуса. Информация о состоянии терморегуляции анализируется в гипоталамусе, где суммируются все термические сигналы. Ядра передней части гипоталамуса отвечают за теплоотдачу, задней части – за теплопродукцию. Состояния, связанные с повышением температуры тела, называются гипертермии. Классификация гипертермий 1. Пирогенно обусловленная (лихорадка). 2. Непирогенно обусловленные: эндогенные гипертермии (психогенные, центрогенные, рефлексогенные, эндокринные); экзогенные гипертермии (перегревание, лекарственная); поведенческая (при интенсивной физической нагрузке). 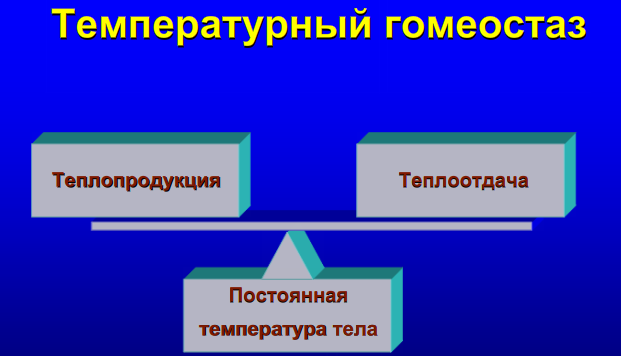  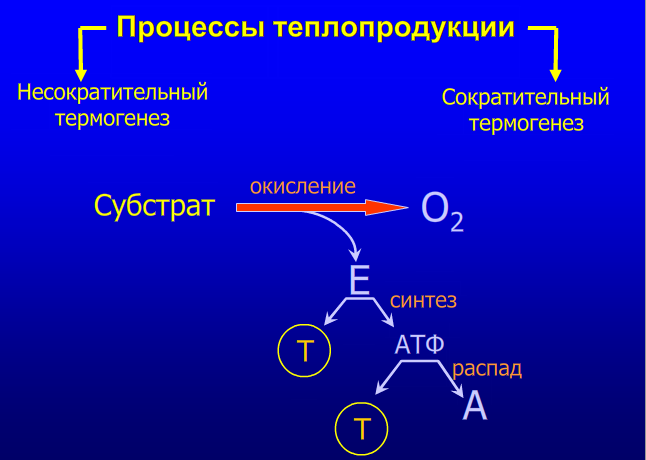  Излуче́ние — это процесс испускания и распространения энергии в виде волн и частиц. Конвекция (от лат. convectiō — «перенесение») — вид теплообмена, при котором внутренняя энергия передается струями и потоками. Испарение — явление перехода твердых и жидких тел в соответствующее им газообразное состояние — в пары, переход, не сопровождающийся разложением молекул сложных тел на составляющие их атомы Теплопроведение (кондукция) – это способ отдачи тепла, который имеет место при контакте, соприкосновении тела человека с другими физическими телами. 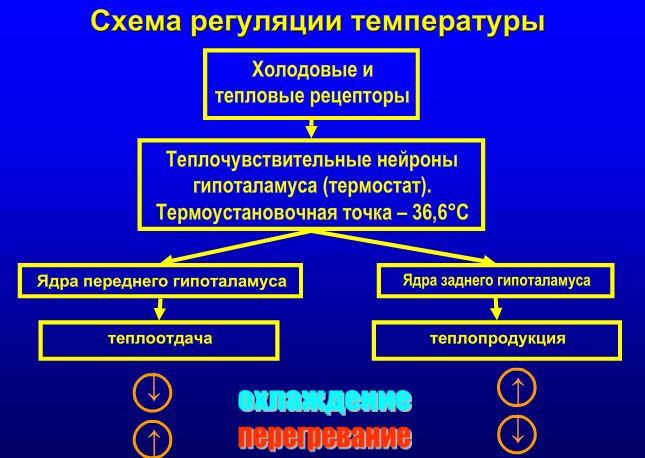 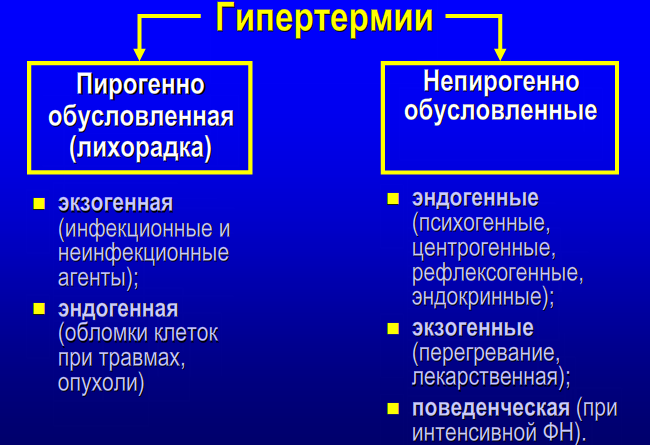          |
