5 Глава Гипертоническая болезнь (эссенциальная гипертензия) и симптоматические гипертензии
 Скачать 2.67 Mb. Скачать 2.67 Mb.
|
|
Гиперкинетический Нормокинетический Гипокинетический синдром в момент синдром в момент синдром в момент аритмии аритмии аритмиио KCL 1,5-2,0 г KCL 1,5-2,0 г KCL 1,5-2,0 г + MgSO4 5,0 г + MgSO4 5,0 г + MgSO4 5,0 г внутривенно* (80%) внутривенно* (20%) внутривенно* + строфантин или дигоксин 0,25 мг (31%) Новокаинамид 1,0-2,0 г Новокаинамид 1,0-2,0 г Пропафенон*** 210- внутривенно** (100%) внутривенно** (100%) 280 мг внутривенно (25%) Кордарон 300-600 мг внутривенно (35%) Примечание: - указывает на продолжение терапии, при отсутствии эффекта при предыдущем лечении; % - эффективность использованных методов лечения в процентах; о – методом выбора является электроимпульсная терапия (электрическая кардиоверсия); * - KCL в дозе 1,5-2,0 г + MgSO4 5,0 г (25% -5,0) вводится внутривенно в разведении на 200 мл физиологического раствора или 5% глюкозы в течение 30-50 мин., ** - при наличии факторов риска развития возможных осложнений при применении новокаинамида целесообразно использовать пропафенон или флекаинид и (или) кордарон, причем, при нормокинетическом синдроме новокаинамид эффективен в качестве монотерапии аритмии (без хлорида калия и магнезии) только в первые 4-6 ч от начала пароксизма мерцания предсердий; *** - вместо пропафенона можно использовать новокаинамид в тех случаях, когда после введения сердечных гликозидов отмечается нормализация гемодинамики и исчезают симптомы сердечной недостаточности, при отсутствии факторов риска развития возможных осложнений при применении новокаинамида. Комментарии к рис. 5.20. 1. Эффективность использования дифференцированной терапии пароксизмов мерцания предсердий в зависимости от состояния гемодинамики в момент аритмии, по нашим данным, составляет, в среднем, 95% (Олесин А.И. и соавт., 1988, 1996). 2. К факторам риска развития возможных осложнений при применении новокаинамида относятся такие, как (Олесин А.И. и соавт, 1983, 1988, 1994, 1996): - увеличение интервала Q-T электрокардиограммы на 20% от нормальных величин, скорректированных по частоте сердечных сокращений; - транзиторная блокада ножек пучка Гиса; - гипокинетический вариант гемодинамики в момент пароксизма мерцания предсердий; - увеличение аритмического индекса Шломка-Рейнделя, определяемого по разнице между максимальным и минимальным интервалом R-R, отнесенный к среднему интервалу R-R при регистрации электрокардиограммы за 1 мин. при мерцании предсердий и отражающего проведение по атриовентрикулярному соединению в момент этой аритмии, более, чем на 0,3 и более в сравнении с должной величиной свидетельствует о высоком риске развития атриовентрикулярных блокад. при терапии новокаинамидом пароксизмов мерцания предсердий (Олесин А.И. и соавт., 1983). Должную величину аритмического индекса Шломка-Рейнделя определяют для частоты желудочкового ритма в момент мерцания предсердий с частотой до 100 ударов в мин. по формуле: [Lg(100-ЧCC)-0,5]0,1 и при ритме более 100 уд/мин – [0,5+0,1(ЧСС –100/20)] 0,1, где ЧСС – частота сердечных сокращений при мерцании предсердий; - в тех случаях, когда давность аритмии можно определить приблизительно, с точностью до месяцев и недель (II группа), а также при отсутствии эффекта при применении внутривенной терапии используется комбинированное лечение хинидином (хинид-дурулес, кинилентин) в сочетании с верапамилом. В возрасте до 60 лет хинидин назначают в следующих дозировках: 1 день – 1000 мг (5 таблеток по 200 мг), 2 день – 1400 мг (7 таблеток по 200 мг), в остальные дни – ежедневное увеличение дозы на 200 мг до достижения суммарной дозы 2000 мг или купирования аритмии (хинидин принимается в сочетании с ежедневным приемом верапамила в дозе 160 мг: 80 мг утром (в 9оо) и 80 мг – вечером (в 21оо); в возрасте старше 60 лет – начальная доза 600-800 мг (3-4 таблеток по 200 мг), с последующим ежедневным увеличением дозы хинидина на 200 мг (1 таблетка по 200 мг) также до достижения суммарной дозы 2000 мг или купирования аритмии (хинидин принимается в сочетании с ежедневным приемом верапамила в дозе 160 мг: 80 мг утром (в 9оо) и 80 мг – вечером (в 21оо); - у больных III группы (осложненное течение мерцательной аритмии) купирование пароксизмов мерцания предсердий проводится после устранения осложнений таких, как сердечная недостаточность, инсульта, тромбоэмболии легочной артерии и т.д.; - у больных IV группы (больные с постоянной формой или с мерцательной аритмии неизвестной давности) проводится терапия хлоридом калия и сердечными гликозидами (лучше использовать дигоксин с медленным темпом насыщения), причем в 65% случаев, по нашим данным, если мерцательная аритмия неизвестной давности является пароксизмом, она купируется. Профилактика пароксизмов мерцания (фибрилляции) предсердий. Сохранение синусового ритма с помощью антиаритмической терапии у больных с пароксизмальной формой мерцания предсердий – сложная и до сих пор нерешенная задача. Для оценки объема и характера противорецидивной антиаритмической терапии пароксизмов мерцания предсердий необходимо учитывать предикторы ее перехода в хроническую форму. Среди них можно выделить анатомические (структурные) и электрофизиологические предикторы. r Анатомические предикторы перехода мерцания предсердий в хроническую форму: - продолжительность аритмии более 7 суток (90%); - увеличение объема предсердий, чаще левого (по данным эхокардиографии – более 4,0 см) (85%); - систолическая или диастолическая дисфункция левого желудочка (80%); - кальциноз аорты, аортального и митрального клапанов (65%); - вегетативный дисбаланс, в частности, ночные пароксизмы мерцательной аритмии, обусловленные избыточным влиянием n. Vagus, например, при заболеваниях желудочно-кишечного тракта - желчнокаменной болезни, хронического холецистита, язвенной болезни и т.д. (55%); - синдром слабости синусового узла (20%); - внутрипредсердные тромбы и опухоли (10%). Примечание: в процентах указана прогностическая значимость каждого показателя. Одним из ведущих мест среди этих предикторов отводится расширению левого предсердия, которое многие авторы называют аритмогенным (М.С. Кушаковский, 1998, 1999; Rensma P., 1987). Расширение левого предсердия, по данным М.С. Кушаковского (1999), обнаруживается примерно у 4/5 больных, переносивших пароксизмы мерцания предсердий. Основными причинами его расширения являются: митральный стеноз, повышение конечного диастолического давления в полости левого желудочка, митральная регургитация, выраженная гипертрофия стенок левого желудочка. Кроме вышеуказанных факторов, увеличение размеров левого предсердия может быть за счет следующих причин: - частые и (или) продолжительные пароксизмы мерцания предсердий, длительный аритмический анамнез (фибрилляции предсердий); - нарушение диастолической функции левого желудочка с расширением полости левого предсердия; - усиление ригидности (жесткости) стенок, обызвествление (кальциноз) кольца митрального клапана, создающие затруднения для оттока крови из левого предсердия в левый желудочек, - первичное («миодистрофическое») расширение левого предсердия, развивающееся без ретроградного влияния со стороны левого желудочка и митрального кольца; - степень тяжести сердечной недостаточности. Определенную роль в развитии пароксизмов мерцания предсердий играет увеличение ушка левого предсердия. По данным некоторых авторов (Кушаковский М.С., 1998, 1999; Omran Н. et al., 1997), сохранение хорошей функции ушка левого предсердия может указывать на потенциальную обратимость мерцания предсердий. Однако не все исследователи придерживаются этой точки зрения (Nerhorst Р. et al., 1995). Вместе с тем, нет противоречий в оценке роли ушка левого предсердия в процессах внутрисердечного тромбообразования, осложняющегося возникновением тромбоэмболических осложнений. r Электрофизиологические факторы риска пароксизмов мерцания предсердий Было замечено, что у 1/5 больных, переносивших пароксизмы мерцания, имеют нормальный или незначительно увеличенный размер левого предсердия. Однако у таких больных могут быть частые пароксизмы этой аритмии. Причины «готовности» этой группы пациентов связаны с особенностями измененного электрогенеза мышечных клеток левого предсердия. К числу электрофизиологических предикторов мерцания предсердий относятся следующие: - предсердные (внутри- и межпредсердные) блокады, увеличение продолжительности зубца Р > 1040 мс предсказывает развитие пароксизма мерцания предсердий с чувствительностью 78% и специфичностью 71% (Andrikopolous G. et al., 1998); - неоднородная предсердная рефрактерность (W. Lammers et al., 1986); - повышенная уязвимость предсердий по результатам кардиостимуляции (Пучков А.Ю., 1995, Шабров А.В. и соавт., 1999, Олесин А.И. и соавт., 2000); - наличие поздних потенциалов предсердий, указывающих на фрагментированную активность миокарда предсердий (Николин К.М., 1996; Волков В.Н., 1998; Аsanin М.et al., 1998; R. Archboid et al., 1998). Анализ многочисленных данных рандомизированных исследований за последние 20 лет показал, что в настоящее время нет такого препарата, которым не пытались предупредить развитие рецидивов мерцания предсердий. Результаты международного исследования “NISA”, оценивающего частоту использования антиаритмических препаратов в разных странах, показали, что для предупреждения развития мерцания предсердий в Италии чаще всего используют пропафенон и флекаинид, во Франции – хинидин и другие препараты IА класса или препараты III класса (соталол и кордарон), в Германии, Испании – кордарон, в Италии – -адреноблокаторы (метопролол), причем, авторы, анализирующие частоту использования противоаритмических средств в разных странах отмечают, что разница в выборе препаратов, по-видимому, может быть объяснена чисто коммерческими интересами (Bracchetti D. et al., 1996). Остальные противоаритмические средства для предупреждения клинических рецидивов мерцания предсердий такие, как дизопирамид, верапамил и т.д., не применяются из-за низкой их противорецидивной активности (Егоров Д.Ф., 1998, Кушаковский М.С., 1999, Bracchetti D. et al., 1996). Обобщая результаты многоцентровых исследований, проведенных за последние 20 лет и посвященных профилактике пароксизмов мерцания предсердий, можно сделать вывод, что положительный противорецидивный эффект всех наиболее часто применяемых препаратов в разных странах мира (см. выше), за исключением кордарона, составляет в первые 3 месяца (от начала ихиспользования), в среднем, 40-70%, через 6 месяцев – 30-50% и через 1-1,5 года – меньше 20-40%. Через 2-3 года приема этих препаратов положительный эффект практически отсутствует. Следует отметить, что при длительном «аритмическом анамнезе» до начала лечения, например, при исходной рефрактерности к терапии препаратами IA подкласса, эффективность большинства антиаритмических средств значительно ниже. Кроме того, побочные, включая аритмогенный, эффекты этих препаратов составляют от 4% до 30%, а некоторые авторы указывают – до 50%, что требует их отмены (Руда М.Я. и соавт, 1996, Розен М.Р., 1996, Егоров Д.Ф., 1998, Кушаковский М.С., 1999, Campbell R.W.F., 1996, Camm A.M., 1997). Наибольший положительный эффект при профилактике мерцания предсердий, по мнению многих авторов, можно достичь только применяя кордарон. Так, в клинике под руководством М.С. Кушаковского (1990, 1999) за 20 летний период применения кордарона противорецидивный эффект этого препарата наблюдался практически в 80% случаев (в 60% - полное устранение приступов и у 20% - их урежение до 2-3 раз в год) на протяжении от 1 до 6 лет. Сходные данные были получены в других многочисленных исследованиях (Недоступ А.В. и соавт., 1990, Олейников В.Э. и соавт., 1995, Howard P.A. et al., 1995, Campbell R.W.F., 1996, Camm A.M., 1997). Следует отметить, что вышеуказанный противорецидивный эффект кордарона практически не меняется при предшествующей резистентности ко многим противоаритмическим средствам. Многие исследователи указывают, что эффективность антиаритмических средств, включая кордарон, различна в зависимости от нозоологии: максимальный эффект (до 80-90%) отмечается при идиопатическом мерцании предсердий и артериальной гипертензии, а минимальный (до 60-70%) – при клапанном поражении сердца (Кушаковский М.С., 1999, Criyns H.J. et al., 1991, 1997). Многочисленные публикации, основанные на исследованиях CASH и CASH-II (1989-1994), DIAMONO (1997), свидетельствуют о высоком риске аритмогенного эффекта и внезапной аритмической смерти при длительном применении препаратов I класса для профилактики аритмий, включая мерцание предсердий. Поэтому в настоящее время считается, что, во-первых, необходим индивидуальный выбор противорецидивной антиаритмической терапии пароксизмов мерцания предсердий путем использования различных электрофизиологических тестов, включая тестирование антиаритмических препаратов с помощью чреспищеводной или внутрисердечной электрокардиостимуляции. Следует отметить, что при назначении препаратов I класса, особенно IC подкласса, для предупреждения пароксизмов мерцания предсердий необходим неоднократный контроль (не реже 1 раза в месяц), включая суточное мониторирование электрокардиограммы, для исключения аритмогенного эффекта. Во-вторых, необходимо разрабатывать неинвазивные, не уступающие по эффективности электрофизиологическим тестам, методы контроля и оценки эффективности профилактической терапии пароксизмов мерцания предсердий. В-третьих, открываются широкие возможности для немедикаментозных способов предупреждения пароксизмов мерцания предсердий таких, как абляция атриовентрикулярного соединения, постоянная электрокардиостимуляция, а также использования различных видов лазеротерапии. В настоящее время подбор противорецидивной терапии пароксизмов мерцания предсердий проводится путем тестирования антиаритмических средств с помощью чреспищеводной электрокардиостимуляции. За 7-10 дней до исследования (или через 5-7 периодов полувыведения) отменяются противоаритмические препараты. Для индуцирования мерцания предсердий обычно используют залповую или медленно-нарастающую сверхчастую стимуляции (Олесин А.И. и соавт., 2000). Залповую стимуляцию проводят с частотой от 300 до 1200 имп/мин с дисперсностью 50 имп/мин, медленно-нарастающую сверхчастую стимуляцию – путем постепенного увеличения частоты стимуляции (за 15 сек.) с базисного ритмовождения (обычно со 100 имп/мин,) до 200-800 имп/мин с дисперсностью 50 имп/мин. (Гросу А.А. и соавт., 1989, Татарченко И.П. и соавт., 1993, Олесин А.И. и соавт., 2000, Buxton A.E. et al., 1989). Частота, на которой индуцируется мерцание предсердий, обозначается как частотный порог индуцирования аритмии. Возникновение пароксизмов мерцания предсердий при проведении сверхчастой стимуляции зависит как от частоты, так и от длительности проведения процедуры. Для медленно-нарастающей свехчастой стимуляции порог индуцирования аритмии расчитывается по формуле: ПИА = N.Т, где ПИА – частотный порог индуцирования аритмии в имп.с, N - число импульсов за время стимуляции, Т - время стимуляции в сек., а для залповой ПИА = 15,7 + (ЧТ2)К, где ПИА – частотный порог индуцирования аритмии в имп.с, Т - время залповой стимуляции в сек., Ч – частота залповой стимуляции в имп/мин., К – коэффициент, равный 1,03 (Олесин А.И. и соавт., 2000). Нами наблюдалось 218 больных с часто рецидивирующими пароксизмами мерцания предсердий(в среднем, 51 приступов в месяц) в возрасте от 38 до 75 лет (в среднем, 52,33,1 года). Длительность «аритмического анамнеза» до начала исследования составила 0,5-2 года. У 85(38,99%) больных основным заболеванием была выявлена гипертоническая болезнь I-II стадии по критериям ВОЗ, у 95(43,58%) – ИБС: стенокардия II-III функционального класса, у 20(9,17%) - инфаркт миокарда в анамнезе. Диагноз ИБС основывался на критериях ВОЗ. У 135(61,93%) больных наблюдалось сочетание гипертонической болезни и ИБС. Хроническую сердечную недостаточность I-II функционального класса по классификации NYHA диагностировали у 115(52,75%) больных. Контрольную группу составили 58 пациентов с гипертонической болезнью и ИБС без нарушений сердечного ритма в возрасте от 40 до 55 лет (в среднем, 462 года). Выбор противорецидивной антиаритмической терапии пароксизмов мерцания предсердий проводился с учетом клинической формы аритмии (вагусная, адренергическая или смешанная), функции синусового узла (Кушаковский М.С., 1999), в том числе основываясь на результаты анализа спектральных компонентов вариабельности сердечного ритма, определяемых по данным суточного мониторирования электрокардиограммы (система Кардиотехника-4000, АОЗТ «ИНКАРТ» НИИ кардиологии МЗ и МП России, С-Петербург), состояния гемодинамики, характера дисфункции левого желудочка, а также антигипертензивного, антиангинального действия, хронотропных эффектов противоаритмических средств и по результатам тестирования противоаритмических препаратов с помощью чреспищеводной электрокардиостимуляции. Всем больным на первом этапе пароксизмы мерцания предсердий вначале индуцировались с помощью залповой сверхчастой стимуляции, а в тех случаях, когда аритмии в этом режиме не вызвать удалось, использовалась медленно нарастающая сверхчастая стимуляция по методике, описанной нами выше. Пароксизмы аритмии считали устойчивыми при их длительности более 1 минуты и неустойчивыми - менее 1 минуты. Для определения противорецидивной антиаритмической терапии пароксизмов мерцания предсердий вначале тестировали препараты II и IV классов: анаприлин в дозе 60-120 мг в сутки, атенолол в дозе 100-150 мг в сутки, дилтиазем в дозе 180-240 мг в сутки, верапамил в дозе 160-240 мг в сутки, а затем - препараты Ia, Ic и III классов: этацизин в дозе 150 мг в сутки, аллапинин – 75 мг в сутки, соталол - 120-240 мг в сутки, хинидин (кинилентин или хинидин-дурулес) - 1200 мг в сутки, пропафенон - 400-600 мг, дизопирамид - 600-800 мг в сутки и в последнюю очередь - кордарон - 600 - 800 мг в сутки. Противоаритмическая терапия проводилась на фоне использования базисной антиангинальной и антигипертензивной терапии, включающей нитраты пролонгированного действия, антиагреганты, ингибиторы АПФ (капотен, эднит, энап и др.) и т.д. За 7-10 дней перед тестированием противоаритмических средств у всех больных оценивалась эффективность базисной терапии. Длительность применения антиаритмических средств составила 4 - 5 дней, а кордарона - 8 - 10 дней. В последний день приема каждого препарата повторяли чреспищеводную электрокардиостимуляцию. Препарат, на фоне применения которого порог индуцирования аритмии возрастал на 70% и более сравнении с исходной частотой или пароксизм аритмии не индуцировался, назначался для предупреждения рецидивов аритмии. Критерием положительного эффекта при длительном применении определенной терапии явилось уменьшение рецидивирования пароксизмов мерцания предсердий в 2 раза и более, сохранение значений порога индуцирования аритмии при повторном исследовании (через 1,3, 6 месяцев и более) в сравнении с исходными данными. Длительность наблюдения обследованных больных составила от 1 года до 6 лет. Контроль за состоянием больных, регистрацию электрокардиограммы проводили 1 раз в месяц. Регулярный контроль артериального давления и частоты сердечных сокращений пациенты осуществляли самостоятельно. Результаты исследования показали, что наиболее эффективной при выборе противорецидивной противоаритмической терапии пароксизмов мерцания предсердий у больных ИБС, согласно полученным нами данным, является применение медленно-нарастающей сверхчастой стимуляции, причем у 88,17% больных при ее использовании была определена терапия, оказавшаяся эффективной более 1 года, а у 69,05% из них - от 3 до 6 лет (в среднем, 4,10,3 года). У 35,71% больных при использовании залповой сверхчастой стимуляции отмечался ложноположительный результат в выборе противорецидивной антиаритмической терапии: у этих пациентов были определены как наиболее эффективные препараты II и IV классов, однако положительный результат при их применении наблюдался от 1 до 2 месяцев. Однако при повторном тестировании с помощью медленно-нарастающей сверхчастой стимуляции наибольшая противорецидивная активность у них была выявлена только при применении препаратов Ia, Ic и III классов. Поэтому при выборе противорецидивной противоаритмической терапии пароксизмов мерцания предсердий у больных ИБС предпочтение следует отдать препаратам Ia, Ic и III классов, а тестировать с помощью кардиостимуляции противоаритмические средства II и IV классов нецелесообразно из-за низкой их противорецидивной активности в отношении этих аритмий. Они по показаниям могут быть использованы без тестирования, в частности у пациентов с впервые возникшими пароксизмами мерцания предсердий в качестве базисной антиаритмической терапии или как препараты «первой ступени». Меньшую результативность залповой сверхчастой стимуляции при выборе противорецидивной антиаритмической терапии пароксизмов мерцания предсердий у больных ИБС можно объяснить, во-первых, наличием индивидуального, возможно, строго фиксированного, частотного порога индуцирования аритмии, во-вторых, изменением рефрактерности миокарда предсердий в результате нарушения внутри- и межпредсердной проводимости, различных метаболических сдвигов, дисфункции левого желудочка, синусового узла и некоторых других факторов. Следует подчеркнуть, что сама процедура чреспищеводной электрокардиостимуляции, а также используемые фармакологические средства, вероятно, разнонаправленно изменяют электрофизиологические свойства миокарда предсердий. Поэтому при повторном исследовании, по-видимому, из-за фиксированной частоты залповой сверхчастой стимуляции аритмия может не индуцироваться, что приводит к снижению ее воспроизводимости и ложноположительному результату при определении противоаритмической терапии. Следует отметить, что при назначении на длительный период антиаритмических препаратов, особенно Iс класса у больных ИБС, вначале их приема необходимо неоднократно проводить суточное мониторирование электрокардиограммы для исключения аритмогенного действия этих препаратов. Несмотря на успехи в выборе противоаритмической терапии пароксизмов мерцания предсердий с помощью электрофизиологических тестов, эта методика имеет ряд недостатков таких, как болезненность при проведении процедуры, необходимость тестирования от 2-3 до 5-10 противоаритмических средств, на что требуется от 1 –2 недель до 1-2 месяцев. Нами предложен неинвазивный оригинальный метод, позволяющий выявить нарушения предсердной проводимости путем оценки скорости и направления распространения возбуждения по предсердиям с расчетом (в %) количества сегментов сердечной мышцы предсердий с антеградным и ретроградным проведением возбуждения, определить адекватную противорецидивную терапию пароксизмов мерцания предсердий, а также проконтролировать ее эффективность (Олесин А.И. и соавт., 1996, Шабров А.В. и соавт., 1999). Метод заключается в том, что больному на синусовом ритме (после купирования аритмии), проводили эхокардиографическое с одновременным электрокардиографическим исследованием в «М» и «В» режимах по общепринятой методике (Feigenbaum H., 1994, 1996). Затем определяли значения показателя внутрипредсердной проводимости (в сек.) от начала электрического возбуждения предсердий (волны «Р») до начала механического сокращения левого или правого предсердий в «М» режиме, причем установку курсора в этих отделах предсердия проводили в «В» режиме перпендикулярно стенке правого и левого предсердий в 4 точках: одна в верхней, две в средней и последняя – в нижней трети (от верхушки до основания) с делением предсердий на сегменты по описанной ранее методике (Шабров А.В. и соавт., 1999). Все значения внутрипредсердной проводимости усредняли по частоте сердечных сокращений. Направление распространения возбуждения определяли от минимального к максимальному показателю внутрипредсердной проводимости в соседних точках: за антеградное проведение возбуждения принимали увеличение значений этого показателя от верхушки до основания, а за ретроградное - от основания до верхушки. Затем для каждого сегмента определяли возможность формирования кругов рециркуляции и их протяженность по формуле: = РП х Vмин., где - длина петли рециркуляции в м., Vмин. – минимальная скорость проведения возбуждения в м/сек, РП – длительность рефрактерного периода сердечной мышцы предсердий, в которой развивается рециркуляция, равная, в среднем, как 1/3 разницы проведения возбуждения между двумя соседними исследуемыми точками внутрипредсердной проводимости (в сек.) (Сперлаксис Н., 1990, Шабров А.В. и соавт., 1999, Олесин А.И. и соавт., 2000). Как показали многочисленные экспериментальные и клинические исследования, при снижении скорости распространения возбуждения до 0,4 м/с и менее оказывается достаточным для развитияаритмии с длиной петли re-entry 9 см и менее (Allessie M.A. et al., 1990, 1995). Затем определяли время проведения возбуждения и частоту рециркуляции по каждой возможной петле re-entry и сравнивали с частотой и продолжительностью волн f-f электрокардиограммы, регистрируемых преимущественно с помощью чреспищеводных отведений в течение 1 мин. и более. Нами наблюдалось 238 больных с впервые возникшими пароксизмами мерцания предсердий (в среднем, 41 приступа в месяц) в возрасте от 38 до 75 лет (в среднем, 53,63,2 года). У 87(36,55%) больных основным заболеванием была выявлена гипертоническая болезнь I-II стадии по критериям ВОЗ, у 95(39,92%) – ИБС: стенокардия II-III функционального класса, у 21(8,82%) - инфаркт миокарда в анамнезе. Диагноз ИБС основывался на критериях ВОЗ. У 145(60,92%) больных наблюдалось сочетание гипертонической болезни и ИБС. Хроническую сердечную недостаточность I-II функционального класса по классификации NYHA диагностировали у 109(45,80%) больных. Контрольную группу составили 58 пациентов с гипертонической болезнью и ИБС без нарушений сердечного ритма в возрасте от 40 до 55 лет (в среднем, 462 года). Купирование впервые возникших пароксизмов мерцания предсердий у всех больных проводилось с учетом неблагоприятных признаков развития возможных осложнений противоаритмической терапии, состояния гемодинамики в момент аритмии и длительности аритмии до начала лечения (Олесин А.И. и соавт., 1996, Шабров А.В. и соавт., 1998). У 42(17,65%) больных длительность аритмии до начала лечения составила до 1 суток, у 115(48,32%) - от 1 до 7 суток (в среднем, 2,80,9 суток). У 10(4,20%) больных пароксизмы мерцания предсердий были купированы анаприлином, у 18(7,56%) – пропафеноном, у 47(19,75%) - соталолом, у 16(6,72%) - внутривенным введением хлорида калия с новокаинамидом, у 18(7,56%) – хинидином, у 79(33,19%) - хинидином в сочетании с верапамилом, у 30(12,61%) – кордароном, у 11(4,62%) – кордароном в сочетании с дилтиаземом или аллапинином, у остальных - аритмия купировалась самостоятельно. У 58(24,37%) больных при назначении препаратов II и IV классов пароксизмы мерцания предсердий не наблюдались в течение 1 года и более (в среднем 2,10,1 года) после первых клинических рецидивов аритмии, в то время как у остальных обследуемых пациентов наиболее эффективными оказались антиаритмические препараты I и (или) III классов, и частота пароксизмов мерцания предсердий уменьшалась в 2-5 раз (в среднем, 3,20,1 раза). Все обследуемые больные, согласно классификации S. Levy (1995, 1998), были разделены на две группы. В I группу вошло 58(24,37%) больных, которым проводилась терапия ингибиторами АПФ в сочетании с препаратами II или IV классов (что соответствует IIв подгруппе, в которой пароксизмы мерцания предсердий рецидивируют менее 1 раза в 3 месяца при назначении -адреноблокаторов или блокаторов кальциевых каналов): 22(37,93%) из этих 58 пациентов получали метопролол, остальные - дилтиазем-ретард (алтиазем-РР), во II группу было включено 180(75,63%) больных, получавших наряду с ингибиторами АПФ противоаритмические препараты I и (или) III классов (что соответствует IIIв подгруппе, в которой пароксизмы мерцания предсердий рецидивируют менее 1 раза в 3 месяца при назначении блокаторов натриевых и (или) калиевых каналов): у 21(11,67%) из этих больных проводилась терапия хинидином, у 40(22,22%) – соталолом, у 27(5,56%) - этацизином, у 31(17,22%) - пропафеноном, у 51(28,33%) - кордароном. У 2(1,11%) и у 8(4,44%) больных II группы наиболее эффективной оказалась комбинированная антиаритмическая терапия: кордарон+аллапинин и кордарон+этацизин соответственно. Достоверного различия по полу, возрасту, сопутствующим заболеваниям, функции синусового узла у больных I и II группы как между собой, так и в сравнении с контрольной группой выявлено не было. У всех больных I группы после купирования первого пароксизма мерцания предсердий было выявлено от 2 до 5 возможных петель re-entry с частотой рециркуляции 240-750 в мин., а у 76(42,22%) и у 104(57,78%) больных II группы соответственно – от 4 до 7 и от 6 до 12 кругов re-entry с частотой рециркуляции 370-1500 в мин. У всех обследуемых больных количество петель re-entry высоко коррелировало с числом участков миокарда предсердий с ретроградным проведением возбуждения (r=0,91). У всех больных I группы частота волн f-f электрокардиограммы в момент приступа аритмии варьировала от 250 до 840 сокращений в мин., а у всех больных II группы – от 340 до 1700 сокращений в мин. Следует отметить, что у больных I и II группы наиболее продолжительный диапазон частот волн f-f составил 250-430 в мин. (в среднем, 33015 в мин.) и 410-1400 в мин. (в среднем 78045 в мин.) соответственно (p<0,001), которые регистрировались, в среднем, на протяжении 75,261,14% записи чреспищеводных отведений электрокардиограммы, причем, корреляция между частотой волн f-f и рециркуляцией по вероятным кругам re-entry у больных I и II группы, в среднем, составилаr=0,91 и r= 0,87 соответственно. У 43(74,14%) больных I группы наиболее эффективной оказалась терапия хлоридом калия с новокаинамидом, хинидином, пропафеноном, в то время как у 75(41,67%) больных II группы – монотерапия соталолом и кордароном, а у остальных – комбинированное лечение хинидином с верапамилом или кордароном в сочетании с дилтиаземом или аллапинином. Следует отметить, что у больных I и в большей степени - II группы увеличение количества кругов рециркуляции и участков с ретроградным проведением возбуждения коррелировали с такими независимыми предикторами трансформации в хроническую форму мерцания предсердий, как дилатация левого предсердия (r=0,89), большая продолжительность тахиаритмии (r=0,77), кальциноз митрального клапана (r=0,84), снижение фракции выброса левого желудочка (r=0,72), ухудшение спектра трансмитрального потока (r=0,92). У 18(31,03%) больных I и контрольной группы наблюдалось антеградное, а у остальных больных этой и у всех пациентов II группы - ретроградное проведение возбуждения по миокарду предсердий, причем, порог индуцирования аритмии и скорость распространения возбуждения в антеградном направлении были достоверно меньше в сравнении с контрольной группой (см. рис. 5.21.). С увеличением участков ретроградного проведения возбуждения уменьшался порог индуцирования аритмии (r = 0,92), уменьшалась скорость распространения возбуждения в антеградном направлении (r = 0,86), причем, эти изменения были более выражены у больных II группы (см. рис. 5.21.). 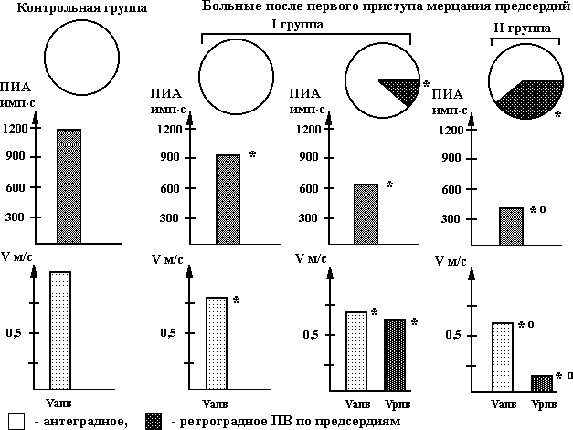 Рис. 5.21. Состояние проведения возбуждения, порога индуцирования аритмии (ПИА) у больных I и II группы после купирования первого пароксизма мерцания предсердий. Vапв - скорость проведения возбуждения в антеградном направлении, Vрпв - скорость проведения возбуждения в ретроградном направлении; ПВ - проведение возбуждения по предсердиям; * - достоверность раздичия показателей в сравнении с контрольной группой, о - I группой (при р < 0,01). 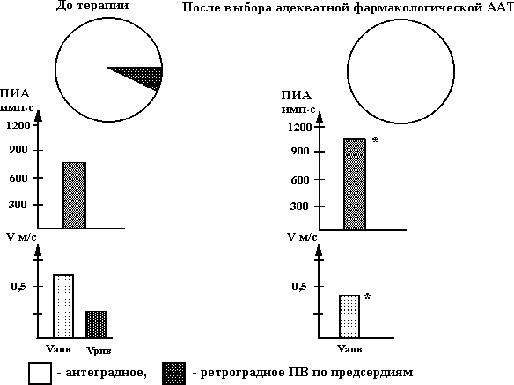 Рис. 5.22. Состояние проведения возбуждения, порога индуцирования аритмии (ПИА) у больных I группы при положительном эффекте противорецидивной антиаритмической терапии. Vапв - скорость проведения возбуждения в антеградном направлении, Vрпв - скорость проведения возбуждения в ретроградном направлении; ПВ - проведение возбуждения по предсердиям;* - достоверность раздичия показателей в сравнении с исходными данными (при Р < 0,01). У больных I группы при положительном эффекте противорецидивной антиаритмической терапии отмечается переход из ретроградного проведения возбуждения в антеградный или сохранение антеградного распространения возбуждения, увеличение порога индуцирования аритмии и снижение скорости проведения возбуждения в антеградном направлении (см. рис. 5.22.). У пациентов II группы, несмотря на выбор адекватной антаритмической терапии и увеличение порога индуцирования аритмии, наблюдалось уменьшение количества участков с ретроградным проведением возбуждения, причем, положительный клинический эффект был, по-видимому, связан с уменьшением скорости распространения возбуждения в антеградном и увеличением - в ретроградном направлении (см. рис. 5.23.). Следует отметить, что после отмены противоаритмической терапии у больных II группы пароксизмы мерцания предсердий практически сразу рецидивировали. В большинстве случаев развитие мерцания предсердий обусловлено механизмом re-entry, причем, устойчивое мерцание предсердий наблюдается при формировании 3 и больше кругов рециркуляции (Allessie M.A., 1990, 1995). Нами были получены аналогичные данные. В настоящее время известно, что, несмотря на то, что пароксизмы мерцания и трепетания предсердий редко непосредственно угрожают жизни, их симптомы значительно беспокоят пациентов и изменяют их образ жизни, который значительно улучшается при восстановлении и сохранении синусового ритма. Положительный опыт использования у человека имплантируемого предсердного дефибриллятора для лечения приступов мерцания предсердий открывают новые перспективы для ничтожно малой части больных с тяжелым побочным действием или резистентностью к противоаритмической терапии. Поэтому подавляющему большинству пациентов для предупреждения часто рецидивирующих пароксизмов мерцания предсердий по-прежнему придется назначать антиаритмическую терапию, что, по меньшей мере, улучшит качество их жизни. 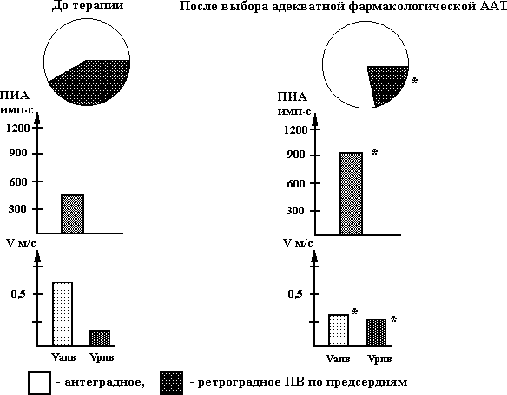 Рис. 5.22. Состояние проведения возбуждения, порога индуцирования аритмии (ПИА) у больных II группы при положительном эффекте противорецидивной антиаритмической терапии. Vапв - скорость проведения возбуждения в антеградном направлении, Vрпв - скорость проведения возбуждения в ретроградном направлении; ПВ - проведение возбуждения по предсердиям;* - достоверность раздичия показателей в сравнении с исходными данными (при Р < 0,01). Полученные нами данные показали, что реальный положительный клинический эффект противорецидивный антиаритмической терапии после первого пароксизма мерцания предсердий наблюдался только у больных I группы, который был, по-видимому, обусловлен нормализацией распространения возбуждения по предсердиям или уменьшением до 9% количества участков с ретроградным проведеним возбуждения. У больных II группы, несмотря на проводимую адекватную антиаритмическую терапию, сохраняется аритмогенный субстрат в виде участков с ретроградным проведением возбуждения, причем, у этих пациентов положительный противорецидивный эффект был связан, по нашим данным, с уменьшением скорости проведения в антеградном направлении и увеличением – в ретроградном, что создает минимальные условия для формирования петель re-entry, причем, при отмене антиаритмических препаратов – пароксизмы мерцания предсердий у них практически сразу рецидивируют. Следует отметить, что соотношение между участками сердечной мышцы предсердий с быстрым и медленным проведением возбуждения меняется, причем, замедление проведения отмечается, по нашим данным, в большей мере в ретроградном направлении, создавая условия для формирования петли re-entry (Allessie M.A., 1990, 1995). Поэтому у таких пациентов, по-видимому, имеется исходная готовность к развитию аритмии, причем, вероятность ее появления повышается при увеличении разницы между скоростью проведения возбуждения по миокарду предсердий в антеградном и ретроградном направлениях. Следует подчеркнуть, что, согласно полученным нами результатам, при увеличении соотношения скорости антеградного и ретроградного распространения возбуждения более чем в 3 раза, количество клинических рецидивов пароксизмов мерцания предсердий увеличивается прямо пропорционально с повышением значений этого показателя. Кроме того, уменьшение соотношения этих скоростей или нормализация распространения возбуждения по предсердиям, возможно, может служить одним из критериев, свидетельствующих о положительном противорецидивном эффекте антиаритмического лечения этой аритмии. Анализ результатов медикаментозной антиаритмической терапии больных ИБС с пароксизмами мерцания предсердий, по данным разных авторов, показал, что их выживаемость в большей степени зависит от того, какими препаратами проводится вторичная профилактика самой аритмии, так и коррекция дисфункции левого желудочка. Доводом для раннего начала противорецидивной фармакологической терапии может служить тот факт, что пароксизмы этой аритмии могут поддерживаться не только из-за прогрессирующей дилатации, но и вследствие уменьшения рефрактерности сердечной мышцы предсердий. Результаты нашего исследования показали, что у 73,25% больных с частыми приступами пароксизмов мерцания предсердий (с межприступным периодом рецидивов аритмии менее 6 месяцев) уже после первого приступа аритмии наблюдалось ретроградное проведение возбуждения по предсердиям, систолическая или диастолическая дисфункция, кальциноз митрального и (или) аортального клапанов и т.д. Поэтому противорецидивную антиаритмическую терапию пароксизмов мерцания предсердий у больных ИБС с дилатацией и дисфункцией левого желудочка целесообразно начинать сразу после первого приступа аритмии. Другим важным важным доводом раннего начала противорецидивного лечения аритмии у этих пациентов может служить сохранность, по нашим данным, у них систолической функции левого желудочка и наличие легкой степени сердечной недостаточности, что снижает риск аритмогенного действия противоаритмических средств. Развитие диастолической дисфункции левого желудочка и дилатация левого предсердия у этих больных, по-видимому, обусловлены прогрессированием артериальной гипертензии и (или) усугублением ишемии, в том числе бессимптомной, миокарда. Поэтому больным ИБС для предупреждения рецидивов пароксизмов мерцания предсердий, после купирования первого приступа аритмии, при выявлении только нарушений ПВ по предсердиям показано применение вначале адекватной гипотензивной и антиангинальной терапии, а при наличии нарушений предсердной проводимости и структурных нарушений миокарда, таких, как дилатации и диастолической дисфункции левого желудочка, дилатации левого предсердия, кальциноз аорты, митрального клапана, нарушения функции синусового узла, а также длительной тахиаритмии, по нашим данным, более 7 суток и т.д. - в сочетании с антиаритмической терапией. Принципы назначения противорецидивной антиаритмической терапии после купирования первого пароксизма мерцания предсердий представлены на рис. 5.24., 5.25. Рис. 5.24. Противорецидивная терапия после купирования первого пароксизма мерцания предсердий у больных ИБС* |
