Патфиз ч.3. Патфиз ч. Частнаяпатология
 Скачать 13.12 Mb. Скачать 13.12 Mb.
|
|
§ Перенапряжение (и срыв) ВНД — невроз. Он является инициальным звеном патогенеза гипотензии. § Невроз характеризуется формированием корковоподкоркового комплекса возбуждения. Оно распространяется на парасимпатические ядра переднего гипоталамуса и другие структуры парасимпатической нервной системы (например, на дорсальное двигательное ядро блуждающего нерва). § Активация парасимпатических влияний на ССС обусловливает снижение сократительной функции миокарда, сердечного выброса крови и тонуса резистивных сосудов. Развивается артериальная гипотензия. Аргументом приведенным выше представлениям является большой «удельный вес» людей со слабым типом ВНД (с высокой частотой развития у них невротических состояний) среди больных артериальной гипотензией. Считают, что именно такой механизм лежит в основе развития гипотонической болезни. При хроническом её течении включаются и другие патогенетические звенья, что способствует стабилизации АД на пониженном уровне или даже усугубляет степень его снижения. † Артериальные гипотензии вследствие органических изменений в структурах мозга. Возникают при повреждении центральных (диэнцефальногипоталамических) и периферических структур, участвующих в регуляции АД. ‡ Наиболее частые причины: травмы головного мозга (при его сотрясении или ушибах), нарушения мозгового кровообращения (ишемия, венозная гиперемия), дегенеративные изменения в веществе головного мозга (дегенерация нейронов экстрапирамидной системы, базальных ядер мозга, заднего ядра блуждающего нерва), нарушение выделения в кровь катехоламинов при физической нагрузке, изменении положения тела из горизонтального в вертикальное (в этом случае нередко развиваются ортостатические коллапсы и обмороки), синдром ШаяДрейджера. ‡ Патогенез. § Снижение активности симпатикоадреналовой системы и выраженности её эффектов на ССС. § Относительное или абсолютное преобладание эффектов парасимпатической нервной системы на сердце и сосуды. § Снижение тонуса стенок артериол, ОПСС, сердечного выброса крови. • Рефлекторные (рефлексогенные, проводниковые) центрогенные артериальные гипотензии. † Причина: нарушение проведения эфферентных гипертензивных импульсов от сосудодвигательного центра продолговатого мозга к стенкам сосудов и сердцу. Наиболее часто это развивается при нейросифилисе, боковом амиотрофическом склерозе, сирингомиелии, периферических невропатиях различного генеза (например, диабетического, инфекционного, нейротоксического). † Механизм развития. Заключается в значительном уменьшении или прекращении тонических влияний симпатической нервной системы на стенки сосудов и сердца. Это приводит к снижению ОПСС и, соответственно — диастолического АД, а также к уменьшению сократительной функции сердца, величины сердечного выброса и систолического АД. В результате развивается артериальная гипотензия. ЭНДОКРИННЫЕ АРТЕРИАЛЬНЫЕ ГИПОТЕНЗИИ Общие звенья патогенеза артериальных гипотензий эндокринного генеза представлены на рис. 22–44. 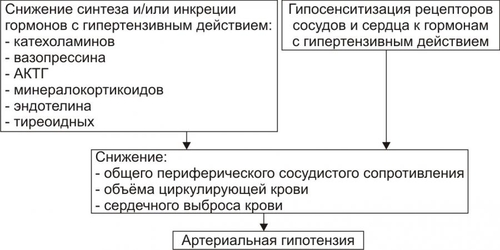 Рис. 22–44. Общие звенья патогенеза «эндокринных» артериальных гипотензий. Различают артериальные гипотензии надпочечникового, гипофизарного, гипотиреоидного генеза. • Артериальные гипотензии надпочечникового происхождения. † Причины: гипотрофия коры надпочечников, опухоль коры надпочечников с разрушением паренхимы, кровоизлияние в надпочечник (один или оба), туберкулёзное поражение надпочечников, деструкция надпочечников в результате реакций иммунной аутоагрессии и травмы, приводящие к повреждению или разрушению надпочечников. † Патогенез. Дефицит катехоламинов, минерало и глюкокортикоидов и/или недостаточность их эффектов обусловливает снижение тонуса стенок артериол и ОПСС, ОЦК и сердечного выброса. • Артериальные гипотензии при поражении гипофиза. † Причина: гипофункция гипофиза. † Патогенез. Развитие артериальной гипотензии при питуитарной недостаточности является результатом недостаточного эффекта вазопрессина, АКТГ, ТТГ, СТГ. В конечном итоге гипофизарная недостаточность приводит к снижению тонуса артериол и ОПСС, ОЦК, сердечного выброса. В совокупности эти изменения обусловливает стойкое снижение и систолического и диастолического АД. • Артериальная гипотензия при гипотиреоидных состояниях. † Причина: Дефицит T3 и T4 и/или их эффектов. † Механизмы развития. ‡ Брадикардия. Развивается вследствие снижения или отсутствия положительного хронотропного эффекта тиреоидных гормонов в связи с их дефицитом, снижения активности симпатикоадреналовой системы. ‡ Снижение величины сердечного выброса. ‡ Снижение тонуса стенок сосудов вследствие их дистрофических изменений и, как результат — уменьшение ОПСС. МЕТАБОЛИЧЕСКИЕ АРТЕРИАЛЬНЫЕ ГИПОТЕНЗИИ Артериальные гипотензии, вызванные нарушением метаболизма веществ с гипо и гипертензивным действием встречаются редко. • Возможные причины. † Дистрофические изменения в органах и тканях (например, при хронических интоксикациях, инфекциях, голодании). Это обусловливает снижение выработки и/или эффектов метаболитов с гипертензивным действием (например, эндотелина, ПгF, тромбоксана А2, ангиотензиногена и др.), падение тонуса миоцитов стенок артериол, снижение сократительной функции миокарда. † Гипогидратация организма. Вызвана уменьшением объёма жидкости в организме в связи со снижением интенсивности метаболизма. Последний, как известно, сопровождается образованием воды. • Патогенез. Основными звеньями патогенеза являются снижение тонуса ГМК стенок сосудов и вследствие этого — ОПСС, падение сократительной функции сердца, ведущее к уменьшению сердечного выброса крови, уменьшение содержания воды в организме, в том числе — объёма циркулирующей жидкости. В совокупности указанные факторы обусловливают стойкое снижение АД ниже нормы — артериальную гипотензию. НАРУШЕНИЯ РЕГИОНАРНОГО КРОВОТОКА Многочисленные расстройства регионарного (периферического, местного, органнотканевого) кровотока подразделяют на нарушения кровотока в сосудах среднего диаметра и расстройства крово и лимфотока в сосудах микроциркуляторного русла (рис. 22–45). 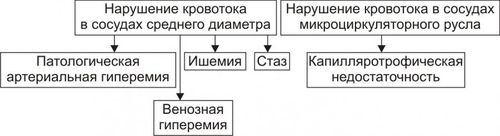 Рис. 22–45. Типовые формы патологии регионарного кровообращения. НАРУШЕНИЯ КРОВОТОКА В СОСУДАХ СРЕДНЕГО ДИАМЕТРА К нарушениям кровообращения в сосудах среднего диаметра относятся патологическая артериальная гиперемия, венозная гиперемия, ишемия и стаз. АРТЕРИАЛЬНАЯ ГИПЕРЕМИЯ Артериальная гиперемия — увеличение кровенаполнения и количества протекающей по сосудам органов и тканей крови в результате расширения артериол и артерий. ПРИЧИНЫ Причины артериальных гиперемий могут иметь различное происхождение и природу. • По происхождению выделяют артериальные гиперемии, причинами которых являются эндогенные или экзогенные факторы. † Экзогенные. Агенты, вызывающие артериальную гиперемию, действуют на орган или ткань извне. К ним относятся инфекционные (микроорганизмы и/или их эндо и экзотоксины) и неинфекционные факторы различной природы. † Эндогенные. Факторы, приводящие к артериальной гиперемии, образуются в организме (например, отложение солей и конкрементов в тканях почек, печени, подкожной клетчатке; образование избытка БАВ, вызывающих снижение тонуса ГМК артериол [вазодилатацию] — аденозина, Пг, кининов; накопление органических кислот — молочной, пировиноградной, кетоглутаровой). • По природе причинного фактора выделяют артериальные гиперемии физического, химического и биологического генеза. † Физические (например, механическое воздействие, очень высокая температура, электрический ток). † Химические (например, органические и неорганические кислоты, щёлочи, спирты, альдегиды). † Биологические (например, физиологически активные вещества, образующиеся в организме: аденозин, ацетилхолин, простациклин, оксид азота). МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ Расширение просвета малых артерий и артериол достигается за счёт реализации нейрогенного, гуморального и нейромиопаралитического механизмов или их сочетания. • Нейрогенный механизм. Различают нейротоническую и нейропаралитическую разновидности нейрогенного механизма развития артериальной гиперемии. † Нейротонический механизм. Заключается в преобладании эффектов парасимпатических нервных влияний (по сравнению с симпатическими) на стенки артериальных сосудов. † Нейропаралитический механизм. Характеризуется снижением или отсутствием («параличом») симпатических нервных влияний на стенки артерий и артериол. • Гуморальный механизм. Заключается в местном увеличении содержания вазодилататоров — БАВ с сосудорасширяющим эффектом (аденозина, оксида азота, ПгE, ПгI2, кининов) и в повышении чувствительности рецепторов стенок артериальных сосудов к вазодилататорам. • Нейромиопаралитический механизм. † Характеристика. ‡ Истощение запасов катехоламинов в синаптических везикулах варикозных терминалей симпатических нервных волокон в стенке артериол. ‡ Снижение тонуса ГМК артериальных сосудов. † Причины. ‡ Продолжительное действие на ткани или органы различных факторов физической или химической природы (например, тепла при применении грелок, согревающих компрессов, горчичников, лечебной грязи; диатермических токов). ‡ Прекращение длительного давления на стенки артерий (например, асцитической жидкости, тугого бинта, давящей одежды). Действие указанных факторов в течение длительного времени существенно снижает или полностью снимает миогенный и регуляторный (главным образом, адренергический) тонус стенок артериальных сосудов. В связи с этим они расширяются, в них увеличивается количество протекающей артериальной крови. ВИДЫ АРТЕРИАЛЬНЫХ ГИПЕРЕМИЙ Существует физиологическая и патологическая артериальная гиперемия. Их различает два критерия — адекватность и адаптивность. • Адекватность — соответствие артериальной гиперемии изменению функции и метаболизма в органах и тканях. • Адаптивность — наличие (или отсутствие) приспособительного биологического значения артериальной гиперемии в каждом конкретном случае. Физиологическая артериальная гиперемия Физиологическая артериальная гиперемия адекватна воздействию и имеет адаптивное значение. Может быть функциональной и защитноприспособительной. • Функциональная. Развивается в органах и тканях в связи с увеличением уровня их функционирования (например, гиперемия в сокращающейся мышце или в усиленно работающем органе). • Защитноприспособительная. Развивается при реализации защитных реакций и процессов (например, — в очаге воспаления либо вокруг чужеродного трансплантата, зоны некроза или кровоизлияния). В этих случаях артериальная гиперемия способствует доставке в ткани кислорода, субстратов метаболизма, Ig, фагоцитов, лимфоцитов, других клеток и агентов, необходимых для реализации местных защитных и восстановительных реакций. Патологическая артериальная гиперемия Патологическая артериальная гиперемия не адекватна воздействию, не связана с изменением функции органа или ткани и играет дизадаптивную — повреждающую роль. Патологическая гиперемия сопровождается нарушениями кровоснабжения, микрогемоциркуляции, транскапиллярного обмена, иногда — кровоизлияниями и кровотечениями. Примеры. • Патологическая артериальная гиперемия головного мозга при гипертензивном кризе. • Патологическая артериальная гиперемия различных органов и тканей, развивающаяся по нейромиопаралитическому механизму (например, в органах брюшной полости после асцита; в коже и мышцах конечности после снятия длительно наложенного жгута; в зоне хронического воспаления; в месте длительного (часы) воздействия тепла — солнечного, при использовании грелки, горчичников; в регионе с симпатической денервацией). ПРОЯВЛЕНИЯ АРТЕРИАЛЬНЫХ ГИПЕРЕМИЙ Проявления артериальных гиперемий приведены на рис. 22–46. 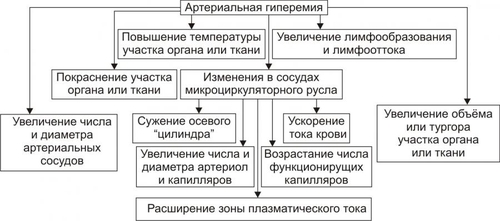 Рис. 22–46. Основные проявления артериальной гиперемии. • Увеличение числа и диаметра артериальных сосудов в зоне артериальной гиперемии. • Покраснение органа, ткани или их участка вследствие повышения притока артериальной крови, расширения просвета артериол и прекапилляров, увеличения числа функционирующих капилляров, «артериализации» венозной крови (т.е. повышения содержания HbO2 в венозной крови). • Повышение температуры тканей и органов в регионе гиперемии в результате притока более тёплой артериальной крови и повышения интенсивности обмена веществ. • Увеличение лимфообразования и лимфооттока вследствие повышения перфузионного давления крови в сосудах микроциркуляторного русла. • Увеличение объёма и тургора органа или ткани в результате возрастания их крове и лимфонаполнения. • Изменения в сосудах микроциркуляторного русла. † Увеличение диаметра артериол и прекапилляров. † Возрастание числа функционирующих капилляров (т.е. капилляров, по которым протекает плазма и форменные элементы крови). † Ускорение тока крови по микрососудам. † Уменьшение диаметра осевого «цилиндра» (потока клеток крови по центральной оси артериолы) и увеличение ширины потока плазмы крови с малым содержанием в ней форменных элементов вокруг этого «цилиндра». Причина: увеличение центростремительных сил и отбрасывание клеток крови к центру просвета сосудов в связи с ускорением тока крови в условиях артериальной гипертензии. ПОСЛЕДСТВИЯ АРТЕРИАЛЬНЫХ ГИПЕРЕМИЙ Последствия артериальной гиперемии приведены на рис. 22–47. 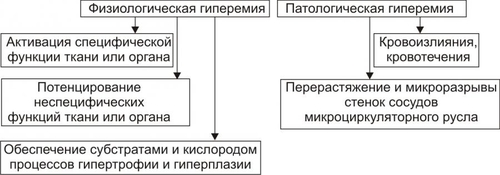 Рис. 22–47. Последствия артериальной гиперемии. • При физиологических разновидностях артериальной гиперемии отмечается активация специфической функции (функций) органа или ткани и потенцирование неспецифических их функций и процессов. Примеры: активация местного иммунитета (в связи с повышением притока с артериальной кровью Ig, лимфоцитов, фагоцитирующих клеток и других агентов), ускорение пластических процессов, увеличение лимфообразования и лимфооттока от тканей. † Обеспечение гипертрофии и гиперплазии структурных элементов тканей продуктами обмена веществ и кислородом. Достижение именно этих эффектов артериальных гипертензий становится целью при проведении лечебных мероприятий (например, при применении компрессов, горчичников, физиотерапевтических процедур; инъекциях сосудорасширяющих ЛС; при хирургических вмешательствах по пересечению симпатических нервных стволов или иссечению симпатических ганглиев при некоторых формах стенокардии и др.), направленных на индуцирование гиперемии. Это применяется при повреждении органов и тканей, их ишемии, нарушении трофики и пластических процессов в них, снижении активности «местного иммунитета». • При патологических вариантах артериальной гиперемии, как правило, наблюдаются перерастяжение и микроразрывы стенок сосудов микроциркуляторного русла, микро и макрокровоизлияния в ткани, кровотечения (наружные и/или внутренние). Устранение или предупреждение этих негативных последствий является целью терапии патологических разновидностей артериальной гиперемии. ВЕНОЗНАЯ ГИПЕРЕМИЯ Венозная гиперемия — увеличение кровенаполнения, но при уменьшении количества протекающей по сосудам ткани или органа крови. В отличие от артериальной гиперемии развивается в результате замедления или прекращения оттока венозной крови по сосудам. ПРИЧИНЫ Основной причиной венозной гиперемии является механическое препятствие оттоку венозной крови от тканей или органа. Это может быть результатом сужения просвета венулы или вены при её компрессии (опухолью, отёчной тканью, рубцом, жгутом, тугой повязкой) и обтурации (тромбом, эмболом, опухолью), сердечной недостаточности, низкой эластичности венозных стенок, сочетающейся с образованием в них расширений (варикозов) и сужений. ПРОЯВЛЕНИЯ Проявления венозной гиперемии приведены на рис. 22–48. 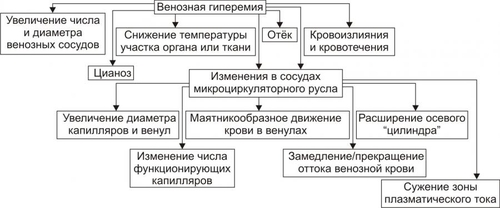 Рис. 22–48. Проявления венозной гиперемии. • Увеличение числа и диаметра просвета венозных сосудов в регионе гиперемии. • Цианоз ткани или органа вследствие увеличение в них количества венозной крови и понижения содержания в венозной крови HbO2. Последнее является результатом утилизации кислорода тканью из крови в связи с медленным её током по капиллярам. • Снижение температуры тканей или органов в зоне венозного застоя в результате увеличения объёма в них более холодной (в сравнении с артериальной) венозной крови и уменьшения интенсивности тканевого метаболизма (является результатом снижения притока артериальной крови к тканям в регионе венозной гиперемии). • Отёк ткани или органа происходит вследствие увеличения внутрисосудистого давления в капиллярах, посткапиллярах и венулах. При длительной венозной гиперемии отёк потенцируется за счёт включения его осмотического, онкотического и мембраногенного патогенетических факторов (см. «Отёк» в главе 11 «Нарушения баланса воды»). • Кровоизлияния в ткани и кровотечения (внутренние и наружные) в результате перерастяжения и микроразрывов стенок венозных сосудов (посткапилляров и венул). • Изменения в сосудах микроциркуляторного русла. † Увеличение диаметра капилляров, посткапилляров и венул в результате растяжения стенок микрососудов избытком венозной крови. † Возрастание числа функционирующих капилляров на начальном этапе венозной гиперемии (в результате оттока венозной крови по ранее нефункционирующим капиллярным сетям) и снижение — на более поздних (в связи с прекращением тока крови в результате образования микротромбов и агрегатов клеток крови в посткапиллярах и венулах). † Замедление (вплоть до прекращения) оттока венозной крови. † Значительное расширение диаметра осевого «цилиндра» и исчезновение полосы плазматического тока в венулах и венах. † «Маятникообразное» движение крови в венулах и венах — «тудаобратно»: ‡ «Туда» — от капилляров в венулы и вены. Причина: проведение систолической волны сердечного выброса крови. ‡ «Обратно» — от вен к венулам и капиллярам. Причина: «отражение» потока венозной крови от механического препятствия (тромба, эмбола, суженного участка венулы). ПАТОГЕННЫЕ ЭФФЕКТЫ ВЕНОЗНОЙ ГИПЕРЕМИИ Венозная гиперемия оказывает повреждающее действие на ткани и органы за счёт ряда патогенных факторов. • Основные патогенные факторы: гипоксия (циркуляторного типа в начале процесса, а при длительном течении — смешанного типа), отёк ткани (в связи с увеличением гемодинамического давления на стенку венул и вен), кровоизлияния в ткани (в результате перерастяжения и разрывов стенок посткапилляров и венул) и кровотечения (внутренние и наружные). • Последствия: снижение специфической и неспецифических функций органов и тканей, гипотрофия и гипоплазия структурных элементов тканей и органов, некроз паренхиматозных клеток и развитие соединительной ткани (склероз, цирроз) в органах. ИШЕМИЯ Ишемия — несоответствие между притоком к тканям и органам артериальной крови и потребностью в ней. При этом потребность в кровоснабжении всегда выше реального притока крови по артериям. ПРИЧИНЫ Причины ишемии могут иметь различное происхождение и природу. • По природе причины ишемии делят на физические, химические и биологические. † Физические факторы: сдавление артериальных сосудов (например, опухолью, рубцовой тканью, инородным телом, жгутом), сужение или закрытие просвета изнутри (например, тромбом, эмболом, атеросклеротической бляшкой), действие чрезмерно низкой температуры. † Химические факторы. Многие химические соединения обладают способностью вызывать сокращение ГМК артериальных сосудов и сужение их просвета. Примеры: никотин, ряд ЛС: мезатон, эфедрин, препараты адреналина, АДГ, ангиотензины. † Биологические факторы: БАВ с сосудосуживающими эффектами (например, катехоламины, ангиотензин II, АДГ, эндотелин), БАВ микробного происхождения: их экзо и эндотоксины, метаболиты с вазоконстрикторным действием. • По происхождению выделяют ишемии, причина которых имеет эндогенное или экзогенное происхождение (инфекционное и неинфекционное). МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ ИШЕМИИ Механизмы возникновения ишемии представлены на рис. 22–49. 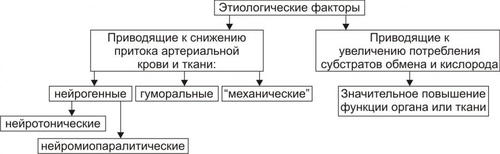 Рис. 22–49. Механизмы возникновения ишемии. Механизмы, обусловливающие преимущественное снижение притока артериальной крови к тканям и органам: нейрогенный, гуморальный и «механический». • Нейрогенный механизм (нейротонический и нейропаралитический). † Нейротонический. Характеризуется преобладанием эффектов симпатической нервной системы на стенки артериол в сравнении с парасимпатической. Это сопровождается повышенным выбросом норадреналина их адренергических терминалей. Причины: активация симпатических влияний на ткани и органы (например, при различных вариантах стресса, действии на ткани низкой температуры, механической травмы, химических веществ) и повышение адренореактивных свойств стенок артериол (например, при сенсибилизации их к вазоконстрикторным агентам: в условиях повышенного уровня Ca2+ или цАМФ в миоцитах). † Нейропаралитический. Характеризуется устранением или снижением («параличом») парасимпатических влияний на стенки артериол. Причины. Торможение или блокада проведения нервных импульсов по парасимпатическим волокнам к артериолам (и в связи с этим — высвобождения ацетилхолина из терминальных нервных волокон в стенках артерий, артериол и прекапилляров). Такая ситуация может наблюдаться при невритах, механических травмах, развитии опухолей, хирургическом удалении ганглиев или пересечении парасимпатических нервов. • Гуморальный механизм. Заключается в увеличении содержания в тканях веществ с вазоконстрикторным действием (например, ангиотензина II, АДГ, тромбоксана А2, адреналина, ПгF) и чувствительности рецепторов стенок артериол к агентам с сосудосуживающим действием (например, при увеличении в тканях [Ca2+] или [Na+]). • Этиологический фактор механического характера. Характеризуется наличием механического препятствия движению крови по артериальным сосудам. • Причины: сдавление (компрессия) артериального сосуда опухолью, рубцом, отёчной тканью, жгутом и уменьшение (вплоть до полного закрытия — обтурации) просвета артериолы (например, тромбом, агрегатом клеток крови, эмболом). • Эмбол и эмболия. † Эмбол — образование, циркулирующее в полостях сердца, кровеносных или лимфатических сосудах и в норме в них не встречающееся. По происхождению различают эндогенные и экзогенные эмболы, а по локализации в сосудах — артериальные и венозные. ‡ Экзогенные. Чаще всего — пузырьки воздуха (попадающие в крупные вены при их ранении) и инородные тела (например, осколки пули или ЛС на масляной основе при их введении в холодном состоянии). ‡ Эндогенные. § Фрагменты тромбов (тромбоэмболы). § Кусочки жировой ткани или кости, образующиеся при размозжении органов или переломах трубчатых костей. § Небольшие фрагменты распадающейся опухолевой или разрушенной нормальной ткани. § Конгломераты микробных клеток, много и одноклеточные паразиты. § Пузырьки газов, в норме растворённых в плазме крови, но образующиеся при быстром переходе от более высокого барометрического давления к более низкому — при разгерметизации самолетов или космических аппаратов, а также при быстром подъёме с больших глубин. ‡ Артериальные эмболы. Закупоривают артериальные сосуды большого круга кровообращения (попадают из лёгочных вен или левых камер сердца), малого круга (заносятся из правых камер сердца или вен большого круга кровообращения). ‡ Венозные. Часто эмболы обнаруживают в мелких венозных сосудах воротной вены. † Эмболия — циркуляция в кровеносном или лимфатическом русле образования, в норме в нём не встречающегося и закрытие либо сужение им кровеносного или лимфатического сосуда. Механизмы возникновения ишемии, обусловливающие преимущественно значительное увеличение потребления тканями кислорода и/или субстратов обмена веществ. При этом потребность в кислороде и субстратах метаболизма превышает уровень их реальной доставки к тканям. • Наиболее частая причина: Значительное повышение функции органа или ткани и возрастание в связи с этим — интенсивности метаболизма в них. • Примеры. † Ишемия мышц (включая и миокард) при интенсивной и длительной физической нагрузке. † Ишемия миокарда при остром значительном повышении уровня АД (например, в условиях гипертензивного криза) и эмоциональном стрессе. В последнем случае работа сердца значительно возрастает под влиянием избытка катехоламинов, оказывающих положительный хроно- и инотропный эффекты. В этих условиях увеличивается и приток крови к миокарду по коронарным артериям. Однако работа миокарда (и в соответствии с этим потребность в кровоснабжении) возрастает в большей мере. Развивается ишемия миокарда, проявляющаяся приступом стенокардии, а нередко гибелью ишемизированного участка сердца (инфаркт миокарда). Одновременно, как правило, выявляются и признаки сужения артериальных сосудов сердца в связи с развитием атеросклеротических изменений в них. ПРОЯВЛЕНИЯ ИШЕМИИ Проявления ишемии представлены на рис. 22–50. 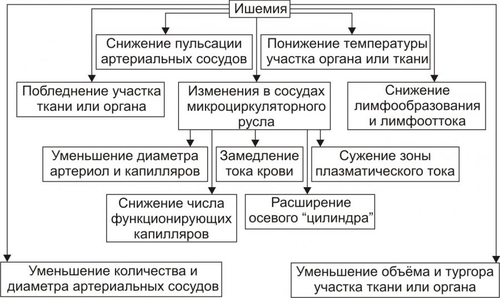 Рис. 22–50. Проявления ишемии. Последствия ишемии Основные последствия ишемии, развивающиеся вследствие гипоксии и многочисленных БАВ, представлены на рис. 22–51. 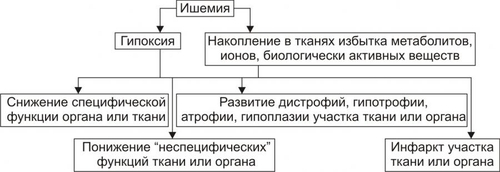 Рис. 22–51. Основные последствия ишемии. • Характер, выраженность и масштаб последствий ишемии зависит от многих факторов. Наиболее значимыми являются: † Скорость развития ишемии (чем она выше, тем более значительна степень повреждения тканей). † Диаметр поражённой артерии или артериолы (чем он больше, тем тяжелее поражение). † «Чувствительность» ткани или органа к ишемии (она особенно высока у ткани мозга, сердца, почек). † Значение ишемизированного органа или ткани для организма (ишемия таких органов как мозг, сердце, почки может привести к гибели организма. В отличие от этого, ишемия участка кожи или какойлибо скелетной мышцы совместима с жизнью). † Степень развития коллатеральных сосудов и скорость включения или активации коллатерального кровотока в ткани или органе. • Коллатеральный кровоток — система кровообращения в сосудах вокруг ишемизированного участка ткани и в нём самом. † Включению (или возрастанию) коллатерального кровообращения способствуют наличие градиента давления крови выше и ниже суженного участка сосуда, накопление в зоне ишемии БАВ с сосудорасширяющим действием (аденозина, ацетилхолина, Пг, кининов и др.), активация местных парасимпатических влияний (способствующих расширению коллатеральных артериол) и высокая степень развития сосудистой сети (коллатералей) в поражённом органе или ткани. † Группы органов и тканей в зависимости от степени развития артериальных сосудов и анастомозов между ними. ‡ С абсолютно достаточной коллатеральной сетью: скелетная мускулатура, брыжейка кишечника, лёгкие. В указанных образованиях совокупный просвет коллатеральных сосудов равен или превышает диаметр магистральной артерии. В связи с этим прекращение кровотока по ней не вызывает выраженной ишемии тканей в регионе кровоснабжения данной артерии. ‡ С абсолютно недостаточными коллатералями: миокард, почки, головной мозг, селезёнка. В этих органах суммарный просвет коллатеральных артерий значительно меньше диаметра магистральной артериальной ветви. В связи с этим окклюзия её приводит к выраженной ишемии или инфаркту ткани. ‡ С относительно достаточными (недостаточными) коллатералями: стенки кишечника, желудка, мочевого пузыря, кожа, надпочечники. В них совокупный просвет коллатеральных сосудов в более или менее выраженной степени меньше диаметра магистральной артерии. Окклюзия крупного артериального ствола в этих органах сопровождается большей или меньшей степенью их ишемии. СТАЗ Стаз — значительное замедление или прекращение тока крови и/или лимфы в сосудах органа или ткани. ПРИЧИНЫ • Ишемия и венозная гиперемия. Они приводят к стазу вследствие существенного замедления кровотока (при ишемии в связи со снижением притока артериальной крови, при венозной гиперемии в результате замедления или прекращения её оттока) и создания условий для образования и/или активации веществ, обусловливающих склеивание форменных элементов крови, формирования из них агрегатов и тромбов. • Проагреганты — факторы, вызывающие агрегацию и агглютинацию форменных элементов крови. ПАТОГЕНЕЗ Патогенез стаза представлен на рис. 22–52. 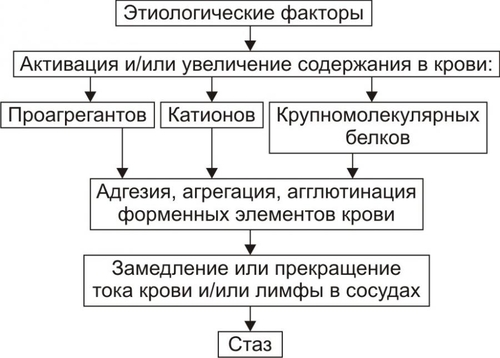 Рис. 22–52. Основные звенья патогенеза стаза. На финальном этапе стаза всегда происходит процесс агрегации и/или агглютинации форменных элементов крови, что приводит к сгущению крови и снижению её текучести. Этот процесс активируют проагреганты, катионы и высокомолекулярные белки. • Проагреганты (тромбоксан А2, аденозиндифосфат, ПгF, ПгE, катехоламины, АТ к форменным элементам крови) вызывают адгезию, агрегацию, агглютинацию форменных элементов крови с последующим их лизисом и высвобождением из них БАВ (в том числе — проагрегантов, потенцирующих реакции агрегации и агглютинации). • Катионы. K+, Ca2+, Na+, Mg2+ и высвобождаются из клеток крови, повреждённых стенок сосудов и тканей. Адсорбируясь на цитолемме форменных элементов крови, избыток катионов нейтрализует их отрицательный поверхностный заряд или даже меняет его на обратный. И если неповреждённые клетки (благодаря отрицательному заряду) «отталкиваются» друг от друга, то повреждённые клетки («нейтрализованные») образуют агрегаты. Ещё более активно агрегируют «перезаряженные» клетки крови. Имея положительный поверхностный заряд, они сближаются с «нейтрализованными» клетками и особенно с повреждёнными (имеющими отрицательный заряд), формируя агрегаты, адгезирующие на интиме сосудов. • Высокомолекулярные белки (например, ВИДЫ СТАЗА Все разновидности стаза подразделяют на первичные и вторичные. • Первичный (истинный) стаз. Формирование стаза первично начинается с активации форменных элементов крови и выделения ими большого количества проагрегантов и/или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к стенке микрососуда. Это и вызывает замедление или остановку кровотока в сосудах. • Вторичный стаз (ишемический и застойный). † Ишемический стаз развивается как исход тяжёлой ишемии в связи со снижением притока артериальной крови, замедлением скорости её тока, турбулентным его характером. Это и приводит к агрегации и адгезии клеток крови. † Застойный (венознозастойный) вариант стаза является результатом замедления оттока венозной крови, сгущения её, изменения физикохимических свойств, повреждения форменных элементов крови (в частности, в связи с гипоксией). В последующем клетки крови адгезируют друг с другом и со стенкой микрососудов. ПРОЯВЛЕНИЯ СТАЗА При стазе происходят характерные изменения в сосудах микроциркуляторного русла: • уменьшение внутреннего диаметра микрососудов при ишемическом стазе, • увеличение просвета сосудов микроциркуляторного русла при застойном варианте стаза, • большое количество агрегатов форменных элементов крови в просвете сосудов и на их стенках, • микрокровоизлияния (чаще при застойном стазе). В то же время проявления ишемии или венозной гиперемии могут перекрывать проявления стаза. ПОСЛЕДСТВИЯ СТАЗА При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается какихлибо существенных изменений. Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко — к гибели участка ткани или органа (инфаркт). НАРУШЕНИЕ КРОВО И ЛИМФООБРАЩЕНИЯ В СОСУДАХ МИКРОЦИРКУЛЯТОРНОГО РУСЛА Микроциркуляция — упорядоченное движение крови и лимфы по микрососудам, транскапиллярный перенос плазмы и форменных элементов крови, перемещение жидкости во внесосудистом пространстве. Микроциркуляторное русло. Совокупность артериол, капилляров и венул составляет структурно-функциональную единицу сердечно-сосудистой системы — микроциркуляторное (терминальное) русло. Терминальное русло организовано следующим образом: от терминальной артериолы отходит метартериола, распадающаяся на образующие сеть анастомозирующие истинные капилляры; венозная часть капилляров открывается в посткапиллярные венулы. В месте отделения капилляра от артериол имеется прекапиллярный сфинктер — скопление циркулярно ориентированных ГМК. Сфинктеры контролируют локальный объём крови, проходящий через истинные капилляры; объём же крови, проходящей через терминальное сосудистое русло в целом, определяется тонусом ГМК артериол. В микроциркуляторном русле присутствуют артериоловенулярные анастомозы, связывающие артериолы непосредственно с венулами или мелкие артерии с мелкими венами (юкстакапиллярный кровоток). Стенка сосудов анастомоза содержит много ГМК. Артериовенозные анастомозы в большом количестве присутствуют в некоторых участках кожи, где они играют важную роль в терморегуляции (мочка уха, пальцы). К микроциркуляторному руслу относят также мелкие лимфатические сосуды и межклеточное пространство. ПРИЧИНЫ РАССТРОЙСТВ МИКРОЦИРКУЛЯЦИИ Многочисленные причины, вызывающие разнообразные нарушения микроциркуляции, объединяют в три группы. • Расстройства центрального и регионарного кровообращения. К наиболее значимым относят сердечную недостаточность, патологические формы артериальной гиперемии, венозную гиперемию, ишемию. • Изменения вязкости и объёма крови и лимфы. Развиваются вследствие гемоконцентрации и гемодилюции. † Гемо(лимфо)концентрация. Причины: гипогидратация организма с развитием полицитемической гиповолемии, полицитемия, гиперпротеинемия (преимущественно гиперфибриногенемия). † Гемо(лимфо)дилюция. Причины: гипергидратация организма с развитием олигоцитемической гиперволемии, панцитопения (уменьшение количества всех форменных элементов крови), повышенная агрегация и агглютинация форменных элементов крови (приводит к значительному повышению вязкости крови), ДВС–синдром. • Повреждение стенок сосудов микроциркуляторного русла. Обычно наблюдается при атеросклерозе, воспалении, циррозах, опухолях и др. ТИПОВЫЕ ФОРМЫ НАРУШЕНИЯ МИКРОЦИРКУЛЯЦИИ Выделено три группы типовых форм нарушения микроциркуляции: внутрисосудистые (интраваскулярные), чресстеночные (трансмуральные) и внесосудистые (экстраваскулярные). Расстройства микроциркуляции приводят к капилляро-трофической недостаточности. ВНУТРИСОСУДИСТЫЕ НАРУШЕНИЯ МИКРОЦИРКУЛЯЦИИ Типовые формы интраваскулярных (внутрисосудистых) расстройств микроциркуляции перечислены на рис. 22–53). 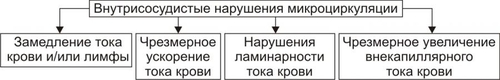 Рис. 22–53. Типовые формы интраваскулярных расстройств микроциркуляции. • Замедление (вплоть до стаза) тока крови и/или лимфы. † Наиболее частые причины. ‡ Расстройства гемо и лимфодинамики (например, при сердечной недостаточности, венозной гиперемии, ишемии). ‡ Увеличение вязкости крови и лимфы (в результате гемо[лимфо]концентрации при длительной рвоте, диарее, плазморрагии при ожогах, полицитемии, гиперпротеинемии, агрегации клеток крови, внутрисосудистом её свёртывании, микротромбозе). ‡ Значительное сужение просвета микрососудов (вследствие сдавления их опухолью, отёчной тканью, образования в них тромбов, попадания эмбола, набухания или гиперплазии эндотелиальных клеток, образования атеросклеротической бляшки и т.п.). † Проявления. Сходны с наблюдающимися в сосудах микроциркуляторного русла при венозной гиперемии, ишемии или стазе. • Ускорение кровотока. † Основные причины. ‡ Нарушения_проницаемости'>Нарушения гемодинамики (например, при артериальной гипертензии, патологической артериальной гиперемии или сбросе артериальной крови в венозное русло через артериоловенулярные шунты). ‡ Снижение вязкости крови вследствие гемодилюции (при водном отравлении), гипопротеинемии, почечной недостаточности (при олигурической или анурической стадии), панцитопении. • Нарушение ламинарности (турбулентность) тока крови и/или лимфы. † Наиболее частые причины. ‡ Изменения вязкости и агрегатного состояния крови (в результате образования агрегатов клеток крови при полицитемии, значительном увеличении числа форменных элементов крови выше нормы или гиперфибриногенемии; при формировании микротромбов). ‡ Повреждение стенок микрососудов или нарушение гладкости их (при васкулитах, гиперплазии клеток эндотелия, артериосклерозе, фиброзных изменениях в различных слоях сосудистых стенок, развитии в них опухолей и т.п.). • Увеличение юкстакапиллярного тока крови. Происходит вследствие открытия артериоловенулярных шунтов и сброса крови из артериол в венулы, минуя капиллярную сеть микроциркуляторного русла. † Причина: спазм ГМК артериол и закрытие прекапиллярных сфинктеров при значительном увеличении уровня катехоламинов в крови (например, при гиперкатехоламиновом кризе у пациентов с феохромоцитомой), чрезмерном повышении тонуса симпатической нервной системы (например, в условиях стресса), гипертензивном кризе (например, у пациентов с гипертонической болезнью). † Проявления: ишемия в регионе сброса крови из артериол в венулы, открытие и/или увеличение диаметра артериоловенулярных шунтов, Турбулентный характер тока крови в местах ответвлений и входов в венулы шунтирующих сосудов (обусловлен тем, что артериоловенулярные шунты отходят от артериол и впадают в венулы, как правило, под значительным углом; это сопровождается соударением форменных элементов крови друг с другом и стенкой сосуда, что приводит к выделению проагрегантов и прокоагулянтов, к образованию агрегатов и тромбов). ТРАНСМУРАЛЬНЫЕ НАРУШЕНИЯ МИКРОЦИРКУЛЯЦИИ Перемещение через стенку микрососуда может относиться либо к жидкой части крови (в этом случае говорят о проницаемости), либо к клеточным элементам (в этом случае говорят об эмиграции). В соответствии с преобладанием проницаемости или эмиграции трансмуральные нарушения микроциркуляции подразделяют на две категории: нарушения проницаемости и нарушения эмиграции. • Нарушения проницаемости. При различных патологических состояниях объём перемещения плазмы крови и/или лимфы через стенку сосуда может возрастать либо уменьшаться. † Увеличение проницаемости. ‡ Основные причины повышения проницаемости стенок микрососудов приведены на рис. 22–54. 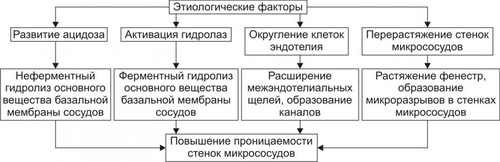 Рис. 22–54. Основные причины повышения проницаемости стенок микрососудов. ‡ Последствия. Повышение проницаемости сосудистой стенки потенцирует механизмы перемещения жидкости: фильтрацию (транспорт жидкости по градиенту гидростатического давления), трансцитоз (энергозависимый пиноцитоз), диффузию (перенос жидкости без затрат энергии), осмос (направленную диффузию жидкости по градиенту осмотического давления). † Уменьшение проницаемости. ‡ Причины: утолщение и/или уплотнение стенок сосудов, либо нарушение энергообеспечения внутриклеточных процессов. ‡ Последствия. Снижение эффективности механизмов перемещения жидкости: фильтрация, диффузия, трансцитоз, осмос. • Нарушения эмиграции. При различных патологических состояниях перемещение форменных элементов крови через стенку сосуда может возрастать либо уменьшаться. Эмиграция лейкоцитов через стенку микрососудов осуществляется и в норме. К патологии же относят чрезмерную эмиграцию лейкоцитов, а также выход из крови тромбоцитов и эритроцитов с последующим развитием микрогеморрагий. ЭКСТРАВАСКУЛЯРНЫЕ НАРУШЕНИЯ МИКРОЦИРКУЛЯЦИИ Внесосудистые (экстраваскулярные) нарушения микроциркуляции сопровождаются увеличением или уменьшением объёма межклеточной жидкости, что приводит к замедлению оттока её в сосуды микроциркуляторного русла. • Увеличение объёма межклеточной жидкости, сочетающееся с замедлением её оттока из интерстициального пространства. † Причина: местные патологические процессы (воспаление, аллергические реакции, рост новообразований, склеротические процессы, венозная гиперемия и/или стаз). † Последствия. ‡ Увеличение содержания в интерстициальной жидкости продуктов нормального и нарушенного метаболизма. Они могут оказывать цитотоксическое и цитолитическое действие. ‡ Дисбаланс ионов (что способствует отёку ткани, нарушает формирование МП и ПД). ‡ Образование избытка и/или активация БАВ (например, ФНО, прокоагулянтов, мембраноатакующего комплекса), способных усугубить повреждение клеток, потенцировать расстройства крово и лимфообращения, пластических процессов. ‡ Нарушение обмена O2, CO2, субстратов и продуктов обмена веществ. ‡ Сдавление клеток избытком интерстициальной жидкости. • Уменьшение объёма межклеточной жидкости, сопровождающееся нарушением её оттока из интерстициального пространства. † Причины. ‡ Гипогидратация организма, тканей и органов (например, в результате длительной диареи, плазморрагии, при интенсивном потоотделении). ‡ Снижение лимфообразования (например, при ишемии ткани или гиповолемии). ‡ Уменьшение эффективности фильтрации жидкости в артериолах и прекапиллярах и/или увеличение реабсорбции её в посткапиллярах и венулах (например, при дистрофических и склеротических процессах в тканях). † Последствия. Сходны с наблюдающимися при увеличении объёма интерстициальной жидкости, сочетающемся с замедлением её оттока (см. выше). КАПИЛЛЯРО-ТРОФИЧЕСКАЯ НЕДОСТАТОЧНОСТЬ Капилляро-трофическая недостаточность — состояние, характеризующееся нарушением крово и лимфообращения в сосудах микроциркуляторного русла, расстройствами транспорта жидкости и форменных элементов крови через стенки микрососудов, замедлением оттока межклеточной жидкости и нарушениями обмена веществ в тканях и органах (рис. 22–55). 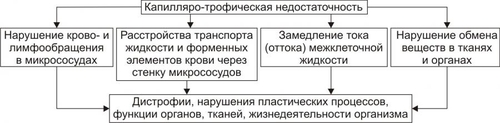 Рис. 22–55. Признаки капилляро-трофической недостаточности. В результате комплекса указанных изменений развиваются различные варианты дистрофий, нарушаются пластические процессы в тканях, расстраивается жизнедеятельность органов и организма в целом. СЛАДЖ Сладж — феномен, характеризующийся адгезией, агрегацией и агглютинацией форменных элементов крови, что обусловливает сепарацию её на конгломераты из эритроцитов, лейкоцитов, тромбоцитов и плазму, а также — нарушение микрогемоциркуляции. • Причины сладжа. † Нарушения центральной гемодинамики (при сердечной недостаточности, венозном застое, ишемии, патологических формах артериальной гиперемии). † Повышение вязкости крови (например, в условиях гемоконцентрации, гиперпротеинемии, полицитемии). † Повреждение стенок микрососудов (при местных патологических процессах: воспалении, аллергических реакциях, опухолях и др.). • Механизмы развития сладжа представлены на рис. 22–56. 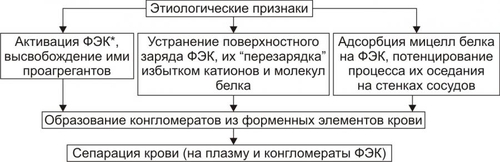 Рис. 22–56. Механизмы сладжа. ФЭК — форменные элементы крови. • Последствия сладжа. † Нарушение тока крови внутри сосудов (замедление, вплоть до стаза; турбулентный ток крови; включение артериоловенулярных шунтов), расстройство процессов транскапиллярного тока форменных элементов крови. † Нарушение метаболизма в тканях и органах с развитием дистрофий и расстройством пластических процессов в них. Причины: нарушения обмена O2 и CO2 в связи с адгезией и агрегацией эритроцитов и развитие васкулопатий в результате прекращения или значительного уменьшения ангиотрофической функции тромбоцитов (они находятся в конгломератах форменных элементов крови). † Развитие гипоксии и ацидоза в тканях и органах. В целом совокупность указанных изменений приводит к развитию капилляро-трофической недостаточности. Отсюда следует важный вывод: феномен сладжа является причиной расстройств микроциркуляции (в тех случаях, когда он развивается первично) или следствием внутрисосудистых нарушений микрогемоциркуляции (при их первичном развитии).
|
