Патфиз ч.3. Патфиз ч. Частнаяпатология
 Скачать 13.12 Mb. Скачать 13.12 Mb.
|
|
ОБЩАЯ ЭТИОЛОГИЯ Общая этиология нарушений деятельности нервной системы рассматривает причины повреждения и условия, определяющие патогенный эффект причин её повреждения (факторы риска). ПРИЧИНЫ ПОВРЕЖДЕНИЯ Факторы, вызывающие повреждение элементов нервной системы, могут быть экзогенными и эндогенными. • Экзогенные причины. Экзогенные факторы имеют физическую, химическую, биологическую и психогенную природу. † Физические (например, механическая травма, ионизирующая радиация, снижение или значительное увеличение pO2 во вдыхаемом воздухе). † Химические (например, этиловый, метиловый и другие спирты; ядохимикаты: фосфорорганические соединения, применяемые в сельском хозяйстве, например, пестициды, в быту, например, хлорофос; нервнопаралитические отравляющие вещества, например, зарин; фармакологические препараты центрального действия, в том числе наркотики; токсины растительного происхождения, например, стрихнин, кураре). † Биологические (например, нейротропные вирусы: возбудители бешенства, полиомиелита, герпеса; микробы: возбудители сифилиса, лепры; микробные токсины: ботулинический, дифтерийный, столбнячный). † Психогенные (например, психотравмирующие ситуации, устрашающие образы, звуки, ощущения). Наиболее часто в клинической практике патогенную роль играет слово — как стрессорный раздражитель, а также другие воздействия, реализующие своё влияние условнорефлекторно, через вторую сигнальную систему. • Эндогенные факторы. Причины эндогенного характера, вызывающие повреждение нервной системы, перечислены на рис. 28–1. 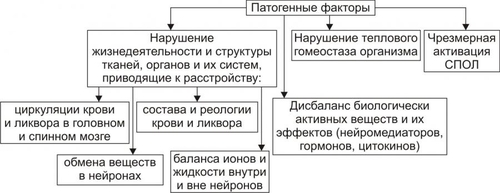 Рис. 28–1. Эндогенные причины повреждения нервной системы. ФАКТОРЫ РИСКА К условиям, определяющим патогенность факторов, воздействующих на нервную систему (факторы риска) относят интенсивность, длительность, частоту и периодичность воздействия, а также состояние нервной системы в момент действия патогенного агента и состояние гематоэнцефалического барьера. • Интенсивность, длительность, частота и периодичность воздействия. Значительные и труднообратимые нарушения нервной деятельности могут возникать не только под влиянием сильных, но и слабых патогенных факторов при определённых режимах их воздействия. Например, небольшие дозы алкоголя, наркотиков, ЛС при достаточной продолжительности и частоте их потребления способны вызывать грубые нарушения ВНД, движений, чувствительности и другие нейрогенные расстройства. • Состояние нервной системы в момент действия патогенного агента. Состояние нервной системы в момент действия патогенного агента определяется её генетическими особенностями (например, типом ВНД) и предшествующими структурнофункциональными повреждениями. Клинические проявления последних к моменту действия данного патогенного фактора могут быть компенсированными (скрытыми) или носить характер следовых реакций, На таком фоне патогенность повреждающих воздействий увеличивается. • Состояние гематоэнцефалического барьера. Патологическая проницаемость гематоэнцефалического барьера для экзо и эндогенных факторов может возникать при действии ионизирующей радиации, интоксикации спиртами, микробными токсинами, в условиях охлаждения организма, развития тяжёлых стрессовых ситуаций, различных шоковых состояний. Особое значение повышение проницаемости гематоэнцефалического барьера имеет для нарушения иммунной автономии головного мозга и развития вследствие этого состояний иммунной аутоагрессии с поражением нервной системы (например, рассеянного склероза, энцефаломиелита). ОБЩИЙ ПАТОГЕНЕЗ РАССТРОЙСТВ НЕРВНОЙ ДЕЯТЕЛЬНОСТИ В этом разделе рассмотрены механизмы повреждения нейронов и нарушения межнейронных взаимодействий, а также механизмы расстройств интегративной деятельности нервной системы. ПОВРЕЖДЕНИЕ НЕЙРОНОВ Механизмы повреждения нейронов могут носить специфический и неспецифический характер. НЕСПЕЦИФИЧЕСКИЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ НЕЙРОНОВ Общие механизмы повреждения клеток рассмотрены в главе 4 «Патология клетки». Такие неспецифические механизмы повреждения нейронов представлены на рис. 28–2. 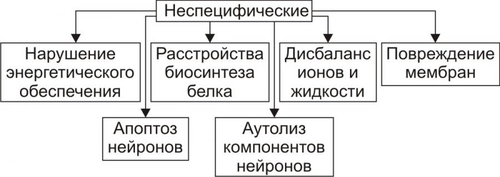 Рис. 28–2. Основные механизмы повреждения нейронов (неспецифические). • Нарушения энергообеспечения. Возникают при уменьшении поступления в мозг глюкозы и кислорода, снижении активности ферментов биологического окисления, разобщении процессов окисления и фосфорилирования, нарушениях транспорта энергии и расстройствах процессов использования энергии. † Уменьшение поступления в клетки глюкозы и кислорода. Наиболее частые причины: гипоксемия, гипогликемия, анемия, снижение мозгового кровообращения, увеличение диффузионного пути глюкозы и O2 от микрососуда до нейронов (при отёке мозга). Глюкоза является основным энергетическим субстратом нервных клеток. Аэробное расщепление субстратов обеспечивает образование примерно 80% энергии, потребляемой мозгом. В норме головной мозг утилизирует около 20% глюкозы плазмы крови и всего потребляемого организмом кислорода. Мозг чрезвычайно чувствителен к сокращению поступления кислорода. Наличие в нервных клетках гликогена как резервного источника энергии лишь отчасти обеспечивает функционирование жизненно важных отделов нервной системы. В конечном итоге дефицит глюкозы и кислорода приводит к гибели нервных клеток, в первую очередь нервных клеток коры головного мозга (корковые нейроны погибают при аноксии и при отсутствии глюкозы в течение минут). † Снижение активности ферментов биологического окисления. Наиболее частые причины: ингибирование и/или денатурация ферментов (например, при отравлении цианидами и солями тяжёлых металлов, при эндогенной интоксикации), недостаточность ферментов (например, при генетических дефектах, авитаминозах B1, B2), нарушение компартментализации (например, при дезорганизации мембран митохондрий под воздействием ионизирующей радиации, высокой температуры, продуктов нарушенного обмена). † Разобщение процессов окисления и фосфорилирования. Наиболее частые причины: избыток в нейронах Ca2+ и накопление жирных кислот. † Нарушение транспорта энергии от мест образования макроэргических соединений до мест расходования энергии. Одна из наиболее частых причин: потеря нейронами BBфракции КФК при повреждении их мембран. † Расстройство процессов использования энергии. Наиболее частая причина: снижение активности АТФаз (в условиях ацидоза, интоксикации, ионного дисбаланса). • Расстройства синтеза белка. † Наиболее частые причины: дефицит аминокислот, нарушения энергообеспечения, снижение активности ферментов протеосинтеза, распад синтезирующего белок органоида — шероховатой эндоплазматической сети (субстанции Ниссля). † Проявления. Расстройства синтеза белка приводят к катастрофическим последствиям для всех стороны жизнедеятельности нервных клеток и — в итоге — к их гибели. • Дисбаланс ионов и жидкости. Ионный гомеостаз нейронов обеспечивается работой энергозависимых калиевых, натриевых, кальциевых и других ионных каналов. † Типичные проявления ионного дисбаланса (возникающие, например, при энергодефиците): накопление Na+ и Ca2+ в нейронах и избыток K+ во внеклеточном пространстве. † Последствия: стойкая деполяризация плазмолеммы нейрона (приводит к прекращению нормальной функции нервных клеток), повышение осмотического давления в нейронах, их набухание и последующая гибель. • Повреждение мембран нейрона. Этот процесс является универсальным механизмом большинства нарушений нервной деятельности. † Наиболее частые причины: чрезмерное образование активных форм O2 и усиления СПОЛ, активации эндогенных фосфолипаз, механическое растяжение мембран, воздействие на мембраны амфифильных соединений. † Последствия. Повреждение мембран возбудимых клеток быстро приводит к прекращению их функциональной активности (электрогенез), нарушению всех проявлений жизнедеятельности нервных клеток (например, синаптическая передача, синтез белка, аксонный транспорт и др.) и их гибели путём аутолиза и апоптоза (см. раздел «Гибель клетки» в главе 4 «Патология клетки»). • Апоптоз. Важная роль апоптоза — генетически контролируемого процесса гибели нейронов — доказана для многих форм невропатологии, особенно для нейродегенеративных заболеваний (например, для болезней Паркинсона, Альцхаймера; старческой деменции; бокового амиотрофического склероза и др.). † Причины: гипоксия нервной ткани любого типа, особенно действующая длительное время (например, при атеросклерозе церебральных сосудов; опухолях головного или спинного мозга, сдавливающих сосуды), внутриклеточный ацидоз (например, при значительной ишемии ткани мозга), избыточная генерация радикалов кислорода, липидов и других веществ в ткани мозга (например, в условиях гипоксии и/или гипероксигенации мозга, отравлении нейротоксическими агентами). † Механизмы апоптоза изложены в разделе «Апоптоз» в главе 4 «Повреждение клетки». Описанные выше механизмы повреждения нейрона тесно взаимосвязаны, они нередко потенцируют друг друга, образуя порочные круги (circulus vitiosus). Формирование таких порочных кругов — неспецифическая, стандартная реакция нейрона на разные патогенные воздействия. СПЕЦИФИЧЕСКИЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ НЕЙРОНОВ. Патогенетическую основу большинства форм нарушений нервной деятельности составляют раздельные или сочетанные расстройства специфических для нейрона процессов метаболизма различных нейромедиаторов (рис. 28–3). 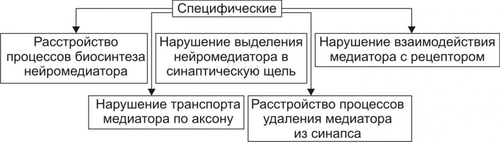 Рис. 28–3. Основные механизмы повреждения нейронов (специфические). • Синтез нейромедиаторов. Наиболее частые причины нарушений синтеза нейромедиаторов: энергетический дефицит, дефицит субстратов синтеза, генетические дефекты ферментов синтеза, ингибирование ферментов синтеза. • Аксонный транспорт нейромедиаторов. Наиболее частые причины нарушения аксонного транспорта рассмотрены далее (раздел «Механизмы нарушений межнейронных взаимодействий»). • Секреция нейромедиатора (см. статью «Нейромедиаторы» в приложении «Справочник терминов»). • Удаление нейромедиатора (см. статью «Нейромедиаторы» в приложении «Справочник терминов»). • Взаимодействие нейромедиатора с его рецепторами (см. статью «Нейромедиаторы» в приложении «Справочник терминов»). Реализация описанных выше неспецифических и специфических механизмов повреждения нейрона обусловливает нарушение восприятия, анализа, генерации и проведения возбуждения нейронами. МЕХАНИЗМЫ НАРУШЕНИЙ МЕЖНЕЙРОННЫХ ВЗАИМОДЕЙСТВИЙ Механизмы нарушений межнейронных взаимодействий приведены на рис. 28–4. 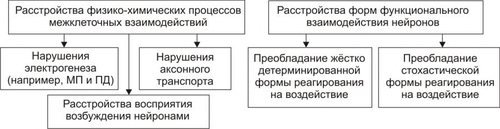 Рис. 28–4. Механизмы нарушений взаимодействия нейронов. В основе нарушений межнейронных взаимодействий находятся расстройства физикохимических процессов и форм функционального взаимодействия нейронов. РАССТРОЙСТВА ФИЗИКОХИМИЧЕСКИХ ПРОЦЕССОВ Существует несколько вариантов расстройств физикохимических процессов, обеспечивающих межклеточные взаимодействия в нервной системе. К ним относятся нарушения мембранного электрогенеза (включая проведение ПД по аксонам), синаптической передачи (включая секрецию и рецепцию нейромедиатора), а также нарушения аксонного транспорта. РАССТРОЙСТВА ФОРМ ФУНКЦИОНАЛЬНОГО ВЗАИМОДЕЙСТВИЯ НЕЙРОНОВ Среди межнейронных функциональных взаимодействий выделяют жёстко детерминированную и вероятностностатистическую формы. • Жестко детерминированная (жёстко программная) — стандартная форма ответной реакции определяется генетически запрограммированными особенностями реагирования нейронов на воздействия и наличием анатомических связей между нейронами, составляющими ту или иную функциональную совокупность (ядра, проводящие пути, нейронные сети и т.п.). • Стохастическая (вероятностностатистическая) форма реакции нейронов означает, что один и тот же стимул может вовлекать в ответные реакции разные нейроны или вызывать неодинаковые ответы. Зависимость между воздействием и ответной реакцией носит вероятностный характер. В основе этой формы взаимодействия лежат изменчивость текущего функционального состояния нейронов и функциональная избыточность нейронов и связей между ними. Стохастичность межнейронного взаимодействия обеспечивает высокую функциональную пластичность, а также значительные компенсаторноприспособительные возможности нервной системы, предотвращающие возможность «случайных» патогенных последствий различных воздействий. • В норме обе формы межнейронного взаимодействия сбалансированы и дополняют друг друга. Нарушение этого баланса приводит к расстройствам нервной деятельности. Например, в агональной стадии процесса умирания наблюдается переход нейронов дыхательного центра на жёсткопрограммный режим деятельности. Обеспечивая необходимый минимум лёгочной вентиляции, дыхательный центр утрачивает возможность реагирования на дополнительные воздействия. В условиях дефицита энергии дыхательный центр не реагирует на афферентные стимулы от синокаротидных рефлексогенных зон, рецепторов растяжения лёгких и других регионов. Такое состояние дыхательного центра обозначают как его «функциональная деафферентация». МЕХАНИЗМЫ РАССТРОЙСТВ ИНТЕГРАТИВНОЙ ДЕЯТЕЛЬНОСТИ НЕРВНОЙ СИСТЕМЫ Механизмы расстройств интегративной деятельности нервной системы заключаются в нарушениях функционирования одного или нескольких звеньев нервной системы: афферентного, центрального и эфферентного. • Афферентные нарушения могут быть связаны с расстройствами восприятия различных воздействий и проведения сигнала от афферентных структур к нервным центрам. • Центральные нарушения характеризующегося расстройствами процессов анализа афферентных сигналов, синтеза и генерации эфферентного сигнала нервными центрами. • Эфферентные нарушения заключаются в расстройствах проведения сигналов из центра и их восприятия исполнительными структурами. Эти расстройства могут приводить к нарушениям деятельности функциональных и физиологических систем организма, а при тяжёлых поражениях — к их распаду. ТИПОВЫЕ ФОРМЫ НАРУШЕНИЙ ДЕЯТЕЛЬНОСТИ НЕРВНОЙ СИСТЕМЫ Типовые формы нарушений деятельности нервной системы представлены на рис. 28–5. 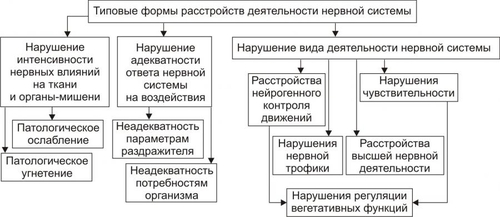 Рис. 28–5. Типовые формы расстройств деятельности нервной системы. Всё многообразие типовых форм расстройств деятельности нервной системы подразделяют на три группы (по критериям зависимости от интенсивности нервных влияний на ткани и органы, адекватности ответа нервной системы на них и нарушенного вида нервной деятельности). • По критерию интенсивности выделены патологическое усиление и патологическое ослабление нервных влияний на ткани и органы. • По адекватности ответа нервной системы на воздействия говорят о фазовых состояниях. • По критерию преимущественно нарушенного вида нервной деятельности выделяют нейрогенные расстройства движений, нарушений чувствительности, расстройства трофики мишеней и нарушения ВНД. ПАТОЛОГИЧЕСКОЕ ОСЛАБЛЕНИЕ НЕРВНЫХ ВЛИЯНИЙ Патологическое ослабление нервного контроля на эффекторы возникает при нарушениях центрального или эфферентного звеньев нервной системы. Причины. К причинам возникновения патологического ослабления нервных влияний относятся органические повреждения и функциональные изменения центрального аппарата нервной регуляции, а также нарушения в эфферентном звене системы нервного контроля. • Органические повреждения центрального аппарата: механическая травма головного и/или спинного мозга, а также органных и тканевых нервных образований (например, нервных сплетений кишечника, брюшной и грудной полости, малого таза и др.), воспалительные процессы (например, энцефалит, менингит, неврит), опухоли (например, головного или спинного мозга и их оболочек), дегенеративные процессы (например, при боковом амиотрофическом склерозе, гибели нейронов коры при болезни Альцхаймера, стрионигральной дегенерации при атаксии и др.), нарушения кровообращения (чаще всего — ишемия, а также венозная гиперемия, стаз). Возникающие при органических повреждениях нервных образований расстройства усугубляются развитием в нейронах вокруг очага повреждения состояния так называемого «охранительного торможения». Оно предотвращает или уменьшает дальнейшее нарастание патологических изменений в нейронах. Однако, это увеличивает степень дефекта нервной функции. Например, при локальном нарушении кровообращения в двигательном анализаторе выраженность паралича определяется, с одной стороны, размером очага органического повреждения, а с другой — торможением деятельности близлежащих неповреждённых нейронов, что усиливает дефект регуляции движений. Со временем (по мере снятия охранительного торможения) двигательная функция может в какой-то степени восстановиться даже при сохранении структурных повреждений мозговой ткани. • Функциональные изменения центрального аппарата нервной регуляции: снижение интенсивности возбудительного процесса (например, при наркозе) и гиперактивация ядер ЦНС, оказывающих тормозное влияние на эффекторы (например, в условиях чрезмерного повышения активации нейронов ретикулярной формации продолговатого мозга, оказывающей тормозное нисходящее влияние на структуры спинного мозга, развиваются расстройства движений, вплоть до парезов мышц, а также снижения чувствительности тканей. В основе этих феноменов лежит угнетение полисинаптических рефлексов в спинном мозге под влиянием тормозных стимулов от нейронов ретикулярной формации). • Нарушения в эфферентном звене системы нервного контроля: травматическое прерывание (частичное или полное) проведения сигналов, расстройства проведения ПД по аксонам и/или аксонного транспорта, расстройства восприятия нервных воздействий клетками–мишенями (например, в условиях гипоксии, дисбаланса ионов, изменения числа и аффинности рецепторов к нейромедиаторам). Возникающий при значительном снижении или выпадении нервного контроля комплекс метаболических, нейромедиаторных и структурнофункциональных изменений в постсинаптических нейронах, тканях и органах получил название «денервационный синдром». ПАТОЛОГИЧЕСКОЕ УСИЛЕНИЕ НЕРВНЫХ ВЛИЯНИЙ Патологическое усиление нервных влияний на эффекторные структуры развивается вследствие первичного и вторичного чрезмерного повышения уровня и/или длительности возбуждения нейронов. • Первичное чрезмерное возбуждение. Причины: увеличение притока возбуждающей афферентации (например, при психогенном стрессе, болевом раздражении, повреждениях чувствительных нервов), пролонгирование действия возбуждающих нейромедиаторов (например, при повышенном выделении нейромедиатора в синаптическую щель, снижении процессов его разрушения и/или удаления), повышение чувствительности нейронов к возбуждающим сигналам (например, в результате избыточной деполяризации нейронов, вызванной увеличением содержания K+ в межклеточном пространстве). • Вторичное чрезмерное повышение интенсивности и/или продолжительности возбуждения нейронов, уже находившихся в состоянии повышенной активности, развивается в условиях деафферентации, уменьшения секреции нейромедиаторов, блокады постсинаптических рецепторов. † Деафферентация нейронов. Блокирует поступление тормозных сигналов к нейронам или нервным образованиям (например, перерезка в эксперименте ствола мозга между передним и задним четверохолмием по Шеррингтону вызывает характерный «феномен растормаживания» — децеребрационную ригидность). † Уменьшение выделения тормозных нейромедиаторов (например, при блокировании столбнячным токсином секреции глицина из вставочных нейронов спинного мозга приводит к развитию судорог). † Блокада постсинаптических рецепторов тормозных нейромедиаторов (например, блокирование стрихнином глициновых рецепторов вызывает развитие судорог). Тормозные механизмы нервной системы весьма чувствительны к различным патогенным воздействиям. В связи с этим «феномен растормаживания» рассматривается как один из основных механизмов развития многих нарушений нервной деятельности. Гиперактивация нервных структур может привести к формированию «застойных очагов возбуждения». Их функционирование проявляется различными нейропатологическими синдромами: приступами эпилептических судорог или болей (например, таламического болевого синдрома, фантомных болей). Образование таких очагов (например, в центрах гипоталамуса) может приводить к выраженным вегетативным расстройствам — артериальной гипертензии, полифагии, гиперсекреции желудка, аритмиям сердца и др. ФАЗОВЫЕ СОСТОЯНИЯ По критерию адекватности ответа нервной системы на различные воздействия выделены такие нарушения её деятельности как фазовые состояния. Фазовые состояния — нарушения адекватных соотношений между интенсивностью и/или характером («качеством») ответной реакции (условнорефлекторной или безусловнорефлекторной) и параметрами раздражителя, вызывающего данную реакцию. Ответы нервной системы в количественном или качественном отношениях не соответствуют ни параметрам раздражителя, ни потребностям организма. • Причины. † Генетически детерминированные патологические изменения на разных уровнях организации нервной системы. Так, конкордантность по рассеянному склерозу среди монозиготных близнецов превышает 50%, а у близких родственников (родителей, братьев и сестёр) риск возникновения этой болезни в 8 раз выше, чем в общей популяции. Это (наряду с влиянием факторов внешней среды) отражает взаимодействие нескольких генетических факторов между собой (так называемая полигенная зависимость). † Приобретённые расстройства структурнофункциональной организации нервной системы (например, в условиях ишемии, роста опухолей, энцефалитов, интоксикаций). • Последствия. † Утрата сложившихся в процессе индивидуальной жизни межнейронных отношений, совокупностей нейронов или систем (функциональный распад нервной системы). † Формирование патологических, не свойственных данному индивиду функциональных связей между нейронами и нервными образованиями («патологическая интеграция»), новых функциональных совокупностей нейронов и систем (образование «патологической системы»). † Снижение пластичности и компенсаторноприспособительных возможностей нервной системы в целом или отдельных её функциональных образований. • Проявления. † Развитие фазовых состояний. Фазовые состояния наиболее характерны для сферы ВНД и нейровегетативных реакций. Типы фазовых состояний. ‡ Уравнительное. Характеризуется одинаковыми ответами нервных структур на воздействия разной интенсивности. ‡ Средних раздражителей. Проявляется максимальным ответом только на раздражители средней интенсивности. ‡ Парадоксальное. Характеризуется слабой реакцией или её отсутствием на сильный раздражитель, сохранением или усилением реакции на слабые раздражители. ‡ Наркотическое. Проявляется последовательным выпадением реакций на слабые, а затем и на сильные раздражители. ‡ Тормозное. Характеризуется отсутствием реакции на любой раздражитель. ‡ Ультрапарадоксальное. Проявляется качественным изменением соотношения между характером раздражителя и вызываемой им реакцией. При этом состоянии негативные реакции развиваются в ответ на положительные раздражители и наоборот. Для фазовых состояний характерна также смена их во времени («временная мозаика») и в разных регионах нервной системы («пространственная мозаика»). НЕЙРОГЕННЫЕ РАССТРОЙСТВА ДВИЖЕНИЙ Нейрогенные расстройства движений характеризуются патологическими изменениями количества движений, их темпа и координации. КЛАССЫ НЕЙРОГЕННЫХ РАССТРОЙСТВ ДВИЖЕНИЙ Выделены следующие классы типовых форм нейрогенных расстройств движения: гипокинезии, гиперкинезии, гиподинамии и атаксии. • Гипокинезии — ограничение объёма и скорости произвольных движений. • Гиперкинезии — выполнение избыточных непроизвольных движений. • Гиподинамии — снижение двигательной активности и силы мышечных сокращений при движении. • Атаксии — нарушение координации движений. АНАТОМИЧЕСКИЕ СИСТЕМЫ РЕГУЛЯЦИИ ДВИЖЕНИЙ К системам, осуществляющим регуляцию движений, относятся пирамидная и экстрапирамидная системы, а также структуры, ответственные за регуляцию координации движений. Аксоны всех нисходящих путей заканчиваются исключительно на мотонейронах спинного мозга. • Пирамидная система. † Нисходящие пути. ‡ Корково-спинномозговой путь передний (пирамидный путь передний, tractus corticospinalis ventralis) образован аксонами нейронов, расположенных в двигательной зоне коры [предцентральная извилина (gyrus precentralis)]. Волокна пути проходят через внутреннюю капсулу и в переднем канатике, заканчиваются в передних рогах, посегментно перекрещиваясь. ‡ Корково-спинномозговой путь латеральный (пирамидный путь латеральный, tractus corticospinalis lateralis) начинается в коре предцентральной извилины, проходит через внутреннюю капсулу и после перекреста в продолговатом мозге проходит в боковом канатике, заканчиваясь в передних рогах. † Уровни (топика, от гр. topos — место) наиболее частого поражения нервных структур пирамидной системы, регулирующей функцию поперечнополосатых мышц и произвольные движения: † тела нейронов центрального двигательного анализатора, расположенные преимущественно в предцентральной извилине двигательной зоны коры — пирамидные нейроны; † корковоядерные и корковоспинномозговые пути; † вставочные клетки спинного мозга, через которые пирамидные нейроны влияют на мотонейроны передних рогов спинного мозга и черепных нервов; † тела мотонейронов передних рогов спинного мозга и двигательных ядер черепных нервов, аксоны мотонейронов, нервномышечные синапсы. • Экстрапирамидная система. † Нисходящие пути. ‡ Красноядерно-спинномозговой путь (пучок фон Монакова, tractus rubrospinalis) — нисходящий проекционный путь экстрапирамидной системы, начинается от красного ядра, проходит в мозговом стволе и боковом канатике и заканчивается в передних рогах. ‡ Ретикулоспинальный путь (tractus reticulospinalis) — эфферентный путь экстрапирамидной системы; начинается в ретикулярной формации продолговатого мозга, заканчивается в передних рогах спинного мозга. Контролирует тонус скелетной мускулатуры и висцеральные двигательные функции (например, автоматизм дыхания). † Уровни (топика) поражения нервных структур экстрапирамидной системы, регулирующих мускулатуру, обеспечивающую непроизвольные («автоматические») движения: † нейроны коры (премоторная зона, поясная извилина и другие), подкорковых ядер стриопаллидарной системы, мозжечка, спинного мозга. † проводящие пути стриопаллидарной системы (например, красноядерно спинномозговой или ретикулоспинальный), • Система координации движений. Уровни (топика) поражения нервных структур, обеспечивающих координацию движений: † тела нейронов лобной и височной областей коры головного мозга, ядер мозжечка. † проводящие пути (от нейронов коры мозга и мозжечка к нейронам гипоталамуса, красного ядра среднего мозга, вестибулярных ядер, ретикулярной формации ствола мозга и др.); † синаптические структуры. ХАРАКТЕРИСТИКА ТИПОВЫХ ФОРМ РАССТРОЙСТВ ДВИЖЕНИЯ В этом разделе рассмотрены разные классы типовых форм нейрогенных расстройств движения: гипокинезии, гиперкинезии и атаксии. • Гипокинезии — ограничения объёма, количества и скорости движений. Они, как правило, сочетаются со снижением двигательной активности и силы мышечных сокращений — гиподинамией. С учётом различных критериев выделяют несколько типов гипокинезий (рис. 28–6). 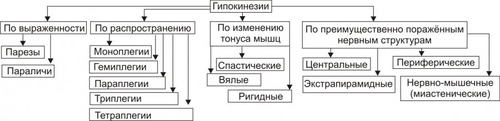 Рис. 28–6. Виды гипокинезий. † В зависимости от выраженности нарушения движений выделяют парезы и параличи. ‡ Парез — уменьшение амплитуды, скорости, силы и количества произвольных движений. ‡ Паралич —полное отсутствие произвольных движений. † В зависимости от распространённости (масштаба) расстройств движения выделяют различные плегии, от моно- до тетраплегии. ‡ Моноплегия — паралич или парез одной конечности (руки или ноги). ‡ Параплегия — паралич или парез обеих рук или обеих ног. ‡ Гемиплегия — паралич или парез левой или правой половины тела. ‡ Триплегия — паралич или парез трёх конечностей. ‡ Тетраплегии — паралич или парез рук и ног. † В зависимости от изменения тонуса мышц различают спастические, ригидные и вялые формы гипокинезий. ‡ Спастические. Повышен тонус мышц, как правило, одной группы (например, сгибателей рук или разгибателей ног). Наблюдается при поражении центральных мотонейронов на любом участке кортикоспинального (пирамидного) пути. ‡ Ригидные. Длительно повышен тонус одной или нескольких групп мышц–антагонистов (например, отводящих и приводящих, сгибательных и разгибательных). В последнем случае (при одновременном повышении тонуса сгибателей и разгибателей) конечность или туловище длительно сохраняют приданную им позу (так называемая «восковидная ригидность», являющаяся следствием поражения экстрапирамидной системы). ‡ Вялые. Понижен тонус мышц в области иннервации повреждённого нервного ствола или центра (например, при поражении мотонейронов или передних корешков спинного мозга). † В зависимости от преимущественно поражённых нервных структур выделяют центральные, периферические, экстрапирамидные и миастенические (нервно–мышечные) формы гипокинезий. Центральные параличи и парезы. † Причины центрального (пирамидного, спастического) паралича или пареза. ‡ Поражение центральных — пирамидных — нейронов двигательного анализатора. ‡ Повреждение проводящих (кортикоспинальных) путей пирамидной системы. † Проявления. ‡ Гиперрефлексия — повышение сегментарных сухожильных и периостальных рефлексов (увеличение амплитуды ответа и расширение зоны вызывания рефлекса). ‡ Мышечная гипертония — повышение тонуса мышц по спастическому типу. Обычно носит неравномерный характер (например, на руке тонус повышается преимущественно в приводящих мышцах плеча, сгибателях предплечья, а в ноге — разгибателях бедра и голени, приводящих мышцах бедра, сгибателях стопы). Со временем это может приводить к контрактурам, — стойким ограничениям движений в суставах и необычным положениям конечностей. ‡ Патологические рефлексы (например, Бабинского, Россолимо, Бехтерева). Эти рефлексы подразделяют на разгибательные и сгибательные. Первые являются одним из наиболее ранних и постоянных проявлений поражения пирамидного пути. Указанные признаки обусловлены повышением сегментарных рефлексов спинного мозга вследствие ослабления тормозных нисходящих влияний головного мозга. ‡ Клонус — высокая степень повышения сухожильномышечных рефлексов. Клонус проявляется серией быстрых ритмичных сокращений отдельных мышц, развивающихся спонтанно или в ответ на раздражение самой мышцы либо её сухожилия (примером может служить клонус мышц надколенника, стопы, кисти, подбородка). ‡ Синкинезии — непроизвольные содружественные мышечные сокращения и движения, возникающие в парализованной конечности при осуществлении произвольных движений другой конечностью или иной частью тела. Синкинезии осуществляются при участии пирамидной системы, мозжечка, спинного мозга. Периферические параличи и парезы. † Причины периферического (вялого, атрофического) паралича или пареза: первичные (наследуемые или врождённые) и приобретённые поражения периферических мотонейронов (клеток передних рогов спинного мозга, ядер черепных нервов). Приобретённые параличи и парезы развиваются в результате дегенеративных изменений (например, при боковом амиотрофическом склерозе), при воспалении (например, при полиомиелите, энцефалите), интоксикации нейротропными ядами (например, ботулиническим, дифтерийным), механической травме и при нарушениях нервномышечной передачи (например, при ботулизме, миастениях, действии ядов, токсинов, аминогликозидных антибиотиков и др.). † Проявления. ‡ Снижение мышечного тонуса (гипотония). Мышцы наощупь дряблые, вялые. ‡ Избыточность пассивных движений в парализованной конечности. ‡ Гипо или арефлексия — снижение или отсутствие сегментарных рефлексов: сухожильных, надкостничных, кожных и др. ‡ Гипо или атрофия мышц. Формируется вследствие длительного бездействия мышц, а также в результате выпадений нейротрофических влияний на них. ‡ Дегенерация мышечных волокон с замещением их жировой и соединительной тканью. ‡ Снижение возбудимости мышц. Развивается в связи с дистрофией (реакция «перерождения» мышцы). Экстрапирамидные параличи и парезы. † Причина: поражение экстрапирамидной системы. † Проявления. ‡ Повышение тонуса мышц по ригидному типу. При этом отмечается примерно одинаковое одновременное повышение тонуса сгибателей и разгибателей, пронаторов и супинаторов. ‡ Ригидность мышц (ригидный паралич). ‡ Появление постуральных, позотонических рефлексов. Они наблюдаются при изменении позы тела (например, нистагм глаз или головы при вращении телом). ‡ Каталепсия — длительное застывание туловища или конечности в приданном ему положении, снижение темпа и координации движений. ‡ В отличие от центральных параличей, при экстрапирамидных не наблюдается патологических рефлексов и выраженной гиперрефлексии. Миастенические гипокинезии. К нервно-мышечным (миастеническим, синаптическим) гипокинезиям относятся миастения тяжёлая псевдопаралитическая (myasthenia gravis) и другие миастенические синдромы (в частности, ЛамбертаИтона). † Причина: нарушение синаптической передачи в холинергических нервно–мышечных синапсах — от терминалей двигательных нервных волокна к скелетным мышечным волокнам. † Механизмы. ‡ Блокада постсинаптических холинорецепторов АТ к ‡ Снижение ответа мышечного волокна на ацетилхолин в связи с уменьшением чувствительности (гипосенситизацией) холинорецепторов. † Проявления: мышечная слабость (миастения) разной степени выраженности, быстрая утомляемость мышц при физической нагрузке. • Гиперкинезии. Гиперкинезы — увеличение объёма и количества непроизвольных движений — развиваются вследствие поражения нейронов различных структур головного мозга (экстрапирамидной системы, таламуса, субталамического ядра, зубчатого ядра мозжечка, красного ядра, коры и их систем связи). С учётом различных критериев выделяют несколько типов гиперкинезий (рис. 28–7). 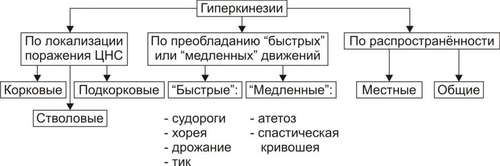 Рис. 28–7. Виды гиперкинезии. † В зависимости от локализации поражённых структур мозга выделяют корковые, подкорковые и стволовые гиперкинезии. † В зависимости от распространённости процесса различают общие (генерализованные, с вовлечением нескольких или большинства групп мышц) и местные (локальные, характеризующиеся непроизвольным сокращением отдельных мышц или их волокон) гиперкинезы. † В зависимости от преобладания фазных (быстро сменяющихся) или тонических (медленных) компонентов сокращения различают быстрые и медленные гиперкинезы. Быстрые гиперкинезии. К быстрым гиперкинезам относят судороги, хорею, дрожания (тремор) и тики. † Судороги — внезапно возникающие, приступообразные или постоянные непроизвольные сокращения мышц различной интенсивности, продолжительности и распространённости. Выделяют клонические, тонические и смешанные судороги. ‡ Клонические. Кратковременные и нерегулярные сокращения отдельных групп мышц, следующие друг за другом через сравнительно небольшие промежутки времени. Возникают чаще всего в результате чрезмерного возбуждения коры больших полушарий или поражения структур пирамидной системы. Распространённые выраженные клонические судороги обозначают как конвульсии. ‡ Тонические. Длительные (до нескольких десятков секунд) мышечные сокращения, в результате которых происходит «застывание» туловища или конечностей в различных вынужденных положениях. Развиваются при чрезмерном возбуждении подкорковых структур и некоторых видах интоксикации (например, алкогольной, столбнячной, окисью углерода). При столбняке может развиться опистотонус. ‡ Смешанные (клоникотонические, тоникоклонические). Наблюдаются при коматозных и шоковых состояниях (например, при диабетической, печёночной или уремической коме; ожоговом или анафилактическом шоке). † Хорея — беспорядочные, быстрые, неритмичные, насильственные сокращения различных групп мышц. Наблюдается при длительной ишемии мозга (например, его сосудов), атеросклеротическом поражении, ревматическом энцефалите, черепномозговых травмах. Может иметь наследственное происхождение (например, хорея Хантингтона). † Тремор — гиперкинез дрожательного типа. Характеризуется непроизвольными, стереотипными ритмическими колебательными движениями тела или его частей в результате повторяющихся сокращений и расслаблений мышц. Возникает преимущественно при поражении ствола мозга. Наблюдается при органических поражениях головного мозга (рассеянном склерозе, болезни Уилсона–Коновалова, энцефалите, расстройстве кровоснабжения), экзогенной интоксикации организма (алкоголем, ртутью, морфином). † Тик — быстрые непроизвольные стереотипные сокращения мышцы или групп мышц, обусловливающие насильственные движения (например, мигание, прищуривание глаз, жестикуляция). Наблюдаются в основном при поражении экстрапирамидной системы в результате энцефалита, интоксикаций, в том числе ЛС (например, при употреблении психофармакологических средств), а также при некоторых психических расстройствах. Медленные гиперкинезии. Медленные гиперкинезы представлены атетозом и спастической кривошеей. † Атетоз — непроизвольные стереотипные, медленные червеобразные вычурные движения, возникающие в результате одновременной длительной активации мышц агонистов и антагонистов. Чаще всего поражаются дистальные отделы конечностей пальцев рук и стоп. Развиваются при поражении стриарной системы (хвостатого ядра, скорлупы) при энцефалите, нарушениях мозгового кровообращения, черепномозговых травмах, опухолях подкорковых отделов головного мозга. † Спастическая кривошея — деформация шеи и неправильное положение головы (наклон в одну сторону) в результате длительного нейрогенного сокращения — спазма мышц шеи. Нейрогенная кривошея наблюдается в результате поражения головного мозга (например, отёке, кровоизлиянии, опухоли) в области tentorium cerebelli, заднего мозга. Нередко является результатом родовой травмы (ротационного подвывиха первого шейного позвонка) у детей. • Атаксии. Атаксии — локомоторные расстройства, характеризующиеся нарушением пространственной и временной координации произвольных движений. При этом сила мышц практически не изменена. Координация движений достигается при взаимодействии различных структур: мозжечка, спинного мозга, лобных отделов коры головного мозга, среднего мозга, таламуса, лабиринта. † Причины: поражение путей проприоцептивной чувствительности (с развитием сенситивной атаксии), повреждение мозжечка (с развитием мозжечковой атаксии), поражение лобной и височной областей коры головного мозга (с развитием корковой атаксии), повреждение вестибулярного аппарата (с развитием вестибулярной атаксии). † Виды атаксий. По локализации основного поражения различают несколько видов атаксий (рис. 28–8).  Рис. 28–8. Виды атаксии в зависимости от локализации поражения. ‡ Сенситивная атаксия (заднестолбовая). |
