Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
Этиология Основные причины и условия, способствующие возникновению и развитию, подагры представлены на рис. 9–4. 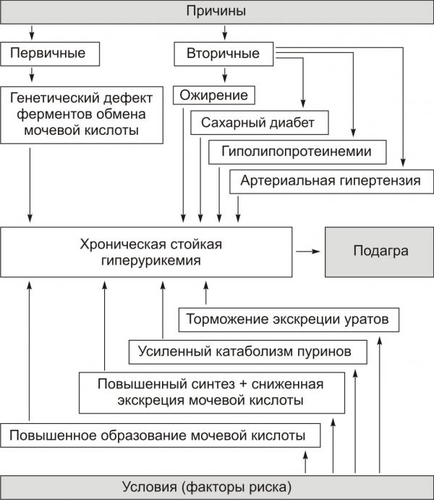 Рис. 9–4. Основные этиологические факторы подагры. Факторы риска • Повышенное образование в организме мочевой кислоты (например, при недостаточности гипоксантин гуанин фосфорибозилтрансферазы, избытке пуринов в пище при употреблении большого количества мяса, молока, икры, рыбы, кофе, какао, шоколада и др.). • Увеличение катаболизма пуриновых нуклеотидов с образованием избытка уратов (например, при применении цитостатиков у пациентов с новообразованиями; массированном апоптозе у пациентов с болезнями иммунной аутоагрессии; распаде АТФ в результате интенсивной мышечной нагрузки). • Торможение выведения мочевой кислоты с мочой (например, при почечной недостаточности, выраженном ацидозе). • Повышенный синтез мочевой кислоты при одновременном снижении выведения её из организма (например, при злоупотреблении алкоголем, развитии шоковых состояний, гликогенозе с недостаточностью глюкозо–6фосфатазы). Патогенез подагры Наиболее важные звенья патогенеза подагры представлены на рис. 9–5. 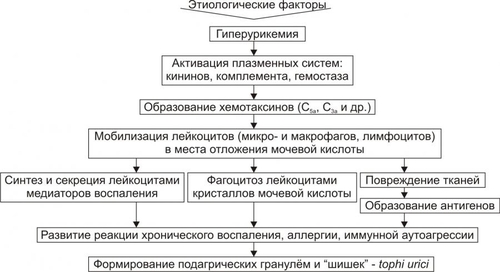 Рис. 9–5. Основные звенья патогенеза подагры. • Избыток уратов в плазме крови и межклеточной жидкости активирует системы комплемента (с образованием факторов хемотаксиса, например, C5а и C3а), кининов, гемостаза. • Хемотаксические вещества мобилизуют из циркулирующей крови лейкоциты, в том числе фагоцитирующие. Они накапливаются в местах максимальной концентрации мочевой кислоты, образующей кристаллы: в коже, почках, хрящах, в околосуставных тканях. • Микро- и макрофаги поглощают кристаллы мочевой кислоты (особенно после адгезии на них Ig). Это обусловливает активацию фагоцитов и высвобождение ими: † Медиаторов воспаления (включая биогенные амины, Пг, лейкотриены, ферменты). † Реактивных форм кислорода, свободных радикалов и перекисей веществ. • Фагоцитирующие клетки высвобождают также провоспалительные цитокины (ИЛ1, ИЛ6, ИЛ8, ФНО • Повреждение клеток и неклеточных элементов уратами, медиаторами воспаления, цитотоксическими лейкоцитами сопровождается образованием антигенных структур, что активирует реакции иммунной аутоагрессии и аллергии. • В зоне отложения уратов скапливается большое количество лейкоцитов (полиморфноядерных нейтрофилов, мононуклеарных фагоцитов, лимфоцитов), эпителиоидных и гигантских макрофагоподобных клеток, фибробластов. Постепенно образуются подагрические гранулемы и подагрические «oeoee» — tophi urici. • Tophi urici формируются вокруг составов (чаще — ступней, голеностопных, локтевых, лучезапястных, в почках, коже, хрящах ушных раковин. Проявления подагры • Постоянно повышенная концентрация мочевой кислоты в плазме крови и моче. • Воспаление различных суставов (чаще моноартриты). • Лихорадка. • Сильная боль в зоне накопления уратов (может иметь характер длительных эпизодов: до 2–3 сут). • Повторное появление тофусов. • Признаки почечной недостаточности. • Нефро и уролитиаз, рецидивирующие пиелонефриты. • Изменения в почках завершаются нефросклерозом, почечной недостаточностью, уремией. ГИПОУРИКЕМИЯ Гипоурикемия — состояние, характеризующееся снижением концентрации мочевой кислоты в крови ниже нормы. Возможная причина: недостаточность ксантиноксидазы и/или сульфитоксидазы (см. статью «Недостаточность ферментов» в приложении «Справочник терминов» на компакт диске). Проявления • Образование кристаллов ксантина и конкрементов в ткани почек, вокруг суставов, в мышцах. • Мышечные судороги и нистагм (обусловлены миозитами, поражением центральных и периферических нейронов, а также нервных стволов).
Липиды — разнородные по химическому составу вещества. В организме человека имеются разнообразные липиды: жирные кислоты, фосфолипиды, холестерин, триглицериды, стероиды и др. Потребность человека в жирах колеблется в диапазоне 80-100 г в сутки. Функции липидов • Структурная: Липиды составляют основу клеточных мембран. • Регуляторная. † Липиды регулируют проницаемость мембран, их коллоидное состояние и текучесть, активность липидозависимых ферментов (например, аденилат и гуанилатциклаз, Na+,K+АТФазы, Ca2+АТФазы, цитохромоксидазы), активность мембранных рецепторов (например, для катехоламинов, ацетилхолина, инсулина, цитокинов). † Отдельные липиды — БАВ (например, Пг, лейкотриены, фактор активации тромбоцитов, стероидные гормоны) — регулируют функции клеток, органов и тканей. • Энергообеспечивающая. Липиды являются одним из главных источников энергии для поперечнополосатой мускулатуры, печени, почек и дополнительным источником энергии для нервной ткани. • Защитная. В составе подкожной клетчатки липиды образуют буферный слой, защищающий мягкие ткани от механических воздействий. •Изолирующая. Липиды создают термоизолирующую прослойку в поверхностных тканях организма и электроизолирующую оболочку вокруг нервных волокон. ТИПОВЫЕ ФОРМЫ ПАТОЛОГИИ Типовые формы патологии липидного обмена представлены на рис. 10–1. 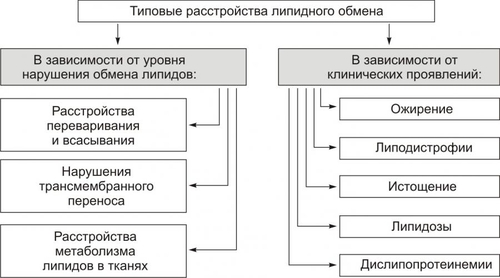 Рис. 10–1. Типовые формы патологии липидного обмена. • В зависимости от уровня нарушений метаболизма липидов выделяют расстройства: † Переваривания и всасывания липидов в ЖКТ (например, в результате дефицита липаз поджелудочной железы, нарушения желчеобразования и желчевыделения, расстройств полостного и «мембранного» пищеварения). † Трансмембранного переноса липидов из кишечника в кровь и утилизации их клетками (например, при энтеритах, нарушении кровообращения в стенке тонкого кишечника). † Метаболизма липидов в тканях (например, при дефекте или недостаточности липаз, фосфолипаз, ЛПЛазы). • В зависимости от клинических проявлений различают ожирение, истощение, дислипопротеинемии, липодистрофии и липидозы. ОЖИРЕНИЕ Нормальное содержание жировой ткани у мужчин составляет 15–20% массы тела, у женщин — 20–30%. Ожирение — избыточное (патологическое) накопление жира в организме в виде триглицеридов. При этом масса тела увеличивается более чем на 20–30%. По данным экспертов ВОЗ, в развитых странах Европы избыточную массу тела имеют от 20 до 60% населения, в России — около 60%. Само по себе увеличение массы жировой ткани не представляет опасности для организма, хотя и снижает его адаптивные возможности. Однако, ожирение увеличивает риск возникновения ИБС (в 1,5 раза), атеросклероза (в 2 раза), гипертонической болезни (в 3 раза), СД (в 4 раза), а также некоторых новообразований (например, рака молочной железы, эндометрия и простаты). ВИДЫ ОЖИРЕНИЯ Основные виды ожирения приведена на рис. 10–2. 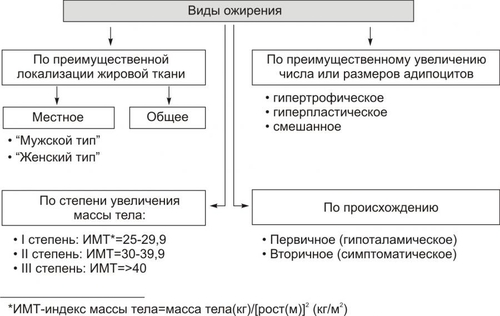 Рис. 10–2. Виды ожирения. ИМТ — индекс массы тела (см. в тексте). • В зависимости от степени увеличения массы тела выделяют три степени ожирения. При этом применяют понятие «идеальная масса тела». Для оценки идеальной массы тела используют различные формулы. † Наиболее простая — индекс Брока: из показателя роста (в см) вычитают 100. † Индекс массы тела вычисляют также по следующей формуле: Масса тела считается нормальной при индексе массы тела в диапазоне 18,5–24,9. При превышении этих значений говорят об избыточной массе тела (табл. 10–1). Таблица 10–1. Степени ожирения
Примечание. ИМТ — индекс массы тела • По преимущественной локализации жировой ткани различают ожирение общее (равномерное) и местное (локальная липогипертрофия). Разновидности местного ожирения: † Женский тип (гиноидный) — избыток подкожного жира преимущественно в области бёдер и ягодиц. † Мужской тип (андроидный) — накопление жира в области живота. • По преимущественному увеличению числа или размеров жировых клеток выделяют: † Гиперпластическое ожирение (за счёт преимущественного увеличения числа адипоцитов). Оно более устойчиво к лечению и в тяжёлых случаях требует хирургического вмешательства по удалению избытка жира. † Гипертрофическое (за счёт преимущественного увеличения массы и размеров адипоцитов). Оно чаще наблюдается после 30 лет. † Гиперпластическогипертрофическое (смешанное). Нередко выявляется и в детском возрасте. • По генезу выделяют первичное ожирение и вторичные его формы. † Первичное (гипоталамическое) ожирение — результат расстройств системы регуляции жирового обмена (липостата) —самостоятельное заболевание нейроэндокринного генеза. † Вторичное (симптоматическое) ожирение — следствие различных нарушений в организме, обусловливающих: ‡ снижение энергозатрат (и следовательно — расхода триглицеридов жировой ткани), ‡ активацию синтеза липидов — липогенеза (наблюдается при ряде заболеваний, например, при СД, гипотиреозе, гиперкортицизме). ПРИЧИНЫ ОЖИРЕНИЯ • Причина первичного ожирения — нарушение функционирования системы «адипоциты — гипоталамус». Это является результатом дефицита и/или недостаточности эффектов лептина (по подавлению выработки нейронами гипоталамуса нейропептида Y, который повышает аппетит и чувство голода). • Вторичное ожирение развивается при избыточной калорийности пищи и пониженном уровне энергозатрат организма. Энергозатраты зависят от степени активности (прежде всего физической) и образа жизни человека. Недостаточная физическая активность является одной из важных причин ожирения. ПАТОГЕНЕЗ ОЖИРЕНИЯ Выделяют нейрогенные, эндокринные и метаболические механизмы возникновения ожирения. • Нейрогенные варианты ожирения Нейрогенные (центрогенный и гипоталамический) механизмы ожирения представлены на рис. 10–3. 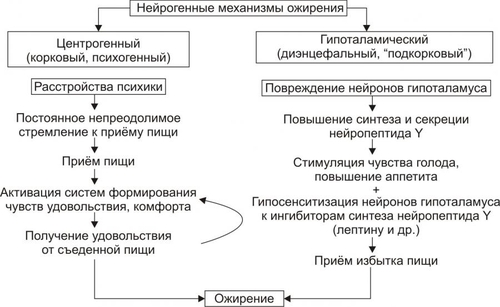 Рис. 10–3. Нейрогенные механизмы ожирения. † Центрогенный (корковый, психогенный) механизм — один из вариантов расстройства пищевого поведения (два других: неврогенная анорексия и булимия). Причина: различные расстройства психики, проявляющиеся постоянным, иногда непреодолимым стремлением к приёму пищи. Возможные механизмы: ‡ активация серотонинергической, дофаминергической, опиоидергической и других систем, участвующих в формировании ощущений удовольствия и комфорта; ‡ восприятие пищи как сильного положительного стимула (допинга), что ещё более активирует указанные системы — замыкается порочный круг центрогенного механизма развития ожирения. † Гипоталамический (диэнцефальный, подкорковый) механизм. Его причина — повреждение нейронов вентромедиального и паравентрикулярного ядер гипоталамуса (например, после сотрясения мозга, при энцефалитах, краниофарингиоме, метастазах опухолей в гипоталамус). Наиболее важные звенья патогенеза: ‡ Спонтанное (без выясненной причины) повышение синтеза и секреции нейропептида Y нейронами заднелатерального вентрального ядра гипоталамуса. ‡ Повреждение или раздражение нейронов вышеназванного ядра также стимулирует синтез и секрецию нейропептида Y и снижает чувствительность к факторам, ингибирующим синтез нейропептида Y (главным образом — к лептину). § Нейропептид Y стимулирует чувство голода и повышает аппетит. § Лептин подавляет образование стимулятора аппетита — нейропептида Y. ‡ Нарушение участия гипоталамуса в формировании чувства голода. Это чувство формируется при снижении ГПК, сокращении мышц желудка при эвакуации пищи и его опорожнении (чувство пищевого дискомфорта — «сосёт под ложечкой»). Информация от периферических чувствительных нервных окончаний интегрируется в нервных ядрах гипоталамуса, ответственных за пищевое поведение. ‡ В результате вышеназванных процессов усиливается выработка нейромедиаторов и нейропептидов, формирующих чувство голода и повышающих аппетит (ГАМК, дофамина, β-эндорфина, энкефалинов) и/или нейромедиаторов и нейропептидов, формирующих чувство сытости и угнетающих пищевое поведение (серотонина, норадреналина, холецистокинина, соматостатина). • Эндокринные варианты ожирения Эндокринные механизмы ожирения — лептиновый, гипотиреоидный, надпочечниковый и инсулиновый — представлены на рис. 10–4. 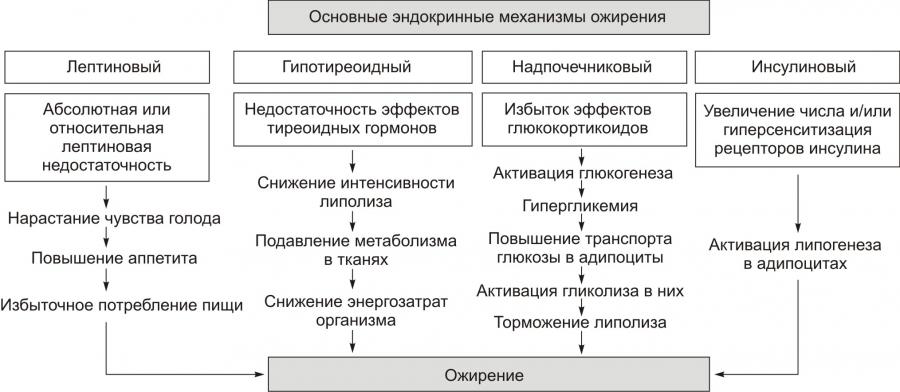 Рис. 10–4. Патогенез ожирения. † Лептиновый механизм — ведущий в развитии первичного ожирения. ‡ Лептин образуется в жировых клетках. Он уменьшает аппетит и повышает расход энергии организмом. Уровень лептина в крови прямо коррелирует с количеством белой жировой ткани. Рецепторы к лептину имеют многие клетки, в том числе — нейроны вентромедиального ядра гипоталамуса. Лептин подавляет образование и выделение гипоталамусом нейропептида Y. ‡ Нейропептид Y формирует чувство голода, повышает аппетит, снижает энергорасходы организма. Между гипоталамусом и жировой тканью существует своего рода отрицательная обратная связь: избыточное потребление пищи, сопровождающееся увеличением массы жировой ткани, приводит к усилению секреции лептина. Это (посредством торможения выработки нейропептида Y) ослабляет чувство голода. Однако, у тучных людей этот регуляторный механизм может быть нарушен, например, изза повышенной резистентности к лептину или мутации гена лептина. ‡ Липостат. Контур «лептиннейропептид Y» обеспечивает поддержание массы жировой ткани тела — липостата (или установочной точки организма в отношении интенсивности энергетического обмена). Помимо лептина, в систему липостата включены инсулин, катехоламины, серотонин, холецистокинин, эндорфины. † Гипотиреоидный механизм ожирения является результатом недостаточности эффектов йодсодержащих гормонов щитовидной железы. Это снижает интенсивность липолиза, скорость обменных процессов в тканях и энергетические затраты организма. † Надпочечниковый (глюкокортикоидный, кортизоловый) механизм ожирения активируется вследствие гиперпродукции глюкокортикоидов в коре надпочечников (например, при болезни или синдроме ИценкоКушинга). Под влиянием избытка глюкокортикоидов активизируется глюконеогенез (в связи с этим развивается гипергликемия), транспорт глюкозы в адипоциты, и гликолиз (происходит торможение липолитических реакций и накопление триглицеридов). † Инсулиновый механизм развития ожирения развивается вследствие прямой активации инсулином липогенеза в жировой ткани. † Другие механизмы. Ожирение может развиваться также при других эндокринопатиях (например, при дефиците СТГ и гонадотрофных гормонов). Механизмы развития ожирения при этих состояниях описаны в главе 27 «Эндокринопатии»). • Метаболические механизмы ожирения † Запасы углеводов в организме относительно малы. Они примерно равны их суточному приёму с пищей. В связи с этим выработался механизм экономии углеводов. † При повышении в рационе доли жиров скорость окисления углеводов снижается. Об этом свидетельствует соответствующее уменьшение дыхательного коэффициента (отношение скорости образования CO2 к скорости потребления O2). † Если этого не происходит (при расстройстве механизма ингибирования гликогенолиза в условиях высокой концентрации жиров в крови), активируется механизм, обеспечивающий повышение аппетита и увеличение приёма пищи, направленное на обеспечение необходимого количества в организме углеводов. † В этих условиях жиры накапливаются в виде триглицеридов. Развивается ожирение. ИСТОЩЕНИЕ Истощение и кахексия — патологическое снижение массы жировой ткани ниже нормы. Одновременно значительно снижается масса мышечной и соединительной ткани. При истощении дефицит жировой ткани может составлять 20–25% и более (при индексе массы тела ниже 20 кг/м2), а при кахексии — ниже 50%. Причины и виды истощения и кахексии Различают эндогенные и экзогенные причины истощения. • Экзогенные причины † Вынужденное или осознанное полное либо частичное голодание (в последнем случае чаще всего — с целью похудания). ‡ Полное голодание — состояние, при котором в организм не поступают продукты питания (например, при их отсутствии, отказе от еды, невозможности приёма пищи). ‡ Неполное голодание — состояние, характеризующееся значительным дефицитом пластических веществ и калорий в пище (например, при неполноценном количественно и качественно питании, однородной пище, вегетарианстве). † Низкая калорийность пищи, не восполняющая энергозатрат организма. • Эндогенные причины Истощение эндогенного генеза подразделяют на первичное и вторичное. † Причины первичного (гипоталамического, диэнцефального) истощения рассмотрены на рис. 10–5. 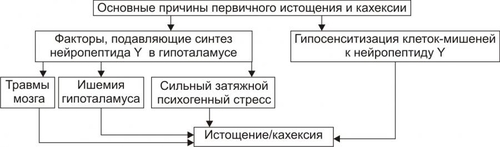 Рис. 10–5. Основные причины первичного истощения и кахексии. † Причины вторичного (симптоматического) истощения приведены на рис. 10–6. 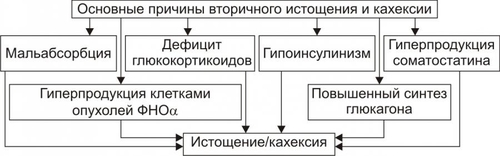 Рис. 10–6. Основные причины вторичного истощения и кахексии. |
