Издательский дом Питер
 Скачать 5.79 Mb. Скачать 5.79 Mb.
|
|
7.5. Принципы производства гемокомпонентов Существует два пути получения компонентов крови: — разделение цельной крови (рис. 23); — селективный аферез. Основной принцип выделения компонентов крови — различие их плотности (табл. 84). 332 Глава 7. Трансфузионные среды 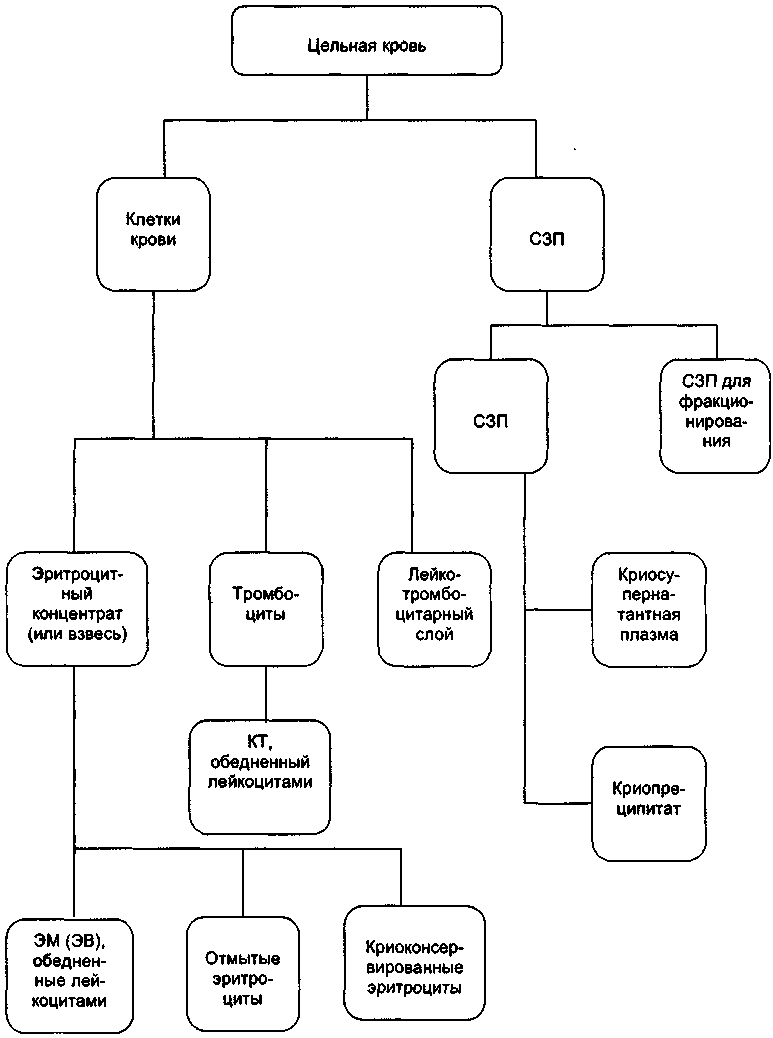 Рис. 23. Схема разделения цельной крови на компоненты. Принципы производства гемокомпонентов 333 Таблица 84 Средние величины плотности и объема основных составляющих крови
Другие факторы, использующиеся для разделения составляющих крови: — размер клеток; — пластичность клеток; — адгезивные свойства клеток; — вязкость среды. Традиционная система для производства гемокомпонентов состоит из первичного гемоконтейнера и присоединенных к нему посредством соединительных трубок одного или нескольких контейнеров. Конфигурация системы зависит от типа необходимых гемокомпонентов. В традиционном первичном гемоконтейнере с одной стороны располагаются входной (для донорской крови) и несколько выходных портов (рис. 24). Жидкая составляющая содержимого с донорской кровью — смесь плазмы и гемоконсерванта. В процессе центрифугирования эритроциты и лейкоциты осаждаются, и в верхней половине контейнера остается плазма, обогащенная тромбоцитами. Далее происходит седиментация тромбоцитов и сосредоточение лейкоцитов в верхней части эритроцитной массы. Скорость этого процесса прямо пропорциональна квадрату оборотов ротора в минуту и расстоянию клетки от центра ротора, т. е. величине «центрифужного поля» (синонимы — «фактор разделения», «относительная центробежная сила»). Центрифужное поле (g) можно вычислить по формуле: g= 1118х 10-8xRxN2, где R (см) — радиус от центра ротора до точки, в которой необходимо вычислить центрифужное поле, N (об/мин) — скорость вращения ротора. Поскольку параметр R вариабелен у различных моделей центрифуг, а скорость вращения ротора может быть задана произвольно, то при описании режима получения гемокомпонентов используют величину g и время центрифугирования . По окончании центрифугирования бесклеточная плазма находится в верхней части контейнера, а концентрат эритроцитов — в нижней. Тромбоциты сосредоточены на поверхности эритроцитов, а лейкоциты чуть ниже — в верхних 10 мл эритроцитной массы. Клетки-предшественники периферической. 334 Глава 7. Трансфузионные среды 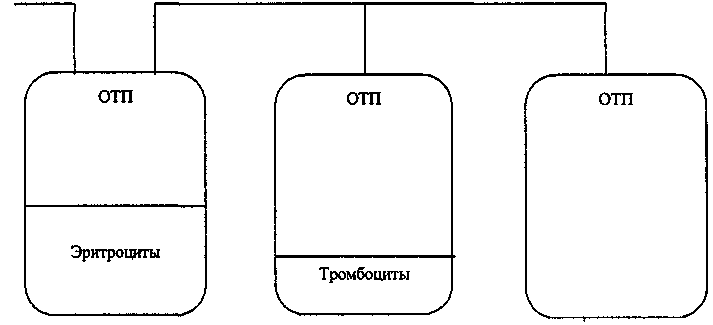 Рис. 24. Схема разделения цельной крови на компоненты с выделением тромбоцитов из обогащенной тромбоцитами плазмы (ОТП). крови расположены среди обычных мононуклеарных клеток (моноцитов и лимфоцитов). Выбор режима центрифугирования определяется задачей — какой гемо-компонент необходимо получить. Так, если нужна обогащенная тромбоцитами плазма, то центрифугирование следует прекратить до начала седиментации тромбоцитов, соответственно скорость центрифугирования должна быть невысока. При необходимости получения бесклеточной плазмы и концентрата эритроцитов целесообразен более жесткий режим центрифугирования (табл. 85). Очень важно для каждой конкретной центрифуги подобрать оптимальный режим (от включения до остановки) разделения крови и регулярно проводить мониторинг качества ее работы. Современные рефрижераторные низкоскоростные центрифуги, специально предназначенные для службы крови (например, Sorvall RC-3C+ и RC-3BP, Sorvall, США), снабжены несколькими роторами и адаптерами и позволяют учреждениям службы крови эффективно решать поставленные перед ними задачи: — фракционировать кровь на клеточные компоненты и плазму; — получать криопреципитат из антигемофильной плазмы; — разделять осадки при производстве препаратов плазмы; — центрифугировать пробирки с образцами донорской крови. Важная эргономическая характеристика центрифуги — уровень шума (не более 60 дБ), позволяющий эксплуатировать центрифуги не в специальных, а в общих рабочих помещениях. Для различных режимов работы нужен ротор, позволяющий одновременно центрифугировать: Принципы производства гемокомпонентов____________________335 Таблица 85 Центрифугирование при приготовлении компонентов крови
Примечание. Время включает время разгона, но не время остановки. Периоды времени даны лишь приблизительно. У каждой отдельной центрифуги следует оценить возможность ее использования для приготовления различных компонентов. — от 2 до 12 одинарных, сдвоенных, строенных контейнеров (до 450 мл цельной крови в одном контейнере, дополнительные пустые); — от 2 до б счетверенных контейнеров по 450 мл в каждом. Пластиковые адаптеры (разделенные и неразделенные) позволяют центрифугировать различные типы пластиковых контейнеров, не вынимая из центрифуги тяжелые металлические стаканы. Целесообразно иметь 2 и более комплекта адаптеров — один комплект с продукцией центрифугируется, другой в это время загружается контейнерами и уравновешивается. В табл. 86 представлены 5 различных методических подходов к первичному разделению цельной крови и состав полученных гемокомпонентов. При последующем обращении (переработке) гемокомпонентов всегда следует учитывать, каким образом было выполнено первичное разделение крови. Очень важно четко отслеживать границу между компонентами крови. При работе на ручном плазмоэкстракторе опытный сотрудник может сделать это визуально. Существуют автоматические плазмоэкстракторы, которые электронным образом контролируют светопропускание в трубке, соединяющей контейнеры, и активируют зажимы, останавливая разделение (см. раздел 8.1.8.). Во второй половине 1980-х гг. С. F. Hogman и соавт. разработали оригинальную систему разделения крови «top and bottom» с выходными портами в верхней и нижней частях первичного гемоконтейнера (рис. 25). После центрифугирования в первичном гемоконтейнере остается ЛТС, плазма переводится в сателлитный контейнер, присоединенный к верхнему порту, а концентрат эритроцитов через нижний порт — в контейнер со взвешивающим раствором. Принципы центрифугирования используются и в аппаратах плазмоцита-фереза. 336 Глава 7. Трансфузионные среды Таблица 86 Пять различных методов первичного разделения цельной крови и примерные составляющие (для стандартной дозы крови 450 ± 45 мл с 60-70 мл гемоконсерванта)
В большинстве аппаратов для плазмоцитафереза центробежная сила разделяет кровь на компоненты на основании разницы в их плотности. Во время удаления из организма донора или пациента цельной крови к ней добавляется определенное количество антикоагулянта. Кровь закачивается во вращающуюся чашу, камеру или трубчатый ротор, в котором происходит разделение слоев компонентов. Необходимая фракция отводится, а остающиеся элементы возвращаются донору (или пациенту) прерывистым или постоянным потоком. Для всех подобных систем требуются заранее приготовленные наборы стерильных контейнеров, трубок и устройств для центрифугирования, подходящих к конкретному аппарату. Каждый аппарат имеет механизм, позволяющий делительному устройству вращаться без скручивания присоединенной трубки. 337 Принципы производства гемокомпонентов 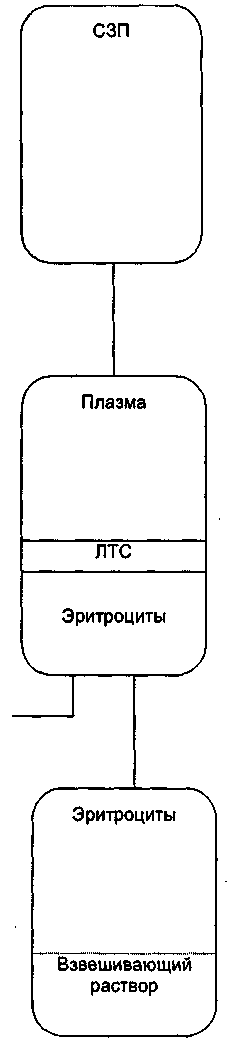 Рис. 25. Схема разделения цельной крови на компоненты с использованием системы «top and bottom». 338__________________________Глава 7. Трансфузионные среды В качестве примера можно привести аппарат MCS+ (Haemonetics, США) (рис. 26), в котором используется принцип прерывистого потока через цент-рифужную разделительную камеру, именуемую колоколом. В колоколе происходит разделение крови на составляющие в зависимости от массы под действием центробежной силы. В честь изобретателя разделительной камеры ей присвоено название Latham-колокол. С помощью этой системы аппарат MCS+ способен выделять любые клеточные компоненты крови при донорском или лечебном аферезе. Каждый компонент, выходящий из колокола, проходит через оптический сенсор, определяющий оптическую плотность среды, в результате чего оператором заранее может быть запрограммировано получение различных компонентов, таких как плазма, тромбоциты, лимфоциты, гранулоциты, стволовые клетки и др. Аппарат забирает небольшое (125 или 225 мл — в зависимости от объема центрифужного колокола) количество крови донора или пациента, концентрирует ее и собирает заданный компонент, а оставшаяся кровь возвращается в кровеносное русло, после чего начинается следующий цикл. Количество циклов и конечный объем продукта программируются оператором. Рис. 26. Схема выделения компонентов крови на аппарате MCS+ (Haemonetics, США). Использование уникальной конструкции Latham-колокола в сочетании с высокоточным оптическим сенсором позволяет выделять клетки из малого объема экстракорпоральной крови. 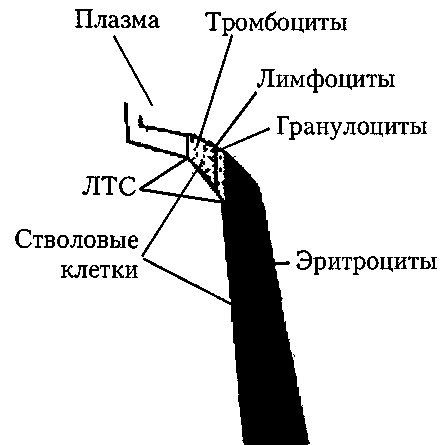 Принципы производства гемокомпонентов ___ _____________339 MCS+ оснащен встроенным гемокалькулятором, который позволяет оператору оптимизировать процесс афереза в зависимости от пола, массы и роста донора или пациента путем расчета ОЦК и подбора наиболее благоприятных параметров работы (скорости взятия и возврата крови, давления в манжете, количество циклов и т.д.). Также MCS+ снабжен высокочувствительным датчиком давления, контролирующим взятие и возврат крови, что очень важно при работе с донорами или пациентами с ограниченным венозным доступом и невозможностью проведения процедуры на других аппаратах. Основные фирмы, производящие клеточные сепараторы: Haemonetics, Fenwal, Cobe, Dideco, Fresenius. В различных аппаратах используются три метода. 1. Метод прерывистого потока. Контейнер центрифуги заполняется и опорожняется в разное время, при этом для удаления и возврата крови используется один и тот же венозный доступ. 2. Метод постоянного потока. Используется два венозных доступа: один для удаления, а другой для возврата. 3. Метод мембранной фильтрации. Фильтрация плазмы через мембрану позволяет провести донорский или лечебный плазмаферез, но не разделение клеточных элементов. В этих устройствах цельная кровь протекает сквозь мембрану, содержащую отверстия определенного размера. Более высокое давление в крови по сравнению с фильтратом продавливает составляющие плазмы, размер которых меньше величины пор, через мембрану в фильтрат. В большинстве устройств мембрана расположена так, что волокна образуют полость, однако в некоторых устройствах мембрана представляет собой плоские пластинки. В силу особых свойств внутренней поверхности мембраны клеточные элементы отталкиваются в ламинарный ток крови, при этом не происходит активации тромбоцитов и укорочения периода жизни эритроцитов. Плазма проникает сквозь основной слой мембраны и оттекает под прямым углом. Изменение величины пор позволяет ранжировать разделение удаляемых белков плазмы. В зависимости от вида процедуры и используемого устройства, время варьирует от 20 мин до 2 ч. Каждый производитель прилагает подробную информацию и протоколы операций. Сравнительная характеристика основных разновидностей вариантов плаз-мафереза представлена в табл. 87. В России основным методом получения донорской плазмы остается метод центрифугирования, с помощью которого в 1999 г. было получено 56,3 % плазмы, спонтанное оседание составляет 14,4 %, сепарирование — 3,7 %, методом прерывистого плазмафереза получено 23,4 %, аппаратного — 3,2 %. К сожалению, аппаратный метод плазмафереза, наиболее прогрессивный и ат- 340 Глава 7. Трансфузионные среды Таблица 87 Сравнительная характеристика основных разновидностей вариантов плазмафереза [Соколов А. А. и соавт., 2000]
* Зависит от характеристик плазмофильтра. ** Периферическая вена. *** Плазмофильтрация с использованием периферических вен возможна только при применении некоторых низкопоточных плазмофильтров (PF 1000, ПФМ 800). Криоконсервирование клеток крови и костного мозга 341 равматичный для донора, в последние два года получает обратное развитие, вследствие отсутствия средств у учреждений службы крови на закупку комплектующего оборудования (рис. 27). Официально утвержденная в России номенклатура гемотрансфузионных сред и другой продукции службы крови представлена в табл. 88. |
