Издательский дом Питер
 Скачать 5.79 Mb. Скачать 5.79 Mb.
|
|
7.6. Криоконсервирование клеток крови и костного мозга В основе консервирующего действия низких температур лежит их способность замедлять или полностью останавливать обменные процессы в живых клетках, сохранять при определенных условиях их морфологическую структуру и функциональные свойства в течение длительных сроков. Однако простое замораживание, как правило, не обеспечивает сохранения структуры и жизнеспособности клеток, которые при этом разрушаются частично или полностью. Наиболее важную роль в повреждении клеток играют обезвоживание клеток, осмотический стресс, механическая травматизация кристаллами льда. Наиболее тяжелые повреждения возникают в клетках во время замораживания и отогрева. Известны вещества (криопротекторы, криофилактики), защищающие клетки от повреждения при замораживании. Механизм защитного действия кри-офилактических веществ основан на их способности образовывать молекулярные связи с водой и этим самым изменять процессы образования и структуру кристаллов воды при замерзании, препятствовать росту концентрации солей в клетках и их обезвоживанию. Криозащитные вещества делят на три группы: — эндоцеллюлярные (способные проникать в клетку); — экзоцеллюлярные (не проникающие в клетку); — комбинированного действия. Защитный эффект внутриклеточных криофилактиков (глицерин, этилен-гликоль, пропиленгликоль, диметилсульфоксид, диметилацетамид) может быть представлено следующим образом: — обладая низкой молекулярной массой, легко проникают в клетку, связывают воду, изменяют кристаллообразование (при замораживании образуются преимущественно мелкие кристаллы); — являясь хорошими растворителями, снижают концентрацию солей внутри и вне клеток, чем предохраняют их от обезвоживания и уменьшают повреждение белковых структур клеток; 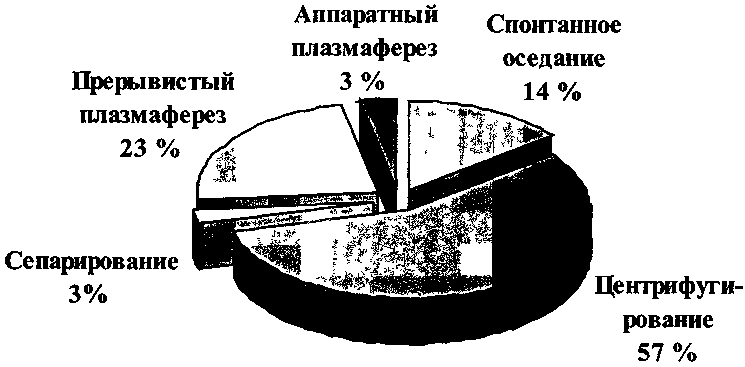 Рис. 27. Методы заготовки плазмы в России в 1999 г. 343 Криоконсервирование клеток крови и костного мозга Таблица 88 Номенклатура основной продукции, выпускаемой учреждениями службы крови из донорской крови
344__________________________Глава 7. Трансфузионные среды — образуют связи со структурными компонентами мембраны клеток, что ведет к снижению степени ее повреждения при замораживании. В группу криофилактиков внеклеточного действия входят поливинилпир-ролидон и гидроксиэтилкрахмал. Механизм действия этих веществ основывается на их способности образовывать прочные связи с внеклеточной водой, замедлять скорость образования кристаллов и изменять их структуру, взаимодействовать с мембраной клеток, следствием чего является повышение ее устойчивости к повреждающему действию кристаллов. Преимуществом криопротекторов этой группы является отсутствие необходимости отмывания клеток. Размороженные клетки крови переливают либо вместе с криофилактиком, либо после удаления части его (после предварительного центрифугирования). Однако по своей криопротективиой активности экзоцеллюлярные криофилактики уступают эндоцеллюлярным. К криофилактикам комбинированного типа относятся ПЭО-400, «Гем-жель» (сочетание растворов ПВП, глицерина и желатины). Механизм их защитного действия обеспечивается как внутри-, так и внеклеточным действием. Количество криофилактика, проникающего при этом в клетку, невелико, вследствие чего отмывания не требуется. Реально, в трансфузиологии используется ограниченное число криопротекторов: глицерин, ДМСО, ДМАЦ, пропиленгликоль и ПЭО. Для усиления криозащитного действия этих веществ в состав рецептур ограждающих растворов включают также некоторые другие компоненты (глюкозу, маннит, сахарозу, ЭДТА, хлорид натрия и др.) Научные исследования по созданию новых криофилактиков продолжаются. Определены требования, которым должны отвечать новые вещества такого предназначения: — быть недорогими и малотоксичными; — предупреждать холодовый шок клеток; — обладать высокой растворимостью в водных растворах электролитов; — связывать (структурировать) воду и обеспечивать ее мелкоструктурную кристаллизацию; — понижать активность осмотических процессов в клетках; — способствовать образованию низкоплавких эвтектических смесей. Криокопсервирование эритроцитов методом замораживания используется для хранения доз: — с редким фенотипом; — аутологичных; — при подготовке к чрезвычайным ситуациям. Общие проблемы применения криоконсервированпых гемотрансфузи-опных сред: — значительные трудозатраты и высокая стоимость; Криоконсервирование клеток крови и костного мозга______________345 — срок хранения после размораживания и отмывания — не более 24 ч (хотя есть перспективные разработки пластиковых систем, позволяющих производить отмывание глицерина в закрытой системе и хранить размороженные клетки в течение 35 сут). Существуют специальные технологии и аппаратура для всех этапов криоконсервирования: — внесения криопротектора; — замораживания; — хранения; — размораживания; — удаления криопротектора. Вследствие существенных различий в методиках криоконсервирования, особенностей аппаратуры в каждом случае следует не только придерживаться инструкций производителей, но разрабатывать инструкции с описанием действий, проводимых в конкретном подразделении. Для замораживания биоматериала по соответствующим программам с различными скоростями теплоотвода используются аппараты — программные замораживатели, позволяющие управлять процессом охлаждения контейнеров с клеточным материалом в широком диапазоне температур (от 30 °С до -196 °С). Эти аппараты работают по принципу регулируемой подачи жидкого азота и предназначены для криоконсервирования различных биообъектов. Для защиты пластиковых контейнеров в течение замораживания, хранения и оттаивания используют металлические емкости (холдеры). При использовании жидкого азота емкость специальных хранилищ составляет от 200 до 1000 л. При выборе необходимого типа хранилища оценивают технические и эксплуатационные характеристики: — количество размещаемых контейнеров для криоконсервирования; — температуру хранения биообъекта; — количество жидкого азота, необходимого для заполнения аппарата (кг); — испаряемость жидкого азота (кг/сут); — критическое время дозаправки (сут); — продолжительность непрерывной работы (годы); — срок эксплуатации (годы). К контейнерам, применяемым при криоконсервировании клеток крови и костного мозга, предъявляется целый ряд требований, наиболее важными из которых являются: — биологическая инертность материалов; — высокая механическая прочность в широком диапазоне температур; — большая теплопроводность; — равномерность охлаждения биоматериала; — герметичность контейнеров; 346__________________________Глава 7. Трансфузионные среды — технологичность; — невысокая стоимость. В нашей стране традиционно широко используются алюминиевые контейнеры емкостью 290 мл (для эритроцитов), 160, 75 и 50 мл (для других клеток), разработанные в 60-е гг. Эти контейнеры имеют ряд существенных недостатков: сложность подготовки контейнеров к повторному использованию, риск поступления в замораживаемую среду пирогенных и иных трудно удаляемых веществ из алюминия, а также техническая сложность и дороговизна производства. Полимерные контейнеры доступны для низкотемпературного консервирования, в них осуществляется заготовка крови от доноров. Во избежание механического повреждения перед замораживанием такие контейнеры с эритроцитами помещают в защитные пеналы-холдеры. Для размораживания биообъектов используют устройство, представляющее собой ванну с электроподогревом (40-45 °С) воды, в которую вмонтирована рамка с электроприводом для покачивания контейнеров в процессе размораживания. При отмывании клеток крови от криофилактика используются: — аппараты, работающие на принципе центрифугирования (аппарат РК-0,5; серия сепараторов «Haemonetics», США, и др.); — цитоагломераторы, работающие на принципе ускоренного осаждения путем обратимой агломерации клеток в слабокислых (рН 5,2-6,1) неэлектролитных растворах с низкой ионной силой. Также с целью удаления криофилактиков из клеточных суспензий используют метод серийного центрифугирования. Наряду с рядом криозащитных растворов (например, пропандиосаха-роль — на основе комбинации пропиленгликоля и сахарозы) для криокон-сервирования эритроцитов применяют глицерин в различных концентрациях (табл. 89). С. R. Valery и соавт. (2001) показали сохранение полноценности эритроцитов, замороженных с 40 % глицерином при -80 °С, в течение 37 лет. Оттаявшие клетки содержат высокую концентрацию глицерина, которая должна быть постепенно уменьшена во избежание гемолиза. Деглицерини-зация достигается отмыванием эритроцитов в серии растворов с понижающейся осмолярностью. Новым шагом в развитии метода криоконсервирования послужило создание автоматической системы для замораживания и отмывание эритроцитов «Haemonetics ACP-215» (Haemonetics, США). Этот аппарат позволяет стерильно добавлять и отмывать глицерин, а отмытые эритроциты 2 нед хранить в жидком состоянии в специальном взвешивающем растворе. В бельгийской армии внедрен метод получения двойной дозы эритроцитов методом цитафереза (Haemonetics MCS+), их криоконсервирования и 347 Криоконсервирование клеток крови и костного мозга Таблица 89 Методы криоконсервирования эритроцитов с глицерином
дальнейшей обработки на аппарате «Haemonetics ACP-215», хранения взвеси (Эритро-Сол) размороженных эритроцитов в течение 35 сут (Vandenvelde С., 2001). Таким образом, создан резерв резус-отрицательных эритроцитов группы О (I), использующихся в чрезвычайных и экстремальных ситуациях. Возможно, вследствие более сложного строения в процессе криоконсервирования тромбоциты повреждаются в большей степени по сравнению с эритроцитами. Тем не менее существует несколько протоколов, при которых в качестве криопротектора применяют ДМСО и ДМАЦ [Захаров В. В., 1998]. Оригинальный раствор на основе гексаметиленбистетраоксиэтил-мочевины — «Кримолит», предназначенный для криоконсервирования тромбоцитов, разработан в Кировском НИИ гематологии и переливания крови Минздрава РФ под руководством профессора Е. П. Сведенцова. Криоконсервирование позволяет создать запас аутологичных тромбоцитов и использовать их в период миелодепрессии после химиотерапии или после пересадки костного мозга. Аналогичный подход разработан для кардиохирургических пациентов, у которых после операции с искусственным кровообращением нередко развивается тромбоцитопения и тромбоцитопатия. 348__________________________Глава 7. Трансфузионные среды Клетки-предшественники гемопоэза, получаемые из костного мозга или периферической крови, замораживают с ДМСО для последующей аутологич-ной или аллогенной трансплантации. 7.7. Основные требования (стандарты) к консервированной крови и ее компонентам Основные требования (стандарты) должны соблюдаться учреждениями службы крови с целью заготовки консервированной крови и ее компонентов, гарантирующей их качество и безопасность при лечебном применении. Невыполнение или снижение этих требований приводит к заготовке некачественной продукции и серьезным осложнениям при трансфузионной терапии. Методика заготовки консервированной крови и ее компонентов изложена в действующих инструктивных документах. Ниже приводятся требования к крови и ее компонентам, введеные в действие приказом Минздрава СССР №155 от 1990 г. Однако эти требования нельзя признать современными. Так, в резолюции научно-практической конференции «Актуальные проблемы трансфузионной медицины» (Киров, 4-5 октября 2000 г.) сказано: «Участники конференции считают необходимым просить Министерство здравоохранения РФ ... в ближайшие сроки обновить и дополнить инструктивно-методические материалы для службы крови взамен устаревшего приказа МЗ СССР № 155». Поэтому ниже с пометкой «СЕ» приводятся требования Совета Европы (2000 г.) 7.7.1. Консервированная кровь Консервированная кровь — это донорская кровь, заготовленная на утвержденных консервирующих растворах от обследованных доноров. Каждая доза консервированной крови маркируется. Консервированная кровь должна храниться при температуре 2-6 °С. Сроки хранения крови определяются консервирующими растворами. Консервированная кровь должна отвечать следующим требованиям: — сохранение целостности и герметичности упаковки; — наличие оформленной этикетки с указаниями срока годности и групповой принадлежности; — четко выраженная граница разделения на плазму и глобулярную массу; 349 Основные требования (стандарты) к консервированной крови — плазма должна быть прозрачной, без мути, хлопьев, нитей фибрина, без выраженного гемолиза; — глобулярный слой крови не должен иметь видимых сгустков, должен быть равномерным, без неровностей на поверхности. Стерильность заготавливаемой крови и ее компонентов обеспечивается применением при их заготовке строгих правил асептики, использованием стерильной замкнутой системы. При этом достигаются максимальные сроки их хранения при температуре 2-6 °С. Использование (в исключительных случаях) системы, замкнутость которой была нарушена или система была смонтирована при заготовке консервированной крови и ее компонентов, ограничивает сроки их хранения до 24 ч при температуре 2-6 °С. Несмотря на то, что у доноров, масса которых превышает 50 кг, стандарт ный объем заготовки крови установлен — 450 мл ±10 % (см. раздел 4.2), доза кроводачи в различных регионах России остается весьма вариабельной (см. рис. 9) . |
