Издательский дом Питер
 Скачать 5.79 Mb. Скачать 5.79 Mb.
|
|
8.2.3. Плазмаферез 8.2.3.1. Ручной (прерывистый) плазмаферез Действующий руководящий документ в нашей стране — «Инструкция по проведению донорского плазмафереза», утвержденная МЗ РФ 25 июня 1995 г. (разработчики — Н. Н. Калинин, М. М. Петров, С. В. Варламов и соавт). При однократном плазмаферезе от донора получают 450-500 мл консервированной крови. Выход плазмы составляет не менее 50 %, т. е. 250±50 мл. При двукратном плазмаферезе из 900-1000 мл консервированной крови получают до 600 мл плазмы. Донорский плазмаферез осуществляется только с помощью пластиковых мешков. Методика проведения донорского плазмафереза У донора берут кровь в сдвоенные полимерные мешки, ее разделяют на плазму и форменные элементы путем центрифугирования, скорость и время которого устанавливают в зависимости от типа центрифуги, согласно номограммам и расчетным формулам. С помощью плазмоэкстрактора плазму переводят во второй (малый) контейнер, мешки разъединяют. Форменные элементы крови, ресуспендированные в физиологическом растворе, возвращают донору через систему для переливания крови. Из дозы цельной консервированной крови получают 200-300 мл плазмы, а из двух доз соответственно 500±50 мл плазмы. Подготовка мешков к взятию крови Работа с пластикатными контейнерами типа 500/300 проводят в соответствии с инструкцией изготовителя. Проверяются сроки годности мешков и их целостность. Мешки маркируют с указанием даты, Ф.И.О., группы крови и Rh-принадлежности донора. Заготавливаются этикетки для маркировки мешков с плазмой. 406_____Глава 8. Заготовка крови, производство ее компонентов и препаратов Особое внимание следует обратить на идентификацию заготовляемой крови и реинфузируемых эритроцитов. С этой целью используют маркировку цветными групповыми марками: — гемоконтейнер с консервантом (марка фиксируется к ушку гемокон-тейнера с помощью степлера или прозрачной ленты — скотча). Дополнительно на гемоконтейнер и спаренный мешок («Компопласт») фиксируется полоска из лейкопластыря с нанесенными фамилией донора и номером цикла операции; — донора — путем закрепления на предплечье браслета из плотной прозрачной полиэтиленовой полоски с фиксированной на ней цветной маркой; — карточки (карты) донора (марка наклеивается на специально отведенном месте). Непосредственно перед гемоэксфузией донору предлагают поставить свою подпись на гемоконтейнер. Маркировку контейнеров для крови и плазмы выполняют, не отходя от донора. Карточка (карта) донора во время проведения операции находится на груди донора. Процесс взятия крови у донора Перед началом взятия крови у донора раскладывается стерильная упаковка для работы с каждым донором. Заполняется система для переливания крови стерильным изотоническим раствором хлорида натрия. При этом необходимо убедиться в герметичности флаконов, проверить срок годности растворов. У донора место венепункции (локтевой сгиб) необходимо дважды обработать антисептиком (приказ МЗ СССР № 408 от 1989 г.), наложить жгут, снять колпачок с иглы мешка и произвести пункцию вены. Иглу закрепить лейкопластырем. Во время эксфузии кровь в мешке периодически перемешивают с консервирующим раствором. В полимерный контейнер набирают тот объем консервированной крови, который указан на этикетке мешка. По окончании взятия крови снимают жгут. Затем на трубку накладывают 2 зажима, отступая 10 см от канюли иглы. Трубку между зажимами обрабатывают спиртом и разрезают стерильными ножницами. Чрезвычайно важно поддерживать порядок, гарантирующий безопасную реинфузию аутологичных эритроцитов. До того как контейнер с кровью отделяется от донора, должно быть 2 независимых этапа идентификации, чтобы и донор, и операционная сестра могли удостовериться в том, что содержимое идентифицировано правильно (уникальный номер и подпись донора). Кровь из трубки полимерного контейнера нужно перевести в мешок (при этом можно использовать зажим для выдавливания крови из трубок — стриппер). Затем трубка герметизируется путем запаивания или наложения металлических колец, или завязыванием у мешка по паре тугих узлов. Донорский гшазмоцитаферез 407 К игле подсоединяется капельница с физиологическим раствором, первые 10 мл которого вводятся струйно для предотвращения тромбирования иглы, затем скорость введения физиологического раствора должна быть 30-40 капель в 1 мин. Центрифугирование пластиковых контейнеров Полимерные контейнеры помещают в центрифужные стаканы, которые попарно уравновешивают на весах. Уравновешенные стаканы устанавливают согласно маркировке в центрифугу для фракционирования (в соответствии с инструкцией по эксплуатации центрифуги). Центрифугирование следует проводить при факторе разделения (см. раздел 7.5) не менее 2000 g, что позволяет добиться высокого выхода плазмы без примеси клеточных элементов и без их травмирования. Центрифугирование следует проводить при температуре 22 °С. Отделение плазмы После окончания центрифугирования полимерный контейнер с разделенной кровью осторожно, чтобы не было перемешивания пограничного слоя, переносят и устанавливают в плазмоэкстрактор, с помощью которого плазма переводится в малый контейнер (300 мл), с трубки последнего снимается пластмассовый зажим. После этого оба контейнера разделяют, накладывая два зажима на соединяющую их трубку. Трубку между зажимами обрабатывают спиртом и разрезают стерильными ножницами. Малый контейнер с плазмой герметизируют запаиванием или наложением металлических колец, или завязыванием по паре тугих узлов около мешка. На мешок с плазмой прикрепляют маркировочную этикетку. Реинфузия аутоэритроцитов В контейнер с эритроцитами перед реинфузией вводится 100 мл изотонического раствора хлорида натрия. Для разведения аутоэритроцитов физиологическим раствором используется система-магистраль для переливания растворов из флакона во флакон (CM-I). Для этого, обработав спиртом пробку флакона с физиологическим раствором, который подключен к системе переливания крови и вводится донору, закрыть капельницу, проткнуть пробку одной иглой магистрали, а другую иглу ввести в трубку от мешка, снять зажим и развести эритроциты 100 мл физиологического раствора, осторожно перемешивая их. После ресуспендирования аутоэритроцитов на трубку мешка вновь наложить зажим, отсоединить от флакона и мешка систему-магистраль (CM-I) и герметизировать трубку мешка с ресуспендированными эритроцитами возможными способами, изложенными выше. 408_____Глава 8. Заготовка крови, производство ее компонентов и препаратов После проверки маркировки мешка и сверки устно с донором его фамилии, имени, отчества, группы крови резус-фактора мешок присоединяется к системе для переливания крови; введение изотонического раствора хлорида натрия прекращают. Осуществляется реинфузия аутоэритроцитов донору. Допускается струйное введение аутоэритроцитов. Операционная сестра, производящая реинфузию форменных элементов, обязана убедиться в их принадлежности именно этому донору путем: — проверки наличия всех элементов идентификации и отсутствия на них механических повреждений; — сопоставления паспортных данных, указанных на гемоконтейнере и полученных при опросе донора; — проверки совпадения цвета марок и маячков, номеров и других отметок на руке донора, журнале (карте) донора, контейнере со взвесью реинфу-зируемых аутокомпонентов; — предъявления донору гемоконтейнера с его подписью. В случае потери или выявления повреждений браслетов на предплечье донора, цветных марок, несовпадения их номеров, а также наличия других признаков, вызывающих сомнение в принадлежности реинфузируемой среды данному донору, дополнительно проводят: — определение группы крови и резус-фактора пробы крови из гемоконтейнера; — пробы на индивидуальную совместимость по системам АВО и резус между сывороткой донора и клеточной взвесью из гемоконтейнера. При совпадении групповой принадлежности эритроцитной массы и крови донора, отсутствии агглютинации в пробах на совместимость, после выполнения биологической пробы проводят переливание клеточной взвеси. О готовности к проведению реинфузии операционная сестра докладывает врачу отделения, который, удостоверившись в правильности ее действий, дает разрешение на переливание аутокомпонентов. В начале реинфузии проводится биологическая проба, оценка которой осуществляется врачом. После возврата аутоэритроцитов процедура заканчивается при однократном плазмаферезе, закрывается капельница, игла вынимается из вены, накладывается стерильная, давящая повязка не менее чем на 2 ч. При проведении двукратного плазмафереза повторяются все этапы, начиная с подготовки гемоконтейнера. После окончания операции путем опроса, осмотра, оценки пульса и АД врач должен убедится, что в состоянии здоровья донора нет никаких отклонений и он может быть отпущен из СПК. Операция оформляется протоколом в карточке (карте) донора, регистрируется в «Книге учета заготовки компонентов крови методами плазмоцитафереза» и «Удостоверении донора» (только для активных доноров). После этого донор инструктируется о дате и времени следующей плазмодачи. Донорский плазмодитаферез 409 Использование плазмы, полученной от донора при плазмаферезе, ее замораживание и дальнейшее хранение осуществляются согласно существующим регламентам. Плата донору за донорский плазмаферез производится в соответствии с существующими документами, утвержденными местными и федеральными органами власти. Бактериологический контроль плазмы осуществляется из невостребованных контейнеров согласно «Инструкции по контролю стерильности консервированной крови, ее компонентов, препаратов, консервированного костного мозга, кровезаменителей и консервирующих растворов» от 1995 г. 8.2.3.2. .Аппаратный плазмаферез Аппаратный плазмаферез регламентирован «Инструкцией по проведению автоматического донорского плазмафереза на аппарате Haemonetics (Гемо-нетик) PCS-2» (Минздрав России, 1999 г.; разработчики Е. А. Селиванов, И. В. Красилыцикова, Л. В. Баранова и др.). Донором автоматического плазмафереза может быть гражданин(ка) России в возрасте от 18 до 60 лет, массой не менее 50 кг, имеющий постоянную регистрацию и проживающий по месту регистрации не менее полугода. Автоматический донорский плазмаферез проводится в государственных учреждениях здравоохранения, занимающихся заготовкой и переработкой крови, ее компонентов и препаратов. При комплектовании донорских кадров для заготовки плазмы методом автоматического плазмафереза с донором проводится разъяснительная беседа, в которой оговариваются права и обязанности медицинских работников и донора. При первичном освидетельствовании доноров исследуются ряд показателей: — клинический анализ крови (далее — 1 раз в год); — количество тромбоцитов и ретикулоцитов (далее — 1 раз в год); — содержание общего белка в сыворотке крови; — белковые фракции сыворотки крови; — электрокардиограмма (лицам старше 40 лет и далее — 1 раз в год); — анализ мочи (далее — 1 раз в год); — флюорография (далее — 1 раз в год). При повторных плазмаферезах исследуются: — содержание гемоглобина или гематокрит; — СОЭ; — количество лейкоцитов; — содержание общего белка в сыворотке крови; — белковые фракции сыворотки крови (после каждых 5 плазмаферезов). Если интервал между процедурами плазмафереза более 2 мес, донор обследуется как при первичном освидетельствовании. При диспротеинемии донор отводится от донорства на 1 мес. 410_____Глава 8. Заготовка крови, производство ее компонентов и препаратов Если донор в дальнейшем не сдает плазму методом автоматического плаз-мафереза, он может быть допущен к любому виду донорства через 14 дней после последней процедуры. Скрининг донорской крови проводится по следующим показателям: — группа крови и резус-принадлежность; — серологические исследования на сифилис; — активность аланинаминотрансферазы (АЛТ) в сыворотке; — поверхностный антиген вируса гепатита В; — антитела к вирусу гепатита С; — антитела к ВИЧ-1/2. При проведении донорского автоматического плазмафереза от донора однократно получают не более 600 мл плазмы вместе с гемоконсервантом, интервал между плазмодачами составляет не менее 14 дней. В течение года от одного донора разрешается получать до 10,5 л плазмы (вместе с консервантом). Перечень основного оборудования при получении плазмы на аппарате Haemonetics PCS-2: — одноразовый стерильный ротор-емкость для центрифуги; — одноразовый стерильный полимерный мешок, содержащий антикоагулянт, имеющий разрешение на применение в России; — одноразовая стерильная система для сбора плазмы; — одноразовые стерильные мешки для сбора плазмы; — одноразовая стерильная металлическая игла, соединенная с адаптером; — стерильный раствор 0,9 % хлорида натрия для внутривенного введения; — адаптер с люэровской насадкой; — держатели для пробирок; — пробирки; — одноразовая стерильная система для переливания раствора из флакона; — высокочастотные генераторы для заварки трубок системы для сбора плазмы типа аппарата «Гематрон»; — весы и разновесы. Для проведения автоматического плазмафереза используются помещения, позволяющие проводить влажную уборку с применением дезинфицирующих средств. Аппараты устанавливаются на подставках у донорских кресел (столов) таким образом, чтобы расстояние от стен до аппарата составляло не менее 15 см. На одно донорское место (аппарат, кресло и расходный материал) требуется не менее 6 м2 площади. Подключение аппарата к электросети и его использование производится в соответствии с требованиями инструкции, прилагаемой к аппарату. Операционный зал подвергается влажной уборке дезинфицирующими средствами через каждые 4 ч работы. После окончания работы в операцион- Донорский плазмоцитаферез___________________________411 ной израсходованные медицинские изделия и материалы дезинфицируют и утилизируют в установленном порядке. Подготовка системы сбора плазмы и проведение автоматического плазма-фереза выполняются в соответствии с настоящей инструкцией и инструкцией, прилагаемой к аппарату. Перед плазмодачей проверяются: — карта донора; — наличие заключения врача о допуске к плазмаферезу; — наличие марки с номером плазмодачи, которая наклеивается на пробирки для проб крови, на этикетку полимерных мешков для сбора плазмы и на все документы, сопровождающие плазмодачу. Место венепункции у донора (локтевой сгиб) необходимо дважды обработать антисептиком, наложить жгут-манжету от аппарата Haemonetics PCS-2, произвести венепункцию, взять пробы крови в 2 специальные пробирки типа Venoject (Monoject), подсоединить иглу для венепункции к системе сбора плазмы и начать процедуру. Врач, операционная медицинская сестра используют стерильные резиновые перчатки для каждой группы доноров, у которых одновременно проводится операция автоматического плазмафереза (не более 4 человек), с периодической их обработкой дезинфицирующим раствором согласно «Инструкции по контролю стерильности консервированной крови, ее компонентов........М., 1995 г.» После выполнения программы сбора плазмы аппарат отключается автоматически, донору в вену вводится капельно 0,9 % раствор хлорида натрия в количестве 500 мл. Отсоединенный мешок взвешивается, его трубки герметически запаиваются. Замораживание плазмы и ее хранение осуществляются согласно действующим регламентам. После получения результатов скрининга крови донора проводится выбраковка плазмы, ее документальная регистрация и передача в экспедицию станции, отделения переливания крови для хранения и выдачи в ЛПУ в соответствии с утвержденной нормативно-технической документацией. Работа операционных медицинских сестер по проведению автоматического донорского плазмафереза проводится под постоянным контролем и с участием врача, который несет ответственность за проведение плазмафереза. При появлении первых симптомов реакции донора на проведение операции, а также при технических затруднениях операционная медицинская сестра останавливает аппарат и ставит в известность врача, который решает вопрос о продолжении или прекращении процедуры; в последнем случае донор получает полную компенсацию за процедуру. Денежная компенсация донорам автоматического плазмафереза производится в соответствии с документами, утвержденными местными органами власти. Разрешение на проведение в учреждениях здравоохранения автоматического донорского плазмафереза дает комиссия, назначаемая приказом местных 412 Глава 8. Заготовка крови, производство ее компонентов и препаратов органов здравоохранения, после прохождения врачами и медсестрами специальной подготовки на базе Российского НИИ гематологии и трансфузио-логии, Кировского НИИ гематологии и переливания крови, Гематологического научного центра, Военно-медицинской академии. 8.2.4. Тромбоцитаферез Наиболее оптимальным методом получения концентрата тромбоцитов (КТ) является аппаратный тромбоцитаферез. Метод проводится с использованием специального оборудования — сепараторов крови. За 70-100 мин на современных сепараторах от одного донора в закрытом контуре можно получать от 8 до 9x10" тромбоцитов. При этом содержание лейкоцитов составляет в среднем менее 5,0х106в дозе КТ, чего не удается достичь при других методах получения тромбоцитов. Кроме того, метод отличают наличие автоматического контроля за процессом разделения крови и возможными осложнениями в ходе операции, относительная непродолжительность, высокая эффективность и безопасность операции.  Методика проведения аппаратного тромбоцитафереза осуществляется согласно инструкции, прилагаемой изготовителем к сепаратору клеток крови (рис. 33). В настоящее время наиболее часто используются сепараторы MSC-3 Plus (Haemonetics); Fresenius A-104/204; CS 3000 Plus (Baxter); V-50, Cobe Spectra (Cobe). Отечественной промышленностью выпускаются фракционаторы (сепараторы) крови АФК-01, АНЦ, ФК-3,5. Хотя технические возможности этих аппаратов ниже зарубежных аналогов, тем не менее они позволяют получать КТ, отвечающие требованиям международных стандартов. В качестве антикоагулянта при получении КТ ria отечественных фракционаторах применяется кислый глюкозо-цитратный раствор. При использовании аппаратов Рис- 33- Аппарат MCS-3 Plus для цитафереза (несмотря на на- (Haemonetics, США). Донорский плазмоцитаферез 413 личие инструкции производителя) в отделении необходимо подготовить специальное руководство, легко доступное для сестринского и технического персонала, подробные описания каждого вида выполняемых процедур отдельно для каждого типа сепаратора клеток. Главным недостатком аппаратного тромбоцитафереза является высокая стоимость сепараторов крови и расходных систем к ним. По этой причине, несмотря на преимущества аппаратного метода и появление новых и более совершенных сепараторов, не потерял своего значения прерывистый метод получения тромбоцитов с использованием полимерных ге-моконтейнеров и рефрижераторных центрифуг. Техника проведения прерывистого тромбоцитафереза регламентируется подготовленной В. М. Городецким «Инструкцией по заготовке тромбоцитов от одного донора методом прерывистого тромбоцитафереза с применением полимерных контейнеров» (МЗ РФ, 1995 г.). У донора производят заготовку дозы крови (400-450 мл) в полимерный гемоконтейнер «Гемакон» 500/300. Лучше использовать встроенные контейнеры типа «Гемакон» 500/300/300, что позволяет осуществлять заготовку тромбоцитов в закрытой системе. Заготовленная донорская кровь подвергается центрифугированию в «мягком» режиме — 400 g, при температуре 22 °С в течение 20 мин и с помощью плаз-моэкстрактора разделяется на эритроциты и обогащенную тромбоцитами плазму (ОТП). Эритроциты после ресуспендирования в изотоническом растворе хлорида натрия реинфузируются донору. ОТП переводится в малый спаренный контейнер и подвергается жесткому центрифугированию (3400 g) при температуре 22 °С в течение 15 мин для осаждения тромбоцитов на дно контейнера. После этого обедненная тромбоцитами плазма переводится в третий спаренный контейнер и в дальнейшем реинфузируется донору(оптимальная скорость — 40 капель в 1 мин). Над слоем тромбоцитов оставляют 50-60 мл плазмы для ресуспендирования. Следующий цикл прерывистого тромбоцитафереза начинается с эксфу-зии у донора очередной дозы крови. За одну операцию тромбоцитафереза можно проводить не более 4 циклов. Полученные единицы тромбоцитной массы перед выдачей в отделение объединяются в первый контейнер. Данная методика позволяет заготовить от одного донора более 200x109 (обычно от 220 до 280x109) тромбоцитов. Объем тромбоцитной массы, получаемой при четырехкратном прерывистом тромбоцитаферезе, должен находиться в пределах 150-250 мл. Продолжительность операции — 2,5-3 ч. Уступая аппаратному тромбоцитаферезу по эффективности получения тромбоцитов (по продолжительности и количеству получаемых клеток), прерывистый метод отличается простотой технического исполнения, экономичностью, доступностью для большинства учреждений службы крови, возможностью осуществлять процедуру одновременно у нескольких доноров. Эти преимущества дают возможность для широкого применения данного способа заготовки тромбоцитов. 414_____Глава 8. Заготовка крови, производство ее компонентов и препаратов 8.2.5. Лейкоцитаферез Техника проведения аппаратного лейкоцитафереза осуществляется согласно инструкции, прилагаемой к сепараторам клеток крови заводом-изготовителем. Аферез гранулоцитов Для достижения лечебного эффекта необходимо ежедневно переливать 1010 функционально полноценных гранулоцитов. Для заготовки столь значительного количества клеток с использованием большинства видов доступного оборудования необходимо назначение донору медикаментов или других адъю-вантов. За рубежом с этой целью применяют гидроксиэтилкрахмал, корти-костероиды и ростовые факторы. Гидроксиэтилкрахмал. Выход гранулоцитов может быть увеличен путем более полного разделения гранулоцитов в нижней, более плотной, части лейкотромбослоя и эритроцитов, расположенных еще ниже. Агенты, способствующие образованию «монетных столбиков», вызывают агрегацию и последующее осаждение эритроцитов, более полное по сравнению с действием изолированного центрифугирования. Это приводит к увеличению выхода гранулоцитов и уменьшению примеси эритроцитов в компоненте. Гидроксиэтилкрахмал (ГЭК) — синтетический полимер аминопектина, который, присутствуя в сосудистом русле донора, существенно увеличивает степень разделения между гранулоцитами и эритроцитами. Необходимы четкие письменные указания о максимальной кумулятивной дозе любого седиментирующего агента, вводимого донору в определенный период. Поскольку ГЭК является колло-идом, то он увеличивает объем циркулирующей крови, а у доноров, получающих ГЭК, вследствие увеличенного объема циркуляции могут возникать головные боли или отеки мягких тканей. Кортикостероиды. Количество заготовленных гранулоцитов зависит от уровня циркулирующих клеток во время лейкоцитафереза, поэтому увеличение количества циркулирующих клеток увеличивает количество заготовленных гранулоцитов. Кортикостероиды мобилизуют гранулоциты из депо в сосудистое русло, а также уменьшают выход гранулоцитов из периферической крови. Пероральные препараты кортикостероидов (гидрокортизон, пред-низон, метилпреднизолон или дексаметазон) могут назначаться до цитафе-реза для увеличения количества циркулирующих гранулоцитов. Кортикостероиды способны удваивать количество циркулирующих гранулоцитов, однако общий выход гранулоцитов зависит от выбора дозы, времени и пути назначения. Протокол, использующий 20 мг преднизона perosза 17, 12и2ч до донации, приводит к наивысшему выходу гранулоцитов с минимальным системным действием стероидов. Перед назначением кортикостероидов до донации у донора выясняется анамнез на предмет наличия симптомов гипер-тензии, диабета и пептической язвы. Стероиды не должны назначаться доно- Донорский плазмоцитаферез___________________________415 рам, имеющим в анамнезе или в настоящее время заболевание, которое может обостриться под действием гормонов. Согласие должно включать особое разрешение относительно любых медикаментов или осаждающих агентов. Ростовые факторы. Гемопоэтические факторы роста — Г-КСФ и ГМ-КСФ — могут эффективно увеличивать выход гранулоцитов. При назначении Г-КСФ в течение процедуры афереза может быть заготовлено 10x1010 гранулоцитов. Предварительные данные подтверждают хорошее восстановление и переживание этих гранулоцитов invivo, а также хорошую переносимость Г-КСФ донорами. Аферез клеток-предшественников периферической крови Цитаферез для заготовки клеток-предшественников гемопоэза особенно полезен при получении аутологичных клеток-предшественников для их трансплантации в целях восстановления нормального кроветворения у пациентов со злокачественными опухолями кроветворной ткани, солидными опухолями, рассеянным склерозом, тяжелым ревматоидным артритом. Множественные заготовки выполняются до того, как пациент получит высокоинтенсивную миелосупрессивную терапию и/или облучение. Количество и частота процедур афереза определяются для каждого донора на основании количества заготовленных клеток и клинического состояния пациента. Использование одного или нескольких гемопоэтических факторов роста обычно увеличивает выход клеток-предшественников в периферическую кровь. Клетки-предшественники гемопоэза также могут быть заготовлены из циркулирующей крови здоровых доноров для пересадки другим пациентам. 8.2.6. Эритроцитаферез Традиционные способы получения донорских эритроцитов имеют ряд недостатков: — между заготовкой и разделением крови проходит определенный период; — недостаточная стандартизация смешивания с антикоагулянтом; — широкие вариации массы эритроцитов в дозе донорской крови (см. табл. 13); Этих недостатков можно избежать, используя процедуру автоматического эритроцитафереза. При этом создаются стандартные условия: автоматическая подача антикоагулянта регулируется в соответствии с гематокритом донора, можно индивидуально варьировать объем получаемой дозы эритроцитов. Для соблюдения принципа «один донор — один реципиент» с использованием аппарата в течение одной процедуры получают 2 дозы концентрата эритроцитов по 220 мл, плазма при этом реинфузируется. 416 Глава 8. Заготовка крови, производство ее компонентов и препаратов В этом разделе следует отметить, что подход к стандартной дозе крово-дачи весьма консервативен и с очень незначительными модификациями существует на протяжение половины столетия. Недостаток традиционного подхода в отношении заготовки эритроцитов представлен в табл. 13. Что если, сохраняя клинический стандарт дозы эритроцитов, попытаться индивидуализировать объем донации, разумеется, не причиняя донору вреда? Возможность дифференцировать объем кроводачи представлена в табл. 106. Если определить в качестве стандарта объема донации в 50 г гемоглобина, то от небольшого донора одну дозу можно получить, заготовив 379 мл крови (11,7 % ОЦК). Заготовив немного большую долю крови от большого донора (13,5 % ОЦК, 689 мл), можно получить две стандартных дозы крови. Вероятно, оптимально определить в качестве стандартной дозы 40 г гемоглобина и заготавливать 303 мл (9,3 % ОЦК) от небольшого донора и 551 мл крови (10,8 % ОЦК) — от большого донора. Такой подход позволяет определить стандартную дозу кроводачи с учетом особенностей конституции населения региона. Возможности для индивидуализации донации эритроцитов представляют клеточные сепараторы. Те же принципы (контролируемое внесение антикоагулянта, индивидуализация объема кроводачи) используются в новой автоматизированной системе заготовки цельной донорской крови — Automated whole blood collection system - AWBCS (Haemonetics, США). Таблица 106 Возможность дифференцировать объем кроводачи в зависимости от ОЦК и концентрации гемоглобина у донора [Hogman С. F., 1998]
Примечание. Донор 1: женщина, масса тела — 50 кг, рост — 165 см, ОЦК — 3250 мл, концентрация гемоглобина — 132 г/л, общий гемоглобин — 429 г. Донор 2: мужчина, масса тела — 85 кг, рост — 185 см, ОЦК — 5100 мл, концентрация гемоглобина — 145 г/л, общий гемоглобин — 740 г. Производство препаратов плазмы крови 417 8.3. Производство препаратов плазмы крови Традиционно плазма фракционируется для получения альбумина, концентратов факторов VIII и IX, а также иммуноглобулинов. Однако в последние годы перечень препаратов плазмы расширился (табл. 107). В отличие от компонентов крови, получаемых небольшими учреждениями, препараты плазмы производятся в заводских условиях, по правилам фармацевтической индустрии. Цель фракционирования плазмы — изоляция ее составляющих, обладающих терапевтическим потенциалом. Во избежание побочных эффектов препараты плазмы должны быть свободны от вирусов, бактериальных пирогенов, вазоактивных и тромбогенных субстанций. Изоляция белковых составляющих плазмы производится путем: — холодовой экстракции этанолом; — хроматографии. Белки плазмы различаются по растворимости. Растворимость белка зависит от его физико-химических характеристик (размер молекулы, аминокислотный состав, количество ионизируемых остатков) и окружающей среды. В 1925 г. Эдвин Кон предложил разделять белки с учетом их различной растворимости под действием нескольких факторов: — рН; — температуры; — концентрации этанола; — концентрации белков. Упрощенная схема фракционирования плазмы представлена на рис. 34. Хроматография как метод изоляции биологически активных молекул и очистки белков плазмы крови использует три принципа: — ионный обмен (выделение ФIХ из криосупернатантной плазмы); — биоспецифическую аффинность (иммобилизованный лиганд выделяет отдельный белок: гепарин — антитромбин III, моноклональные антитела - ФVIII и Ф1Х); — исключение размера (инертный ФIХ гель Sefacryl S-200 с заданным размером пор используется для окончательной очистки альбумина и сс1-ан-титрипсина). Хроматографические методы обладают рядом преимуществ: — одновременное выделение нескольких белков; — высокое качество чистоты конечного продукта; — большая возможность автоматизации; — меньшая стоимость; — гибкость (возможность очистки рекомбинантных белков). 418_____Глава 8. Заготовка крови, производство ее компонентов и препаратов Таблица 107 Основные препараты плазмы
Современные методики выделения белков используют колоночную жидкостную хроматографию. Инертный гель (агароза, декстран, полиакриламид) используют в качестве матрикса для активных (ионы или лиганды) участков связывания. Об инактивации вирусов при производстве препаратов плазмы см. раздел 15.2.5.5. 8.4. Производство донорской крови, ее компонентов и препаратов в России Как следствие уменьшения количества доноров (см. главу 3) в России сократился и объем заготавливаемой крови, однако не так значительно за счет повышения средней разовой дозы. Так, если в 1985 г. заготавливалось 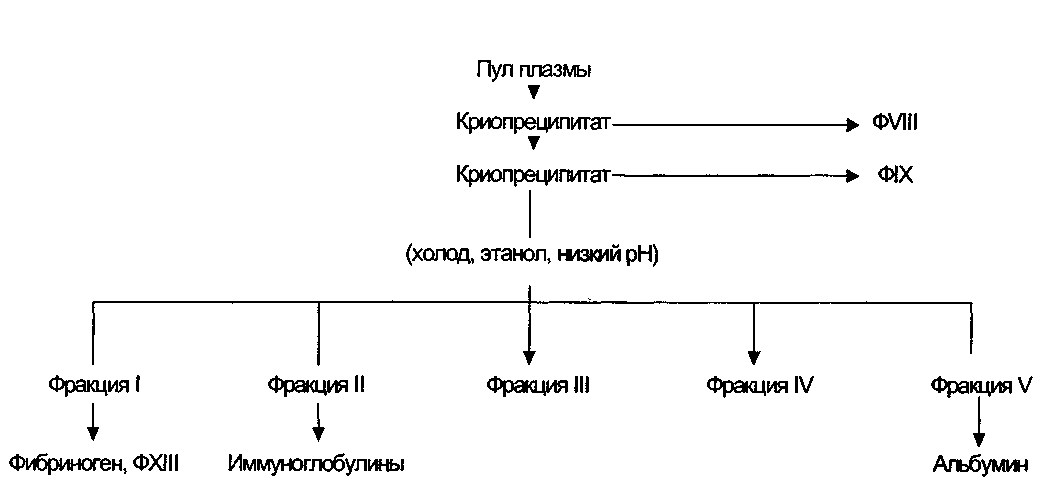 Рис. 34. Упрощенная схема фракционирования плазмы. 420_____Глава 8. Заготовка крови, производство ее компонентов и препаратов 2100 тыс. литров цельной крови, то в 1999 г. это количество составило 1566 тыс. литров (рис. 35), более 90 % из которых переработаны на компоненты и препараты. Непосредственно для переливания использовано 4 % заготовленной цельной крови. Производственные показатели службы крови России представлены в табл. 108. Направленность на производство компонентов крови положительно сказалась на внедрении в практическое здравоохранение гемокомпонентной терапии: соотношение переливаемых в лечебно-профилактических учреждениях эритроцитсодержащих сред и цельной крови имеет положительную динамику: 1996 г. - 3 : 1; 1997 г. - 3,5 : 1; 1998 г. - 4,8: 1; 1999 г. - 5,6 : 1. При сохранении объемов выданной лечебно-профилактическим учреждениям эрит-роцитарной массы в 1999 г. по сравнению с 1998 г. увеличилась выдача замороженной эритромассы (на 17 %), эритроцитарной массы, обедненной лейкоцитами и тромбоцитами (на 1 %); количество свежезамороженной плазмы уменьшилось на 2 %, доз концентрата тромбоцитов — на 13 %), гипериммунной антистафилококковой плазмы — на 25,2 %. Недостаточное финансирование в ряде случаев приводит к отказу от современных технологий заготовки крови. Так, получившая достаточно широкое применение пластиковая тара для забора крови, обеспечивающая безопасность и снижающая процент брака производства, в настоящее время из-за отсутствия средств практически повсеместно заменяется на устаревшую стеклянную. Высокая цена зарубежной пластиковой тары не позволяет закупать ее в необходимом объеме, а современное отечественное производство практически отсутствует. Единственный завод в г. Кургане выпускает пластиковую тару в недостаточном количестве. Использование форменных элементов и плазмы крови в 1999 г. в России представлено на рис. 36 и 37. Индустриальное производство препаратов крови из донорской плазмы было организовано в начале 1970-х гг. созданием 7 корпусов фракционирования плазмы на базе СПК городов Санкт-Петербурга, Москвы, Новосибирска, Челябинска, Иванова, Ростова-на-Дону, Самары. География их размещения предусматривала равномерное обеспечение препаратами крови регионов страны. К 1977 г. корпуса фракционирования вышли на проектную мощность, а к середине 1980-х гг. их производственная мощность увеличилась более чем в 2 раза. Освоено производство основных препаратов крови (альбумин, им-муноглобулины для внутримышечных введений). В последние годы налажено производство современных препаратов крови: иммуноглобулина для внутривенного введения, противоэнцефалитного иммуноглобулина. В то же время, в последние годы, в связи с крайним дефицитом бюджетных средств, направляемых на содержание учреждений службы крови, состо- 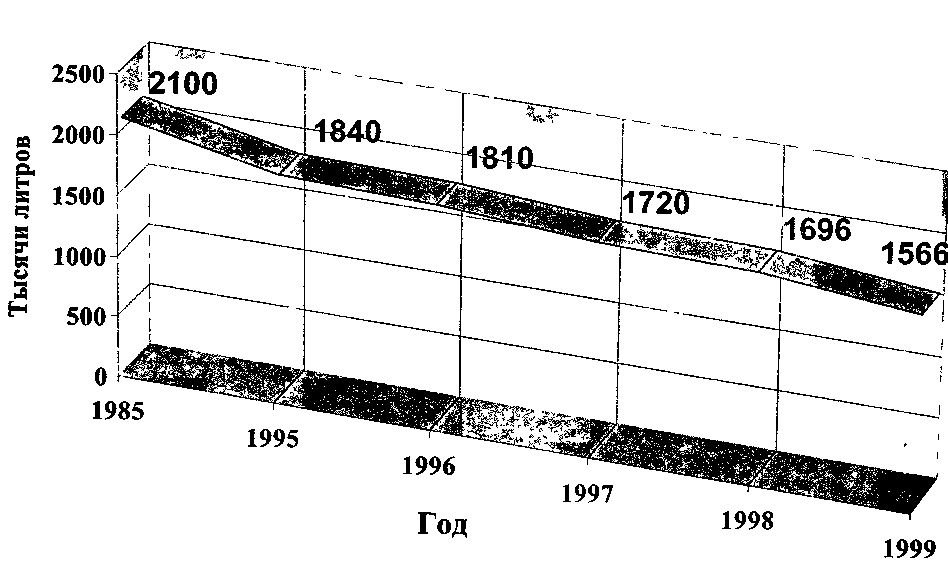 Рис. 35. Изменение объема заготовки крови в России с 1985 по 1999 г. [по Селиванову Е. А. и др., 2000]. 422 Глава 8. Заготовка крови, производство ее компонентов и препаратов Таблица 108 Производство консервированной крови, компонентов и препаратов в Российской Федерации в 1997-1999 гг. [Селиванов Е. А. и др., 2000]
Производство донорской крови, ее компонентов и препаратов в России 423 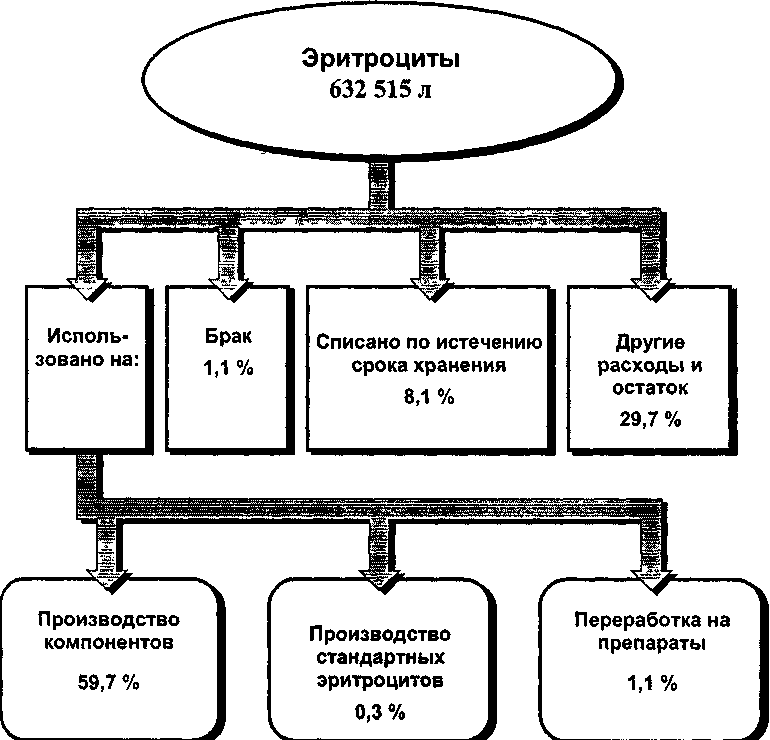 Рис. 36. Использование эритроцитов в службе крови России в 1999 г, [по Селиванову Е. А. и др., 2000]. 424 Глава 8. Заготовка крови, производство ее компонентов и препаратов 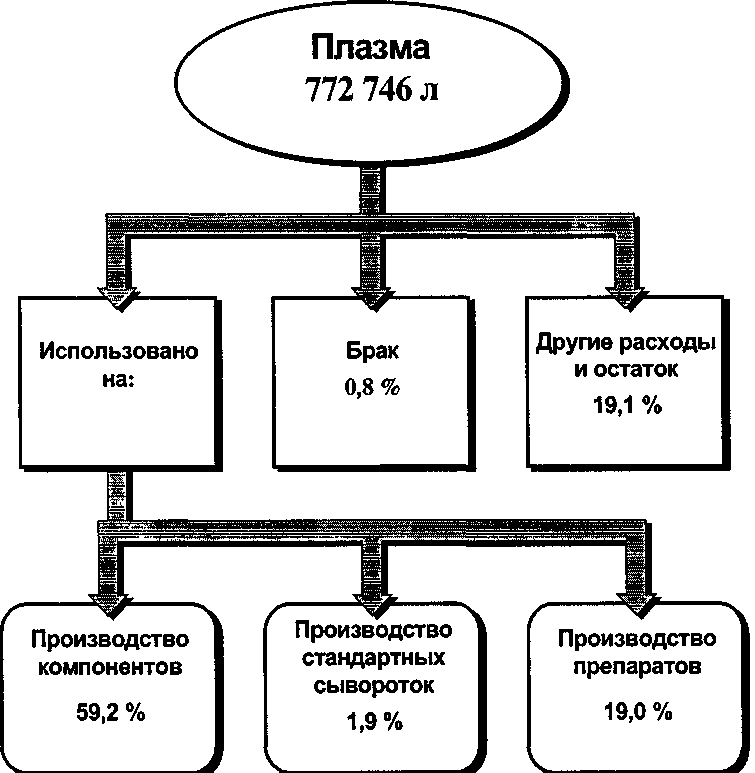 Рис. 37. Использование плазмы в службе крови России в 1999 г. [по Селиванову Е. А. и др., 2000]. Производство донорской крови, ее компонентов и препаратов в России____425 яние материально-технической базы службы резко ухудшилось. С 1991 г. она практически не пополнялась новым оборудованием, а имеющееся отработало технический срок и нуждается в замене. В ряде производств специальное оборудование вышло из строя и в связи с отсутствием средств не может быть заменено новым. По этой причине закрыты корпуса фракционирования в СПК Новосибирска и Санкт-Петербурга. Таким образом, производственные мощности службы крови и их техническое оснащение не позволяют обеспечить объем продукции, удовлетворяющий потребности здравоохранения в основных препаратах крови, а также использовать современные технологии производства препаратов крови, обеспечить их количество и номенклатуру в необходимых объемах. В результате сложившейся ситуации производство большинства препаратов крови в 1999 г. сократилось по сравнению с 1998 г.: альбумина — на 1,2 тыс. л (8,3 %), аминокровина — на 2,6 тыс. л (13,6 %), криопреципитата — на 7,5 %. Несколько увеличилось по сравнению с 1998 г. производство иммуноглобу-лина человеческого нормального и антистафилококкового. Как положительный момент следует отметить освоение и выпуск в лечебную сеть с 1996 г. имму-ноглобулинов для внутривенного введения в г.Кирове (1998 г. — 4623 доз, 1999 г. — 5090 доз), а также организацию и развитие производства противо-энцефалитного иммуноглобулина на базе Свердловской ОСПК, что в настоящее время чрезвычайно актуально в связи с учащением случаев заболевания вирусным энцефалитом в данном регионе. В связи со сложившейся ситуацией удовлетворение потребности в препаратах крови в России находится на чрезвычайно низком уровне по сравнению с нормативами ВОЗ (рис. 38). Так, в 1999 г. потребность в плазме удовлетворялась на 59,6 %, эритроцитсодержащих средах — на 43,9 %, криопре-ципитате — на 22,2 %, альбумине — на 15,4 %, иммуноглобулинах всех видов — на 5,3 %. При анализе данных сведений по регионам можно констатировать, что хуже всего с обеспечением препаратами крови в 1-й зоне, где потребность в альбумине удовлетворяется только на 1,4 %, иммуноглобулинах всех видов — на 0,4 %. 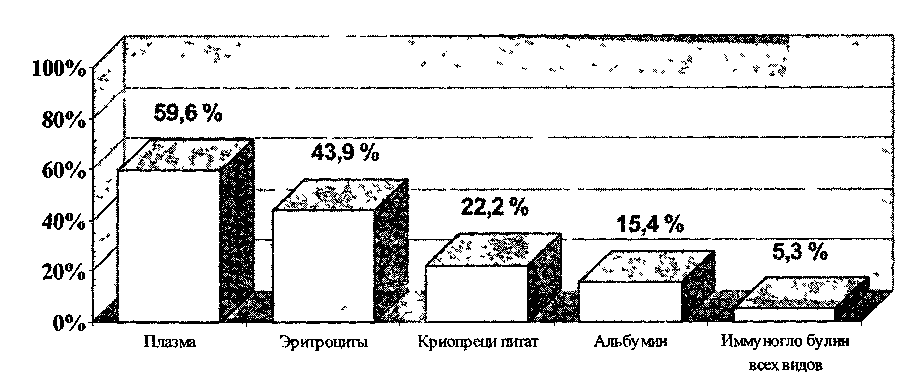 Рис. 38. Удовлетворение потребности ЛПУ России в плазме, эритроцитсодержащих средах, препаратах крови в 1999 г. (в процентах по сравнению с нормами ВОЗ) [по Селиванову Е. А, и др., 2000]. |
