Издательский дом Питер
 Скачать 5.79 Mb. Скачать 5.79 Mb.
|
|
558 Глава 12. Альтернативы переливанию крови 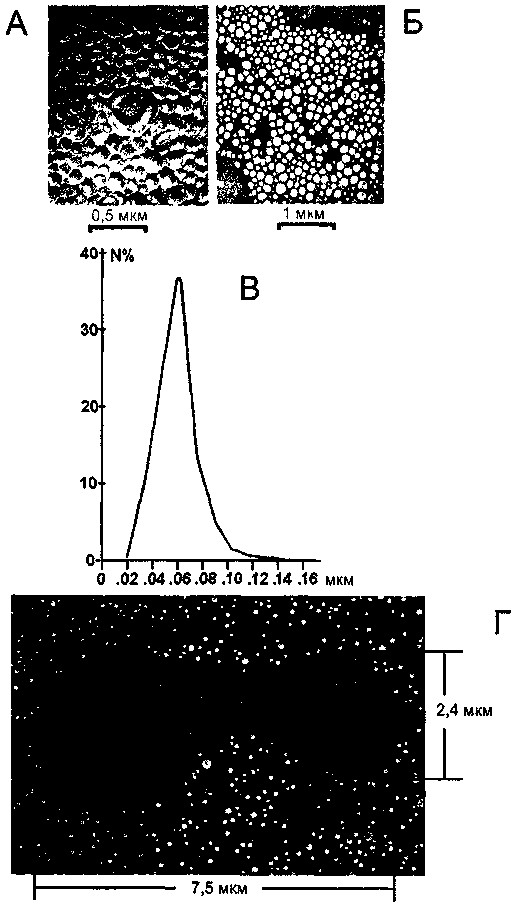 Рис. 42. Сравнение размеров частиц эмульсии «перфторан» и эритроцита цельной крови. А, Б, Г - электронномикроскопические фотографии: А - эмульсия и Г - эритроцит, окруженный эмульсией, при фиксации методом замораживания-скалывания; Б - эмульсия, контрастированная уранила ацетатом; В - распределение частиц эмульсии «перфторан» по размерам. Альтернативы трансфузиям эритроцитов_____________________559 — регионарная перфузия конечности, миокарда; — лаваж легких и ран. Период полувыведения перфторана из кровеносного русла составляет 24 ч. Поверхностно-активное вещество полностью покидает организм через почки в течение первых суток. Перфторуглероды химически инертны и в организме не подвергаются метаболизму. Даже после замещения 70 % ОЦК пер-фторуглероды полностью выводятся из организма в течение 18-24 мес. Перфторан противопоказан при гемофилиях, во время беременности его можно использовать только по жизненным показаниям. При применении перфторана возможны аллергические реакции (крапивница, кожный зуд, покраснение кожных покровов), учащение пульса, снижение артериального давления, повышение температуры, головная боль, боли за грудиной и в поясничной области, затруднение дыхания, анафилактоидные реакции. В случае возникновения этих реакций или осложнений следует немедленно прекратить инфузию и, не вынимая иглы из вены, ввести десенсибилизирующие, кардиотонические, глюкокортикоидные, вазопрессорные и другие лекарственные средства, применяемые в терапии анафилактического шока. Перед переливанием перфторана врач должен провести визуальный осмотр препарата. Препарат считается пригодным для использования при условии отсутствия трещин на бутылке, сохранения герметичности укупорки, сохранности этикетки. Результаты визуального осмотра бутылок и данные этикетки (наименование препарата, предприятие-изготовитель, номер серии) регистрируются в истории болезни. Если после легкого встряхивания на дне флакона остается осадок, препарат не пригоден к употреблению. Перфторан нельзя вводить в одной системе или в одном шприце, или в одном АИК с декстранами: полиглюкином, реополиглюкином и оксиэтил-крахмалом с молекулярной массой свыше 100000. Указанные растворы при необходимости следует вводить в другую вену или в ту же, но после окончания инфузии перфторана. Перфторан совместим с альбумином, донорскими гемокомпонентами, изотоническим солевым раствором, глюкозой, антибиотиками. При взаимодействии перфторана с известными кровезаменителями (мафусол, полиоксидин) выявлено, что препараты, имеющие в основе электролитный состав и не поддерживающие коллоидно-осмотическое давление, не изменяют биологических и физико-химических свойств перфторана. Кровезаменители, хотя бы в незначительной степени поддерживающие коллоидно-осмотическое давление (по-лиглюкин, реополиглюкин, оксиэтилкрахмал), способствуют резкому укрупнению среднего размера частиц эмульсии перфторана и изменяют ее биологические и физико-химические свойства. При применении перфторана обязательно проведение биологической пробы: после медленного введения первых 5 капель препарата прекращают пе- 560 Глава 12. Альтернативы переливанию крови реливание на 3 мин, затем вводят еще 30 капель и снова прекращают переливание на 3 мин. При отсутствии реакции продолжается введение препарата. Результаты биопробы обязательно регистрируются в истории болезни. Пер-фторан вводят внутривенно струйно или капельно в дозе от 5 до 30 мл/кг (взрослым). Разовая и суммарная дозы препарата зависят от тяжести исходного состояния и возраста больного. Эффект перфторана максимален, если во время и после его инфузии в течение суток больной дышит смесью, обогащенной кислородом (40-60 %). Для противоишемической защиты донорских органов перфторан используют в аппарате искусственного кровообращения в качестве перфузата из расчета 10-40 мл/кг массы тела. Срок годности и условия хранения: перфторан следует хранить в замороженном состоянии при температуре от -4 до -18 °С. В размороженном виде препарат можно хранить в холодильнике при температуре 4 °С не более 2 нед. Размораживать препарат рекомендуется при комнатной температуре. После размораживания препарат необходимо осторожно взболтать до полной однородности состава, а перед инфузией согреть до 21-23 °С. Допускается 5-кратное размораживание/замораживание. Препарат не пригоден к использованию в случае: — расслоения эмульсии (наличия прозрачных маслянистых капель, оседающих на дно даже после взбалтывания); — появления белого осадка на дне флакона. Срок годности препарата при температуре от -4 до -18 °С — 3 года, при температуре 4 °С — 2 нед. Перфторан следует хранить в местах, не доступных для детей. По истечению срока годности препарат не применяется. Запрещается: размораживать перфторан при температуре выше 30 °С, хранить при температуре ниже -18 °С. Перфторан выпускается во флаконах из стекла по 50, 100, 200, 400 мл. 12.2.3.2. Растворы гемоглобина Исследования по созданию кровезаменителей на основе модифицирован-ого гемоглобина проводятся в нашей стране и за рубежом около семидесяти ет. Препараты нативного гемоглобина токсичны (нарушение функции почек, желудочно-кишечного тракта, гипертензия) и недостаточно эффективно переносят кислород. Внеэритроцитарный гемоглобин, введенный в сосудистое русло реципиента, диссоциирует на низкомолекулярные димеры, которые переходят в ткани и попадают в почечные канальцы. Вазоконстрикция, по современным представлениям, обусловлена выходом тетрамера гемоглобина из сосудистого русла в интерстициальное пространство и комплексированием его с оксидом азота — естественным вазодилататором эндотелиального происхождения. Недостаточная же эффективность растворов гемоглобина как переносчиков кислорода заложена в резко повышенном сродстве к кислороду внеэритроцитарного Альтернативы трансфузиям эритроцитов_____________________561 гемоглобина (вследствие потери 2,3-дифосфоглицерата — природного регулятора обратимого присоединения кислорода к гемоглобину), малой кислородной емкости его раствора, быстром выведении молекул кислорода из кровеносного русла почками и окислении гемоглобина в метгемоглобин с потерей способности к обратимой оксигенации. В 1960-х гг. в Ленинградском НИИ гематологии и переливания крови был создан первый в мире лечебный препарат гемоглобина человека — «эри-гем», содержащий 2,5-3 % гемоглобина и равное количество глюкозы в качестве стабилизатора. Кислородная емкость эригема была, несомненно, мала, гемоглобин имел высокое сродство к кислороду при небольшом периоде полувыведения. Многолетний опыт клинического применения эригема показал, что кровезаменители на основе растворов нативного гемоглобина нельзя расценивать в качестве переносчиков кислорода при их несомненной эффективности в качестве препаратов гемостимулирующего и гемостатического действия, а также для восполнения дефицита объема циркулирующей плазмы при умеренной кровопотере. Для того чтобы раствор гемоглобина мог служить основой истинного кровезаменителя-переносчика кислорода, необходима предварительная модификация молекулы гемоглобина с целью: — снижения сродства к кислороду; — увеличения периода циркуляции в сосудистом русле, стабилизации тетрамера гемоглобина и предотвращения его диссоциации на токсичные димеры. Первая задача решается с помощью химического присоединения регулятора обратимой оксигенации (пиридоксаль-5-фосфат, 2-нор-2-формил-пири-доксаль-5-фосфат, бис-N-малеиновый эфир и др.), вторая — при увеличении размеров молекулы гемоглобина. Синтез высокомолекулярных производных гемоглобина осуществляется с помощью разнообразных агентов: глута-рового альдегида, полиэтиленгликоля, декстрана, гидроксиэтилкрахмала, раффинозы. Полимеризация гемоглобина либо конъюгация его с высокомолекулярным носителем позволяет добиться высокой концентрации гемоглобина в растворе (до 10-14 г/л) при нормальном онкотическом давлении и невысокой вязкости. При этом период полувыведения гемоглобина из сосудистого русла может быть увеличен до 48 ч. Стабилизация молекулы нативного гемоглобина может быть достигнута также путем внутримолекулярной химической сшивки с использованием, например, диаспирина. Одним из весьма перспективных подходов к решению вышеупомянутых задач является также создание липосомальной формы гемоглобина в виде искусственных микроэритроцитов. За рубежом кровезаменители на основе гемоглобина активно разрабатывают 7 компаний: Aji Pharma USA, Baxter Healthcare Corporation, Biopure/ Upjohn, Enzon, Hemosol, Northfield Laboratories и Somatogen. Два препара- 562 _____Глава 12. Альтернативы переливанию крови та: о-раффиноза-полимеризованный гемоглобин «Hemolink» (Hemosol, США) и бычий гемоглобин, «упакованный» с использованием ПЭГ (полиэтилен-гликоль), технологии Enzon (США) получили разрешение к клиническому использованию, а еще три проходят клинические испытания. Первый отечественный кровезаменитель-переносчик кислорода на основе полимеризованного гемоглобина создан сотрудниками Российского НИИ гематологии и трансфузиологии Минздрава России и Института высокомолекулярных соединений РАН под руководством члена-корреспондента РАМН профессора Е. А. Селиванова. Молекулярная масса препарата — ISO-260 к Да, Р50 О2 — 28 торр, период полувыведения — 8-14 ч. Одна лечебная доза кровезаменителя содержит 4 г гемоглобина, в качестве стабилизаторов и антиокислителей использованы глюкоза и аскорбиновая кислота. Выпуск препарата осуществляется в лиофильно высушенной форме. Препарат хорошо переносится, улучшает кислородный режим организма, системную гемодинамику и микроциркуляцию, уменьшает степень анемии. Преимущества кровезаменителей на основе гемоглобина: — возможность длительного хранения (особенно в лиофильно высушенной форме); — использование немедленно без предварительного определения групп крови; — инфекционная безопасность. История создания кровезаменителей-переносчиков кислорода на основе модифицированного гемоглобина и первых клинических испытаний наиболее совершенных вариантов показывает возможность применения их при острой кровопотере, различных видах анемии, депрессиях кроветворения, ишемии различного генеза, кардиоплегии, при консервации органов. Учитывая, однако, все недостатки растворов модифицированного гемоглобина первого поколения, реально можно рассчитывать на эффективность их использования при острой кровопотере в первые часы до начала гемокомпонентнои терапии в специализированном лечебном учреждении. 12.3. Альтернативы трансфузиям тромбоцитов Возможность совершенствования стандартной технологии криоконсерви-рования появляется при использовании ингибиторов активации тромбоцитов. Добавление этих веществ позволяет сократить концентрацию ДМСО с 6 до 2 % при улучшении функции клеток. Кроме того, отрабатываются способы длительного хранения высушенных и замороженных тромбоцитов. Клеточная терапия_______________________________ 563 Предложена новая стратегия хранения тромбоцитов в жидком состоянии при температуре 4 °С. Для сохранения морфофункциональной полноценности при таком консервировании используют ингибиторы актина цитоскелета, ингибиторы вторичных клеточных мессенджеров; дисахарид, гликопротеины — антифризы (последние изолированы из рыб, обитающих в полярных регионах). Разработан оригинальный продукт — мембраны тромбоцитов для инфу-зий (Cypress Bioscience, США). Они готовятся путем фрагментации тромбоцитов (из концентратов клеток с истекшим сроком хранения) до фосфоли-пидных мицелл, на которых отсутствуют HLA-антигены, но экспрессированы гликопротеины. В эксперименте показан гемостатический эффект инфузий мембран тромбоцитов при тромбоцитопении. Фибриноген (точнее, одна из его пептидных последовательностей — RGD-аргинин-глицин-аспартат) связывает интегрин с GPIIbIlIa-рецептором тромбоцитов. Поскольку таких последовательностей в фибриногене несколько, то стимулированные тромбоциты образуют агрегаты. Этот феномен может быть воспроизведен эритроцитами, покрытыми фибриногеном или RGD. Разрабатываются синтетические альтернативы тромбоцитам: — микросферы альбумина, покрытые фибриногеном; — липосомы , покрытые гликопротеином 1Ь; — прокоагулянтные липосомы с активированным фактором X. Для уменьшения аллоиммунизации существует два подхода к производству HLA-редуцированных тромбоцитов: 1) обработка хлорохином; 2) кислотная обработка. Однако эта работа находится в экспериментальной стадии [BlajmanM. А.,2001]. 12.4. Клеточная терапия Традиционные технологии предполагают использование клеток крови, достигших конечной стадии дифференцировки — эритроцитов, тромбоцитов, лейкоцитов. В настоящее время к этому арсеналу добавляются недифференцированные клетки-предшественники гемопоэза, полученные из периферической или пуповинной крови. Методы современной клеточной терапии представлены в табл. 126. Используя разнообразные цитокины и ростовые факторы (их комбинации), вне организма можно поддерживать культуры клеток-предшественников, получать коммитированные и некоммитированные клетки. Достаточно эффективно в клинике применяются трансфузии донорских лейкоцитов при повторном развитии лейкоза после аллогенной транспланта- 564 Глава 12. Альтернативы переливанию крови Таблица 126 Методы клеточной терапии [Prowse С. V., 1998]
ции (ремиссия у пациентов с хроническим миелолейкозом развивается в 60-80 % случаев). Некоторый прогресс отмечается в генной терапии дефицита аденозинде-заминазы, хронического гранулематоза и болезни Гоше. 12.5. Стимуляторы гемопоэза 12.5.1. Эритропоэтин Высокая потребность лечебных учреждений в компонентах и препаратах крови сочетается с возрастающей себестоимостью последних, дополнительные трудности создает сокращение донорского контингента. Вышеизложенное обусловливает поиск альтернативных средств профилактики и лечения анемии. Одним из таких средств является рекомбинант- Стимуляторы гемопоэза______________________________565 ный человеческий эритропоэтин (ЭП), внедренный в клиническую практику за рубежом в 1987 г. Предпосылкой для создания рекомбинантного человеческого ЭП послужила изоляция и клонирование гена ЭП (об ЭП см. главу 5) в 1985 г. В 1995 г. разрешен к медицинскому применению рекомбинантный человеческий ЭП отечественного производства. Опыт использования лекарственных форм ЭП показал высокую эффективность этого препарата у различных категорий пациентов. Приведем патологические состояния (лечебные мероприятия), при которых применяется эритропоэтин: — хроническая почечная недостаточность (диализные и предиализные пациенты); — онкологические заболевания (цитостатическая терапия); — трансплантация органов и тканей; — СПИД (терапия ВИЧ-инфекции зидовудином); — аутодонорство; — пред- и послеоперационный периоды без аутодонорства; — анемия при хронических воспалительных заболеваниях; — анемия у ослабленных пациентов (пожилые люди, недоношенные дети, обожженные и т. д.); — отказ от трансфузий аллогенных гемокомпонентов. ЭП признан неотъемлемой составляющей длительной заместительной терапии больных с хронической почечной недостаточностью (ХПН), находящихся на программном гемодиализе. Число таких пациентов во многих странах мира превышает 200 человек на 1 млн населения (в Японии — 710). У 95-98 % пациентов с ХПН, получающих гемодиализ, имеются показания для назначения препаратов ЭП (содержание гемоглобина около 80 г/л). Схемы назначения ЭП отработаны и совершенствуются. Показана эффективность комбинации ЭП с препаратами железа, витаминами, кальцитриолом. Через неделю после начала терапии количество ретикулоцитов в крови возрастает в 2-3 раза, а через 2-3 нед увеличивается содержание гемоглобина. Хирургические болезни часто сопровождаются анемией вследствие нарушенной продукции ЭП. Массивная хируругическая травма может еще более угнетать продукцию ЭП, особенно у женщин. В плановой хирургии ЭП широко используется при заготовке аутологичных гемокомпонентов. Для обеспечения донаций двух доз аутокрови перед ортопедическими операциями или операциями на сосудах оптимальным считают подкожное введение ЭП (250 ЕД/кг дважды в неделю в течение 3 нед [Biesma D. et al., 1994]. Перед протезированием суставов пациентам с ревматоидным артритом вводили 400-800 ЕД/кг ЭП подкожно 1 раз в неделю. Аутологичную кровь заготавливали после повышения содержания гемоглобина на 5 % или более. 566________________Глава 12. Альтернативы переливанию крови При таком режиме удается заготовить 1-3 дозы крови и в большинстве случаев отказаться от аллогенных трансфузий. Введение ЭП не влияет на проявления ревматоидного артрита. Введение ЭП (300 ЕД/кг) в течение 14 дней периоперационного периода существенно снижает необходимость в гемотрансфузиях при протезировании тазобедренного сустава [Bailey W. et al., 1995]. Особое значение имеет применение ЭП при аутодонациях перед операциями на сердце и печени, когда необходимо заготовить 4-6 доз крови. С момента начала использования ЭП он приобрел колоссальное значение для кардиохирургии. Мультицентровый анализ гемотрансфузионного пособия при операциях аортокоронарного шунтирования (АКШ) показал, что 59 % пациентов получают гемотрансфузии только в день операции (75 % крови всей переливаемой крови), 95 % пациентов получают до 4 доз крови, что позволяет рекомендовать заготовку аутологичных гемотрансфузионных сред перед операцией АКШ. При необходимости кардиохирургических операций у пациентов с анемией (гемоглобин менее 100 г/л) апробировано введение 600-700 ЕД/кг ЭП в неделю в течение 2-12 нед, что приводит к повышению содержания гемоглобина (110-145 г/л), дает возможность заготовить 400-1200 мл аутокрови и ликвидировать потребность в аллогенных трансфузиях у 90 % пациентов. Показана также высокая эффективность сопровождения аутодонаций перед кардиохирургической операцией внутривенным введением ЭП в дозе 200 ЕД/кг 3 раза в неделю и приемом perosсульфата железа 210 мг/день. При внутривенном введении ЭП 2 раза в неделю в течение 4 нед более эффективно использовать 400-800 ЕД/кг в сочетании с препаратами железа. В качестве триггеров аутодонаций рекомендуют считать содержание гемоглобина 130 г/л и уровень гематокрита 34 %. При этом аллогенные гемо-компоненты исключаются у 81 % пациентов. Использование ЭП позволяет усовершенствовать программу предопера-ционого резервирования аутокрови в клинике торакальной хирургии. При незлокачественных заболеваниях перед пневмонэктомиями, лобэктомиями и сегментэктомиями однократно забирают 1200-1600 мл крови с последующим введением 3000 ЕД ЭП внутривенно. При этом трансфузии аллогенной крови исключаются у 85 % пациентов. При противопоказаниях к аутодонаций рекомендуется вводить ЭП подкожно в течение 3-4 дней до и после операции в дозе 100 ЕД/кг в сочетании со 100 мг железа внутривенно. После аллогенной трансплантации костного мозга рекомендуется ежедневное внутривенное введение рекомбинантного человеческого эритропоэтина в дозе 150 ЕД/кг до достижения гематокрита свыше 35 %. При этом происходит более быстрое восстановление эритропоэза и необходимость трансфузий эритроцитов снимается в среднем на 17-й день (на 7 дней раньше, чем без Стимуляторы гемопоэза___ 567 применения ЭП). Использование ЭП позволяет избежать посттрансфузион-ной иммуносупрессии при отсроченном иммунном гемолизе у реципиентов ал-логенного костного мозга от АВО-несовместимых доноров. Важно, что при применении ЭП после трансплантации костного мозга быстрое восстановление эритропоэза происходит не в ущерб восстановлению других ростков кроветворения, т. е. «соревнование стволовых клеток» отсутствует, и содержание лейкоцитов и тромбоцитов своевременно восстанавливается. Продукция и сывороточный уровень ЭП снижены при анемии у онкологических и инфекционных больных пожилого возраста, соответственно использование ЭП у этой категории пациентов патогенетически оправдано и весьма эффективно. Более того, применение ЭП позволяет заготавливать аутокровь у пациентов 65 лет и старше с анемиями различного генеза и даже у пациентов старше 80 лет. Показана эффективность ЭП в коррекции анемии при синдроме приобретенного иммунодефицита, бронхолегочной дисплазии, после трансплантации легких. С использованием двойного слепого метода исследования показано, что применение ЭП снижает на 40 % потребность в гемотрансфузиях у недоношенных детей, способствует стимуляции эритропоэза. Побочное действие ЭП представляет собой ответ функциональных систем организма, адаптированных к условиям анемии, на существенное и достаточно быстрое увеличение уровня гемоглобина. Так, гипертензия является вторичным следствием увеличения гематокрита при увеличенном сердечном выбросе и повышенной резистентности сосудов. Отмечающуюся в некоторых случаях тенденцию к микротромбозу связывают с увеличением гематокрита, повышением вязкости крови, агрегации и адгезии тромбоцитов, тромбоцито-зом (редко), снижением содержания протеина С и протеина S [Шевченко Ю. Л. и др., 1996]. Повышение содежания натрия, фосфатов и креатини-на в крови пациентов на хроническом гемодиализе, получающих ЭП, может быть обусловлено нарушением диеты или снижением клиренса при гемодиализе вследствие повышения гематокрита. Причины резистентности к ЭП: — другие причины нарушения эритропоэза (дефицит железа, витамина В12, фолиевой кислоты, гиперпаратиреоидизм, инфекции, опухоли и т. д.); — продолжающееся кровотечение; — гемолиз; — образование антител к рекомбинантному ЭП. Таким образом, внедрение препаратов ЭП повышает эффективность лечебных мероприятий по коррекции и профилактике анемий, сокращает гемо-трансфузионную нагрузку и улучшает качество жизни потенциальных реципиентов аллогенных эритроцитов. 568 Глава 12. Альтернативы переливанию крови 12.5.2. Гранулоцитарный колониестимулирующий фактор (Г-КСФ) в хирургической практике. Другие стимуляторы гемопоэза Среди цитокинов, стимулирующих гемопоэз, особенно интенсивно изучается в эксперименте и в клинике Гранулоцитарный колониестимулирующий фактор (Г-КСФ), который был выделен, очищен и клонирован в 1980-х гг. Г-КСФ — гликопротеин, регулирующий нейтрофильный гранулоцитопоэз, а также модулирующий функции зрелых нейтрофилов. Г-КСФ укорачивает время созревания нейтрофилов с 5 до 1 дня, что ведет к быстрому выходу зрелых нейтрофилов из костного мозга в периферическую кровь. Эти свойства Г-КСФ позволили успешно использовать его для профилактики и лечения нейтропении, интенсификации химиотерапии и получения стволовых клеток для последующей трансплантации. Г-КСФ у человека синтезируется фибробластами, эндотелиальными клетками и моноцитами. Рецепторы Г-КСФ экспрессируются на клетках нейтро-фильного ряда от миелобластов до нейтрофилов, на клетках моноцитоидно-го ряда и некоторых негемопоэтических клетках. Фагоцитирующие клетки являются одним из важнейших звеньев иммунитета, обеспечивающих защиту при хирургических повреждениях. При воздействии Г-КСФ на лейкоциты происходит активация клеток, что ведет к увеличению их размеров, повышает складчатость клеточных мембран параллельно повышению внутриклеточной продукции гидроперекисей. Изменяя спектр экспрессии поверхностных молекул, Г-КСФ регулирует взаимодействие нейтрофилов с эндотелиальными клетками в тканях и обеспечивает пополнение численности лейкоцитов в очаге воспаления. Хирургическая травма и полиорганная недостаточность (ПОН) — серьезные проблемы, связанные с осложнениями после хирургических операций, ранений и сочетанных повреждений, сопровождаются высокой летальностью, несмотря на развитие способов поддержания функций органов, трансфузи-онно-инфузионной и антибактериальной терапии. Хотя механизмы этих патологических состояний все еще не полностью понятны, в настоящее время известно, что кровотечение, анестезия, гиповолемическая ишемия, реперфузия и инфекция — коэтиологические факторы ПОН. У хирургических пациентов существенно изменяется состояние иммуно-компетентных клеток, уровень продукции и содержания в крови различных цитокинов. Дисбаланс цитокиновой сети является важнейшей причиной развития неэффективных иммунных реакций и нарушения гомеостаза. При оптимальном ответе на хирургический стресс синхронно повышается сывороточная концентрация ИЛ-1, -6, -8, ФНО-сс и Г-КСФ, достигая максимума в 1-е сутки, с последующим снижением в течение 7 дней. Стимуляторы гемопоэза S69 При обследовании разных групп пациентов (ишемическая болезнь сердца, рак пищевода, механическая травма и др.) показано, что относительно низкий уровень и преимущественное снижение содержания Г-КСФ свидетельствуют о развитии иммунодефицита и угрозе гнойно-воспалительных осложнений. Причины недостаточного содержания Г-КСФ уточняются. Четко установлено существенное снижение резервных возможностей кроветворения и им-муногенеза у пожилых пациентов, что может рассматриваться как показание для использования препаратов Г-КСФ в клинических ситуациях, требующих функционального напряжения миелопоэза. Рекомбинантный человеческий Г-КСФ (рГ-КСФ), вырабатываемый бактериями Escherichiacoli(филграстим), производится с середины 1980-х гг., и с этого времени началось его клиническое изучение. Применение рГ-КСФ у здоровых добровольцев молодого и пожилого возрастов в дозах 30 и 300 мкг/сут показало, что препарат значительно увеличивал количество митозов в костномозговых клетках нейтрофильного ряда и укорачивал время созревания постмитотических клеток. Использование дозы 300 мкг/сут приводит к достоверному повышению количества нейтрофилов в периферической крови и активизирует их функциональную активность. Стремительное накопление данных о механизмах влияния Г-КСФ на лейкоциты позволило предположить, что этот препарат может быть эффективен не только у пациентов с нейтропенией, но и у больных с нормальным и даже повышенным содержанием лейкоцитов как иммуномодулирующий агент. Показано, что рГ-КСФ: — повышает способность фагоцитов генерировать супероксиданион-ра-дикал — основной действующий фактор кислородзависимой микробицид-ности; — увеличивает уровень экспрессии рецепторов, вовлеченных в процессы адгезии, диапедеза, хемотаксиса и фагоцитоза; — повышает способность лейкоцитов секретировать эластазу и лактофер-рин; — стимулирует миграцию нейтрофилов в очаг воспаления; — стимулирует киллинг опсонизированных бактерий; — снижает уровень и активность цитокинов — индукторов синдрома системного воспалительного ответа (в первую очередь ФНО); — снижает уровень бактериемии. Исследование противовоспалительного потенциала Г-КСФ, динамики его продукции в ходе хирургического вмешательства и результаты апробации в опытах на животных явились основанием для использования этого цитокина в клинической практике для профилактики и лечения различных воспалительных и инфекционных осложнений. Однако серьезным препятствием к применению рГ-КСФ при бактериемии и сепсисе было опасение, что инду- 570 Глава 12. Альтернативы переливанию крови цированный препаратом нейтрофилез может приводить к острому поражению легких (реакции острого респираторного дистресс-синдрома). Экспериментальные исследования и клиническое изучение больных, подвергшихся резекции легких, показали, что рГ-КСФ не увеличивает клиренс жидкости через альвеолярный эпителий. Хотя введение рГ-КСФ приводило к почти пятикратному возрастанию количества нейтрофилов, инъекции бактериального липополисахарида (ЛПС) на этом фоне не вызывали изменений оксигенации крови или артериального давления. Частота развития острых повреждений легких не увеличивалась в группе животных, получавших рГ-КСФ и ЛПС по сравнению с контрольной группой (получавшей только ЛПС). При этом у животных, не получавших рГ-КСФ, отек легких и выпот белкового транссудата в альвеолы был более значительным. Таким образом, индуцированный рГ-КСФ нейтрофилез не имел неблагоприятных последствий при ответе на ЛПС у экспериментальных животных и хирургических пациентов, но приводил к активации иммунных реакций, снижая частоту возникновения и активность течения инфекционных и воспалительных реакций. В настоящее время накоплен и некоторый клинический опыт применения рГ-КСФ для профилактики и лечения послеоперационных воспалительных осложнений. Безопасность применения низких доз рГ-КСФ (филграстим) в лечении хирургических пациентов была исследована на 20 больных с синдромом системного воспалительного ответа и сепсисом. Филграстим назначался внутривенно в дозе 1 мкг/кг в течение 3 дней, а затем в дозе 0,5 мкг/кг еще 4 дня. Ни у одного из больных с синдромом системного воспалительного ответа не развились сепсис и полиорганная недостаточность, при этом уровни ИЛ-6 и ИЛ-8 достоверно снизились в первые 3 дня от начала лечения. Ни у кого из больных не были зарегистрированы какие-либо отрицательные эффекты. Во время введения филграстима повышался уровень Г-КСФ, достоверно возрастало количество лейкоцитов и на них изменялась экспрессия поверхностных рецепторов. Таким образом, назначение филграстима приводило к увеличению эффективности антибактериальной терапии и улучшению функции нейтрофилов, снижало гиперактивность провоспалительных процессов [Gross-WeegeW. et al, 1997]. Рандомизированное изучение эффективности рГ-КСФ было проведено у больных диабетом с воспалительными пораженими стопы. У больных, получавших рГ-КСФ (20 пациентов) и плацебо (20 пациентов) применялись сходные режимы антибактериальной терапии и инсулинотерапии. Терапия рГ-КСФ приводила к более ранней эрадикации патогенных микроорганизмов из инфицированных язв, более быстрому разрешению целлюлита и сокращению сроков госпитализации, более короткой длительности курсов внутривенного введения антибиотиков. Ни один из больных, получавших рГ-КСФ, не нуждался в хирургическом вмешательстве, в то время как в группе сравнения у Стимуляторы гемопоэза______________________________571 4 больных проведены операции (причем у 2 — ампутации). При проведении терапии рГ-КСФ у больных к 7-му дню достоверно повышалась продукция нейтрофилами супероксиданион-радикала, при этом терапия рГ-КСФ хорошо переносилась пациентами [Gough A. et al., 1997]. Применение филграстима (5 мкг/кг/сут) в периоперационный период при резекции и пластике пищевода у 30 больных раком пищевода позволило снизить частоту инфекционных осложнений с 39 % в контроле до 10,5 %. При этом летальность уменьшилась с 9,1 % до 0. У И онкологических пациентов при проведении радикальной вульвэктомии назначение филграстима в дозе 300 мкг/сут до и после операции (вместе со стандартной антибактериальной терапией) приводило к уменьшению раневого отделяемого, снижению температуры тела и увеличению доли больных с полным первичным заживлением ран [Lorenz W. et al., 1994]. У 3 больных с рефрактерным хроническим синуситом, которым не помогали ни антибактериальная терапия, ни хирургическое лечение, назначение филграстима в дозе 300 мкг /сут привело к полной ремиссии инфекционного процесса. Интересен также случай применения рГ-КСФ у пациента с инфекционным эндокардитом, резистентным к терапии антибактериальными препаратами. При использовании рГ-КСФ отмечались трехкратное увеличение числа лейкоцитов при нормализации уровней СОЭ С-реактивного белка, нормализация температуры без каких-либо побочных эффектов. В посттрансплантационном периоде у реципиентов аллогенной печени, получавших рГ-КСФ (5-10 мкг/кг/сут), частота сепсиса была снижена в 3, а острого отторжения — в 2,5 раза по сравнению с контрольной группой. Аналогичные данные в эксперименте получены в отношении пересадки сердца, что связывают со сниженным уровнем ФНО. Таким образом, имеются убедительные основания считать рГ-КСФ (его препарат филграстим) эффективным иммуномодулирующим агентом, который стимулирует селективное привлечение к очагам инфекции нейтрофилов, повышает бактерицидный потенциал этих клеток, нормализует баланс про-воспалительных цитокинов. Уникальные свойства препарата позволяют использовать его для повышения неспецифической резистентности у больных с иммунодефицитными состояниями различного генеза, пожилых пациентов, а также у хирургических больных, имеющих высокий риск развития инфекционных осложнений. При этом следует помнить об основном принципе проведения иммуномодулирующей терапии — индивидуализации: определении четких показаний, дозы и режима введения препарата [Волчек И. В., 2001]. Также доступен и гранулоцитарно-макрофагальный колониестимулиру-ющий фактор (ГМ-КСФ) ГМ-КСФ (саргармостим) вводят после аутологичной трансплантации костного мозга — 250 мг/м2 внутривенно в течение 2 ч ежедневно 21 день. 572 Глава 12. Альтернативы переливанию крови Возможны побочные эффекты: синдром повышенной проницаемости капилляров и гриппоподобный синдром. При отторжении или медленном приживле-нии аллотрансплантата — ТКМ 250 мг/м2 внутривенно в течение 2 ч ежедневно 14 дней. Если приживление не произошло — повторить через 7 дней; можно провести третий курс — еще через 7 дней 500 мг/м2/сут. Последние достижения в области ростовых факторов гемопоэза связаны со стимуляцией мегакариоцитарного ростка. Проходит клинические испытания рекомбинантный тромбопоэтин, а И Л-11 уже рекомендован для коррекции тромбоцитопении после пересадки костного мозга. 12.6. Лейкоцитарные фильтры 4 августа 2000 г. министр здравоохранения Российской Федерации издал приказ № 311 «О мерах по повышению безопасности гемотрансфузий», в котором предписывается обеспечить внедрение в практику лечебно-профилактических учреждений и учреждений службы крови методов фильтрации трансфузионных сред. Побочные эффекты гемотрансфузий (см. главы 14 и 15), обусловленные примесью лейкоцитов в гемокомпоненте, в обобщенном виде представлены в табл. 127. Таблица 127 Нежелательные эффекты примеси лейкоцитов в переливаемых клеточных компонентах крови
573 Лейкоцитарные фильтры Возможно, фрагменты разрушающихся при хранении лейкоцитов способствуют экспрессии на мембране эритроцитов скрытых антигенов или других субстанций, опосредующих связь эритроцитов с фагоцитами селезенки. Таким образом, в гемоконтеинере моделируется процесс старения эритроцита. Также возможно, что фрагменты мембран апоптозных лейкоцитов прилипают к эритроцитам и непосредственно дают сигнал «захвати меня» фагоцитам реципиента. Соответственно после переливания такие эритроциты будут находиться в циркуляции очень недолго. Учитывая достаточно четкую зависимость развития посттрансфузионных осложнений от количества лейкоцитов (рис. 43), Европейский Совет по транс-фузионной медицине рекомендует снижать примесь лейкоцитов в дозе клеточных компонентов крови менее чем до 1,0х10б. Традиционные методы уда- 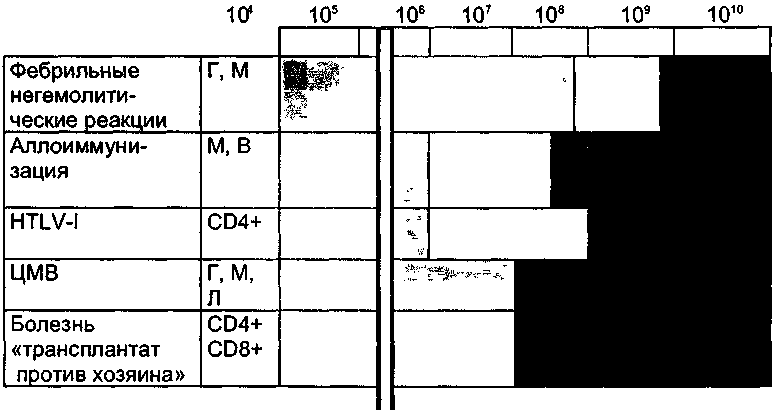 Число лейкоцитов в ЭМ / КТ (< 2 х 105) после пропускания через лейкоцитарный фильтр Imugard III ______Terumo (Япония)______ Ц высокая встречаемость | | неизвестно предотвращает Рис. 43. Посттрансфузионные реакции и осложнения, обусловленные примесью лейкоцитов в клеточных компонентах крови. Г — гранулоциты; М — моноциты; В — В-лимфоциты; Л — лимфоциты; CD4+ — Т-хелперы; CD8+ — Т-супрессоры. 574 Глава 12. Альтернативы переливанию крови ления лейкоцитов (центрифугирование, криоконсервирование, отмывание, использование фильтров первого и второго поколений) не дают подобной чистоты (табл. 128 и 129). Лейкоцитарные фильтры третьего поколения фирмы Terumo (Япония) — Imugard III-RC (для эритроцитсодержащих сред) и Imugard III-PL (для концентрата тромбоцитов) позволяют выполнить эти рекомендации — удалить из клеточных компонентов крови микроагрегаты и до 99,99-99,999 % лейкоцитов, снижая их уровень менее чем до 2,0x10 5 (табл.129 и 130). В процессе хранения крови или ее клеточных компонентов происходит частичное разрушение лейкоцитов. Образующиеся фрагменты, как и целые лейкоциты, могут вызывать HLA-аллоиммунизацию, а освободившиеся из клеток цитокины и другие биологические вещества — фебрильные и нефеб-рильные посттрансфузионные реакции. Учитывая это, выпускаются две разновидности лейкоцитарных фильтров: — для фильтрования клеточных компонентов крови сразу после их изготовления в учреждениях службы крови; — для фильтрования клеточных компонентов крови у постели больного в процессе их переливания. Использование лейкоцитарных фильтров третьего поколения Imugard III-RC при переливании эритроцитсодержащих сред рекомендуется: Таблица 128 Применение фильтров при переливании компонентов крови
Таблица 129 Примесь лейкоцитов в эритроцитсодержащих средах, полученных различными методами
Примечание. +/++/+++ — показана; - — не показана; (+) — по индивидуальному подбору; (1) — доза приготовлена из 500 мл консервированной крови; ЭМОЛТ — эритроцитная масса, обедненная лейкоцитами и тромбоцитами; РОЭ — размороженные отмытые эритроциты. Таблица 130 Примесь лейкоцитов в концентратах тромбоцитов, полученных различными методами
576 Глава 12. Альтернативы переливанию крови — при повторных фебрильных негемолитических посттрансфузионных реакциях; — при предполагаемом длительном повторном переливании эритроцитсо-держащих сред; — у потенциальных кандидатов на трансплантацию костного мозга; " — у HLA-аллоиммунизированных и рефрактерных больных с анемиями. Использование лейкоцитарных фильтров третьего поколения Imugard III-PL при переливании КТ рекомендуется : — при повторных фебрильных негемолитических посттрансфузионных реакциях; — при предполагаемой длительной повторной тромбоцитотерапии; — у потенциальных кандидатов на трансплантацию костного мозга; — у аллоиммунизированных и рефрактерных больных с кровотечениями. Во многих странах мира введено или будет введено в ближайшее время обязательное удаление лейкоцитов из эритроцитов, тромбоцитов и плазмы. Весьма важный момент при проведении процедур фильтрации — сохранение закрытого контура. Инструкция по использованию первого отечественного лейкоцитарного фильтра УЛЛ-01 («Интероко», Московская область) предусматривает промывание физиологическим раствором. Использование дополнительной среды делает систему открытой, поэтому фильтрованные эритроциты необходимо перелить в течение 24 ч. Для стерильного встраивания лейкоцитарных фильтров путем соединения трубок «конец в конец» разработаны специальные устройства — «сте-рильконнекторы» (например, TSCD, Terumo sterile tubing welder, Terumo Corporation, Япония). Компактный, весом 5,5 кг, TSCD позволяет при температуре 320 °С, не повреждая клетки крови, стерильно соединять трубки с наружным диаметром 3,9-4,5 мм, внутренним диаметром от 2,9 до 3,1 мм, т. е. фактически все трубки, применяющиеся в трансфузиологической практике. Помимо встраивания лейкоцитарных фильтров, TSCD весьма эффективен при пулировании тромбоцитов. Доступны системы со встроенными лейкоцитарными фильтрами, позволяющие в закрытой системе получить: — цельную кровь (рис. 44); — эритроцитную взвесь и плазму (фильтрация цельной крови) (рис. 45); — -эритроцитную взвесь, плазму (с раздельной фильтрацией) и лейко-тромбоцитарный слой. А. В. Голубева (2001) и R. Walter и соавт. (2001) отмечают, что реологические свойства фильтрованной трансфузионной среды улучшаются. 577 Лейкоцитарные фильтры 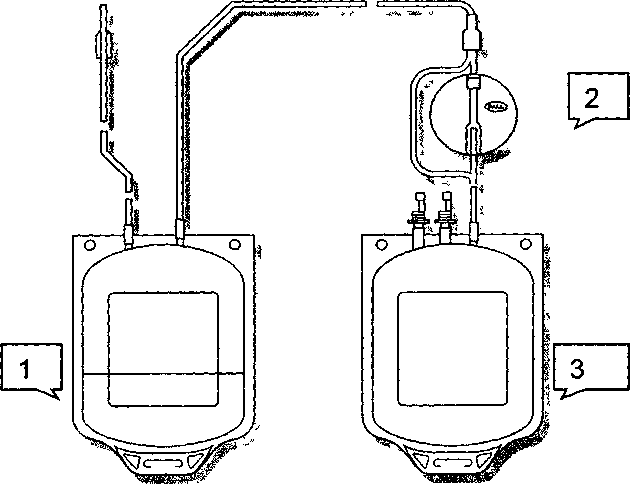 Рис. 44. Закрытая система пластиковых контейнеров для заготовки крови с интегрированным лейкофилътром Leukotrap A1 (Pall). 1 — контейнер для сбора 450 мл цельной крови (с иглой для забора крови; содержит 63 мл CPDA-1); 2 — лейкоцитарный фильтр; 3 — контейнер для сбора крови, обедненной лейкоцитами. Мероприятия, повышающие безопасность гемотрансфузий, ведут к увеличению стоимости гемотрансфузионных средств. Так, по подсчетам D.Provan (1999) после введения обязательного требования удаления лейкоцитов из эритроцитсодержащих сред стоимость одной дозы эритроцитнои массы возрастет с 29,14 до 78,88 фунтов стерлингов. Затраты на внедрение элиминации лейкоцитов из всех гемокомпонентов в Великобритании составляют 40 млн фунтов стерлингов в год [Williamson L. M. et al., 2001]. Оптимально разрабатывать целевые программы развития службы крови (региона, лечебного учреждения и т. д.), предусматривающие совершенствование производства гемокомпонентов и оказания специализированной медицинской помощи. 578 Глава 12. Альтернативы переливанию крови 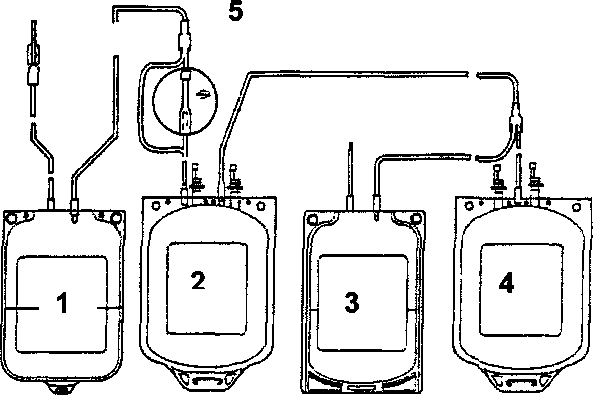 Рис. 45. Закрытая система пластиковых контейнеров для заготовки крови с интегрированным лейкофилътром Leukotrap WB (Pall). 1 — контейнер для сбора 450 мл цельной крови (с иглой для забора крови; содержит 63 мл CPD); 2 — переходный контейнер; 3 — контейнер для обедненной лейкоцитами эритроцитной взвеси (содержит 100 мл SAGM); 4 — контейнер для плазмы; 5 — лейкоцитарный фильтр. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
