фармакология. Лекция 1. Общая фармакология. Фармакология
 Скачать 1.35 Mb. Скачать 1.35 Mb.
|
Классификация психостимуляторов.Производные фенилалкиламина:фенамин. Производные пиперидина:меридил. Производные сиднонимина:сиднокарб. Производные ксантина:кофеин. Лекарственные растения:жень-шень; китайский лимонник; элеутерококк; кофе, чай. Механизм действия.В основе лежит активация адренергической передачи на всех уровнях (от ЦНС до исполнительных органов). Это происходит за счет следующих процессов (см. рис.): психостимуляторы являются непрямыми адреномиметиками, т.е. способствуют выделению адреналина и норадреналина в синаптическую щель и взаимодействию с адренорецепторами; психостимуляторы угнетают процесс обратного захвата медиаторов в пресинаптическое волокно; 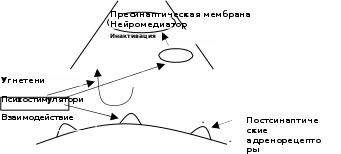 психостимуляторы являются конкурентными ингибиторами МАО. психостимуляторы являются конкурентными ингибиторами МАО.
Постсинаптическая мембрана Рис. Механизм действия психостимуляторов Психостимулирующее действие. Фармакодинамика.Пропадает сонливость (на 10-12 часов), появляется желание работать, целеустремленность, эйфория. Однако, снижается внимание и увеличивается количество ошибок при выполнении работы. У психически больных и у здоровых при передозировке способны провоцировать бредовые идеи, мании и галлюцинации. Повышение физической выносливости. У человека повышается темп и объем выполняемой работы. Однако происходит ослабление контроля опасности предела физических нагрузок (т.е. развивается «допинговый эффект»). Сужение сосудов, повышение АД, тахикардия. Усиление гликогенолиза в печени, мышцах, миокарде; липолиза в жировой ткани. Вызывают анорексию. Показания к применению.Депрессивные состояния с явлениями заторможенности; астения и астенические неврозы при нейроинфекциях; адинамия при гипертиреозе. Побочные эффекты.Сухость во рту; повышение АД; головная боль; боль в области сердца; аллергические сыпи; нарушение суточного ритма сна; развитие пристрастия при длительном применении (кофеизм). Лекция №10.НООТРОПНЫЕ СРЕДСТВА. АДАПТОГЕНЫ. АКТОПРОТЕКТОРЫ. ОБЩИЕ СВОЙСТВА. ЛС «ЭКОНОМИЗИРУЮЩЕГО ТИПА». Стимулирующий эффект препарата зависит от его способности нормализовать обмен веществ. Применение препаратов не приводит к активации функции симпато-адреналовой системы, не зависит от обмена катехоламинов, не является допингом. Препараты малотоксичны. Побочные эффекты малочисленны. Могут быть применены не только у больных людей, но и у здоровых с целью повышения умственной и физической работоспособности. Ноотропные средства.Ноотропные средства (noos-разум) – это группа ЛС, оказывающие специфическое активирующее влияние на интегративные функции мозга, стимулирующие обучение, умственную деятельность, повышающие устойчивость организма к агрессивному воздействию, а также способные улучшать мозговое кровообращение. Классификация ноотропных средств.Производные пирролидона:пирацетам (ноотропил). Производные ГАМК:натрия оксибутират; фенибут; аминалон; пикамилон. Нейропептиды:тиролиберин. Цереброваскулярные средства:кавинтон (винпоцетин); циннаризин; сермион; пентоксифиллин. Антиоксиданты:препаратывитаминов: токоферола ацетат (вит. Е); аскорбиновая кислота (вит. С); никотиновая кислота (вит. РР); кверцетин (вит. Р). Разные средства:актовегин; церебролизин; глутаминовая кислота. клетке: Механизм действия ноотропных средств.В основе механизма действия лежит в изменение биоэнергетических процессов в нервной увеличивается потребление глюкозы и кислорода нейронами; усиливается утилизация глюкозы; активация аденилатциклазы; усиление кругооборота АТФ; стимулирование синтеза РНК и белков; усиление в мозговой ткани обмена фосфатидилэтаноламина и фосфатидилхолина. Ноотропные средства также оказывают влияние на обмен медиаторов: им присуща N- метилдеаспартат потенцирующая активность, а также способность активизировать глутаматергические и ГАМК-ергические процессы. Таким образом, ноотропные средства, называемые нейрометаболическими церебропротекторами оказывают как нейромедиаторный эффект, так и метаболический, который реализуется стимуляцией скорости и активности процессов энергообеспечения нейронов. Фармакодинамика ноотропов.Ноотропный эффект – влияют на задержку развития или нарушение высших корковых функций, повышают уровень суждений и критических возможностей мозга; психостимулирующее действие – устраняется апатия и психическая заторможенность; седативный эффект – уменьшается раздражительность и эмоциональная возбудимость; атиастеническое действие; мнемотропное действие (способствуют улучшению запоминания). антидепрессивное действие; адаптогенное действие (повышают устойчивость мозга к воздействию неблагоприятных факторов окружающей среды); антиэпилептическое действие – предупреждают деградирование личности при применении противоэпилептических средств; антипаркинсоническое действие; иммуннокоррегирующее действие; повышение уровня бодрствования сознания. проявляют антигипоксический эффект. Показания к применению.Олигофрения: лечение олигофрении ноотропами проводится с целью повышения интеллектуальных возможностей мозга, а также стимуляции обучаемости. В геронтологической практике для лечения старческой деменции, в том числе при болезни Альцгеймера. Применение ноотропов позволяет сохранить интеллектуальные способности пожилых людей на более длительный срок. Лечение алкогольного слабоумия. Различные цереброваскулярные расстройства (последствия черепно-мозговых травм, инсультов) для ускорения и расширения процессов функциональной реабилитации. Комплексная терапия депрессий. Эпилепсия – в комплексной терапии с противоэпилептическими препаратами. ИБС и другие заболевания, сопровождающиеся ишемией. Побочные явления.Диспепсические расстройства; возбуждающее действие (пирацетам); сонливость (фенибут и натрия оксибутират); снижение АД и брадикардия (аминалон и кавинтон). Адаптогены.Адаптогены – это группа ЛС, повышающих неспецифическую сопротивляемость организма и увеличивающих его устойчивость к воздействию неблагоприятных факторов внешней среды. Классификация адаптогенов.Препараты растительного происхождения.настойка жень-шеня; экстракт элеутерококка; настойка лимонника китайского; препараты эхинацеи (настойка эхинацеи, имунал). Препараты животного происхождения.рантарин; пантокрин. Механизм действия адаптогенов.Активируют адаптивный синтез РНК и белков за счет мембранопротекторного действия и регуляции селективной проницаемости мембран. Антиоксидантное действие, которое реализуется путем повышения эндогенных антиоксидантов в организме. Ослабляют биохимические и функциональные сдвиги при стресс-реакциях. Фармакодинамика.Адаптогенное действие – повышают устойчивость организма к воздействию экстремальных факторов; тонизирующее действие – улучшают функции ЦНС, не вызывая эйфории и не нарушая суточных ритмов; актопротекторное действие; повышают устойчивость организма к инфекционным агентам; антиоксидантное действие, которое реализуется путем повышения эндогенных антиоксидантов в организме; защитное действие при интоксикации ксенобиотиками. Показания к применению:Неврозы и пограничные состояния. Астенические состояния. Общее ослабление функций организма после перенесенных заболеваний. Синдром хронической усталости (СХУ). Для профилактики стрессовых реакций. Правила приема адаптогенов.Длительность курса около 3-х месяцев. Время приема: осень, зима. Режим приема: настойки принимают натощак за 30 минут до еды по 15-20 капель. Режим питания: исключение из рациона жирных и пряных блюд, алкоголя. Побочные явления:Возбуждение ЦНС; повышение АД (редко). Актопротекторы.Актопротекторы – это группа ЛС, повышающих физическую и умственную работоспособность в экстремальных условиях. К ним относятся следующие препараты: -ацефен -бемитил Механизм действия.Улучшают метаболизм клеток организма. Бемитил стимулирует активность ферментов глюконеогенеза, что стимулирует аэробные пути деградации глюкозы. Показания к применению: (см. адаптогены). Побочные явления:Гипергликемия; диспепсические расстройства. Лекция №11.СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ (АНТИАНГИНАЛЬНЫЕ СРЕДСТВА). Ишемическая болезнь сердца (ИБС) – это острое или хроническое заболевание, которое возникает в результате уменьшения или прекращения кровоснабжения миокарда в связи с поражением коронарных сосудов. ИБС является собирательным понятием и включает стенокардию (angina pectoris) и инфаркт миокарда (ИМ). Ключевым звеном патогенеза ИБС является несоответствие между потребностью миокарда в кислороде (крови) и его доставка. Этиопатогенез ИБС.Причины, вызывающие уменьшение доставки кислорода ксердцу: атеросклероз коронарных артерий; тромбоз коронарных артерий; спазм коронарных артерий; нарушение микроциркуляции в миокарде в силу усиления агрегации тромбоцитов и снижения фибринолиза; гипотония и брадикардия; сердечная недостаточность. Причины, вызывающие увеличение потребности миокарда в кислороде(крови): стресс психоэмоциональный; сильное физическое перенапряжение; гипертрофия миокарда (у спортсменов); тиреотоксикоз; гипертония и тахикардия; инфекционный миокардит. Пример развития «порочного круга» при ИБС в условиях стресса. стресс  стимуляция симпато – адреналовой системы  выброс в кровь адреналина и норадреналина) Увеличение ЧСС, ССС, АД  (увеличение работы сердца и его потребности в кислороде) стенокардия 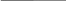 (большой синдром страха перед смертью) Основные принципы фармакотерапии ИБС.Уменьшение потребления сердцем кислорода (энергии) за счет снижения ЧСС, ССС, АД; увеличение энергообеспечения (доставки кислорода) сердца за счет усиления коронарного кровотока в результате расширения коронарных артерий; коррекция нервнопсихотического состояния больного и метаболизма в миокарде. Факторы риска: нерациональное питание (холестеринемия – атеросклероз); работа или учеба (стрессы); образ жизни: гиподинамия, вредные привычки. Классификация антиангинальных средств.Средства, уменьшающие потребность миокарда в кислороде:Органические нитраты: нитроглицерин; сустак; нитронг; тринитролонг; нитросорбид; эринит. Блокаторы кальциевых каналов. дилтиазем; нифедипин (фенигидин). -блокаторы (кардиоселективные1-блокаторы): талинолол; окспренолол; метапролол; небиволол. Средства, увеличивающие доставку кислорода к миокарду:Ингибиторыфосфодиэстеразы: но-шпа; эуфиллин; папаверин; карбокромен; пентоксифиллин. Ингибиторыаденозиндезаминазы: - дипиридамол (курантил). Антиагреганты: - ацетилсалициловая кислота (аспирин). Коронарорасширяющие средства, рефлекторного действия(коронаролитики): валидол. Средства, увеличивающие устойчивость сердечной мышцы к гипоксии:Средства, нормализующие электролитный баланс в миокарде: калия хлорид; аспаркам (панангин); калия оротат. Антиоксиданты: витамин Е; витамин С; кверцетин; витамин А; липоивая кислота. Средства, нормализующие окислительно-восстановительные процессы вмиокарде: цитохром С; рибоксин; фосфаден. Нитроглицерин. Является производным глицерина СН2 О NО2 СН О NО2 СН2 О NО2 Ранее существовало представление о том, что в основе антиангинального действия нитроглицерина лежит его способность расширять коронарные сосуды, т.е. оказывать коронаролитический эффект. Однако, позже инструментальными методами было доказано, что нитроглицерин практически не обладает коронаролитической активностью. Но, в тоже время, нитроглицерин оказывает выраженный вазодилатирующий эффект в отношении как резистивных (артерии, артериолы), так и емкостных (вены, венулы) сосудов. В результате этого происходит уменьшение как пред-, так и постнагрузки на сердце, что проявляется снижением выполняемой сердцем работы, а значит и уменьшение потребления миокардом кислорода, т. о. реализуется антиангинальная активность нитроглицерина и других препаратов из группы органических нитратов. Остается открытым вопрос о механизме расширения емкостных и резистивных сосудов под действием нитроглицерина. Для ответа на данный вопрос были проведены многолетние исследования ученых различных специальностей. Установлено, что под действием нитроглицерина происходит накопление в эндотелии сосудов EDRF – релаксирующего фактора, что приводит к расширению сосудов. Так как природа EDRF включает в себя NO-группу, то нитроглицерин является донатором NO группы.  Ионы кальция, проходя по своим медленным каналам внутрь клетки, непосредственно участвуют в гладкомышечном сокращении. При блокаде кальциевых каналов с помощью препаратов кальция входит в клетку, мышечное сокращение не происходит, а наоборот расслабление, что сопровождается расширением сосудов. Дезагреганты (аспирин). Фосфолипиды фосфолипаза Составные части: глицерин, РО4, ненасыщенные жирные кислоты – арахидоновая кислота ЦОГ Циклические эндоперекиси Простагландины Тромбоксан Простациклин Тромбоксан: - повышает агрегацию тромбоцитов; - способствует сужению сосудов. Простациклин: - снижает агрегацию тромбоцитов; - способствует расширению сосудов. Тромбоксан локализован в тромбоцитах, а простациклин содержится в эндотелии сосудов. Циклооксигеназа (ЦОГ) тромбоцитов более чувствительна к действию аспирина, чем циклооксигеназа эндотелиоцитов. ЦОГ тромбоцитов ингибируется ацетилсалициловой кислотой необратимо, а ЦОГ эндотелия сосудов – обратимо. Наиболее оптимальная доза введения аспирина как дезагреганта - 0,5 мг/кг 1раз в 3 дня. Ингибиторы аденозиндезаминазы.1 2 3 4 5 АТФ ц-АМФ АМФ Аденозин Инозин Гипоксантин 6 Ксантин Мочевая кислота выводится с мочой Ферменты, участвующие в обмене АТФ: Аденилатциклаза. Фосфодиэстераза. Нуклеотидаза. Аденозиндезаминаза. Нуклеозидфосфорилаза Ксантиноксидаза. цАМФ является эндогенным антигипоксантом сосудорасширяющего типа действия. Аденозин – коронаролитик и антигипоксант. При применении средств, блокирующих фосфодиэстеразу, происходит накопление цАМФ, а при применении ингибиторов аденозиндезаминазы – увеличение и накопление аденозина. Средства, применяемые при инфаркте миокарда.Для купирования болевого синдрома – наркотические анальгетики, нейролептаналгезия, иногда ингаляционные наркотические средства. Для восстановления ритмичной деятельности сердца – противоаритмические средства. Для профилактики тромбообразования и нормализации свертывающей функции крови - антикоагулянты, антиагреганты и фибринолитики. Для восстановления кислотно-основного равновесия при образовании некротической зоны - щелочные препараты. Лекция №12.СРЕДСТВА ДЛЯ НАРКОЗА. Общие анестетики – это группа Л.С., которые при введении в организм различными путями вызывают временную (обратимую) потерю сознания, всех видов чувствительности, снижение мышечного тонуса, рефлекторной активности, при сохранении жизненно-важных функций. В настоящее время применяется большое количество препаратов. Необходимость в значительном числе однотипно действующих средств обусловлено: Отсутствием «идеального» анестетика, полностью удовлетворяющего требованиям практики; При разных условиях хороши различные анестетики; Целесообразность сочетания препаратов, что позволяет максимально использовать достоинства каждого из них и свести к минимуму побочные эффекты. Классификация.Ингаляционные анестетики (вводятся через дыхательные пути):летучие жидкости: диэтиловый эфир; фторотан; метоксифлуран; изофлуран; энфлуран. газообразныевещества: закись азота; циклопропан. Неингаляционные анестетики (как правило вводятся внутривенно):Препараты короткого действия (до 10 – 15минут): кетамина гидрохлорид; Пропанидид (Сомбревин). Препараты средней продолжительности действия (20 – 50минут): натрия тиопентал; гексенал. Препараты длительного действия(60 минут иболе): натрия оксибутират. Механизм действия.Для объяснения механизма взаимодействия анестетиков с клетками широко привлекаются физико-химические закономерности. Наиболее жизнеспособной оказалась липоидная - теория Овертона- Мейера, усовершенствованная Н.В. Лазаревым, которая состоит из 3 постулатов: все липофильные химически инертные соединения обладают свойством анестетиков; сила наркотического действия пропорциональна степени липофильности; ЦНС весьма богатая липидами ткань, склонна избирательно сорбировать анестетики, которые накапливаются в ее мембранах. Накопление анестетиков в гидрофобных зонах мембран ведет к изменению тонкой структуры липидной фазы и ассоциированных с липидами белков, что сопровождается нарушением ряда свойств мембран. В результате внедрения молекул анестетика липидная основа набухает, в результате чего суживаются ионные каналы. Ионы натрия имеют значительно большую гидратную оболочку, чем ионы калия, поэтому в фазу возбуждения натрия не проникает в клетку, нарушается процесс деполяризации, и при отсутствии передачи импульса развивается наркотическое состояние. Кроме того, страдает также выход медиаторов ЦНС из везикул через пресинаптическую мембрану. Третьим следствием высказанного действия ЛС является нарушение структурно- функциональной организации ферментов дыхательной цепи в мембранах митохондрий и, возможно, перемещения через мембраны крупных ионов. В результате снижается интенсивность дыхания клеток, потребление кислорода мозгом и организмом в целом, снижается продукция АТФ. Наряду с изложенным резорбтивным действием, средства для наркоза оказывают местное действие (эфир) и рефлекторное (возбуждение рефлексов верхних дыхательных путей – угнетение дыхания, повышается тонус сосудов, повышается АД, активируются рефлексы с нижних дыхательных путей – учащение ЧДД, ЧСС, снижение тонуса сосудов, понижение АД). Ингаляционные наркотические средства.Ингаляцию летучих жидкостей и газообразных веществ проводят при помощи интубационной трубки (интратрахеальный наркоз) или наркозную маску с воздуховодами (масочный наркоз). С целью точного дозирования анестетика используется специальная аппаратура, которая сводит к минимуму возможность передозировки, позволяет добавлять в дыхательную смесь необходимую концентрацию кислорода, проводить при необходимости ИВЛ. Из организма общие анестетики выводятся легкими. Элиминацию их можно форсировать при помощи усиленной ИВЛ. Требования к ингаляционным анестетикам.Высокая наркотическая активность Большая наркотическая широта, т.е. достаточное соотношение концентраций анестетика в крови, вызывающих нужный уровень хирургического наркоза и концентраций, приводящих к параличу жизненно-важных функций (чаще дыхательного центра). Высокая анальгезирующая активность, которая позволила бы использовать анестетик для анальгезии без выключения сознания, потенцировала защитное действие средств премедикации против хирургической «агрессии» и сохранялась в ближайшем посленаркозном периоде. Хорошая управляемость наркозом – быстрое введение, хорошая регулируемость его глубины при изменении концентрации анестетика во вдыхаемой смеси, быстрое пробуждение без выраженной посленаркозной депрессии. Отсутствие стадии возбуждения – при введении в наркоз и выходе из него. Отсутствие раздражающего действия на слизистые дыхательных путей, которое вызывает чувство удушья и на сосудодвигательный центр. Отсутствие токсического влияния на печень и почки. Ряд технических условий – длительность хранения, невоспламеняемость, удобство и простота в применении. К сожалению ни один из существующих препаратов полностью не соответствует вышеперечисленным требованиям – каждый обладает преимуществами и недостатками, что требует осуществление рационального выбора препарата с учетом характера патологии у больного и условий проведения наркоза. Независимо от индивидуальных особенностей больных, в клинической картине наркоза выделяют следующие стадии, последовательно сменяющие друг друга по мере углубления наркотического сна (на примере эфира): – стадия аналгезии. Обычно продолжается 6-10 минут, характеризуется постепенной утратой болевых ощущений при частичном сохранении тактильной, температурной чувствительности и сознания. Частично развивается амнезия. Несколько повышена ЧСС. Характерно раздражающее действие на слизистые дыхательных путей (за счет способности эфира избирательно угнетать афферентный вход в активирующую систему ствола мозга, и увеличения выброса эндогенных анальгетиков). – стадия возбуждения. Продолжается 1-3 минуты, проявляется двигательным беспокойством, речевым возбуждением, нарушением дыхания. Сознание утрачено, все виды рефлексов повышены, любое раздражение усиливает симптомы этой стадии, тонус скелетной мускулатуры повышен. Как свидетельствуют результаты исследований И.П. Павлова, это протекает за счет угнетения функции корковых нейронов – уменьшаются тормозные влияния коры на нижележащие отделы мозга, усиливается поток афферентных импульсов с верхних дыхательных путей, сосудов, легких, в связи с раздражающим действием эфира. Любое вмешательство противопоказано в эту стадию, а задача анестезиолога – максимально быстро пройти эту стадию (для этого увеличивают увеличить концентрацию эфира). – стадия хирургического наркоза. Наступает по мере углубления наркоза. Возбуждение коры ослабевает, и наркотическое угнетение распространяется на кору и нижележащие отделы ЦНС. Наступление этой стадии характеризуется следующими симптомами: дыхание ритмичное, глубокое, нормализуется АД, пульс урежается, тонус скелетных мышц снижается. Различают три уровня наркоза: легкий наркоз – сознание и ощущение боли утрачены; дыхание активное, при помощи межреберных мыщц и диафрагмы; зрачки умеренно сужены, (гипоксии нет), АД в норме. повышение концентрации наркотического средства приводит к расширению зрачков, реакция на свет вялая (повышается гипоксия), АД в норме, пульс не изменен (или несколько снижен), снижена амплитуда дыхательных движений; тонус мышц передней брюшной стенки понижен. Большинство операций проводятся на данном уровне наркоза. глубокий наркоз - нарастает гипоксия, зрачки расширяются, АД понижается, амплитуда дыхательных движений снижается, угнетаются жизненноважные центры ЦНС, тонус мышц не определяется. Наблюдается глубокое угнетение процессов в коре головного мозга. Дальнейшая подача анестетика не рекомендуется, так как газообмен сильно снижается, функции ЦНС и рефлексы угнетаются, зрачки сильно расширены. За тем отмечается максимальное расширение зрачков, дыхание не определяется, тонуса мышц отсутствует, на ЭЭГ – небольшие колебания потенциала, рефлексы отсутствуют – стадия пробуждения. Начинается сразу после прекращения вдыхания анестетика, длительность 20-40 минут, но бывает до нескольких часов; возможна посленаркозная депрессия. Восстановление рефлексов происходит в обратной последовательности их исчезновению. Недостатки эфирного наркоза: снижает тонус сосудов и угнетает деятельность сердца; токсическое действие на функции печени; снижает клубочковую фильтрацию в почках; вызывает ацидоз; ухудшает тканевой кровоток; сильно выражены постнаркозная тошнота и рвота. Фторотан – летучая жидкость со сладким запахом и температурой кипения 49-51 0С. Это наиболее сильный анестетик – в 3 раза сильнее эфира и в 50 раз сильнее закиси азота, однако лишен анальгезирующих свойств, в связи с чем для ингаляционной анальгезии он не используется. Наркоз наступает при вдыхании фторотана 2-2,5 об.% (в концентрации 0,83-1,04 ммоль/л) через 3-5 минут. Стадия анальгезии выражена плохо, а стадия возбуждения отсутствует. Пробуждение быстрое, депрессия и рвота отсутствуют. 75% препарата выводится почками, при этом фторотан может оказывать на них неблагоприятное воздействие. Умеренно угнетает дыхательный центр, снижает сократимость миокарда, снижает АД (обладает ганглиоблокирующим, миотропным, сосудорасширяющим и адренолитическим эффектом. В большей степени, чем у эфира выражено гепатотоксическое действие. Однако, отсутствует метаболический ацидоз. Закись азота (N2О) – бесцветный газ, в 1,5 раза тяжелее воздуха. Особенностью наркоза под действием данного анестетика является моментальное наступление наркоза без стадии возбуждения, а также быстрое пробуждение. Обладает слабым общеанестезирующим действием без достаточной релаксации мышц. Оптимальное соотношение в смеси N2О и О2 – 80% к 20%, когда отсутствуют признаки гипоксии. Смесь 90% N2О и 10% О2 обеспечивает поверхностный наркоз с признаками гипоксии. Поэтому закись азота всегда комбинируют с более сильными анестетиками – эфиром, фторотаном. Обладает весьма высокой анальгезирующей активностью. Не бладает раздражающим действием на слизистые дыхательных путей, не усиливает секрецию слюнных и бронхиальных желез, не оказывает негативного воздействия на сердечно-сосудистую систему и печень, однако имеются сведения о неблагоприятном действии на гемопоэз – может вызвать тромбоцитопению и агранулоцитоз. Неингаляционные анестетики.Преимущества неингаляционного наркоза: быстрое, незаметное для больного, введение в наркоз с максимальным устранением психической травмы; возможность проведения наркоза с помощью простейших технических средств (шприц, система), причем наркотизация может начинаться прямо в палате, что очень важно при вводном наркозе у детей; отсутствие раздражающего действия на дыхательные пути; отсутствие неблагоприятного воздействия на функции паренхиматозных органов; редко возникает постнаркозная тошнота и рвота. Недостатки неингаляционного наркоза: низкая управляемость глубиной; невозможность быстро прекратить анестезию в нужный момент при использовании длительно действующих препаратов; склонность анестетиков к кумуляции, что ограничивает возможность их повторного применения и затрудняет использование при продолжительных операциях. Виды наркоза: Вводный наркоз – необходим проведения интубации трахеи, и переход на ингаляционный наркоз с доведением его до нужного уровня хирургической стадии, минуя стадию возбуждения. Длительность вводного наркоза составляет 10-20 минут. В данном случае позитивным качеством неингаляционного анестетика выступает его способность подавлять глоточный и ларингеальный рефлексы. Базисный наркоз – обеспечивает неполный анестетический фон на период основных этапов операции. Нужная глубина хирургического обезболивания достигается наслоением ингаляционной анестезии. Самостоятельный (мононаркоз) – при использовании одного анестетика. Мононаркоз используют в амбулаторной хирургии, длительностью на 3-6 минут с возможностью повторного введения анестетика и для обеспечения средних по объему и длительности оперативных вмешательств (на 60 минут и более) с возможностью повторного введения анестетика без явлений кумуляции. Пропанидид (Сомбревин) – препарат ультракороткого действия. Наркоз развивается через 20 секунд при внутривенном введении в дозе 4-8 мг/кг в зависимости от состояния больного. Оказывает стабилизирующее действие на мембраны за счет и торможения входящего натриевого тока, вызывая, тем самым, анестезию. Очень быстро гидролизуется эстеразами крови, поэтому действует кратковременно. Кумуляция отсутствует, обратимость наркоза полная и быстрая. В отличие от других анестетиков сомбревин непосредственно действует на кору больших полушарий и «выключает» их функцию. Сомбревин оказывает негативное влияние на сердечно-сосудистую систему (возможна остановка сердца), стимулирует моторные центры коры больших полушарий. Отмечаются аллергические реакции в виде бронхоспазма и сыпи на кожных покровах. Кетамин – анестетик быстрого действия и высокой анальгезирующей активностью. Вызывает «диссоциированный наркоз», т.к. избирательно блокирует таламо-кортикальные связи, вызывает дезорганизацию афферентной чувствительности. Используют при кратковременных операциях, не требующих релаксации. Возможно применение в родах, препарат не угнетает сократимость миометрия. Кетамин повышает тонус симпато-адреналовой системы, в связи с чем противопоказан при повышенном АД; возможна, дезориентация в посленаркозном периоде, галлюцинации и возбуждение. Тиопентал натрия. Действует на ретикулярную формацию мозга, при этом возрастает порог ее возбудимости, понижается тонус коры больших полушарий, и сознание утрачивается (производное барбитуровой кислоты) - при внутривенном введении наркоз наступает сразу после введения, «на игле». Препарат быстро проникает в головной мозг, сердце, печень, почки, и вызывает наркоз. В последующие 20 минут препарат депонируется в коже, подкожно-жировой клетчатке, мышцах – это пробуждение больного, но не за счет инактивации наркозного средства. Переход тиопентала натрия в кровь является результатом развития посленаркозной депрессии. Потребление кислорода мозгом при этом снижается на 50%, что нередко используется при тяжелых травмах головного мозга. Тиопентал натрия вызывает сильное угнетение ЦНС; бронхоспазм; угнетает сократимость миокарда и тонус сосудов. При передозировке используют бемегрид. При неэффективности больного переводят на ИВЛ, симптоматически вводят норадреналин, кофеин и др. Оксибутират натрия. Является производным ГАМК и нормальным метаболитом мозга, который образуется в ходе деградации ГАМК. Хорошо проникает через ГЭБ. Препарат повышает проницаемость для ионов хлора, увеличивает выход ионов калия, при этом наблюдается гиперполяризация мембран, задерживается выход медиатора, блокируется межнейронная передача импульсов. Его принципиальное отличие заключается в медиаторном типе действия. Препарат оказывает антигипоксическое действие, повышает резистентность организма к кислороду, нормализует кислотно- основное равновесие. Наркоз наступает при внутривенном введении 100-120 мг/кг через 7-10 минут. Длительность наркоза составляет от 40 минут до 2 часов и более. Таким образом, выбор анестезии и ее метода проведения зависит от общего состояния больного, характера заболевания, степени проявления сопутствующей патологии, вида и объема операции. Очень часто применяют комбинирование анестетиков с производными бенздиазепинов, с курареподобными ЛС и др. В основе комбинированного применения анестетиков лежит явление суммации. Лекция №13.АНАЛЕПТИКИ. ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА ФУНКЦИИ ОРГАНОВ ДЫХАНИЯ. Лекарственные средства, влияющие на функции органов дыхания подразделяют на следующие группы: Дыхательные аналептики; отхаркивающие средства; противокашлевые средства; средства, применяемые при бронхиальной астме; средства, применяемы при отеке легких. Дыхательные аналептики – это вещества, которые прямо или рефлекторно стимулируют дыхательный и сосудодвигательный центры. Классификация дыхательных аналептиков.Препараты прямого действи:.бемегрид; этимизол; кофеин. Препараты рефлекторного действия (н – холиномиметики):лобелин; цититон. Препараты смешанного действия.кордиамин; камфора; сульфокамфокаин. Механизм действия аналептиков.Препараты прямого действия непосредственно повышают возбудимость клеток дыхательного центра. Этимизол ингибирует фосфодиэстеразу, что приводит к повышению количества цАМФ, увеличению выхода ионов кальция из эндоплазматического ретикулума, а это в свою очередь приводит к стимуляции процесса гликогенолиза и повышению метаболизма нейронов дыхательного центра. Н-холиномиметики активируют хромаффинные клетки каротидных клубочков и рефлекторно (по нерву Геринга) стимулируют дыхательный центр продолговатого мозга, вследствие чего увеличивается частота и глубина дыхательных движений. Фармакодинамика.Стимулирующее действие на дыхание наиболее выражено проявляется в условиях угнетения функций дыхательного центра и падения его реактивности к физиологическим стимулам (СО2). Восстанавливают функции внешнего дыхания обычно неустойчиво. Повторное введение может вызвать судорожные реакции. Стимулируют сосудодвигательный центр. Повышается тонус резистивных и емкостных сосудов, что приводит к повышению венозного возврата крови и повышению АД. Это действие наиболее выражено у камфоры и кордиамина. Антинаркотическое действие проявляется во временном ослаблении глубины депрессии ЦНС, прояснением сознания и улучшением координации движения. Препараты показаны, если депрессия не достигает уровня наркоза. Наиболее выражено действие у бемегрида и коразола. Показания к применению.Обострение хронических заболеваний легких, сопровождающееся явлениями гиперкапнии, сонливостью, утратой откашливания; остановка дыхания у недоношенных новорожденных (применяется этимизол); гиповентиляция легких при отравлении средствами, угнетающими ЦНС, угарным газом, при утоплении, в послеоперационном периоде; коллаптоидное состояние; нарушение мозгового кровообращения (при обмороке); ослабление сердечной деятельности у пожилых людей. 2. Отхаркивающие средства – это группа ЛС, способствующих отхождению мокроты. Классификация.Бронхосекреторные средства:Средства рефлекторногодействия: трава термопсиса; корень алтея; трава фиалки трехцветной; мукалтин; терпингидрат. Средства резорбтивногодействия: калия йодид; натрия гидрокарбонат. Отхаркивающие средства прямого действия (муколитики):Препараты протеолитическихферментов: трипсин кристаллический; химотрипсин. Синтетические препараты: ацетилцистеин. Препараты, стимулирующие синтезсурфактанта: бромгексин; амброксол (лазолван). ФармакодинамикаСнижают вязкость мокроты и улучшают ее отделяемость; повышают активность эпителия слизистой бронхов; снижают количество инфекции; улучшают газообмен за счет усиления дренажа бронхов; ослабляют воспалительные реакции; снижают раздражение чувствительных окончаний слизистых оболочек. Механизмы действия отхаркивающих средств.Препараты рефлекторного действия содержат алкалоиды, сапонины, которые раздражают слизистую оболочку желудка. В результате импульс передается к ядрам блуждающего нерва, а от них через эфферентные волокна к гладкой мускулатуре и секреторным клеткам дыхательных путей, что приводит к усилению секреции бронхиальных желез, улучшению перистальтики бронхиол, усилению деятельности мерцательного эпителия. Повышение объема секрета снижает раздражение слизистой и способствует снижению воспалительного процесса. Препараты резорбтивного действия применяются перорально, а выделяются бронхиальными железами, что способствует разжижению мокроты, снижению ее вязкости. Активируют двигательную активность эпителия бронхиол. Обладают также противомикробным действием. Муколитики растворяют белковые и нуклеиновые компоненты гноя, отложений фибрина, способствуют отделению особенно плотной и спаянной с поверхностью слизистой мокроты. Протеолитические ферменты: разрывают белковые связи в компонентах мокроты. Синтетические препараты (ацетилцистеин): является донатором SH – групп, которые разрывают дисульфидные связи мукополисахаридов мокроты, вызывают деполимеризацию мокроты и снижают ее вязкость. Средства, стимулирующие синтез сурфактанта: увеличивают число и секреторную активность лизосом эпителия, что приводит к увеличению выделения ферментов, гидролизирующих белковые молекулы. Усиливают выделение секрета бронхиальными железами. За счет улучшения синтеза сурфактанта нормализуют газообмен. Противокашлевые средства – это группа препаратов, снижающих возбудимость кашлевого центра и уменьшающих кашель. Классификация.Средства центрального действия, угнетающие кашлевой центр:наркотические анальгетики: кодеин; морфина гидрохлорид. Ненаркотическиесредства: глауцин (глаувент). Периферического действия:- либексин. Показания к применению.Длительный сухой кашель при хронических воспалительных заболеваниях дыхательных путей (при сухом непродуктивном кашле). При этом препараты должны устранять перераздражение кашлевого центра и их применение не должно ухудшать дренаж дыхательных путей. Эти препараты не применяются при продуктивном кашле. Кодеина фосфат. При длительном применении снижается легочная вентиляция, поэтому противопоказан детям до 6 месяцев; угнетает дыхательный центр; вызывает лекарственную зависимость. Глауцин. Его действие основано на избирательном угнетении кашлевого центра; не угнетает дыхание; не угнетает выделение мокроты; не вызывает лекарственную зависимость. Либексин. Обладает местноанестезирующими свойствами, блокирует чувствительные окончания кашлевых рефлексогенных зон; обладает спазмолитическим действием; не вызывает зависимости; не угнетает дыхание. 4. Средства, применяемые при бронхиальной астме.Классификация. Бронхолитики (бронхорасширяющие средства):м –холиноблокаторы: атропин; метацин; ипратропиум бромид. Адреномиметики: , - адреномиметики: адреналина гидрохлорид; эфедрина гидрохлорид. - адреномиметики: изадрин; орципреналина сульфат (алупент). 2 – адреномиметики: сальбутамол; фенотерол; тербутамин. Средства, задерживающие дегрануляцию тучных клеток: ингибиторыфосфодиэстеразы: теофиллин; эуфиллин. Средства, влияющие на медиаторы аллергии:Глюкокортикоиды: преднизолон; беклометазон. Эуфиллин. Угнетает активность фосфодиэстеразы; блокирует аденозиновые рецепторы; стимулирует выделение адреналина. Фармакодинамика.Уменьшает давление в малом круге кровообращения; улучшает кровоток в сердце, почках, ЦНС; оказывает умеренное диуретическое действие. Особенности применения при бронхиальной астме. Эуфиллин применяется в качестве базисной терапии. Способен к развитию кумуляции, что иногда приводит к нарушению сердечного ритма, а в высоких дозах возможно развитие судорог и коллаптоидного состояния. 5. Средства, применяемые при отеке легких. Классификация.Средства, снижающие давление в легочных капиллярах:Средства, расширяющие емкостныесосуды: ганглиоблокаторы (гигроний, бензогексоний); нитраты (натрия нитропруссид). Мочегонные средства быстрогодействия: фуросемид (лазикс); кислота этакриновая. Средства, восстанавливающие нарушенный газообмен (противовспенивающие):спирт этиловый; антифомсилан. Средства, снижающие проницаемость гематоальвеолярного барьера:глюкокортикоиды; антигистаминные средства (Н1-блокаторы). Лекция №14.СЕРДЕЧНЫЕ ГЛИКОЗИДЫ. Сердечные гликозиды – это безазотистые вещества растительного происхождения, которые имеют в своей основе стероидное ядро, оказывающие высокоспецифичное тонизирующее действие на сердце и составляющие основу для лечения сердечной недостаточности (кардиотоники). Сердечные гликозиды состоят из гликона – сахаристая часть молекулы; и агликона – не сахаристая часть молекулы. Гликон определяет растворимость сердечного гликозида, степень его биотрансформации и выведение из организма, т.е. определяет приимущественно фармакокинетические особенности. Агликон представлен ненасыщенным лактонным ядром, с помощью которого сердечный гликозид связывает мембраной миофибрилл сердца и оказывает специфический кардиотонический эффект. Для определения активности сердечных гликозидов используют биологическую стандартизацию. Необходимость ее проведения обусловлена малой широтой терапевтического действия гликозидов; невозможностью определения их с помощью обычных физико – химических методов; коротким сроком хранения препарата. Биологическая стандартизация проводится на лягушках. ЛЕД (лягушачьи единицы действия) – доза вещества, которая вызывает остановку сердца у большинства животных опытной группы (3 из 5). Так же существуют КЕД (кошачьи единицы действия) и ГЕД – голубиные единицы действия. Классификация.Препараты наперстянки:дигитоксин; дигоксин; цименид. Препараты строфанта:строфантин К. Препараты ландыша:коргликон. Препараты горицвета:настой травы горицвета весеннего (адонизид).  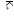 Сердечный гликозид Na+, K+ |
