Учебник А.Н. Окороков Диагностика болезней внутренних органов(том 4, кровь). Учебник А.Н. Окороков Диагностика болезней внутренних органов(то. Литература 2001 удк 616. 1. 4 I ббк 54. 1 I
 Скачать 4.05 Mb. Скачать 4.05 Mb.
|
|
тромбопоэтин стимулирует конечные стадии созревания мегакарио-цитов и «отшнуровку тромбоцитов». Регуляция В-лимфоцитопоэза на ранних стадиях осуществляется ИЛ-7 и ФСК. После образования пре-В- и В-лимфоцитов дальнейшее их развитие индуцируется ИЛ-4 и ИЛ-6. Регуляция Т-лимфоцитопоэза— самые ранние стадии индуцируются ИЛ-6, ИЛ-7, далее на развитие Т-лимфоцитов регулирующее воздействие оказывает тимус (ИЛ-2, ИЛ-4). Продукцию натуральных киллеров стимулирует ИЛ-15, плазматических клеток — ИЛ-7. Клетки микроокружения влияют на пролиферацию и дифферен-цировку кроветворных клеток, однако, данные о конкретной роли каждой клетки достаточно противоречивы. Роль фибробластов в поддержании и регуляции гемопоэза в настоящее время окончательно не выяснена. Среди фибробластов обнаружены клетки, переносящие ИКМ. Может быть, в этом и заключается главная роль фибробластов микроокружения. Известно, что в свою очередь кроветворные клетки влияют на фибробласты. Так, секретиру-емый тромбоцитами и мегакариоцитами тромбоцитарный фактор роста стимулирует пролиферацию фибробластов. В тоже время зрелые ■ гранулоциты и Т-лимфоциты оказывают ингибирующее влияние на I фибробласты микроокружения. Половые гормоны также в определен- | ной степени влияют на активность фибробластов - андрогены угнета-щ ют, а эстрогены стимулируют их рост. Большую роль в поддержании нормального гемопоэза играют жировые клетки микроокружения. Эндотелиоциты сосудов и синусов костного мозга регулируют выход кроветворных клеток из костного мозга в кровь, а также синтезируют колониестамулирующий фактор. При апластической анемии развиваются функциональные нарушения в микроокружении, что значительно снижает способность клеток микроокружения индуцировать пролиферацию и дифференциацию стволовых клеток в связи с понижением продукции гемопо-этических факторов роста. Предполагается, что этиологические-факторы гипопластической анемии одновременно воздействуют на стволовую клетку, клетки всех трех кроветворных ростков и строму (микроокружение). Но наиболее аргументирована точка зрения, что внутренний дефект полипотент-ной стволовой клетки является первичным нарушением, которое про-I является или усиливается при воздействии различных этиологических 1 факторовнагемопоэтическиеклеткичерез изменение ИКМ (К М. Аб-1 дулкадыров, С. С. Бессмельцев, 1995; К. Ниссен, 1993). а Иммунная депрессия кроветворения и индукция апоптоза стволо- Ц вых кроветворных клеток. Иммунным механизмам придается боль-щ шое значение в развитии апластической анемии. По мнению 1 Л. И. Идельсона (1985), «значительная часть апластических анемий а относится к иммунным». Предполагается, что происходит блокиро-1 вание Т-лимфоцитами дифференциации стволовых клеток, Диагностика болезней системы крови образуются антитела к стволовым клеткам, эритроцитам, клеткам-предшественницам разных линий кроветворения, что приводит к депрессии гемопоэза. Аутоиммунный генез заболевания несомненно доказан для парциальной формы гипопластической анемии — парциальной красноклеточной аплазии. При этой форме апластической анемии закономерно обнаруживаются антитела к ядрам эритроблас-тов или эритропоэтину (Ф. Э Файнштейн, 1987). В настоящее время большинством гематологов считается, что в основе развития апластической анемии лежит иммуноопосредованное истощение пула стволовых кроветворных клеток (А. А. Масчан, 1999). Процесс иммунной депрессии гемопоэза опосредуется ми и цитотоксическими цитокинами — у-интерфероном и фактором некроза опухоли а. При взаимодействии гемопоэтических стволовых кроветворных клеток с активированными цитотоксическими Т-лимфоцитами и указанными цитокинами стимулируется апоптоз (запрограммированная клеточная смерть) стволовых клеток гемопоэза (Young, Maciejewski, 1997). Этому механизму придается огромное значение в развитии апластической анемии. Подробно об апоптозе см в гл «Лейкозы». Укорочение продолжительности жизни эритроцитов. Уменьшению продолжительности жизни эритроцитов отводится значительная роль в патогенезе апластической анемии. Имеются данные, свидетельствующие о внутрикостномозговом разрушении эритроцитов. У некоторых больных обнаружено снижение активности в эритроцитах ключевого фермента пентозного цикла глюкозо-6-фосфатдегидрогеназы, а также гексокиназы, глутатионредуктазы, восстановленной формы глу-Указанные изменения делают эритроциты гиперчувствительными к различным повреждающим факторам. Нарушение метаболизма кроветворных клеток. При гипопластической анемии значительные изменения претерпевает метаболизм кроветворных клеток. Наибольшие нарушения происходят в метаболизме нуклеопротеидов — резко уменьшается содержание нуклеиновых кислот, в первую очередь в эритропоэтических клетках. Возможно, вследствие этого клетки всех трех кроветворных ростков не усваивают в достаточной мере необходимые для оптимального гемопоэза (железо, витамин В12 и др.). Снижение интенсивности пролиферации и дифференциации клеток красного ряда кроветворения, повышенное разрушение эритроцитов, неоптимальное использование железа и нарушение гемогло-бинообразования приводят к накоплению в организме железа с отложением железосодержащих пигментов в различных органах и тканях (печени, селезенке, коже, миокарде, надпочечниках и др.) — развивается вторичный гемохроматоз Содержание эритропоэтина в крови может быть повышено, что указывает на неиспользование его костным мозгом для Патогенез апластической анемии представлен на рис 10. Этиологические факторы Поражение полипотентной стволовой кроветворной клетки Активированные цитотоксические Т-ЛИМфОцШЫ Поражение микроокружения стволовой кроветворной клетки Нарушение метаболизма кроветворных клеток Антипролиферативные цитокины ФНО-а, ИФ-у Индукция апоптоза стволовых гемопоэтических клеток Нарушение пролиферации кроветворных клеток, снижение колониеобразующей способности костного мозга Продукция антител к клеткам-предшественницам разных линий гемопоэза 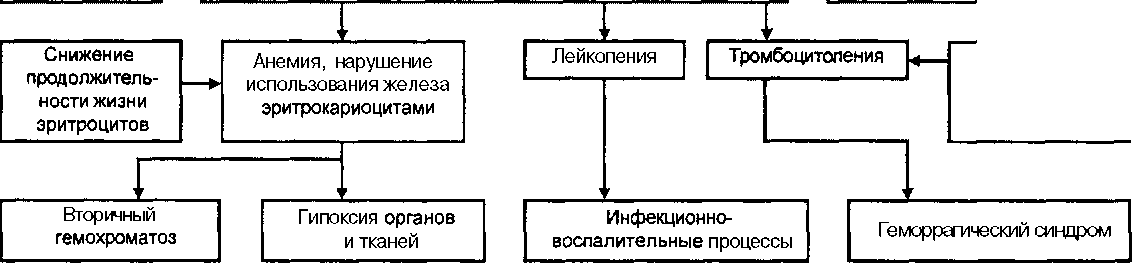 Снижение продолжительности жизни тромбоцитов ФНО ИФ-у - - фактор некроза опухоли интерферон у Рис. 10 Патогенез апласттеской анемии Диагностика болезней системы крови Классификация Классификация гитю- и апластических анемий (В. И. Калиниче- ва, 1998; Л. И. Идельсон, 1985) отражает следующие принципы: • наследственная или приобретенная гипо- илиапластическая анемия; • поражение всех трех ростков кроветворения или только нарушение эритропоэза; • наличие или отсутствие гемолитического синдрома; • роль иммунного механизма в развитиигитю- И апластической анемии. I. Наследственные формы 1. Наследственная гипоГО1астическая анемия с поражением всех трех кроветворных ростков: • с наличием врожденных аномалий развития (анемияФанкони); • без врожденных аномалий развития (анемияЭстрена- Дамешека) 2. Наследственныая парциальная гипопластическая анемия с избирательным поражением эритропоэза (анемия Блекфена-Дайемонда). 3. Врожденный дискератта. П. Приобретенные формы 1. Приобретенная гипопластическая анемия с поражение всех трех ростков: • острая; • подострая; • хроническая. 2. Приобретенная парциальная гипопластическая анемия с избирательным поражением эритропоэза. Приобретенные формы могут быть идиопатическими (форма Эрлиха) и известной этиологии. иммунных факторов в развитии анемии 1. Иммунная форма 2. Неиммунная форма. IV. Гемолитический синдром 1. С гемолитическим сндромом. 2. Без гемолитического синдрома. Клиническая картина Основная клиническая и лабораторная симптоматика приобретенной гипо- и апластической анемии с поражением всех трех кроветворных ростков костного мозга обусловлена тотальным угнетением гемопоэза, а также гипоксией органов и тканей и геморрагическим синдромом. Выраженность симптоматики зависит также от степени тяжести и варианта течения гшюпластической анемии. Больные жалуются на прогрессирующую общую слабость, одышку и сердцебиения, наиболее значительно выраженные при физической нагрузке, головокружения, шум в ушах, мелькание мушек перед глазами. Характерны также кровоточивость (десневые, носовые, желудоч-# почечные, маточные кровотечения) и частые ционно-воспалительные заболевания (ангины, пневмонии и др.). Гипо- и апластические анемии При острой форме симптомы развиваются быстро и течение заболевания с самого начала тяжелое. Однако у большинства больных заболевание развивается достаточно медленно, постепенно, в определенной мере пациенты: адаптируются к анемии, хотя, конечно, качество жизни ухудшается. Заболевание обычно распознается уже при значительно выраженной симптоматике, больные обращаются за медицинской помощью при выраженной панцитопении и развитии геморрагического синдрома. При осмотре больных обращает на себя внимание выраженная бледность кожи и видимых слизистых оболочек, часто с желтушным оттенком (обычно при сопутствующем гемолитическом синдроме); геморрагические высыпания на коже, чаще в виде кровоподтеков различной величины. Часто на месте инъекций (внутримьшгечньгх, внутривенных, подкожных) образуются обширные гематомы. Геморрагическая сыпь локализуется преимущественно в области голеней, бедер, живота, иногда на лице. Могут наблюдаться кровоизлияния в конъюнктиву и видимые слизистые оболочки — губы, слизистую оболочку полости рта. При остром течении и выраженном обострении хронической формы гипо- и анемии геморрагический синдром выражен весьма значительно — у больных развиваются тяжелые носовые, желудочно-кишечные, почечные, легочные кровотечения. У женщин мен- | сопровождаются обильными и длительными кровотечениями. У многих больных заболевание осложняется внугрицеребральными кро- i воизлияниями, которые могут послужить причиной смерти. Тяжелое течение апластической анемии может осложниться разви- | тием язвенно-некротического воспалительного процесса слизистой ; оболочки полости рта. Периферические лимфоузлы при апластической анемии не увеличены \ При исследовании внутренних органов могут обнаруживаться следующие изменения: • Система органов дыхания — частые бронхиты, пневмонии (в свя- , зи с дефицитом гранулоцитов и высокой предрасположенностью больных к инфекционно-воспалительным процессам). Сердечно-сосудистая система — развивается синдроммиокардио-дистрофии, что проявляется одышкой, сердцебиениями, небольшим расширением границы сердца влево, негромким систолическим шумом в области верхушки сердца, снижением амплитуды зубца Т преимущественно в грудных отведениях ЭКГ. • Система органов пищеварения — при выраженном геморрагическом синдроме могут обнаруживаться эрозии на слизистой оболочке желудка, кишки. Увеличение печени не характерно, но в некоторых случаях может наблюдаться. Л. И. Идельсон (1985) объясняет это развитием недостаточности кровообращения вследствие • Селезенка пригипопластической анемии не увеличивается, наличие требует уточнения диагноза. Однако следует Диагностика болезней системы крови что при развитии увеличение селезенки воз- можно. Следует отметить, что гемосидероз при апластической анемии развивается нередко вследствие повышенного разрушения неполноценных эритроцитов, снижения использования железа костным мозгом, нарушения синтеза гема, частых переливаний эритроцитарной массы. Клиннко-лабораторные особенности гемолитической формы апластической анемии При развитии гемолитического синдрома у больных апластичес-кой анемией появляются характерные симптомы: • желтуха; • увеличение содержания в кровинеконъюгированного (непрямого) билирубина; • уменьшение продолжительности жизни эритроцитов (определяется с помощью радиоактивного хрома); привнутрисосудистом гемолизе возможно появлениегемосиде-ринурии, гемоглобинурии, повышение содержания в крови свободного гемоглобина; • появление в моче уробилина, темный цвет мочи, отсутствие в ней билирубина. Лабораторные данные и инструментальные исследования Общий анализ крови — выраженное снижение количества эритроцитов и гемоглобина; анемия у большинства больных нормохром- ная, нормоцитарная (при выраженном геморрагическом синдроме возможно развитие гипохромной анемии); характерно также отсутствие или резкое снижение количества ретикулоцитов (арегенератор-ная анемия); наблюдается лейкопения за счет гранулоцитопении с относительным лимфоцитозом; чрезвычайно характерна тромбоцито-пения. Таким образом, наиболее существенным лабораторным проявлением гипо- и апластической анемии является панцитопения. СОЭ, как правило, увеличена. Исследование фагоцитарной функции нейт-рофильных лейкоцитов выявляет значительное ее снижение. Общий анализ мочи без существенных изменений, при выраженном геморрагическом синдроме и почечном кровотечении наблюдается микро- или макрогематурия. При развитии гемолитического синдрома в моче обнаруживается уробилин. Биохимический анализ крови — существенных изменений, как правило, не выявляется. Содержание сывороточного железа повышено, процент насыщения железом трансферина значительно увеличен. При развитии синдрома гемолиза увеличено содержание в крови неконъю-гированного (непрямого) билирубина, возможно также небольшое повышение активности аланиновой аминотрансферазы. Иммунологический анализ крови — в связи с лейкопенией может отмечаться снижение содержания Т-лимфоцитов, В-лимфоцитов. и анемии Исследование коагулограммы - обнаруживается гипокоагуляция, обусловленная тромбоцитопенией и в определенной мере неполноценностью тромбоцитов. Исследование стернального пунктата (миелограмма) наблюдается выраженное уменьшение и рядов, лимфоцитов и значительная редукция го ростка. Таким образом, характерно резкое уменьшение количества миелокариоцитов. В тяжелых случаях костный мозг выглядит «опустошенным», в стернальном пунктате можно обнаружить лишь единичные клетки плазматические клетки, редкие ты). Суммарное содержание клеточных элементов нейтрофильногоряда значительно снижено, а относительное процентное содержание лимфоцитов и плазматических клеток повышено. Характерна также задержка созревания клеток эритро-, лейко- итромбоцитопоэза. О торможении созревания клеток нейтрофильного ряда можно судить на основании индекса созревания (в норме он равен у больных гипопластической анемией колеблется от 0.9 до 3.2, а при тяжелой форме может повышаться даже до 5-6.6) Задержка созревания эритро-и характеризуется относительным увеличением количества на фоне резкого снижения количества миелокарио-цитов. Количество ретюсулоцитов в костном мозге резко уменьшено, а при тяжелой анемии они не определяются вовсе. Значительно снижается количество и фильных мегакариоцитов, могут обнаруживаться дегенеративные, гигантские клетки. В костном мозге значительно увеличивается содержание железа, расположенного как так и (количество сидероцитов и сидеробластов увеличивается). Гистологическое исследование трепанобиоптата гребня подвздошной кости — характерно резкое уменьшение количества костномозговых кроветворных элементов («опустошение» костного мозга) и почти полное замещение кроветворного мозгажировой тканью. Стандартный критерий апластической анемии — цитоз в биоптате менее 25%. Встречаются лишь единичныелимфоидные, плазматические, ретикулярные клетки, отдель-щ ные эритробласты, нормобласты, промиелоциты. Мегакариоциты в препарате могут практически не обнаруживаются. В некоторых участках трепанобиоптата выявляются участки кровоизлияния. При менее тяжелом течении апластической анемии в трепанобиоптате могут обнаруживаться небольшие участки с уменьшенным, но сохраненным гемопоэзом. УЗИорганов брюшной полости — выявляются небольшое увеличение печени, повышение акустической плотности ее паренхимы и неоднородность эхоструктуры (К. М. Абдулкадыров, С. С. Бессмельцев, Е. Р. Шилова, 1995). Увеличение селезенки не обнаруживается. Офтальмоскопия — могут быть кровоизлияния на сетчатке. |
