Министерство здравоохранения республики
 Скачать 1.98 Mb. Скачать 1.98 Mb.
|
|
с    хема 4 Клиника лейкоза хема 4 Клиника лейкоза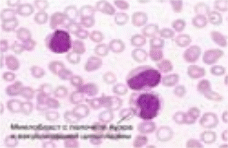 Рис. 4 - Гемограмма при остром миелобластном лейкозе Основными молекулярными проявлениями, ведущими к формированию лейкемического клона при миелоидных лейкозах, являются либо возникновение специфических транслокаций, как правило, с вовлечением протоокогенов, либо мутации генов, участвующих в контроле пролиферации и дифференцировки миелоидной ткани. Для миелоидных опухолей наиболее характерными являются реципрокные транслокации, при которых происходит обмен генетическим материалом между различными хромосомами с образованием патологических хромосомных структур. Самой известной из этих хромосом является Филадельфийская хромосома. В периферической крови и костном мозге преобладают миелобласты (Рис. 3,4). При цитохимическом исследовании выявляется активность пероксидазы, повышение содержания липидов, низкая активность неспецифической эстеразы. 2. Острый лимфобластный лейкоз чаще встречается у детей и у лиц молодого возраста. Характеризуется увеличение какой-либо группы лимфоузлов, селезенки. Самочувствие больных не страдает, интоксикация выражена умеренно, анемия незначительная. Геморрагический синдром часто отсутствует. Больные жалуются на боли в костях. Острый лимфобластный лейкоз отличается частотой неврологических проявлений (нейролейкемия). В периферической крови и в пунктате присутствуют лимфобласты (молодые крупные клетки с округлым ядром) (Рис. 5). При цитохимическом исследовании: реакция на пероксидазу всегда отрицательная, липиды отсутствуют, гликоген в виде крупных гранул. Отличительной чертой лимфобластного острого лейкоза является положительный ответ на применяемую терапию. Частота ремиссии отмечается в 50-90% случаев. Ремиссия достигается применением комплекса цитостатических средств. 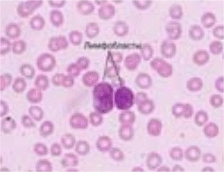 Рис. 5 - Гемограмма при остром лимфобластном лейкозе Рецидив болезни может проявляться нейролейкемией, инфильтрацией нервных корешков, костномозговой ткани. Каждый последующий рецидив имеет худший прогноз и течет более злокачественно, чем предыдущий. У взрослых заболевание протекает тяжелее, чем у детей. Реже встречаются формы острых лейкозов: - Острый промиелоцитарный лейкоз характеризуется чрезвычайной злокачественностью процесса, быстрым нарастанием тяжелой интоксикации, выраженным геморрагическим синдромом, приводящим к кровоизлиянию в мозг и к гибели больного. Опухолевые клетки с крупной зернистостью в цитоплазме затрудняют определение структур ядра. Геморрагический синдром зависит от выраженной гипофибриногенемии и избыточного содержания в лейкозных клетках тромбопластина. Выход тромбопластина провоцирует внутрисосудистое свертывание Имеют место положительные цитохимические признаки: активность пероксидазы, увеличение липидов и гликогена, резко положительная реакция на кислую фосфатазу, наличие гликозоаминогликана. - Острый миеломонобластный лейкоз является субвариантом острого миелобластного лейкоза. По клинической картине они почти идентичны, однако миеломонобластная форма протекает злокачественней, с более выраженной интоксикацией, глубокой анемией, тромбоцитопенией, более выраженным геморрагическим синдромом, частыми некрозами слизистых и кожи, гиперплазией десен и миндалин. В крови выявляются бластные клетки (крупные, неправильной формы, с молодым ядром, напоминающим по форме ядро моноцита). При цитохимическом исследовании в клетках определяется положительная реакция на пероксидазу, гликоген и липиды. Характерным признаком является положительная реакция на неспецифическую эстеразу в клетках и лизоцим в сыворотке и моче. Средняя продолжительность жизни больных вдвое меньше, чем при миелобластном лейкозе. Причиной смерти обычно являются инфекционные осложнения. - Острый монобластный лейкоз. Клиническая картина напоминает острый миелобластный лейкоз и характеризуется анемийной наклонностью к геморрагиям, увеличением лимфатических узлов, увеличением печени, язвенно-некротическим стоматитом. В периферической крови анемия, повышенный лейкоцитоз, лимфомоноцитарный профиль, тромбоцитопения. Появляются молодые бластные клетки. При цитохимическом исследовании в клетках определяется слабоположительная реакция на липиды и высокая активность неспецифической эстеразы. Лечение редко вызывает клинико-гематологические ремиссии. Продолжительность жизни больного составляет около 8-9 месяцев. - Эритромиелоз характеризуется тем, что патологическая трансформация кроветворения касается как белого, так и красного ростков костного мозга. В костном мозге обнаруживаются молодые недифференцированные клетки белого ряда и бластные анаплазированные клетки красного ростка - эритро- и нормобласты в большом количестве. Красные клетки больших размеров имеют уродливый вид. В периферической крови имеется стойкая анемия, анизоцитоз эритроцитов (макроциты, мегалоциты), пойкилоцитоз, полихромазия и гиперхромия. Эритро- и нормобласты в периферической крови встречаются до 200-350 на 100 лейкоцитов. Часто отмечается лейкопения, но может быть умеренное увеличение лейкоцитов до 20-30.109/л. По мере развития болезни появляются бластные формы - монобласты. Лимфаденопатии не наблюдается, печень и селезенка могут быть увеличены или оставаться в норме. Заболевание протекает более длительно, чем миелобластная форма, в некоторых случаях отмечается подострое течение эритромиелоза (до двух лет без лечения). Острый лейкоз может долгое время скрываться под маской других заболеваний, которые не поддаются обычной терапии. Диагностика острых лейкозов Диагноз острого лейкоза основывается на выявлении бластных клеток в крови и костном мозге (20%). Верификация диагноза должна основываться на следующей картине (таблица 2): - цитоморфологической (выявление бластов), - цитохимической, - цитогенетической - на иммунофенотипировании бластных клеток (выявление кластеров дифференцировки (СД-маркеров). Таблица №2 - Определяющий метод диагностики вариантов острого лейкоза 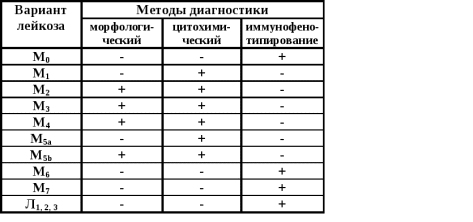 Анализ крови: нормохромная нормоцитарная анемия; количество лейкоцитов может быть различным низким (ниже 5.109/л), нормальным (от 5.109/л до 20.109/л.), повышенным (свыше 20.109/л., достигая в некоторых случаях 200.109/л); нейтропения (не зависит от общего количества лейкоцитов); абсолютный лимфоцитоз; тромбоцитопения (присутствует почти всегда); «лейкемический провал», что означает присутствие бластов, зрелых форм на фоне отсутствия промежуточных форм; при остром миелобластном лейкозе можно обнаружить азурофильные гранулы и палочки Ауэра. Лейкопенический вариант острого лейкоза встречается почти у 50% больных. Миелограмма (количественное определение всех клеточных форм костного мозга) получается при стернальной пункции или трепанобиопсии подвздошной кости (рис 6): увеличение содержания бластных клеток от 20% и до тотального бластоза. Морфология бластов различна в зависимости от типа лейкоза. Отмечается увеличение промежуточных форм, лимфоцитоз, красный росток кроветворения угнетён (за исключением острого эритромиелоза), мегакариоциты отсутствуют или их количество незначительно (за исключением острого мегакариобластного лейкоза). 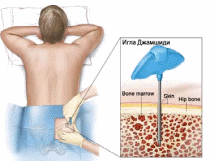 Рис. 6 – Методика проведения трепанобиопсии подвздошной кости Таблица №3 - Основные цитохимические характеристики бластных клеток при острых лейкозах
Цитохимическое исследование - основной метод диагностики форм острых лейкозов. Его проводят с целью выявления ферментов, специфических для различных бластов. Цитохимические методы представляют собой достаточно простые, хорошо воспроизводимые, не требующие сложной аппаратуры методики, которые могут быть освоены в любой лаборатории. По совокупности цитоморфологических и цитохимических признаков бластных клеток, инфильтрующих костный мозг и циркулирующих в периферической крови, выделяются несколько форм острого лейкоза. Среди множества клеточных компонентов, таких как неорганические элементы, белки, аминокислоты, углеводы, различные ферменты, которые могут быть определены с помощью цитохимических реакций. Международный совет по стандартизации в гематологии, в соответствии с FAB-классификацией острых лейкозов, рекомендовал использовать в качестве основных для дифференциальной с помощью цитохимической диагностики следующие: на миелопероксидазу, липиды (окраска Суданом черным), неспецифическую эстеразу, кислую фосфатазу, гликоген с помощью PAS-реакции (Таблица 3). Иммунофенотипирование бластов проводят автоматизированным методом на проточном цитофлюориметре или иммуноферментным методом на стекле с использованием световой микроскопии. Последний имеет то преимущество, что его можно проводить параллельно с цитохимическим исследованием. Иммунофенотипирование позволяет определить с помощью моноклональных антител наличие или отсутствие кластеров дифференцировки бластных клеток (CD-маркёры). Его проведение в первую очередь необходимо для точной диагностики острого лимфолейкоза, а также в трудных случаях дифференциальной диагностики острых лимфобластных и миелобластных лейкозов. Иммунодиагностика гемобластозов основана на сопоставлении морфофункциональных характеристик лейкозных бластов и нормальных/нетрансформированных клеток гемопоэза. По мере функционального созревания лимфоидных и миелоидных клеток происходит перестройка генов, кодирующих специфические рецепторы клеток, а значит, происходит изменение набора рецепторов для различных факторов роста, дифференцировки и межклеточного взаимодействия. По набору мембранных и цитоплазматических антигенов можно установить линейную принадлежность, стадию зрелости и функциональное состояние клетки. Сходство между лейкозными и нормальными клетками позволяет установить линейность и стадию созревания патологических клеток, что необходимо для иммунофенотипического диагноза, классификации и прогностической оценки различных типов онкогематологических заболеваний. Выявление лейкозных бластов в периферической крови и/или костном мозге методом проточной цитометрии основано на отличии их фенотипа от фенотипа неизмененных клеток. Нормальные клетки, сохраняющиеся в некотором количестве даже при выраженной опухолевой экспансии, могут использоваться как внутренний стандарт антигенной экспрессии. Именно уровень антигенной экспрессии и физические характеристики определяют местоположение каждой популяции клеток в многомерном пространстве проточной цитометрии. При работе с бластными популяциями обогащение образца, т.е. отбор определенных, интересующих клеток можно проводить двумя путями: - методом градиентного центрифугирования на градиенте плотности для получения суспензии мононуклеаров (лимфоцитов, моноцитов и бластов). При выраженной клональной пролиферации большинство клеток в суспензии будут представлять собой субстрат опухолевой трансформации, бласты. - с помощью гейтирования (селективное гейтирование) по физическим характеристикам клеток и/или на основании экспрессии определенного маркера. - определение иммунофенотипического профиля Цитогенетическое исследование лейкозных клеток позволяет определить хромосомные аномалии и дальнейший прогноз. Лечение острых лейкозов. Лечение острого лейкоза проводят в условиях специализированного гематологического или онкологического отделения при наличии изоляторов (боксов), реанимационного оборудования, отделения переливания крови. Основные направления терапии Специфическая химиотерапия направлена на достижение и закрепление ремиссии заболевания, состоит из нескольких этапов, различна для лимфобластного и миелобластного лейкозов. Расчёт доз производят на площадь поверхности тела по таблице Дюбуа с учётом массы тела и роста. Сопутствующая терапия. Её проводят для борьбы с инфекциями, обусловленными агранулоцитозом, для снижения интоксикации при лизисе опухолевого субстрата, для уменьшения побочных токсических эффектов химиотерапевтических препаратов. Заместительная терапия необходима при угрожающей тромбоцитопении, тяжёлой анемии, нарушениях свертывания крови. Трансплантация стволовых кроветворных клеток или костного мозга. Химиотерапия Лечение химиотерапевтическими препаратами начинают после установления типа (лимфобластный, миелобластный) и варианта острого лейкоза. Все острые лейкозы лечатся индивидуально по строго соблюдаемым протоколам (программам) полихимиотерапии, которые создаются на основе результатов исследований объединенных гематологических научных групп в различных странах. Лечение миелобластного и лимфобластного лейкозов различное. Острый лимфобластный лейкоз. Лечение острого лимфобластного лейкоза проводят соответственно его иммунофенотипическому варианту, данных цитогенетики. Протоколы лечения в данном случае обязательно включают в свой состав L-аспарагиназу. Выделяют группы стандартного и высокого риска острого лимфобластного лейкоза (за исключением варианта В-клеточного острого лимфобластного лейкоза, который лечат по иной программе). Стандартный риск Индукция ремиссии. Используют комбинации винкристина в разовой дозе 1,4 мг/м² (не выше 2 мг) внутривенно еженедельно, преднизолона в дозе 60 мг/м² внутрь ежедневно, даунорубицина (рубомицин) в дозе 45 мг/м² внутривенно еженедельно, 5000 ЕД L-аспарагиназы в/в, циклофосфамида в дозе 600 мг/м² внутривенно, цитарабина в дозе 75 мг/м² внутривенно 3 раза в неделю, меркаптопурина в дозе 60 мг/м² внутрь и шести люмбальных пункций с интратекальным введением 15 мг метотрексата, 30 мг преднизолона и 30 мг цитарабина. Консолидацию (закрепление) ремиссии проводят в течение 5 дней на 13, 17-й и, после проведения реиндукции, на 31, 35-й неделе лечения. Применяют два препарата - этопозид (вепезид) 120 мг/м² внутривенно и цитарабин 75 мг/м² внутривенно. Реиндукцию ремиссии проводят с 21-й по 26-ю неделю лечения и далее через 3 месяца после последнего курса консолидации с интервалом 3 месяца в течение 2 лет. Препараты и их дозы аналогичны применяемым при индукции ремиссии. Поддерживающую терапию проводят метотрексатом в дозе 20 мг/м² внутривенно и меркаптопурином в дозе 60 мг/м² внутрь через 3-4 недели после последнего курса консолидации в течение 2 лет. Высокий риск Лечение группы высокого риска отличается тем, что после стандартной индукции ремиссии проводят жесткую консолидацию двумя 7-дневными курсами RACOP с интервалом 4-5 недель [даунорубицин (рубомицин) 45 мг/м² внутриненно, цитарабин 100 мг/м² внутривенно, циклофосфамид 400 мг/м² внутривенно, винкристин 1,4 мг/м² внутривенно, но не более 2 мг и преднизолон 40 мг/м² внутрь)]. После окончания консолидации и оценки результатов в зависимости от получения (А) или отсутствия (В) ремиссии проводят постконсолидационную терапию, включающую: (А). Протокол лечения стандартного риска, начиная с 6-недельной реиндукции, с последующими двумя курсами поздней консолидации вепезидом и цитарабином, постоянная поддерживающая терапия меркаптопурином и метотрексатом, прерываемая 6-недельными курсами реиндукции, проводимыми с интервалом 3 месяца в течение 2 лет. (В). Ротирующие курсы RACOP, COAP (циклофосфамид 400 мг/м² внутривенно, винкристин 1,4 мг/м² внутривенно, цитарабин 60 мг/м² внутривенно, преднизолон 40 мг/м² внутрь) и СОМР (циклофосфамид 1000 мг/м² внутривенно, винкристин 1,4 мг/м² внутривенно, метотрексат 12,5 мг/м² внутривенно дважды и преднизолон 100 мг внутрь). Поддерживающая терапия не проводится. Полихимиотерапия В-клеточного, пре-В-клеточного, Т-клеточного острого лимфолейкоза и лимфосаркомы отличается тем, что при лечении этих форм используют высокие дозы метотрексата (1500 мг/м²), циклофосфамида (1000 и 1500 мг/м²), L-аспарагиназы (10 000 ME). При Т-клеточном ОЛЛ и лимфосаркоме проводят облучение средостения в суммарной дозе 20 Гр. Острый миелобластный лейкоз Программой лечения острого миелобластного лейкоза является "7+3" - "золотой стандарт" полихимиотерапии. Индукция ремиссии. Цитарабин 100 мг/м² внутривенно капельно каждые 12 часов в течение 7 дней, даунорубицин (рубомицин) в разовой дозе 60 мг/м² внутривенно через 2 часа после введения цитарабина в течение 3 дней. Проводят два курса. Консолидация ремиссии - два курса "7+3". Поддерживающая терапия курсами "7+3" с интервалом 6 недель в течение года с заменой рубомицина на тиогуанин в дозе 60 мг/м² 2 раза в день внутрь. При гиперлейкоцитозе выше 100.109/л перед началом индукционных курсов показана терапия гидроксикарбамидом в дозе 100-150 мг/кг до снижения количества лейкоцитов ниже 50.109/л. Если на фоне гиперлейкоцитоза развиваются спутанность сознания, одышка, на рентгенограмме выявляют усиление сосудистого рисунка лёгких (признак «лейкоцитарных стазов»), необходимо проведение 2-4 сеансов лейкофереза. Полную ремиссию констатируют при наличии в пунктате костного мозга менее 5% бластных клеток при количестве нейтрофилов в периферической крови не менее 1,5.109/л и тромбоцитов не менее 100.109/л. Первую контрольную пункцию проводят на 14-21-й день после первого индукционного курса. Профилактику нейролейкемии проводят только при острых лимфобластных, миеломонобластном и монобластном лейкозах, а также при всех формах острого миелоидного лейкоза с гиперлейкоцитозом. Она включает периодическое интратекальное введение трёх препаратов и краниальное облучение в суммарной дозе 2,4 Гр. Острый промиелобластный лейкоз. Одним из важнейших достижений гематологии в последнее десятилетие стало обнаружение дифференцирующего эффекта дериватов ретиноевой кислоты на бластные клетки острого промиелобластного лейкоза. Появление коммерчески доступного препарата all-трансретиноевой кислоты (ATRA) кардинально изменило судьбу больных с этой формой миелобластного лейкоза: из прогностически наименее благоприятного он превратился в наиболее курабельный. ATRA принимают внутрь в дозе 45 мг/м² в два приема за 4 дня до первого индукционного курса "7+3" и до достижения полной ремиссии (но общей продолжительностью не более 90 дней). Такая терапия позволяет получить 85-96% ремиссий и пятилетнюю выживаемость у 78% больных. ATRA при остром промиелобластном лейкозе применяют только при цитогенетическом обнаружении транслокаций t(15;17) и, в меньшей степени, t(l 1;17). При их отсутствии или других вариантах транслокаций all-трансретиноевая кислота не эффективна. В последнее время в мире разработаны множество новых протоколов лечения. |
