Министерство здравоохранения республики
 Скачать 1.98 Mb. Скачать 1.98 Mb.
|
|
Лечение нейролейкемии. В случае обнаружения в ликворе при первой диагностической люмбальной пункции цитоза более 103 диагностируется нейролейкемия. Лечение проводится путем введения в спинномозговой канал тех же трех препаратов в дозах, описанных ранее. После первой диагностической пункции первая и последующие лечебные должны проводиться с интервалом в 3 дня, то есть на фоне курса химиотерапии и после него. Эндолюмбальное введение цитостатиков проводится до трех нормальных анализов ликвора, но может быть временно прекращено при развитии глубокой цитопении (лейкоциты <1.109/л, тромбоциты <20.109/л). Последующие пункции выполняются перед каждым очередным курсом индукции/консолидации. С учетом данных международных исследований по лечению острого миелолейкоза, показавших наибольшую эффективность комбинации лучевой и химиотерапии при нейролейкемии, по завершении консолидации ремиссии проводится краниальное облучение в суммарной дозе 24 Гр (по 1,5 Гр ежедневно в течение 16 дней). Затем люмбальные пункции проводятся перед каждым вторым курсом поддерживающей терапии, т. е. 1 раз в 7-8 недель в течение года. В дальнейшем люмбальные пункции проводятся 1 раз в 3 месяца в течение 2 лет, даже когда системная терапия уже закончена. Интервалы между курсами. Интервал между окончанием индукции и началом ранней интенсификации, между первым и вторым курсом ранней интенсификации, ранней интенсификацией и профилактикой нейролейкемии и так далее устанавливается строго индивидуально для каждого больного в зависимости от восстановления показателей гемопоэза по периферической крови и миелограмме. Использование всех протоколов полихимиотерапии требует обязательного проведения профилактики осложнений, основными моментами которой являются: гидратационная терапия (до 2-3 л/м2 в сутки физиологического раствора, раствора глюкозы, неорондекса, реополиглюкина, рондферрина) в сочетании с диуретиками (фуросемид); селективная пероральная деконтаминация желудочно-кишечного тракта (нистатин, гросептол, ципрофлоксацин, цефалексин, дифлкжан); профилактика ДВС-синдрома (гепарин, этамзилат натрия, овомин); парентеральная антибиотикопрофилактика (пенициллин, ампициллин, оксациллин) и адекватная непрерывная заместительная терапия эритроцитарной массой, тромбоконцентратом и свежезамороженной плазмой. Диспансеризация больных проводится 1 раз в 1-2 месяц. Одним из методов лечения острых лейкозов в настоящее время является трансплантация костного мозга, показания приведены в таблице №4. Костный мозг производит стволовые клетки. Стволовые клетки развиваются в клетки крови (лейкоциты, тромбоциты и эритроциты). У больных лейкозом, апластической анемией, а также некоторых иммунодефицитных заболеваний, процесс превращения стволовых клеток в клетки крови дает сбой, в результате которого производится чрезмерное количество дефектных или незрелых клеток крови. Незрелые клетки крови препятствуют производству нормальных клеток крови, накапливаются в крови и могут поразить и другие ткани. Трансплантация костного мозга успешно используется для лечения пациентов с лейкозом, апластической анемией, лимфомами (лимфома Ходжкина, множественная миелома, иммунная недостаточность, нейробластомы), и при некоторых солидных опухолях (рак груди и рак яичников). Здоровые стволовые клетки пересаживаются реципиенту для возобновления нормального функционирования системы кроветворения. Трансплантация костного мозга, несмотря на название, является на самом деле является трансплантацией стволовых клеток костного мозга. Пересадка костного мозга является очень интенсивным методом лечения, поэтому возраст пациента и общее состояние здоровья должны приниматься во внимание при решении вопроса трансплантации. К примеру, обычно пациент должен не старше 65 лет для прохождения такого лечения. Трансплантация костного мозга возможна тогда, когда активность заболевания находится на как можно на более низком уровне. Идеальная ситуация для пересадки когда пациент в полной ремиссии. Добиться этого состояния можно при помощи химиотерапии и лучевой терапии. Таблица 4 - (Harrison). Показания к трансплантации костного мозга
Различают аллотрансплантацию и аутотрансплантацияю костного мозга. Аллотрансплантация костного мозга впервые была успешно проведена в конце 60-х гг. ХХ-го столетия, а в 70-х годах получила всеобщее признание. Аллотрансплантация - это пересадка стволовых клеток от совместимого по системе HLA (родственного или неродственного) донора. Аутотрансплантация подразумевает использование заранее заготовленных собственных стволовых клеток крови или костного мозга реципиента, забор которых производится до начала лечения. Существует также гаплоидентичная пересадка - пересадка с 50% совместимостью, как правило, от близкого родственника. Прогноз острых лейкозов Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев. До появления современных цитостатических препаратов и программ лечения острый лейкоз был быстро прогрессирующим и фатальным во всех случаях заболеванием со средней продолжительностью жизни пациентов 2,5-3 месяца. У большинства больных причиной смерти являлись тяжелые инфекционные осложнения из-за агранулоцитоза и геморрагического синдрома вследствие тромбоцитопении, причиной которых является вытеснение нормального кроветворения опухолевым. 5. Хронические лейкозы (хронический миелолейкоз, хронический лимфолейкоз, эритремия) Морфологический субстрат хронических лейкозов-это относительно дифференцированные клетки кроветворной ткани. Больные могут жить без лечения в течение нескольких месяцев и лет. Хронические лейкозы нередко трансформируются в острые формы. В группу хронических лейкозов входят дифференцирующиеся опухоли системы крови, исходящие из костного мозга. Основной субстрат этих лейкозов составляют морфологически зрелые клетки. Хронические лейкозы подразделяют на миелоидные (хронический миелолейкоз), лимфоидные (хронический лимфолейкоз и волосатоклеточный лейкоз), моноцитарные (миеломоноцитарные), эритроцитарные (истинная полицитемия) и мегакариоцитарные. Для всех хронических опухолей крови характерно то, что они длительно остаются на стадии моноклоновой доброкачественной опухоли с последующим переходом в злокачественную бластную форму. Лейкозные клетки являют собой клон-потомство одной мутированной клетки. Хромосомный анализ, проведенный при хроническом лейкозе, выявил однотипность лейкозных клеток, что явилось доказательством их происхождения из одной клетки. 5.1 Хронический миелолейкоз. Эпидемиология, этиология, патогенез, клиника, диагностика, лечение Хронический миелолейкоз – опухоль, возникающая из ранних клеток, предшественниц миелопоэза, дифференцирующихся до зрелых форм. При хроническом миелолейкозе морфологическим субстратом опухоли являются активно пролиферирующие дифференцирующиеся и зрелые клетки гранулоцитарного ряда. Эпидемиология хронического миелолейкоза В структуре заболеваемости гемобластозами хронический миелолейкоз занимает пятое место (8,9% случаев). Нестандартизованный среднегодовой показатель заболеваемости на 100 000 населения составляет 1 случай. Он диагностируется редко в детском и юношеском возрасте, хронический миелолейкоз одинаково часто встречается среди мужчин и женщин, болеют обычно люди в возрасте 30-70 лет, в детском и юношеском возрасте заболевание встречается редко. Возрастной пик приходится на 40-50 лет. Среди больных отмечено небольшое преобладание мужчин. Этиология хронического миелолейкоза Нередко причина возникновения хронического миелолейкоза остается неустановленной, но наиболее частой причиной является ионизирующая радиация, что доказано достоверно статистически. Значительное увеличение числа случаев хронического миелолейкоза в Хиросиме и Нагасаки среди лиц, находившихся в зоне действия атомной бомбы, является одним из доказательств роли радиации в его развитии. Имеются данные о влиянии химических соединений и врожденных дефектах хромосом. Митотический индекс и индекс метки промиелоцитов, миелоцитов костного мозга и периферической крови у больных хроническим миелолейкозом не отличаются от нормативных показателей, в то время как фракция миелобластов характеризуется кинетическими параметрами, обнаруживаемыми при остром миелобластном лейкозе. Патогенез хронического миелолейкоза В большинстве случаев (80-88%) хронического миелолейкоза выявляется хромосомный маркер опухолевого клона Ph'-хромосома, называемая филадельфийской, которая присутствует почти во всех клетках костного мозга гранулоцитах, моноцитах, эритрокариоцитах и мегакариоцитах, в лимфоцитах ее нет. Эта аномалия часто сочетается с трисомией 8, 9, 19, 21, делецией 5 и с другими дефектами хромосом. До 95% случаев хронический миелолейкоз-Ph-позитивный и лишь 5-8% регистрируются как Ph-негативный. Иногда встречаются случаи Ph'-негативного варианта заболевания Хотя возникновение заболевания связано с изменением хромосомного материала, семейной предрасположенности не выявлено, также не установлена ассоциация с HLA-генотипом. Клиническая картина хронического миелолейкоза Клиническая картина зависит от стадии заболевания. Выделяют 3 стадии хронического миелолейкоза: начальную, развернутую и терминальную (ВОЗ 2001 г.). В начальной стадии хронический миелолейкоз практически не диагностируется или выявляется при случайном исследовании крови, поскольку симптоматика в этот период почти отсутствует. Имеются жалобы на слабость, потливость, снижение аппетита, похудание, тошноту, повышение температуры тела, одышку, сердцебиение, боли в сердце, боли в костях, в левом или правом подреберье, увеличение периферических лимфатических узлов. Уже в этой стадии увеличивается селезенка, что вызывает неприятные ощущения в левом подреберье, чувство тяжести, особенно после еды. В периферической крови: постоянный и немотивированный лейкоцитоз (40-70.109/л) с нейтрофильным профилем, сдвигом влево до миелоцитов (рис. 7). Важным гематологическим признаком является увеличение количества базофилов и эозинофилов различной зрелости (рис. 8). Анемия в этот период не наблюдается. Отмечается тромбоцитоз до 600-1500.109/л. Практически эту стадию выделить не удается. Болезнь, как правило, диагностируется на стадии тотальной генерализации опухоли по костному мозгу, то есть в развернутой стадии. Ведущий клинический симптом - спленомегалия как следствие миелоидной метаплазии (инфильтрации) селезенки Костный мозг: - гиперклеточный, Л/Э 10:1 - увеличение миелокариоцитов происходит за счет незрелых и зрелых форм гранулоцитов - количество бластных клеток не превышает 5% - изредка эритробластоз - в 1/3 случаев - гиперплазия мегакариоцитов Развернутая стадия характеризуется появлением клинических признаков заболевания, связанных с лейкемическим процессом. Больные отмечают быструю утомляемость, потливость, субфебрильную температуру, потерю веса. Появляются тяжесть и боли в левом подреберье, особенно после ходьбы. При объективном исследовании почти постоянным признаком в этот период является увеличение селезенки, достигающей в ряде случаев значительных размеров. При пальпации селезенка остается безболезненной. Быстрый рост селезенки часто приводит к перисплениту и у половины больных инфарктам селезенки, проявляющиеся острыми болями в левом подреберье с иррадиацией в левый бок, левое плечо, усиливающейся при глубоком вдохе. Печень также увеличена, однако ее размеры индивидуально вариабельны. Функциональные нарушения печени выражены незначительно. Гепатит проявляется диспепсическими расстройствами, желтухой, увеличением размеров печени, повышением прямого билирубина в крови. Лимфаденопатия в развернутой стадии хронического миелолейкоза наблюдается редко, геморрагический синдром отсутствует. Могут наблюдаться нарушения со стороны сердечно - сосудистой системы (боли в сердце, аритмия). Эти изменения обусловлены интоксикацией организма, нарастающей анемией. Присоединяются интеркуррентные заболевания, может возникнуть ДВС-синдром, гиперурикемия и гиперурикозурия. 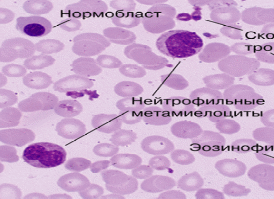 Рис. 7 - Гемограмма при хроническом миелолейкозе В периферической крови: анемия имеет нормохромный характер, нередко выражен анизо- и пойкилоцитоз. В лейкоцитарной формуле представлен весь гранулоцитарный ряд включительно до миелобластов (бластные клетки 5-10%). Количество лейкоцитов достигает 250-500.109/л. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
