Хирургия печени и желчных путей. Нежизнеспособности ее у больного или для борьбы с тяжелой печеночной недостаточностью
 Скачать 11.68 Mb. Скачать 11.68 Mb.
|
|
Лабораторные исследования. Падение гемоглобина ниже 70 ед. отмечается у половины больных. Резкое снижение содержания его в крови (ниже 20 ед.) отмечается редко. Как указывает Г. Ф. Николаев (1955), уже через 3—4 часа после травмы при выраженных кровотечениях количество гемоглобина падает до 40—50 ед., а эритроцитов — до 3—3,5 млн. в 1 мм3. Придавая большое значение определению наряду с гемоглобином гематокрита, Г. А. Барашков (1953) считал их важными показателями как интенсивности кровопотери, так и состояния компенсаторных возможностей организма. Многие придают существенное значение парастапию числа лейкоцитов (до 25 000, а иногда 50 000 в 1 мм3). Лейкоцитарная реакция, как отмечают Maddins с соавторами (1946), представляет характерную кривую увеличения лейкоцитов от 150 до 300% впервые 10 часов после травмы. У наших больных отмечено увеличение числя лейкоцитов в крови от 10 000 до 22 000 в 1 мм3. В первые часы после травмы наблюдался умеренный лейкоцитоз (12—13 тыс. в 1 мм3), несмотря на значительную кровопотерю (до 1000 мл), и в более поздние часы — лейкоцитоз до 20 000 на фоне кровопотери такого же объема. Снижение числа эритроцитов и гемоглобина крови отмечено лишь спустя 1—2 часа после травмы, в последующие часы развивается острая анемия, усугубляющая течение травматического шока. Примесь крови в рвотных массах и желудочном содержимом является следствием гемобилии при центральных разрывах печени. При повреждениях ее отмечается повышение активности глютаминопи-руватной трансаминазы, на 3—4-й день в ряде случаев отмечается повышение концентрации билирубина. Специальные исследования. Сюда входят рентгенографический метод и пункция брюшной полости. Рентгенографически наличие разрыва печени можно определить по появлению контрастной тени в боковых отделах брюшной полости. Mс Cort (1953) истечение крови в брюшную полость обнаружил таким методом у 21 из 24 больных с повреждением печени. Рентгенографически можно определить и наличие крови в малом тазу. Определение высокого стояния диафрагмы, ограничение ее подвижности, перелом ребер в области проекции печени, увеличение границ тени печени, разрыв диафрагмы, наличие пневмо- и гемоторакса — являются косвенными рентгенологическими симптомами повреждений печени. Центральный разрыв печени с кровоизлиянием в паренхиму обычными рентгенографическими методами обнаружить не удается, поэтому целесообразно применять ангиографию, позволяющую определить повреждение артериальной печеночной системы и скопление крови в печени.  В последнее время все чаще стали применять лапаропункцию для выявления свободной крови (В. Г. Борисов, 1968; А. Н. Беркутов и соавт., 1969; А. Ф. Жлоба, 1962, 1972; Gris-word и Collier, 1961; Carlson и соавт., 1962; Or Coff, 1966). Этот метод позволяет выявить наличие крови в брюшной полости у подавляющего большинства больных. Возможность повреждения при пункции полых органов практически исключена. Ciudado с сотрудниками (1962) пришел к заключению, что пункция брюшной полости особенно показана при множественных травмах, сопровождающихся шоковым состоянием больного. В этих случаях, по их мнению, она решает вопрос о лапа-ротомии, которая в этом состоянии может привести к ухудшению состояния при отсутствии повреждения печени. Turai с сотрудниками (1963) считает пробную пункцию в подвздошной ямке безобидным мероприятием, позволяющим выявить внутреннее кровотечение до появления «клинических симптомов». Carlson с соавторами (1962) для более точной диагностики предлагает производить пункцию в четырех квадрантах живота. В последнее время все чаще стали применять лапаропункцию для выявления свободной крови (В. Г. Борисов, 1968; А. Н. Беркутов и соавт., 1969; А. Ф. Жлоба, 1962, 1972; Gris-word и Collier, 1961; Carlson и соавт., 1962; Or Coff, 1966). Этот метод позволяет выявить наличие крови в брюшной полости у подавляющего большинства больных. Возможность повреждения при пункции полых органов практически исключена. Ciudado с сотрудниками (1962) пришел к заключению, что пункция брюшной полости особенно показана при множественных травмах, сопровождающихся шоковым состоянием больного. В этих случаях, по их мнению, она решает вопрос о лапа-ротомии, которая в этом состоянии может привести к ухудшению состояния при отсутствии повреждения печени. Turai с сотрудниками (1963) считает пробную пункцию в подвздошной ямке безобидным мероприятием, позволяющим выявить внутреннее кровотечение до появления «клинических симптомов». Carlson с соавторами (1962) для более точной диагностики предлагает производить пункцию в четырех квадрантах живота.Располагая опытом 127 пункций при различных повреждениях органов брюшной полости, мы убедились в ее высокой и ранней диагностической ценности, позволившей у 95% больных подтвердить или исключить предположительный диагноз. У 5% больных при пункции получена кровь, которая оказалась кровянистым выпотом при обширных кровоизлияниях в забрюшинное пространство и брыжейку кишечника, выявленные на операции. Показанием для пункции брюшной полости являлось подозрение на внутрибрюшное кровотечение, тяжелое бессознательное состояние больного, особенно при сочетанных травмах, с возможным повреждением органов брюшной полости. В случаях, когда клинически возможно поставить диагноз, не исключающий опе- рацию, пункцию брюшной полости не производили. Пункцию производят иглой в местах наибольшей тупости или троакаром, который позволяет при незначительном скоплении крови вводить в брюшную полость катетер для увеличения объема жидкости путем добавления физиологического раствора, что увеличивает диагностические возможности пункции. Так, у 4 больных вну-трибрюшное кровотечение было диагностировано путем исследования полученной жидкости под микроскопом (обнаружение форменных элементов). Оставление катетера на некоторое время позволяет судить об усилении или продолжении кровотечения. Каких-либо осложнений, связанных с оставлением катетера даже на сутки, мы не наблюдали и таким путем нам удалось констатировать прекращение кровотечения под воздействием гемостатической терапии у 2 больных. У 10 больных, у которых при первом исследовании было обнаружено незначительное кровотечение (жидкость лишь слегка окрашена кровью), при исследовании через каждые 30 минут диагностировано увеличение крови в брюшной полости, и больные были подвергнуты операции, на которой обнаружили одиночные трещины диафрагмальной поверхности печени. Пункция брюшной полости и исследование полученной жидкости у ряда больных позволяет установить до операции топический диагноз. Высокое содержание аммиака свидетельствует о внутрибрюшном разрыве мочевого пузыря, высокое содержание лимфоцитов, превышающее в 3 раза и больше обычное содержание их в периферической крови — о повреждении селезенки, обнаружение желчи и крови — о повреждении крупных желчных протоков и паренхимы печени, наличие в пунктате желчи — об изолированном повреждении желчного пузыря или крупных желчных протоков, обнаружение в пунктате желудочного или кишечного содержимого — о перфорации полых органов и, наконец, получение гнойного пунктата — о наличии перитонита. Техника абдоминальной пункции троакаром. Пункцию производят по средней линии живота на 2—3 см ниже пупка троакаром диаметром 2—3 мм различной длины в зависимости от возраста п упитанности больного. В положении лежа на спине на месте предстоящей пункции производят небольшой разрез кожи. Апоневроз прокалывают и оттягивают вверх однозубым крючком. Прокол брюшной стенки производят под углом 45°. После извлечения стилета троакар несколько продвигают в брюшную полость, если кровь не поступает сразу, то через троакар вводят хлорвиниловую стерильную трубочку на глубину 20— 25 см в сторону малого таза, правую или левую подвздошную области (направление придается наклоном троакара). Троакар извлекают. Если через дренаж кровь не отсасывается, то в брюшную полость вводят от 300 до 1000 мл физиологического раствора и затем производят отсасывание шприцем. У детей манипуляцию лучше выполнять под общим наркозом, у взрослых возможно и под местной анестезией. Относительным противопоказанием для лапароцентеза является спаечный процесс после перенесенных ранее операций. Абдоминальная пункция является важным дополнительным методом, уточняющим показания к хирургическому вмешательству. Во всех сомнительных случаях, при бессознательном состоянии больного (череп-номозговая травма), сильном алкогольном опьянении, сопутствующих переломах костей грудной клетки, таза, конечностей, которые могут маскировать клиническую картину повреждения печени, следует прибегать в первую очередь к лапаропунк-ции и затем только к лапаротомии как диагностическому приему. В этом отношении мы не можем согласиться с мнением К. Д. Микеладзе (1959), В. И. Акимова и 3. М. Контора (1963), II. М. Исакова и М. В. Левиной (1967), Б. В. Петровского (1972), Petterson (1952), Bromberg (1952) о необходимости вскрывать брюшную полость при малейшем подозрении на повреждение внутренних органов. Считать диагностическую лапарото-мию «невинной» операцией совершенно необоснованно. При сочетанных повреждениях в тяжелом состоянии эта операция часто ведет к необратимому нарушению компенсаторных возможностей организма и смерти (А. Н. Беркутов и соавт., 1969). Лапароскопия как метод исследования при повреждении печени теряет свой смысл после получения убедительных данных при помощи лапаро-пункции. Применять специальные методы исследования в случаях, когда клиническая картина внутрибрюшного кровотечения не вызывает сомнения, нет необходимости. В этих случаях показана операция. ЛЕЧЕНИЕ Консервативная терапия заключается в выведении больного из состояния геморрагического шока и остановке кровотечения. Выведение больного из шока является одновременно и подготовкой к хирургическому вмешательству. Внутривенные вливания начинают с введения декстранов, плазмы, цельной крови. В случае необходимости переливание крови продолжают и во время операции. Потеря ее более 20% требует переливания цельной свежей крови. Переливание крови, излившейся в брюшную полость, не рекомендуется из-за ее токсического действия в связи с примесью в ней желчи. В некоторых случаях возникновение анурии после аутотранс-фузии при разрыве печени приписывается именно этому явлению. Во время операции необходимо также следить за свертывающей системой, так как способность печени синтезировать фибриноген и протромбин ухудшается при потере крови больше 35%. Не следует забывать о возможности одновременных повреждений грудной клетки и ее органов (нневмото- ракc, гемоторакс, разрывы легкого). Для восстановления дыхательной функции легких грудная клетка дренируется. Еще в дооперационном периоде начинают применять антибиотики широкого спектра действия, анальгетики. В желудок вводят зонд для предотвращения его расширения и освобождения от пищи. Для учета диуреза в мочевой пузырь вводят катетер. Хирургическое лечение. После определения внутрибрюшного кровотечения показана срочная лапаро-томия, так как промедление с операцией увеличивает риск вмешательства, вторичного инфицирования и других осложнений. Цель хирургического вмешательства — остановка кровотечения, удаление некротических тканей, установление наружных дренажей и лечение других повреждений органов грудной и брюшной полости. Вид разреза зависит от предполагаемых повреждений. При проникающих и непроникающих ранениях брюшной полости с повреждениями печени предпочтение обычно отдают абдоминальным вертикальным разрезам (верхне-срединная лапаротомия, разрез по Шалимову, Бруншвигу — Тон Тхан Тунгу, Рио—Бранко, Петровскому—Почечуеву; рис. 92). Однако верхне-срединная лапаротомия удобна лишь для манипуляций на левой доле (II и III сегмент), в случае необходимости ревизии правой доли следует рассечь серповидную связку, более свободный доступ к правой доле при поражении IV, V, VI сегментов переднего края печени дает разрез по Шалимову, Рио— Бранко, Петровскому — Почечуеву. Этими же доступами можно достичь и широкого обнажения ворот печени. При необходимости резекции левой доли верхне-срединную лапаротомию дополняют поперечными разрезами вправо и влево по Brunschwing — Ton Than Tung. При обширном повреждении печени в области II сегмента иногда возникает необходимость в расширении разреза кверху путем продольного рассечения грудины, особенно при наличии узкого эпигастрального угла (см. рис. 92, 28). В верхней части грудину рассекают поперечно, в нижней косо слева направо или наоборот в зависимости от необходимости. Такой разрез позволяет выполнить и левостороннюю гемигепатэктомию (И. Л. Бригадзе, А. Н. Волков, 1959; Б. С. Шапкин, 1907). Стернотомию выполняют стер-нотомом, кусачками Дальгрена или остеотомом. Следует остерегаться повреждения плевры, а если это произойдет, удалить воздух из соответствующей плевральной полости при помощи катетера или пункции грудной полости. Рану расширяют мощным расширителем, для мобилизации печени рассекают левую треугольную и коронарную связки, а иногда и диафрагму (стерномедиасти-нофренолапаротомия). Рассечением грудины удобно дополнить и аркообразный разрез (см. рис. 92, 24) в эпигастральной области (West, 1962) при необходимости удаления вместе с левой долей печени и селезенки. При повреждении диафрагмаль-ной поверхности печени одной верхне-срединной лапаротомии недостаточно. В этих случаях часто используют доступ по Мардведелю (см. рис. 92, 29). В этом разрезе верхнесрединную лапаротомию дополняют правым горизонтальным от срединного разреза до самой низкой точки правой реберной дуги, вскрыв задний листок влагалища правой прямой мышцы и обнажив реберную дугу и поперечную фасцию, путем отсепаровывания треугольного кож-но-мышечного лоскута, пересекают реберные хрящи у его основания. Осторожно отделяют от грудины реберный хрящ VII и VI ребра и затем рассекают поперечную фасцию и брюшину вдоль кожного разреза. В этом случае удается лапаротомным крючком отвернуть реберную дугу вместе  Рис. 92. Оперативные доступы: 1) косо-поперечный (по С. П. Федорову); 2) косо-поперечный (Кер); 3) торако-абдоми-нальный (Ф. Г. Углов); 4) косо-поперечный (Ридель—Кохера); 5) косой (Шпрснгсль); 6) полуовальный (Де Рубейн): 7) углообразный (Черни); 8) S-образньш (Беоейн); 9) волнообразный (Кер); 10) срединный; JJ) поперечный (Шпренгсль); 12) расширенный косой (Керте. Майо—Робсон); 13) лоскутный (Лангенбуш), 14)углообразный (Рио— Бранко); 15) торако-абдоминальный (Райфершайд); 10) левосторонний косо-поперечный. 17) углообразный (Кохер); 18) торако-абдоминальный (Крафирд); 29) торако-абдоминальный (Райфершайд); 20) а — клюшкообразный, б — срединная лапарото-мия с огибанием пупка енрапа и продолжением разреза ниже его на 2 см (А. А. Шалимов), 21) разрея по Бруншвичу — Тон Тхая Тунгу, 22) аркообразный разрез; 23) доступ по Де Васко; 24) доступ по Вест; 25) разрез по С. II. Федорову, продолженный влево 24) доступ по С. А. Боровкову; 27) разрез по Б. В. Петровскому—Почечуеву; ?«) стерномедиастинолапаротомия. 29) абдоминальный доступ по Марведелю; 30) открытая торако-френолапаротомия по Куино (а — общий вид операционной раны, б — мобилизованная правая доля, печень повернута влево, видна нижняя полая вена). 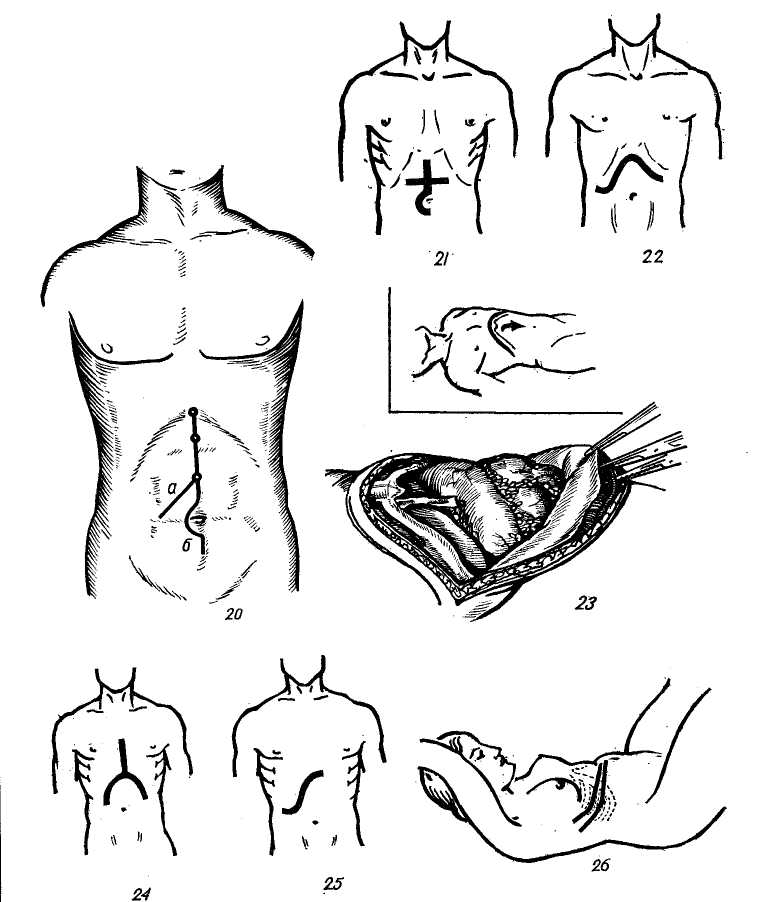 с треугольным лоскутом вверх и направо. При повреждении печени в результате торакальных или торако-абдоминальных ранений доступ для вмешательства лучше выбирать тора-коабдоминальный. Для этих целей чаще пользуются открытой торако-френолапаротомией (Ю. М. Репин, 1951; И. Л. Бригадзе, 1955; С. А. Боровков, 1968; Б. И. Альперович, 1969; В. С. Шапкин, 1969; Couinaud, 1955, 1966, 1967; Mallet—Guy, 1962). Разрез ведут косо от угла правой лопатки по VIII межреберыо вниз к пупку. Реберную дугу пересекают, вскрывают грудную и брюшную полости, диафрагму рассекают, не доходя до нижней полой вены на 2 см (предложение Ton Than Tung, 1967) для предотвращения повреждения диафрагмальной вены (см. рис. 92, 30). Доступ позволяет иммобили- 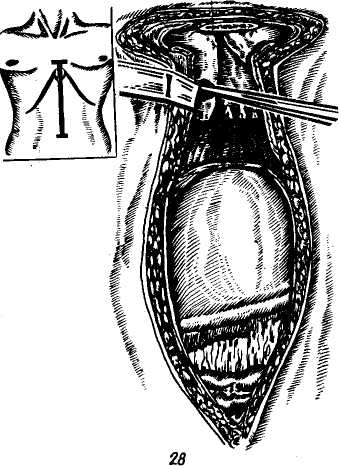 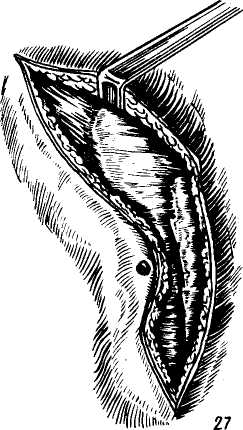 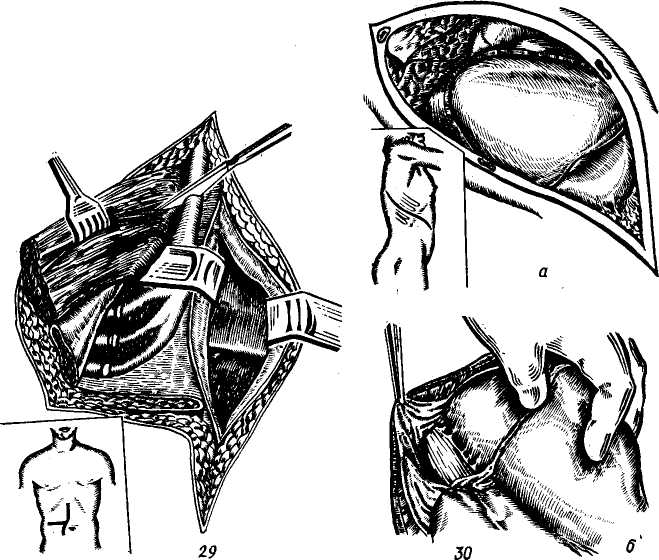 Рис. 92. (продолжение). зовать правую половину печени и низвести ее книзу и кпереди. Schwartz (1969) рекомендует при повреждениях диафрагмальной поверхности печени подобный торако-абдоминальный доступ из правого трансторакального разреза с продолжением на правую реберную дугу и косой разрез от пупка вправо с пересечением реберной дуги, рассечением диафрагмы и вскрытием грудной клетки по 7-му или 8-му межреберному промежутку. Для исследования задней поверхности печени М. А. Рубанова (1940) и С. А. Гешемин (1960) из комбинированных лапаротомных разрезов рекомендуют пересекать круглую, серповидную и венечные связки, что способствует выведению печени в рану. После обработки ее возвращают на прежнее место, а связки ушивают шелковыми швами. Этот прием позволяет в ряде случаев избежать торакотомии для ушивания ран диафрагмальной поверхности печени. Разрезы, применяемые в нашей клинике при повреждении печени, представлены в табл. 19. Выполняя абдоминальный доступ, рационально укладывать больного на резиновый валик высотой 20 — 25 см. При положении больного на спине валик укладывают на уровне XI—XII грудных позвонков, лежа Таблица 19 Оперативные доступы при ранении печени, применяемые в нашей клинике
на левом боку — под левый бок на том же уровне. Такое положение валика обеспечивает наиболее удобные условия для оперирующего и практически не нарушает функций органов дыхания и кровообращения у больного. После вскрытия брюшной полости удаляют всю кровь и сгустки, а также оторванные участки печени. Большое количество крови в брюшной полости еще не свидетельствует о повреждении крупных сосудов, и обычно во время вмешательства сильного кровотечения не отмечается. Повреждение воротных сосудов характеризуется профузным кровотечением во время вмешательства, остановка которого возможна только после кратковременного пережатия пальцами пе-ченочно-двенадцатиперстной связки. Опыт лечения травматических повреждений печени свидетельствует о необходимости наряду с остановкой кровотечения, обязательного проведения хирургической обработки раны печени. Обычно рана печени выполнена ее размозженной тканью или оторванными кусочками паренхимы, кровяными сгустками. Необработанная рана, как правило, ведет к образованию абсцессов, желчных свищей и вторичному кровотечению, а всасывающиеся продукты распада — к развитию гепато-ренального синдрома. Экономное иссечение краев раны с удалением всех поврежденных и оборвавшихся тканей является единственно правильным путем лечения повреждения печени. Возникшее кровотечение в ране при хирургической обработке останавливают перевязкой сосудов в ране, а менее сильное — при ее ушивании или биологической тампонаде. При обширных разрывах доли печени требуется ее резекция, при краевых ранах рекомендуют клиновидную резекцию. Наиболее трудны для обработки раны диафрагмальной и задней поверхности печени. Фиксацией печени швами к париетальной брюшине достигается прижа- 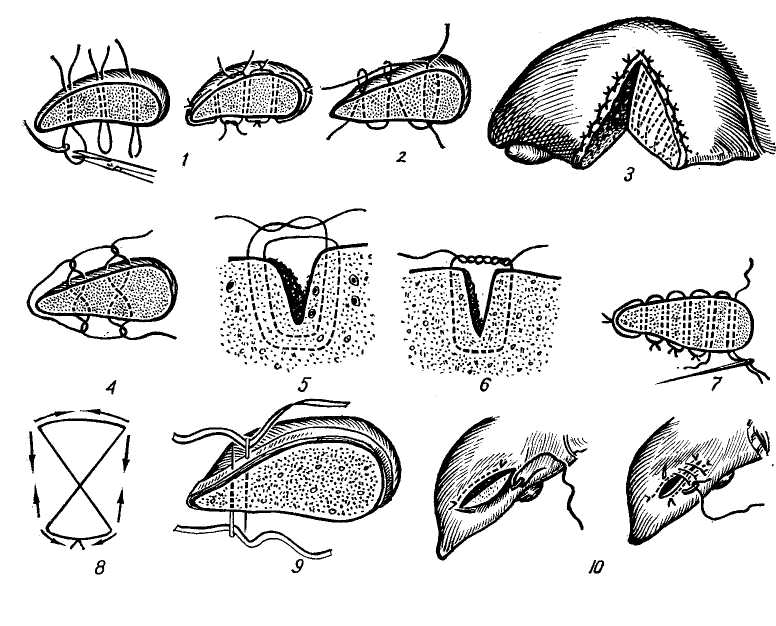  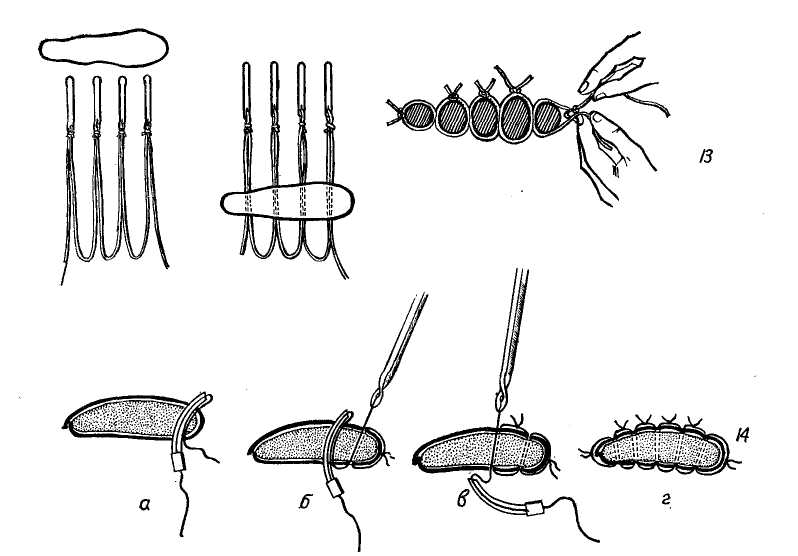 Рис. 93. Швы печени. ] — шов Джордано; 2 — шов Овре; 3 — шов Оппеля; 4 — шов Лабокка; б — шов Смирнова; 6 — шов Бетанелли; 7 — шов Варламова; 8 — шов Телкова; 9 — шоп Грицишина; 10 — шов печени со страхующими от прорезывания дополнительными стежками; 11 — наложение на рану печени П-образных швов с прокладкой сальником; 12 — наложение на печень П-образных швов Кузнецова—Пенского; 13 — гирляндный шов И. А. Брегздзе; 14 — техника наложения гемостатических швов полой иглой по А. А. Бабура (шов накладывается через пластмассовую манжетку: а — наложение первого шва, б, в — наложение последующих швов; г — швы в законченном виде). тие раны к диафрагме, помимо этого рану тампонируют гемостатической рассасывающейся марлей, губкой или сальником на питающей ножке. Применение наружного дренажа, подведенного к травмированной поверхности, а если необходимо — то и в глубину самой раны, а. также дополнительные дренажи в подпече-ночной области и поддиафрагмаль-ном пространстве и с выведением их через отдельный разрез, являются необходимым элементом профилактики осложнений и хирургического лечения травмы печени. Для этих целей лучше использовать резиновые дренажи. Такое дренирование в большинстве случаев предотвращает образование абсцессов и желчного перитонита. Таким образом, хирургическое лечение травм печени заключается в остановке кровотечения в первую очередь и иссечении поврежденных тканей вплоть до резекции доли. Г. Ф. Николаев (1955) различает следующие методы остановки кровотечения.
5. Резекция печени. Механические методы. Наиболее надежным способом остановки кровотечения, создающим условия для хорошего заживления раны является сближение ее краев после иссечения поврежденных участков и наложение швов. Различают обычные и специальные швы для ушивания паренхима-  тозных органов (рис. 93). Простой узловатый шов применяют чаще всего, однако техника наложения его на ткань печени имеет свои особенности. Игла должна быть круглой с большой кривизной изгиба. Вкол в паренхиму печени должен быть на 2—3 см от края раны. Шов должен захватывать всю глубину раны до дна для предотвращения образования центральных гематом. тозных органов (рис. 93). Простой узловатый шов применяют чаще всего, однако техника наложения его на ткань печени имеет свои особенности. Игла должна быть круглой с большой кривизной изгиба. Вкол в паренхиму печени должен быть на 2—3 см от края раны. Шов должен захватывать всю глубину раны до дна для предотвращения образования центральных гематом.При ушивании ран печени следует всегда помнить о возможности перевязки или прошивания крупных ветвей воротной вены, печеночной артерии, желчных протоков или печеночных вен, что в последующем может привести к образованию анемических некрозов печени, развитию посттравматических гепатитов, желчных свищей. Кроме того, острая блокада магистральных ветвей портального пучка может вызвать резкие гемодинамические сдвиги в организме с последующим развитием послеоперационного коллапса и шока. В связи с этим рекомендуют прошивать края раны на определенную глубину, которая на диафрагмальной поверхности не должна превышать 2—2,5 см, а на нижней — 1,5 см. Очень важно своевременно распознать кровотечение в ране, связанное с повреждением магистральных ветвей сосудов портального пучка, повреждение которых в последующем ведет к некрозу печени (Г. А. Покровский с соавт., 1970). Характерными признаками подобного повреждения являются соответствующая локализация раны, пульсирующее кровотечение, кратковременное потемнение ткани печени с последующим стойким изменением ее цвета (темно-фиолетовый, черный). В таких случаях следует производить резекцию печени в пределах здоровых тканей. Ушивание производят кетгутом, размоченным в теплом физиологическом растворе. Silvis (1951) с успехом использовал для швов кетгут в виде ленты. Применение шелковых нитей нежелательно, так как они про- питываются желчью и приводят к осложнениям (И. М. Воронцов, 1949). Перед затягиванием узлов необходимо сблизить края раны, закрепляют нити осторожно двойным узлом. Если в глубине раны или на ее стенках есть сосуды, необходимо их перевязать с предварительным захватыванием кровоостапавливающим зажимом или путем обшивания. В связи с тем, что ткань печени легко прорезывается, в качестве прокладки большинство хирургов используют изолированный или на ножке сальник (см. рис. 93, И). М. М. Кузнецов, Ю. Р. Пенский в 1843 г. предложили специальный шов для остановки кровотечения из ран печени. Его накладывают тупой иглой и двойной нитью. Стежки нити петлеобразно проходят один за другим, в связи с чем создаются условия для сдавления сосудов поврежденного участка (см. рис. 93, 12). Подобный шов, только 2 иглами, накладывали А. И. Лаббок и Г. А. Орлов (1936, см. рис. 93, 4.) И. Л. Бригадзе (1964), учитывая ряд практических неудобств при выполнении шва Кузнецова—Пенского, несколько упростил трудные моменты; предотвратил перепутывание петель перед их затягиванием путем использования металлических пугов-чатых зондов с ушками, заранее привязанными к наружным петлям шва, что значительно упрощает методику их затягивания (см. рис. 93, 13). Такую нить из толстого кетгута готовят заранее, зонды укрепляют на расстоянии 30 см друг от друга и фиксируют тонкими лигатурами. Шов получил название гирляндного. В последнее время в таком шве применяют атравматические нити. Для наложения гирляндного шва требуется достаточно хорошая иммобилизация печени. Ткань прошивают через всю толщу через равные промежутки в 2—3 см, после этого зонды отсекают, а нити завязывают. Такой же шов получают при ушивании печени полой иглой с продетой в нее лигатурой — шов Топалова, но применяют его в настоящее время в модификации А. А. Бабура (1962, см. рис. 93,14). Для предотвращения прорезывания нити по линии шва прокладывают участок сальника или другой аллопластический материал, даже металлические пластинки. Наложение такого шва весьма выгодно, так как создаются изоли рованные участки печени, сдавленные одной нитью. Для наложения ана стомоза с внутрипеченочным прото ком достаточно снять одну лишь нить, сдавливающую участок печени с наиболее крупным протоком (В. С. Шапкин, 1972). Наибольшее распространение получили П-образные швы, которые не прорезываются и создают вполне удовлетворительный гемостаз (см. рис. 93, 11, 12). Для ревизии раны и остановки кровотечения в ней применяют кратковременное пережатие печеночно-двенадцатиперстной связки и прижатие аорты под диафрагмой. Для этого пальцы левой руки вводят в foramen Winslowi и сдавливают проходящие в ней печеночную артерию и воротную вену. Кровотечение обычно останавливается. Так, И. М. Мороз и И. М. Кобыльчак (1972) производили обработку сильнокровоточащей раны печени с прижатием печеночно-двенадцатиперстной связки на 15— 18 минут, при этом не отмечая угрожающих жизни осложнений. В. С. Шапкин и Ж. А. Гриненко (1972) на основании клинических и экспериментальных данных, выполненных в той же клинике М. Г. Ма-словыми Е. В. Якубовским, считают, что пережатие печеночно-двенадцати-перстиой связки возможно на 20 минут, а при необходимости более длительного ее пережатия рекомендуют внутрибрюшпую гипотермию печени. Тон Тхап Тунг (1972) сообщил, что метод пальцевого прижатия «ножки» печени при обильных кровотечениях из ее паренхимы позволяет определить показания к резекции пе- чени, а именно: при остановке кровотечения производят перевязку печеночной артерии, при его продолжении — гемигепатэктомию. ТонТханТунг (1972) пришел к заключению, что опасности, связанные с перевязкой печеночной артерии, преувеличены и остановка кровотечения путем лигировапия печеночной артерии является более простым и легким способом, при котором нет необходимости наложения швов на рану с гемостатической целью, тем более, что это часто сопровождается развитием абсцессов и некрозов печени, а в ряде случаев ведет к возникновению вторичных кровотечений и поддиафрагмальных абсцессов. Тон Тхан Тунг различает высокую перевязку артерий в области ворот печени, которая может оказаться смертельной, и низкую непосредственно после отхождения желудочно-двенад-цатиперстной артерии, которую он имеет в виду при остановке кровотечения. Прежде чем решать вопрос об ушивании раны или резекции печени при глубоких кровоточащих ранах, огнестрельных, рваноушиблен-ных, и разрывах после тупой травмы, следует составить четкое представление о характере повреждения внутри-печеночных сосудов и желчных протоков. Для этой цели необходимо использовать порто- и холангиогра-фию, которые позволяют выявить повреждение ангио-билиарного дерева с топической их характеристикой. Самыми трудными участками для остановки кровотечения являются верхняя и верхнезадняя поверхности печени. Встречается этот вид повреждения почти у 50 % больных с повреждением печени (А. А. Королев, 1945; Г. Ф. Николаев, 1953, и др.). В этих случаях, если состояние больного не позволяет выполнить резекцию печени прибегают к гепатопек-сии по методу Хиари—Николаева. Трудность доступа к ранам печени такой локализации привела к попыт-  Рис. 94. Гепатопексия: а) по Хиари—Николаеву; б) задне-нижняя по В. С. Шапкину. ке ушивать их из торако-абдоминаль-ного доступа, однако тяжесть оперативного доступа, несостоятельность швов на выпуклой части печени и, как правило, тяжелое состояние больного заставляли хирургов прибегать к марлевой тампонаде, тампонаде сальником (Н. С. Макоха, 1951) или лоскутом диафрагмы (Б. В. Петровский, 1952). В 1921 г. Chiari при разрывах выпуклой части печени применил ее фиксацию к реберной дуге, придавив печень таким образом к диафрагме и остановив кровотечение. Детальная разработка методики этой операции в эксперименте и клинике принадлежит Г. Ф. Николаеву (1940—1955). Операция стала называться Хиари—Николаева (рис. 94,а). Доступ срединный или Федорова, рану печени очищают пальцем, марлевыми тампонами и шариками от отторгнутых участков и сгустков крови. Печень придавливают кверху в подреберье, свободный край на всем протяжении подшивают к париетальной брюшине 7—14 П-образными швами. К месту разрыва через отдельный разрез подводят резиновый дренаж для оттока желчи и предотвращения развития поддиаф-рагмального абсцесса. В первые дни после операции отмечают ограничение движения купола диафрагмы справа, которое исчезает в последующие 1,5—2 недели. Приемом Хиари В. С. Шапкин (1963) рекомендует пользоваться также при разрывах задненижней поверхности печени. В этих случаях дорсальную брюшину подшивают к печени с таким расчетом, чтобы она полностью закрыла всю раневую поверхность, поджимая при этом печень кверху. В. С. Шапкин назвал этот метод задненижней гепатопек-сией (рис. 94,6). В. В. Виноградов и др. (1969) предложили клей — цйаноакрилат, которым покрывают швы на печени (В. С. Шапкин, 1972). Он предупреждает просачивание желчи, обеспечивая герметичность раны и в то же время не повреждает паренхимы печени. В тех случаях, когда тяжесть состояния больного, неопытность хирурга, не владеющего техникой резекции печени, или обширность раны, непозволяющая выполнить ушивание ее, заставляет ограничиться простыми методами остановки кровотечения, применяют тампонаду раны марлевыми тампонами, которые кроме остановки кровотечения предотвращают и развитие желчного пери- тонита. Тампонада не должна быть очень тугой, чтобы не вызвать сдав-ления и нарушения питания соседних участков печеночной ткани. Выведение тампонов наружу, как и различных дренажей, производят через отдельный разрез для предотвращения образования послеоперационных грыж. Однако частые парезы кишечника, нагноение ран, вторичные кровотечения, поддиафраг-мальные абсцессы, наружные желчные свищи, высокая смертность ограничивают возможность применения марлевых тампонов и применяют их только в тех случаях, когда другие оперативные методы неприемлемы или внезапное ухудшение состояния больного требует быстрейшего окончания операции, а квалификация хирурга не позволяет выполнить более подходящего вмешательства. В последнее время получила распространение остановка кровотечения при помощи клипсов (рис. 95). Физические методы. Из физических методов остановки кровотечения применяют только электрокоагуля-ционные способы, применение же для этих целей пара, горячего воздуха и термокаутера имеют лишь историческое значение. Хотя метод электрокоагуляции нашел место главным образом при операциях на печени по поводу опухолей, последний с успехом применен и при обработке обширных закрытых повреждений печени, которые фактически являются атипичными резекциями и электрокоагуляция сосудов значительно облегчает ее выполнение. К сожалению, электрокоагуляция не приемлема в ранах с обильным продолжающимся кровотечением. Вопрос использования лучей лазера с гемостатической целью еще изучается. Биологические методы и применение гемостатических препаратов. В тех случаях, когда кровотечение в глубине раны трудно остановить механическим путем, применяют там- 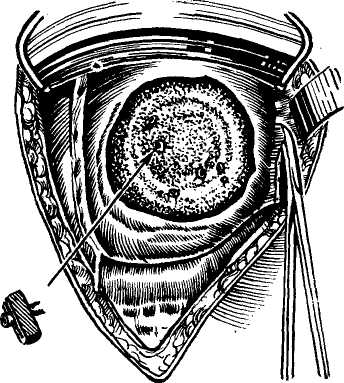 Рис. 95. «Клипирование» печеночных сосудов. понаду сальником на ножке, который вкладывают в глубину раны и подшивают ушивающими рану швами. Боязнь развития кишечной непроходимости в этих случаях (А. Г. Караванов, И. В. Данилов, 1967) явно преувеличена. Применение же изолированного участка сальника ведет к некрозу и в случае инфекции создается источник нагноения. С гемостатической целью наряду с ушиванием раны печени применяют гемо-статическую губку, сухой тромбин и гемостатическую марлю. Хороший гемостатический эффект получен от комбинированного применения гемостатической губки и сальника, причем после осушивания к кровоточащему участку печени следует вначале приложить губку, затем сальник и после этого лишь прижать тампоном на 3—4 минуты.Прижатие губки непосредственно тампоном способствует возобновлению кровотечения после его снятия, так как вместе с тампоном отрывают и губку. С успехом применяют и биологические тампоны, приготовленные из плазмы донорской крови или сухого фибриногена, с добавлением в них кровеостанавливающих и противоми-кробных средств.  Рис. 96. Объяснение в тексте. | |||||||||||
