Патология шпоры. Общая нозология
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
Некоронарогенные повреждения сердца. Существует несколько экспериментальных моделей некроза сердечной мышцы, причина возникновения которого не связана с патологией сосудов сердца и которые в известной степени отражают ситуацию, наблюдаемую в естественных условиях. Гипоксический некроз миокарда может быть воспроизведен с помощью различных видов гипоксии: гипоксической, гемической. При этом на фоне общей недостаточности кислорода в организме, которая сама по себе ведет к повышению нагрузки на систему кровообращения, развивается некротическое повреждение мышечных волокон сердца. Развитию некроза способствует фиксация животного в неудобной позе, например растягивание в станке, или дополнительная нагрузка — бег в тредбане. Электролитно-стероидная кардиопатия с некрозом. По наблюдениям Селье, при введении крысам значительного количества солей натрия в сочетании с некоторыми анионами (сульфатами, фосфатами) в сердце появляются очаги повреждения дегенеративно-некротического типа, часто сопровождающиеся гиалинозом сосудов других органов. Эти повреждения становятся более обширными или возникают при введении меньшего количества солей, если одновременно вводятся некоторые стероидные гормоны надпочечных желез. На таком фоне легче развиваются и тяжелее протекают повреждения сердца, вызванные другими причинами. Так, например, введение даже небольших доз норадреналина, производных кальциферола, гипоксия, мышечное напряжение или, наоборот, значительно ограничение подвижности ведут к развитию обширного некроза миокарда. Соли калия и магния при этом обладают защитным действием. Иммунные повреждения сердца возможны при введении в организм экспериментального животного гетерогенной сыворотки, содержащей антитела к белкам сердца животного данного вида (кардиоцитотоксины). Доказано также, что в организме при определенных ситуациях могут возникать антитела и сенсибилизированные лимфоциты, направленные против тканей собственного сердца и оказывающие на них повреждающее действие. Этому способствует проникновение в кровоток денатурированных компонентов некротизированных кардиомиоцитов. В эксперименте аналогичный процесс можно вызвать введением животному взвеси миокарда со стимулятором иммунологической реакции (адъювантом Фрейнда). Сердце может быть повреждено и циркулирующими иммунными комплексами антиген — антитело — комплемент, а также при фиксации на его структурах цитофильных антител типа IgE и последующей их реакции с антигеном.
При перегрузочной форме СН миокард не справляется с резко возрастающей нагрузкой на сердце, например, при быстром нарастании АД в начальную стадию гипертонической болезни, при клапанных пороках сердца, артериовенозных шунтах. В этой форме недостаточности выделяют еще 2: при перегрузке повышенным сопротивлением, например при сосудистом спазме, сужении восходящей аорты; при перегрузке повышенным объемом притекающей крови, например, при некоторых клапанных пороках, артериовенозных шунтах. Надо сказать, что левый и правый желудочки сердца по-разному чувствительны к двум этим факторам перегрузки. Это обусловлено следующим. В среднем можно принять, что правый желудочек по своей массе примерно в 3,5 раза меньше чем левый. Но оба желудочка в единицу времени перекачивают одинаковый объем крови, т.е. минутный объем правого и левого сердца одинаков, иначе бы в кровотоке создался разрыв и нормальное кровообращение стало бы невозможным. Следовательно, в норме на единицу массы правого желудочка приходится в 3,5 раза большая нагрузка, следовательно, правый желудочек более тренирован. Давление крови в аорте примерно в 4-6 раз превышает давление крови в легочной артерии. Значит, на единицу массы и в левом и в правом желудочке приходится в норме одинаковая перегрузка. Т.е. к перегрузке давлением оба желудочка в норме тренированы одинаково. Следовательно, и на такую перегрузку они будут реагировать одинаково. Стадии компенсаторной гиперфункции сердца: 1. Аварийная стадия - кратковременная, патологические реакции преобладают над компенсаторными. Клинически - Острая недостаточность сердца; Идет мобилизация резервов миокарда; Гиперфункция обеспечивается увеличением количества функции каждой единицы миокарда. Идет увеличение интенсивности функционирования структур (ИФС). Это влечет активацию генетического аппарата миокардиоцитов, активацию синтеза белка, нуклеиновых кислот; Растет масса миофибрилл, митохондрий; Активируется энергообразование; Растет потребление кислорода; Интенсифицируются окислительные процессы; Активируется анаэробный ресинтез АТФ; Активируется анаэробный синтез АТФ. Все это - структурная основа гипертрофии миокарда. 2. Стадия завершившейся гипертрофии и относительно сохранившейся гиперфункции - полная компенсация, исчезновение патологических изменений в миокарде. Клинически - нормализация гемодинамики; Возросшая функция миокарда распределяется на все функциональные единицы гипертрофированного миокарда; ИФС нормализируется; Нормализируется активность генетического аппарата, синтез белка и НК, энергообеспечение, потребление кислорода. В эту стадию компенсаторные реакции преобладают. 3. Стадия постепенного истощения и прогрессирующего кардиосклероза. Преобладают патологические сдвиги: дистрофия; нарушение обмена; гибель мышечных волокон; замещение соединительной ткани; нарушение регуляции. Клинически - недостаточность сердца и кровообращения; ИФС уменьшается; Генетический аппарат истощается; Синтез белка и НК угнетается; Уменьшается масса миофибрилл, митохондрий; Снижается активность митохондриальных ферментов, уменьшается потребление О2; Комплекс изнашивания: вакуолизация, жировая дистрофия, кардиосклероз. Гипертрофия-это увеличение массы сердечной мышцы и соответственно размеров сердца . Гипертрофия сердца - это компенсаторная приспособительная реакция миокарда. Она развивается в ответ на повышенную нагрузку, которую испытывает тот или иной отдел сердца при наличии клапанных пороков или при повышении давления в большом или малом кругах кровообращения. При любой перегрузке сердца наблюдается увеличение напряжения миокарда в определенной камере сердца. Основным фактором, который стимулирует развитие гипертрофии миокарда, является увеличения напряжения миокарда при перегрузке сопротивлением. Гипертрофия миокарда развивается при перезагрузке объемом в период диастолы и при перегрузке сопротивлением в период систолы. При последнем она более выражена и появляется без первоначальной дилатации, соответствующей сердечной камеры. До сегодняшнего дня не выяснены механизмы, провоцирующие развитие гипертрофии миокарда. Считается, что и систолическое и диастолическое перерастяжение провоцирует активацию определенных генов, которые регулируют в кардиомоцитах протеосинтез. Полагается, что главная роль в стимуляции появления и развития гипертрофии миокарда принадлежит локально-образующемуся в сердце ангиотензину II. При оценке биологического значения гипертрофии миокарда следует обратить внимание на внутреннюю противоречивость данного явления. С одной стороны, это весьма совершенный приспособительный механизм, который обеспечивает длительное выполнение сердцем повышенной работы в нормальных и патологических условиях, а с другой — особенности структуры и функции гипертрофированного сердца служат предпосылкой для развития патологии. Преобладание одной из сторон в каждом конкретном случае определяет особенности протекания патологического процесса.
Снижение сократительной функции сердца является итогом развития СН самой разной этиологии. Несмотря на различие причин и известное своеобразие начальных звеньев патогенеза СН, ее механизмы на клеточном и молекулярном уровне едины. Механизмы снижения сократительной функции сердца: 1) недостаточность энергетического обеспечения клеток миокарда: расстройство энергосбережения основных процессов, происходящих в клетках миокарда (прежде всего его сокращения и расслабления), развивается вследствие нарушения ресинтеза макроэргов, транспорта их энергии к эффекторным структурам кардиомиоцитов, утилизации ими энергии макроэргических фосфатных соединений (энергетическое обеспечение клеток осуществляется за счет АТФ, образующейся преимущественном в митохондриях. из множества выполняемых митохондриями функций наиболее важны окисление в цикле Кребса, транспорт электронов, хемоосмотическое сопряжение, фосфорилирование АДФ, сопряжение окисления и фосфорилирования); нарушение обеспечения кардиомиоцитов энергией на этапах ее продукции, транспорта и утилизации может быть как стартовым механизмом снижения сократительной функции сердца, так и существенным фактором нарастания ее депрессии. 2) Повреждение мембран и ферментов кардиомиоцитов: повреждение клеточных мембран и ферментов; альтерация мембран и ферментов клеток миокарда — главное, а нередко и инициальное звено патогенеза сердечной недостаточности. Изменение физико-химических свойств и конформации молекул белка (структурных и ферментов), липидов, фосфолипидов и ЛП сопровождается значитель ным обратимым, а часто — необратимым повреждением структуры и фун кции мембран и ферментов, в том числе митохондрий, саркоплазматического ретикулума, миофибрилл, плазматической мембраны, обеспечиваю щих реализацию сократительной и ритмической функций сердца. 3) Ионный дисбаланс: нарушение содержания и соотношения между отдельными ионами внутри и вне клеток (дисбаланс ионов и воды в клетке, как правило, развивается вслед за или одновременно с расстройствами энергетического обеспечения и повреждением мембран и ферментов. В результате существенно изменяется трансмембранный перенос многих ионов. В наибольшей мере это относится к K+, Na+, Ca 2+, Mg2+, Cl- , т.е. ионам, которые принимают участие в таких жизненно важных процессах, как возбуждение, проведение потенциалов действия, электромеханическое сопряжение. Ионный дисбаланс характеризуется изменением соотношения отдельных ионов в цитозоле и нарушением трансмембранного соотношения ионов как по обе стороны плазмолеммы, так и внутриклеточных мембран). Ниже приведены специфичные для развития сердечной недостаточности особенности ионного дисбаланса; ионный дисбаланс при сердечной недостаточности проявляется наруше нием соотношения между отдельными ионами в разных секторах кардиомиоцитов: в органеллах (митохондриях, саркоплазматическом ретикулуме, миофибрилл ах), в цитозоле, по разные стороны плазматической мем браны кардиомиоцитов. В наибольшей степени это относится к ионам: К+, Na+, Са2+. Именно эти катионы в основном определяют реализацию таких процессов, как возбуждение, электромеханическое сопряжение, сокращение и расслабление миокарда. 4) Нарушение в генетической программе кардиомиоцитов: нарушения в генетической программе клеток и/или механизмов её реализа ции (повреждение ядерного генома и/или механизмов экспрессии генов, репликации и репарации ДНК, клеточного цикла - существенные механизмы альтерации, имеющие далеко идущие последствия. Эти повреждения особенно важны для малигнизации клеток и процессов онкогенеза); при сердечной недостаточности происходит активация генов, контролирующих процессы обновления субклеточных структур кардиомиоцитов, а также роста сосудов микроциркуляторного русла и нервных волокон. В частности, при ишемическом и стрессорном повреждении сердца подавлена экспрессия мРНК для Са2+-зависимой АТФазы саркоплазматической сети. Это и потенцирует ингибирование процессов захвата и выброса Са2+ ретикулумом миоцитов. В условиях ишемии и инфаркта миокарда, хронического эмоционально-болевого стресса подавлен также процесс трансляции генетической информации. Это сопровождается нарушением синтеза различных белков клеток миокарда. 5) Расстройства нейрогуморальной регуляции сердца: нарушения жизнедеятельности клетки могут быть результатом расстройства одного или нескольких уровней реализации регуляторных механизмов. Действие патогенных факторов - (изменение числа рецепторов клетки к БАВ; изменение чувствительности рецепторов клетки в БАВ; нарушение функции внутриклеточных посредников («мессенджеров» регуляторных воздействий) – расстройство жизнедеятельности клетки): а) изменение механизмов симпатической регуляции: уменьшение содержания нейромедиатора симпатической нервной сис темы — норадреналина в ткани сердца. Причины: снижение синтеза норадреналина в нейронах симпатической нервной системы (в норме в них образуется около 80% медиатора, содержащегося в миокарде). Является результатом подавления активности фермента тирозин-гидроксилазы и торможения захвата норадреналина нервными окончаниями; снижение адренореактивных свойств сердца, т.е. выраженности ино-, хроно-, дромо- и батмотропных эффектов норадреналина и адреналина; б) изменение механизмов парасимпатической регуляции: ацетилхолин через м-холинорецепторы вызывает уменьшение частоты сер дечных сокращений, ингибируя образование цАМФ и активируя образо вание цГМФ который, в свою очередь, активирует цГМФ-зависимую киназу, подавляющую активность потенциалозависимых Са2+-каналов; изменение механизмов парасимпатической регуляции при сердечной недостаточности выражено значительно меньше, чем симпатической. Это является результатом более высокой резистентности парасимпати ческих механизмов к различным повреждающим факторам. Последствия нарушенных симпатических и парасимпатических влияний на миокард состоят в снижении степени управляемости и надёжности регуля ции сердца. Это приводит к падению темпа и величины мобилизации со кратительной функции сердца, особенно в чрезвычайных условиях.
Нарушения К. могут быть вызваны изменениями функции сердца, сосудов, а также реологических свойств текущей по ним крови. Поскольку отдельные части кровеносной системы тесно связаны между собой, нарушение функции каждой из них всегда оказывает влияние на функцию других. Нарушения К. могут быть общими, охватывая всю кровеносную систему, и местными (в отдельных участках сосудистого русла). Поскольку непрерывное К. необходимо для обеспечения нормального функционирования любых частей организма, его нарушение влечет за собой расстройства функции соответствующих органов. Сердце работает как насос, перекачивающий кровь из венозной системы в артериальную. Для того чтобы кровоток во всей сосудистой системе организма был непрерывным, необходим некоторый постоянный уровень кровяного давления в аорте и крупных артериальных ветвях, называемый общим артериальным давлением (АД) Причинами нарушения основной, т.е. насосной, функции сердца могут быть уменьшение возврата крови из вен к сердцу, что обычно бывает обусловлено уменьшением объема циркулирующей крови; декомпенсированные пороки сердца, в частности недостаточность клапанов сердца, когда неполное смыкание их створок приводит к возврату части крови в ретроградно расположенную полость сердца или же имеется стеноз сердечных отверстий, значительно увеличивающий сопротивление кровотоку в них; слабость сердечной мышцы, сокращения которой не обеспечивают достаточно высокого внутрижелудочкового давления для того, чтобы перемещать весь объем крови в пределах большого и малого круга К.; неспособность полостей сердца к достаточному расширению во время диастолы в результате накопления значительного количества крови (при тампонаде сердца) или экссудата (при перикардитах) в полости перикарда или же облитерации последней вследствие хронического перикардита. Проявления СН: При развившейся острой сердечной недостаточности или при обострении хронической возникает ряд находящихся во взаимосвязи нарушений сначала внутрисердечной, а затем и общей гемодинамики. 1. Увеличение остаточного систолического объема крови. В полостях желудочков нормально функционирующего сердца после систолы остается некоторое количество крови, которое получило название остаточного систолического объема. В условиях развития сердечной недостаточности, когда сократительная способность миокарда ослаблена, количество крови, остающееся в полости декомпенсированного желудочка по окончании систолы, увеличивается. 2. Возрастание конечного диастолического давления. От объема крови, оставшегося в желудочках сердца, зависит и величина диастолического давления в их полостях. Естественно, при увеличении этого объема возрастет и конечное диастолическое давление. 3. Дилатация желудочков сердца. Увеличение систолического объема крови и возрастание конечного диастолического давления в полостях желудочков сердца ведут к дилатации (расширению) желудочков. Различают две формы расширения полостей сердца: тоногенную и миогенную дилатацию. Тоногенная дилатация развивается на фоне в достаточной степени сохранных сократительных и эластичных свойств сердечной мышцы, подчиняющейся в данном случае закону Франка-Старлинга, согласно которому сердце тем эффективнее сокращается во время систолы, чем оно сильнее растянуто в диастолу. Здесь четко видно, что патогенетический механизм может играть саногенетическую роль, поскольку вследствие тоногенной дилатации возрастает сердечный выброс. Эти закономерности резко нарушаются при миогенной дилатации, в основе которой лежит снижение эластичности сердечной мышцы, в результате чего она в значительно меньшей степени начинает подчиняться закону Франка-Старлинга. В данном случае можно говорить не только о дилатации, но и об определенной атонии сердечной мышцы. 4. Повышение давления в венах, по которым кровь притекает к декомпенсированному отделу сердца. В случае развития миогенной дилатации или при такой высокой гемодинамической перегрузке, когда даже тоногенно дилатированное сердце не обеспечивает необходимого сердечного выброса, резко повышается давление в предсердиях. Если декомпенсирован левый желудочек, то возрастание давления в левом предсердии приведет и к повышению давления в венах малого круга кровообращения. При декомпенсации правого желудочка возрастет давление в правом предсердии и, соответственно, в венах большого круга кровообращения. 5. Отеки. При выраженной недостаточности левого желудочка сердца может развиться гемодинамический отек легкого и общие отеки, поскольку уменьшение выброса крови в аорту может быть фактором, инициирующим задержку натрия, а затем и воды в организме. При недостаточности правого желудочка или при тотальной декомпенсации сердечной деятельности в развитии отеков главную роль начинает играть гемодинамический фактор, связанный с венозным застоем. Подробно механизмы сердечных отеков рассмотрены в «Нарушения водно-солевого обмена». Кроме гемодинамических, наблюдаются и другие (естественно, связанные в своей основе с нарушениями гемодинамики) проявления декомпенсации сердечной деятельности. 1. Одышка. Это - один из наиболее частых симптомов сердечной недостаточности, обусловленный застоем крови в легких. Вначале она проявляется только при физической нагрузке, а при прогрессировании процесса - и в покое. 2. Ортопноэ. У больных одышка уменьшается, когда они либо сидят, либо лежат с поднятым изголовьем. Такое положение больного уменьшает венозный приток к правым отделам сердца, в результате чего снижается давление в капиллярах легких. На первый взгляд парадоксальным является уменьшение интенсивности ортопноэ по мере нарастания правожелудочковой недостаточности. Это объясняется тем, что при прогрессировании процесса застой крови происходит преимущественно в большом круге кровообращения. 3. Сердечная астма. Она проявляется приступами удушья или приступами острой сердечной недостаточности, преимущественно, в ночное время. Это состояние характеризуется исключительно тягостным удушьем, кашлем с мокротой, клокочущим дыханием. Больной бледен и цианотичен. Затянувшийся приступ сердечной астмы может закончиться отеком легких. Что касается частого возникновения таких приступов в ночное время, то это связано с уменьшением во время сна легочной вентиляции из-за снижения чувствительности дыхательного центра к адекватным для него стимулам, ослаблением сократительной функции сердца в связи со снижением во сне уровня адренергической стимуляции и с горизонтальным положением больного, при котором из депо выходит больше крови, что ведет к возрастанию ОЦК.
Аритмия – типовая форма патологии сердца – характеризуется нарушением частоты и периодичности генерации возбуждения и/или последовательности возбуждения предсердий и желудочков. Развитие аритмий может быть связано с нарушениями основных функций проводящей системы сердца: автоматизма, возбудимости и проводимости. На этом основана классификация аритмий, согласно которой выделяют: 1) Аритмии, обусловленные нарушением автоматизма. 2) Аритмии, связанные с нарушением возбудимости. 3) Аритмии, обусловленные нарушением проводимости. 4) Аритмии, связанные с сочетанными нарушениями возбудимости и проводимости. Аритмии, связанные с нарушением автоматизма сердца делятся на 2 группы: 1. Номотопные аритмии – генерация импульсов к сокращению, как и в норме, происходит в синусно-предсердном узле. К этой группе относятся: а) синусная тахикардия – увеличение ЧСС, б) синусная брадикардия – уменьшение ЧСС, в) синусная (дыхательная) аритмия – изменение ЧСС в разные фазы дыхательного цикла (учащение при вдохе и урежение при выдохе). 2. Гетеротопные аритмии – генерация импульсов к сокращению происходит не в синусно-предсердном узле, а в других структурах проводящей системы, являющихся водителями ритма II и III порядка. Синдром развивается в результате уменьшения активности или прекращения деятельности синусно-предсердного узла при повреждении его клеток или первичных функциональных нарушениях. При этом могут развиваться следующие виды патологических ритмов сердца: а) предсердный медленный ритм – водитель ритма находится в структурах левого предсердия, ЧСС меньше 70 в 1 мин; б) атриовентрикулярный ритм – источник импульса – водители II порядка (верхняя или нижняя часть атриовентрикулярного узла), ЧСС в зависимости от места генерации импульсов уменьшается от 70 до 40 в 1 мин; в) идиовентрикулярный желудочковый ритм – генерация импульсов происходит в водителях ритма III порядка (пучок Гисса или его ножки), ЧСС меньше 40 в 1 мин. Аритмии, связанные с нарушениями функции возбудимости. В их основе лежит появление расположенных вне синусно-предсердного узла так называемых эктопических очагов возбуждения, генерирующих внеочередные импульсы к сокращению. В патологических условиях может проявиться собственнй автоматизм нижележащих отделов проводящей системы сердца (потенциальных водителей ритма). Такие условия могут возникнуть при снижении автоматизма синусно-предсердного узла или при повышенной способности к генерации импульсов вдругих участках миокарда. В этих случаях частота импульсов, генерируемых нормальным водителем ритма, оказывается недостаточной для подавления автоматизма других отделов, что приводит к появлению добавочных импульсов из эктопически расположенных очагов возбуждения. Другим механизмом, приводящим к появлению эктопическеих очагов возбуждения, может быть возникновение разности потенциалов между расположенными рядом миоцитами вследствие, например, разновременного окончания реполяризации в них, что может вызывать возбуждение в волокнах, которые уже вышли из фазы рефрактерности. Это явление наблюдается при локальной ишемии миокарда и при отравлении СГ. Среди аритмий рассматриваемой группы наиболее часто встречаются экстрасистолия (нарушение ритма сердца, характеризующееся возникновением одиночных или парных преждевременных сокращений сердца (экстрасистол), вызываемых возбуждением миокарда, исходящим, как правило, не из физиологического источника сердечного ритма (синусно-предсердного узла), т.е. являющимся гетеротопным) и пароксизмальная тахикардия (приступообразное увеличение частоты сердечных сокращений при сохранении их правильного ритма, обусловленное патологической циркуляцией возбуждения по миокарду или активацией в нем патологических очагов высокого автоматизма). Аритмии, связанные с нарушением проводимости делят на 2 группы: 1. Блокады сердца – обусловлены замедлением или полным прекращением проведения импульсов по проводящей системе. Причина блокады – повреждение проводящих путей, которое ведет к удлинению рефрактерного периода, ухудшению других функциональных характеристик и сопровождается замедлением или полным прекращением проведения импульса. Нарушения проводимости могут возникать между синусно-предсердным узлом и предсердиями, внутри предсердий, между предсердиями и желудочками и в одной из ножек пучка Гисса. Поэтому выделяют следующие виды блокад: а) внутрипредсердную, б) предсердно-желудочковую, в) внутрижелудочковую. 2, Ускоренное проведение импульсов – синдром Вольфа-Паркинсона-Уайта - характеризуется ускоренным проведением импульсов от предсердий к желудочкам, в результате чего происходит преждевременное возбуждение последних, развивается тахикардия, уменьшается интервал P-Q на ЭКГ. 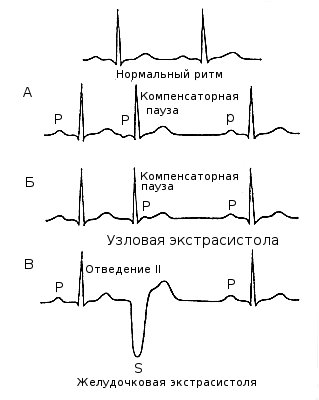 Изменения электрокардиограммы. Существуют два основных типа патологических изменений ЭКГ: к первому относятся нарушения ритма и возникновения возбуждения, ко второму — нарушения проведения возбуждения и искажения формы и конфигурации зубцов. Аритмии, или нарушения ритма сердца, характеризуются нерегулярным поступлением импульсов из синоатриального (СА) узла. Ритм (частота сокращений) сердца, может быть низким (брадикардия) или очень высоким (тахикардия). Предсердные экстрасистолы характеризуются укороченным Р-Р интервалом, после которого следует длинный Р-Р интервал (рис. 32, А). При желудочковых экстрасистолах, когда возбуждение возникает в эктопическом очаге, локализованном в стенке желудочка, преждевременное сокращение характеризуется искаженным комплексом QRS (рис 32, В). Желудочковая тахикардия сопровождается быстрыми регулярными разрядами эктопического очага, расположенного в желудочке (рис. 32, Д). Рис. 32. ЭКГ при аритмии сердца. А — предсердная экстрасистола; Б — узловая экстрасистола; В — желудочковая экстрасистола; Г — предсердная тахикардия; Д— желудочковая тахикардия; Е — мерцание предсердий; Ж— трепетание предсердий.
Артериальная гипертензия – стойкое повышение АД выше нормы: систолическое до 140мм рт. ст. и выше, диастолическое до 90 мм рт. ст. и выше (при условии, что эти значения получены в результате как минимум трех измерений, произведенных в различное время на фоне спокойной обстановки, а больной за сутки до измерений не принимал ЛС, изменяющих АД) Классификация: 1.По минутному объему сердца (сердечному выбросу): а) гиперкинетические – с увеличением сердечного выброса выше нормы, б) эукинетические – с нормальным сердечным выбросом, в) гипокинетические – с уменьшенным сердечным выбросом. 2. П инициальному звену патогенеза: а) эндокринные – развиваются вследствие эндокринопатий надпочечников, щитовидной железы и гипофиза, б) гемические – развиваются вследствие увеличения объема и/или вязкости крови, в) нейрогенные – деляться на центрогенные и рефлекторные (рефлексогенные), г) метаболические (гипоксические) – выделяют ишемические (почечно-ишемическая, цереброишемическая) венозно-застойные и гипоксические (без первичного нарушения гемодинамики в органах и тканях), д) смешанные. 3.По преимущественно повышенному АД: а) систолические, б) диастолические, в) смешанные. 4. По клиническому течению: а) доброкачественные – с медленным развитием, повышение как систолического, так и диастолического АД, как правило, эукинетические, б) злокачественные – быстро прогрессирующие, с преимущественным повышением диастолического АД, как правило, гипокинетические, реже – гиперкинетические (особенно на начальном этапе). Механизмы развития первичных и вторичных АГ. В основе патогенеза гипертонической болезни лежит увеличение объема минутного сердечного выброса и сопротивления периферического сосудистого русла. В ответ на воздействие стрессового фактора возникают нарушения регуляции тонуса периферических сосудов высшими центрами головного мозга (гипоталамусом и продолговатым мозгом). Возникает спазм артериол на периферии, в т. ч. почечных. Альдостерон, участвующий в минеральном обмене, вызывает задержку воды и натрия в сосудистом русле, что еще более увеличивает объем циркулирующей в сосудах крови и повышает АД. При артериальной гипертензии увеличивается вязкость крови, что вызывает снижение скорости кровотока и обменных процессов в тканях. Инертные стенки сосудов утолщаются, их просвет сужается, это делает артериальную гипертензию необратимой. В дальнейшем повышается проницаемость и плазматическое пропитывание сосудистых стенок, что в конечном итоге ведет к вторичным изменениям в тканях органов: склерозу миокарда, гипертонической энцефалопатии, первичному нефроангиосклерозу. Экспериментальное моделирование АГ. 1) Нарушение функции ЦНС: столкновение процессов условного возбуждения и торможения, приводящее к развитию неврозов; моделирование психоэмоционального напряжения, изменений биоритмов; электрическая и химическая стимуляция лимбических структур ГМ. 2) Нарушение мозгового крово- и лимфообращения: одно- и двусторонняя перевязка питающих мозг сонных и позвоночных артерий; блокада лимфооттока по периневральным и периваскулярным лимфатическим путям с помощью каолина, вводимого в большую цистерну мозга. 3) Нарушение функции депрессорных регуляторных систем: двустороннее перерезание у кроликов и собак депрессорных и синусных нервов, в результате чего снимаются тормозящие влияния с барорецепторов рефлексогенных зон дуги аорты и каротидного синуса (рефлексогенная гипертензия); центральная деафферентация барорецепторов, вызываемая повреждением ядра солитарного тракта; подавление синтеза простагландинов в помощью индометацина. 4) нарушение функции почек: сужение обеих почечных артерий или сужение одной почечной артерии с удалением второй контрлатеральной почки. Возникновение АГ в этом случае связано с активацией ренин-ангиотензинной системы; удаление обеих почек и перевод животных на гемодиализ для предотвращения уремии; обертывание почек целлофаном, шелком. При этом возникает перинефрит: сдавливается почечная паренхима, развивается венозный застой и гипоксия почек, активируется ренин-ангиотензинная система. 5) Нарушение гормонального состояния: введение животным адреналина; введение вазопрессина; субтотальное удаление коры надпочечников, при этом происходит усиление регенерации железистой ткани с усиленной продукцией кортикостероидов, особенно альдостерона (надпочечниково-регенерационная гипертензия). 6) Нарушение водно-солевого обмена: введение животным большого количества поваренной соли (солевая гипертензия); введение минералкортикоидов (альдостерон) – минералокортикоидная гипертензия. 7) Модели генетически обусловленной АГ. Во многих лабораториях мира получены чистые линии крыс, характерной особенностью которых является гипертензия, передаваемая по наследству. Это крысы со спонтанной гипертензией, крысы, предрасположенные к инсультам, крысы, чувствительные к солевой диете.
Артериальная гипотензия - стойкое понижение артериального давления, обусловленное преимущественно понижением тонуса резистивных сосудов. Наблюдается она чаще у лиц астенической конституции, характеризуется понижением физического развития и питания, общей адинамией, быстрой утомляемостью, тахикардией, одышкой, головокружением, головной болью, обмороками. В настоящее время выделяют артериальную гипотензию физиоло гическую (не сопровождается болезненными симптомами) и патологическую (с характерным симптомокомплексом). Последняя бывает острой и хронической. Хроническая артериальная гипотензия подразделяется на симптоматическую (вторичную) и нейроциркуляторную дистонию гипотензивного типа (первичную гипотензию). Патогенетически, учитывая, что уровень артериального даления определяется величиной сердечного выброса, количеством циркулирующей крови и тонусом резистивных сосудов, возможны три гемодинамические формы артериальной гипотензии: связанная с недостаточностью сократительной функции сердца; вызванная уменьшением количества циркулирующей крови и возникающая вследствие понижения тонуса резистивных сосудов. Виды артериальных гипотензий: 1) фиологическая артериальная гипотензия: а) индивидуальный вариант нормы (так называемое нормальное низкое АД); б) артериальная гипотензия высокой тренированности (спортивная артериаль ная гипотензия); в) адаптивная (компенсаторная) артериальная гипотензия (характерная для жителей высокогорья, тропиков, Заполярья). 2) патологическая артериальная гипотензия: а) острая: коллапс (острая недостаточность кровообращения, возникающая вслед ствие острого снижения функции сердца, быстрого падения сосудистого тонуса и/или уменьшения ОЦК; проявляется резким снижением артери ального и венозного давления, гипоксией головного мозга и угнетением жизненно важных функций организма); продолжительное снижение систолического АД ниже 90 мм рт.ст., со провождающееся анурией, симптомами нарушений периферического кро вообращения и сознания, например при шоке; б) хроническая: хроническая первичная артериальная гипотензия. Артериальная гипотензия нейроциркуляторная (с нестойким обратимым течением и выраженная стойкая форма — гипотоническая болезнь); артериальная гипотензия ортостатическая идиопатическая (первичная вегетативная недостаточность); хроническая вторичная (симптоматическая) артериальная гипотензия с ортостатическим синдромом или без него. Патогенез гипотонической болезни практически не изучен (возможно, в связи с тем, что гипотоническая болезнь не имеет опасных для здоровья и жизни последствий или осложнений). Предполагают, что у больных гипотонической болезнью все системы, поддерживающие артериальное давление на необходимом для организма уровне, функционируют на нижней границе физиологической нормы. Совпадение такого «нижнеуровневого» функционирования ряда систем регуляции АД и приводит к его стойкому понижению. Экспериментальное моделирование. Не менее интересны экспериментальные исследования авторов, показавшие значение почечного фактора в генезе гипотонии. Авторы, исходя из того, что при распаде тканей образуются депрессорные субстанции (гистамин, ацетилхолин, аденозинфосфорная кислота) и что почки выделяют в кровь не только прессорные, но и депрессорные вещества, использовал анемизацию почек и венозный застой в них для получения экспериментальной гипотонии. Анемизация вызывалась путем зажатия обеих почечных артерий на 30—60 минут, при этом артериальное давление снижалось на 40—60% по сравнению с исходным. Гипотония держалась неделями. Венозный застой автор получал путем накладывания зажима на обе почечные вены в течение 25—35 мин. В результате возникала стойкая длительная гипотония. Автор объясняет это гуморальными влияниями — образованием депрессорных веществ в почках после нарушения кровообращения в них.Следует подчеркнуть, что до настоящего времени нет исчерпывающего объяснения, почему при неврозах вазомоторных центров у одних развивается гипотония, а у других — гипертония? Известно, что И. П. Павлов различал неврозы, протекающие с преобладанием возбуждения и с преобладанием торможения центральной нервной системы. Следовательно, вопрос о реализации невроза принципиально был решен И. П. Павловым. Однако пути, непосредственной реализации невротических нарушений по типу гипотонии или гипертонии остаются все еще невыясненными
Атеросклероз - это заболевание, поражающее стенки сосудов, главным образом артерий мышечного и мышечно-эластического типа, в основе которого лежат нарушения жирового и белкового обмена, прежде всего, обмена холестерина, проявляющееся имбибицией (пропитыванием) сосудистой стенки белками и липидами с последующим развитием вокруг этих отложений реактивных изменений. Атерогенез представляет собой сложный многоступенчатый процесс, в ходе которого в просвете сосудов формируется фиброзная бляшка, состоящая из покрышки, включающей гладкомышечные клетки и фиброзную ткань под слоем эндотелия, и ядра, содержащего желтоватые жиры. Первопричиной или пусковым механизмом развития атеросклероза считают, является повреждение клеток эндотелия, это клетки которые выстилают внутреннею оболочку сосудов. Повреждение эндотелия происходит по различным причинам, это токсическое воздействие на эти клетки курения, в результате токсического действия холестерина, повышенное артериальное давление также является повреждающим фактором. Здесь можно предположить, что и наследственная слабость этих клеток имеет не маловажное значение. После повреждения клеток выстилающих внутреннею стенку сосуда, жиры или иначе холестерин, а точнее частицы липопротеинов низкой плотности (ЛПНП) или плохой холестерин проникает в среднюю стенку сосуда, где с ним происходят сложные реакции, которые вызывают воспаление в этом месте. В дальнейшем при прогрессировании процесса идет дальнейшее накопление холестерина в месте воспаления и происходит формирование атеросклеротической бляшки, в дальнейшем в этой бляшке откладываются соли кальция, происходит кальциноз, отвердение бляшки. Образно атеросклеротическую бляшку модно сравнить с бородавкой внутри сосуда. Последствия: 1.Атеросклеротическая бляшка частично перекрывает просвет сосуда, результатом чего является хронический недостаток кислорода и питательных веществ в органе, который кровоснабжает пораженный сосуд. Если этот орган сердце то может развиться стенокардия, аритмия, сердечная недостаточность. 2. Атеросклеротическая бляшка не такая эластичная, как здоровая артерия и в момент пульсового растяжения просвета артерии может дать трещину. Трещина в атеросклеротической бляшке обнажает соединительную ткань сосуда, и этот момент является пусковым механизмом образования тромба. Тромб, перекрывая просвет сосуда, приводит к развитию инфаркта или некроза, а проще говоря, омертвению части органа. 3. Трещина в области бляшки может привести к разрыву стенки сосуда и кровоизлиянию в соответствующий орган, например кровоизлияние в головной мозг, так называемый геморрагический инсульт. Трещина в области бляшки на аорте может привести к расслаивающей аневризме аорты.
Недостаточность внешнего дыхания – патологическое состояние, при котором система внешнего дыхания не способна обеспечить нормальный состав газов крови (газовый гомеостаз). Внешнее дыхание – совокупность процессов, совершающихся в легких и обеспечивающих нормальный газовый состав артериальной крови. Классификация: 1) По клиническому течению: а) острая недостаточность - развивается на протяжении нескольких дней, часов и даже минут (БА, острая пневмония); б) подострая недостаточность – может быть рассмотрена на примере гидроторакса, накопления различной природы жидкости в плевральной полости (недели); в) хроническая недостаточность – развивается на протяжении длительного времени и является следствием заболевания бронхов и легких (эмфизема легких, хроническая пневмония).следует отметить, что патологические изменения при хронической недостаточности внешнего дыхания, как правило, необратимы, тогда как при острой и подострой недостаточности внешнего дыхания возможно полное восстановление нарушенных функций. 2) По выраженности клинических признаков: а) компенсированная – гепоксемии нет, но определяют различные варианты и степени обструктивных, рестриктивных и смешанных нарушений вентиляционной функции легких; б) субкомепнсированная – гипоксемия имеет место, показатели вентиляции легких нормальны или снижены в различной степени, могут быть нарушения диффузионной способности легких или нарушение легочного кровотока (в зависимости от вида недостаточности внешнего дыхания); в) декомпенсированная - определяется тяжелая гипоксемия. 3) По патогенезу: а) вентиляционная – вследствие нарушения обмена газов между атмосферным воздухом и альвеолами легких, т.е. в результате нарушения легочной вентиляции; б) паренхиматозная. Проявления дыхательной недостаточности: 1) изменение работы дыхательных мышц, что приводит к изменению дыхательного объема: увеличение работы (гиперпноэ – увеличение глубины дыхания, тахипноэ - увеличение частоты дыхательных движений, обычно сочетается с уменьшением дыхательного объема); уменьшение работы (брадипное – уменьшение частоты дыхания со снижением дыхательного объема); 2) нарушение газового состава артериальной крови – артериальная гипоксемия и (иногда) гиперкапния (респираторный ацидоз); 3) одышка – объективное проявление дыхательной и сердечной недостаточности, а также гипоксемии, обусловленной другими факторами (тяжелая анемия, дефицит кислорода во вдыхаемом воздухе, когда в крови его напряжение становится меньше порога возбуждения рецепторов – 40 мм. рт. ст.); 4) цианоз - признак декомпенсированной ДН с выраженной гипоксемией; 5) вторичный эритроцитоз - возникает при тяжелой декомпенсированной хронической ДН. Основным внешним проявлением ДН является изменение интенсивности работы дыхательных мышц и экскурсии грудной клетки (изменение объема грудной клетки и ЧДД), что может развиваться в результате: влияний на ДЦ афферентной импульсации от различных рецепторов, в том числе и тех, которые активируются при увеличении сопротивлению дыхания (адаптационное увеличение ДО со снижением ЧДД или снижение ДО с увеличением ЧДД при различных видах ДН); прямое воздействие на ДЦ повреждающих факторов, нарушающих его деятельность (возникает первичная гиповентиляция).
Типовыми формами нарушения альвеолярной вентиляции являются: альвеолярная гипо-, гипервентиляция и неравномерная вентиляция. Альвеолярная гиповентиляция – типовая форма нарушения внешнего дыхания, при котором реальный объем вентиляции альвеол за единицу времени ниже необходимого организму в данных условиях. Причины: обструкция дых. путей, нарушение растяжимости легких, нарушение регуляции внешнего дыхания. Различают расстройства обструктивные и рестриктивные. Обструктивный заключается в снижении проходимости дыхательных путей. Снижается объем вентиляции соответствующих областей легких, возрастает работа дых. мышц, увеличиваются энергозатраты. Причины: обтурация просвета дых. путей инородными телами, запавшим языком, мокротой, слизью, кровью; спазм бронхов и бронхиол; спазм мышц гортани; сдавление (компрессия) дых. путей извне; динамическое сдавление бронхов при повышении внутрилегочного давления во время выдоха. Проявления: снижение показателей объема форсированной жизненной емкости легких(ФЖЕЛ) и объема форсированного выдоха за 1с (ФЖЕЛ1),снижение индекса Тиффно (ФЖЕЛ\ФЖЕЛ1); сохранение в диапазоне нормы показателя общей емкости легких; увеличение показателей остаточного объема легких(ООЛ) и отношения ООЛ к общей емкости легких. Рестриктивный или альвеолярный характеризуется снижением степени расправления легких, увеличивается нагрузка на дых. мускулатуру, повышается энергетическая «стоимость» дыхания. Причины: внутрилегочные причины (вызывают снижение растяжимости ткани легких – фиброзные процессы, ателектазы, диффузные опухоли); внелегочные причины(обуславливают ограничение дыхательных экскурсий легких –сдавление грудной клетки, снижение подвижности суставов гр.клетки, наличие в грудной клетке крови, экссудата, транссудата, воздуха; плевриты и др. Проявления: уменьшение показателей общей емкости легких, снижение остаточного объема легких, уменьшение ЖЕЛ. Альвеолярная гипервентиляция- типовая форма нарушения вн. дых-я, характеризующаяся превышением реальной вентиляции легких за единицу времени над необходимой организму в данных условиях. Причины: неадекватный режим ИВЛ(пассивная гипервентиляция); стрессы, неврозы; органические повреждения мозга; гипертермические состояния; экзогенная гипоксия. Основные проявления альвеолярной гипервентиляции: снижение потребления органами и тканями кислорода; дисбаланс ионов крови; гипокапния и дых. алкалоз; судороги. Неравномерная вентиляция. Регионарное распределение альвеолярной вентиляции при спокойном дыхании не вполне равномерно. Базальные сегменты получают относительно большую часть дыхательного объема, верхние отделы - меньшую часть. Изменения вентиляции могут происходить в отдельных участках легкого (неравномерная вентиляция) или охватывать легкие целиком. Регионарные изменения эластичности, недостаточное расправление легочной ткани (пневмосклероз, пневмокониоз), регионарная обтурация бронхов и т.п. являются причинами неравномерной вентиляции. Причины нарушения альвеолярной вентиляции (альвеолярная вентиляция заключается в регулярном обновлении альвеолярных газов в соответствии с потребностями организма): 1) нарушение функции дыхательного центра. Вентиляция альвеол регулируется нейронами дыхательного центра, расположенного в продолговатом мозге и мосту; 2) нарушение функции мотонейронов спинного мозга. Функция мотонейронов спинного мозга, иннервирующих дыхательные мышцы, может быть нарушена при развитии опухоли в спинном мозге; 3) нарушение функции нервно-мышечного аппарата. Нарушение вентиляции может возникать при поражении нервов, иннервирующих дыхательные мышцы (воспаление, авитаминоз, травма), при затруднении передачи мышцам нервного импульса (при миастении, ботулизме, столбняке), при нарушении функции самих дыхательных мышц (миозит, дистрофия); 4) нарушение подвижности грудной клетки. Все патологические процессы, ограничивающие подвижность грудной клетки, ограничивают растяжение легких; 5) нарушение целости грудной клетки и плевральной полости. Целость плевральной полости обеспечивает создание постоянного транспульмонального давления; 6) нарушение функции легких. Вентиляция альвеол может нарушаться при поражении легочной ткани и воздухоносных путей.
В норме соотношение между величинами вентиляции и перфузии сопряжены как в отдельных областях, так и в лёгких в целом: кровоток реализуется в тех участках лёгкого, в которых осуществляется вентиляция. При этом соотноше ние перфузии и вентиляции оптимально. Именно в указанных участках лёгко го происходит газообмен между воздухом альвеол и кровью, протекающей по межальвеолярным капиллярам. Это обеспечивает такое отношение выделения лёгкими СО2 к потреблению О2, которое адекватно дыхательному коэффици енту, отражающему интенсивность обмена веществ (эти коэффициенты — вентиляционно-перфузионный и дыхательный — в норме равны примерно 0,8). Нарушение сопряжения вентиляции и перфузии лёгких приводит к развитию дыхательной недостаточности. Количественная зависимость между вентиляци ей (V) и перфузией (Р) лёгких выражается показателем V/Р, который в норме колеблется в диапазоне 0,8—1,0. Причины нарушения диффузии газов в легких: Диффузия газов через альвеолокапиллярную мембрану осущест вляется в соответствии с первым законом Фика: где V - количество газа, диффундирующего за единицу времени; К - коэффициент диффузии; S — общая площадь, через которую происхо дит диффузия; l - толщина мембраны; Р1 и Р2 - парциальное давле ние газов по обе стороны мембраны. Исходя из этого, можно выделить следующие причины наруше ний диффузии газов в легких: 1) уменьшение коэффициента диффузии. Величина его зависит как от природы газа, так и от среды, в которой происходит диффузия. Практически имеет значение уменьшение коэффициента диффузии кислорода в связи с изменением свойств легочной ткани. При этом переход СО2 из крови в альвеолы, как правило, не меняется, посколь ку коэффициент его диффузии очень высокий (в 20-25 раз выше, чем кислорода); 2) уменьшение площади диффузии. Имеет место при уменьшении дыхательной поверхности легких; 3) увеличение толщины альвеолокапиллярной мембраны;4) уменьшение разности между парциальным давлением газов в альвеолярном воздухе и их напряжением в крови легочных капилляров. Такая ситуация возникает при всех нарушениях вентиляции легких; 5) уменьшение времени контакта крови с альвеолярным воздухом. Диффузия кислорода нарушается в том случае, если время контакта становится меньше 0,3 с. |
