ростовский государственный медицинский университет министерства здравоохранения
 Скачать 1.44 Mb. Скачать 1.44 Mb.
|
ЭПИГЕНЕТИКА. ПЕРСПЕКТИВЫ.ИСПОЛЬЗОВАНИЕ ДОСТИЖЕНИЙ В МЕДИЦИНЕ Михайлов И.И. Научный руководитель: к.м.н. Рамазанова Л.И. ФГБОУВО«Ростовскийгосударственныймедицинскийуниверситет» Научный обзор, представленный в данной статье, посвящен одному изактуальных и неоднозначных направлений в современной биологии и теорети-ческой медицине – эпигенетике, как важному средовому фактору в формиро-вании фенотипа. В статье приведены результаты научных достижений веду-щих мировых лабораторий в области эпигенетики и нутригеномики; сделанывыводы о перспективах дальнейших исследований в этой области с целью про-филактики патологических процессов. Ключевые слова: эпигенетика, экспрессия генов, эпигенетические меха-низмы,нутриенты. Эпигенетика («epi» с латинского «над») – это своего рода «над-генетика», то есть наследование по механизмам эпигенетики определяется не молекула- ми наследственности (ДНК и РНК), а их «ближайшим окружением»: на ДНК ( и, как было доказано недавно, также на РНК) в определенных местах надстраиваются, т.е. прикрепляются снаружи некоторые группы атомов. Они не изменяют саму генетическую информацию, но оказывают влияние на её судьбу [1]. Развитие эпигенетики как отдельного направления биологии началось в сороковых годах прошлого столетия. Тогда английский генетик Конрад Уод- дингтон сформулировал концепцию «эпигенетического ландшафта», объясня- ющую процесс формирования организма (рис. 1) [2]. Шарик вверху обозначает первоначальные неспециализированные клетки зародыша. Под воздействием генетических и эпигенетических сигналов клетке будет задана траектория онтогенеза, и она станет специализированной — клет- кой сердца, печени и т.д.  Рисунок 1 – «Эпигенетический ландшафт» Эта новая дисциплина утверждает, что генотип – изменяющаяся в тече- ние всей жизни структура. Люди сами могут «включать» и «выключать» те или иные гены. Например, правильно питаясь, тем самым, избегая генетически обу- словленные болезни. Более того, помогая избежать их своим детям и внукам. Казалось бы, на что могут влиять биодобавки? На этот вопрос постара- лись ответить учёные Рэнди Джиртл и Роберт Уотерлэнд из Университета Дьюка в Северной Каролине. Опыты проводились на мышах, носителей гена агути, склонных к ожирению. Добавляя в пищу самкам-агути за две недели до спаривания и во время беременности витамин B12, фолиевую кислоту, метио- нин и холин, исследователи обнаружили, что на свет появлялись мышата с нормальным бурым цветом шерсти, вместо характерного жёлтого, а также на протяжении всей жизни они имели нормальный вес и здоровье [3]. Объяснить это можно только тем, что изменение материнского рациона выключило де- фектный ген, несмотря на то, что ни одна буква в «наследственной инструк- ции» не была переписана. Интересным примером является опыт Натальи Красовой из харьковского Института проблем эндокринной патологии. Она подвергала крыс социальному стрессу. Для этого их каждые три дня переносили в новые клетки. Не успеет животное, искусанное сородичами, прийти в себя, как его снова переселяют. Эксперименты, конечно, жестокие, но результаты того стоили. Оказалось, что потомки переживших стрессы самок намного больше предрасположены к диа- бету, чем самок из контрольной группы. И эта склонность сохранялась в не- скольких последующих поколениях [4]. Ранее считалось, что у организма под влиянием определенного воздей- ствия (теплового шока, голодания и т.д.) происходит образование эпигенетиче- ских маркеров, которые бесследно стираются при оплодотворении и образова- нии зародыша и не передаются потомкам. Оказалось, что это не так. В большом количестве работ последних лет эпигенетические изменения, индуцированные средовыми стрессами у представителей одного поколения, обнаруживались у представителей 3-4 последующих поколений. Это свидетельствует о возможно- сти наследования приобретенных признаков, что до последнего времени каза- лось абсолютно невозможным. 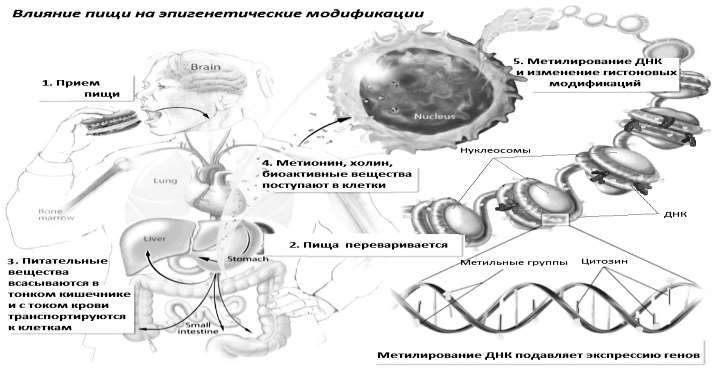 Каковы же механизмы эпигенетического регулирования? Один из них – это отсутствие доступа к фрагментам ДНК для ферментов, копирующих генетиче- скую информацию. Из-за отсутствия химической модификации хвостов гистонов, на которые намотаны цепи ДНК, не происходит ослабления связи между гистона- ми и самой ДНК, поэтому считывание информации становится невозможным. Но лучше изучен процесс метилирования ДНК (рис. 2). Это процесс, когда с одной из четырех «букв» генного алфавита, с цитозином, взаимодействует метильная груп- па, состоящая из углерода (С) и трех атомов водорода (Н). Этот маркер блокирует считывание информации, заставляя ген «молчать»[5, 9]. Каковы же механизмы эпигенетического регулирования? Один из них – это отсутствие доступа к фрагментам ДНК для ферментов, копирующих генетиче- скую информацию. Из-за отсутствия химической модификации хвостов гистонов, на которые намотаны цепи ДНК, не происходит ослабления связи между гистона- ми и самой ДНК, поэтому считывание информации становится невозможным. Но лучше изучен процесс метилирования ДНК (рис. 2). Это процесс, когда с одной из четырех «букв» генного алфавита, с цитозином, взаимодействует метильная груп- па, состоящая из углерода (С) и трех атомов водорода (Н). Этот маркер блокирует считывание информации, заставляя ген «молчать»[5, 9].Рисунок 2 – Метилирование ДНК Одним из первых, кто начал связывать эпигенетические маркеры с болез- нями, был Доктор Сциф, профессор фармакологии из Монреаля. На примере многочисленных исследований, он доказал, что развивается рак, если в клетке метилируется, тем самым выключается, ген, отвечающий за деление клеток. Сциф заблокировал фермент, отвечающий за метилирование, и опухоль пере- стала расти [6]. Возможен и обратное: метильные группы удаляются, ген акти- вируется. Прионизация белков (Прионные белки обладают аномальной трёхмерной структурой и способны катализировать структурное превращение гомологич- ных им нормальных белков в себе подобный (прионный) белок, присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои. Прионы — един- ственные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот, а также они осуществляют единственный известный путь передачи информации от белка к белку. Инактивация Х-хромосомы - процесс, в ходе которого инактивируется одна из двух копий Х-хромосом, представленных в клетках самок млекопита- ющих (рис. 3). ДНК неактивной Х-хромосомы упаковывается в транскрипци- онно неактивный гетерохроматин. Инактивация Х-хромосомы происходит в клетках самок млекопитающих для того, чтобы с двух копий Х-хромосом не образовывалось вдвое больше продуктов соответствующих генов, чем у самцов млекопитающих. Такой процесс называется дозовой компенсацией генов. У плацентарных выбор Х-хромосомы, которая будет инактивирована, случаен. Инактивированная Х-хромосома будет оставаться неактивной во всех последу- ющих дочерних клетках, образующихся в результате деления. Одной из специализаций эпигенетики является нутригеномика. Это новое направление, которое изучает влияние пищи на экспрессию генов [7]. На сегодняшний день большинство исследований влияния питания на эпигенетическую регуляцию генов сфокусированы на ДНК-метилировании. 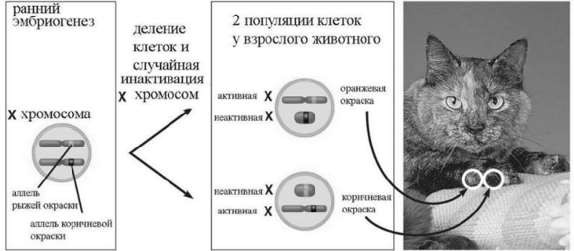 Рисунок 3 – Инактивация Х-хромосомы Однако, для нутриентов свойственен еще один, посредством которого пища изменяет экспрессию генов. Его иллюстрирует схема: «компонент пищи → рецептор → сигнальный путь → транскрипционный фактор → включение генов». Рецепторы распознают строго определенную структуру веществ, по- этому схожие по строению компоненты пищи различно воздействуют на орга- низм (например, насыщенные и ненасыщенные жиры)[8]. Первые 1000 дней жизни, которые охватывают время беременности и первые два года жизни ребенка, являются наиболее уязвимыми. Адекватное пи- тание в этот период, как оказалось, играет наиважнейшую роль, больше чем за всю последующую жизнь. Данные, полученные на моделях животных, позволили предположить, что недостаточность питания женщины во время беременности приводит к за- держке развития плода, а также к изменению экспрессии биохимических меха- низмов, связанных с эндокринологическим и метаболическим контролем [10]. Действительно, было показано, что потомство от матерей, получавших на про- тяжении всей беременности диету, дефицитную по белку, имеет измененный метаболический фенотип с наличием признаков, характерных для кардио- метаболических заболеваний человека, включающих гипертензию, увеличение отложения жира, повреждение гомеостаза глюкозы, дислипидемию и сосуди- стую дисфункцию [11]. Подводя итог, можно с уверенностью сказать, что эпигенетические меха- низмы формирование патологического фенотипа несомненны. Представляется перспективным применение знаний в этой области в практическом здравоохра- нении: в акушерстве для составления полноценной диеты беременных, в онко- логии, гериатрии и других областях здравоохранения. Список литературыStover P.J., Caudill M.A. Genetic and epigenetic contributions to human nutrition and health: Managing genome-diet interactions // J. Am. Diet. As- soc. - 2008. - Vol. 108. - P. 1480-1487. Waddington C.H. Canalization of development and the inheritance of ac- quired characters.// Nature.-1945 - №150 - С.563-565; Waterland R.A. and Jirtle R.L. Transposable elements: targets for early nu- tritional effects on epigenetic gene regulation. Mol. Cell. Biol. – 2003. – №23. С.5293–5300. Председатель Технологической платформы «Медицина будущего». Стратегическая программа исследований технологической платформы « Медицина будущего» // Бесплатная библиотека Научно- практических Конференций [Электронный ресурс]. – Режим доступа: http://libed.ru/knigi-nauka/818944-1-utverzhdayu-predsedatel- tehnologicheskoy-platformi-medicina-buduschego-2014-strategicheskaya- programma-issledovaniy.php. - (дата обращения 06.05.2019). Ванюшин Б.Ф. Эпигенетика сегодня и завтра//Вавиловский журнал ге- нетики и селекции - 2013 - №17. - С.805–832. Этан Уоттерс. Эпигенетика / /Научный журнал Geo. – 2007. - №07 - С.128-142. Mead M.N. Nutrigenomics: The genome food-interface // Environ. 23. Health Perspect. 2007. - Vol.115. - Р. 582-589. Michael Müller, Sander Kersten. Opinion: Nutrigenomics: goals and strate- gies. Nat Rev Genet. 2003. - №4. - Р.315-322. Sharma A.M., Staels B. Peroxisome proliferator-activated receptor 34. gamma and adipose tissue - understanding obesity-related changes Waterland R.A., Michels K.B. Epigenetic epidemiology of the developmen- tal origins hypothesis // Annu. Rev. Nutr. 2007. - Vol. 27. -Р. 363-388. Cutfield W.S., Hofman P.L., Mitchell M., Morison I.M. Could epigenetics play a role in the developmental origins of health and 33. disease? // Pedi- atr. Res. 2007. Vol. 61. С. 68-75. УДК 67.034:612.014.4 |
