Пат физиология. Учебные пособия для студентов высших учебных заведений
 Скачать 7.09 Mb. Скачать 7.09 Mb.
|
|
8.4. СТАЗ Стаз (от греч. stasis — стояние, неподвижность) — прекращение, тока крови (гемостаз) или лимфы (лимфостаз) в сосудах микроциркуляторного русла. Причинами стаза могут быть:
Истинный стаз возникает под воздействием химических (неорганические и органические яды), физических (холод, тепло, высыхание) и биологических (токсины микробиального, паразитарного происхождения) факторов. Под влиянием патогенов клетки сосудов и окружающих тканей выделяют биологически активные вещества (гистамин, серотонин, брадикинин), расширяющие стенки сосудов, повышающие их проницаемость, что ведет к усиленному выходу жидкости, электролитов, низкомолекулярных белков в ткани. Возрастает концентрация высокомолекулярных белков — глобулинов, фибриногена в плазме крови, повышается вязкость, замедляется кровоток. Адсорбция высокомолекулярных белков на поверхности эритроцитов способствует началу их агрегации и агглютинации. Эти процессы потенциируются биологически активными веществами, такими, как агглютинины, катехо-ламины, простагландины F и Е, тромбоксан А2- Эритроциты в просвете капилляров останавливаются, образуя «монетные столбики». Агрегация эритроцитов является важным фактором, изменяющим реологические свойства крови. Сопротивление току крови в капиллярах возрастает. Поступающие из поврежденных эндотели-оцитов и клеток ткани катионы — ионы калия, кальция, магния, натрия и др. адсорбируются на мембране эритроцитов, нейтрализуют отрицательный заряд или меняют его на положительный. В результате агрегаты эритроцитов адгезируются на интиме сосудов, движение тока крови замедляется, а затем останавливается. Эритроциты деформируются, границы между ними исчезают, развивается капиллярный стаз. Стаз ишемического происхождения развивается как следствие замедления и прекращения притока артериальной крови. Замедленный приток, возникновение турбулентности в движении крови по артериолам и капиллярам вторичны; вслед за первичной закупоркой, сдавливанием, спазмом артерий ведет к агрегации, агглютинации и адгезии эритроцитов к эндотелиальной стенке сосудов — стазу. Венозный стаз представляет собой заключительный этап венозной гиперемии, явившейся результатом тромбоза или сдавливания венозных сосудов. Отток крови при венозной гиперемии замедлен. Она сгущается, меняются ее физико-химические и реологические свойства. Выделяемые поврежденными клетками (гипоксия, ацидоз) биологически активные вещества определяют агрегацию, агглютинацию эритроцитов и адгезию к сосудистой стенке. Признаки стаза легко обнаруживаются при микроскопии. В сосудах микроциркуляторного русла хорошо видны неподвижные агрегаты эритроцитов, других клеточных элементов крови, признаки микрокровотечений, а при гемолизе эритроцитов — окрашивание межклеточной жидкости. Внешне признаки «вторичного» стаза затушеваны проявлениями ишемии или венозной гиперемии. Последствия стаза зависят от ряда обстоятельств. При быстром устранении причин агрегированные эритроциты возвращаются в общее русло крови с сохранением своих специализированных функций. Агглютинизированные, адгезированные эритроциты не покидают микроциркуляторное русло. Продолжительный стаз становится причиной дистрофических изменений окружающих клеток. Слияние участков микронекроза как самого тяжелого исхода стаза может привести к инфаркту. 8.5. ИНФАРКТ Участок ткани, подверженный некрозу в результате прекращения кровоснабжения, адекватного потребностям, носит название инфаркта (от лат. infarcire — начинять). Причины инфарктов — образование в просвете сосуда тромба или закупорка его эмболами, длительный спазм артерий, эндоартерииты, застойная гиперемия. Инфаркты поражают чаще всего паренхиматозные органы, наиболее чувствительные к гипоксии, кровоснабжение которых обеспечивается концевыми артериями. Закрытие просвета такой артерии приводит к омертвению конусообразного участка, обращенного основанием к поверхности органа. Поэтому на разрезе омертвевшая ткань имеет форму клина. Различают инфаркты белые (анемические, ишемические) и красные (геморрагические). Белый инфаркт развивается в органах, где коллатерали очень слабо развиты, кровь в ишемизированный участок не поступает. Этому способствует рефлекторный спазм окружающих артерий, препятствующий поступлению туда эритроцитов, сосуды заполнены лишь плазмой. Белые инфаркты чаще обнаруживают у животных в почках, сердце (рис. 7). Встречаются ишемические инфаркты с геморрагическим поясом (венчиком), возникающие в результате быстрой смены рефлекторного спазма коллатералей, окружающих некротизированный участок, на паралитическую вазодилатацию и переполнение их кровью. Красный инфаркт назван так потому, что в некротизированную ткань поступают эритроциты из окружающих сосудов. Клетки крови через стенки разрушенных капилляров ингибируют, пропитывают некротизированные участки тканей, окрашивая их в темно-красный цвет, они хорошо отграничены. Геморрагические инфаркты бывают обычно в легких, кишечнике. Застойного происхождения они могут быть в результате быстрого сдавливания или тромбоза венозных сосудов. У сельскохозяйственных животных их наблюдают при перекручиваниях матки, завороте кишок, часто регистрируемом у свиней, инвагинациях, ущемлениях в грыжевом мешке. 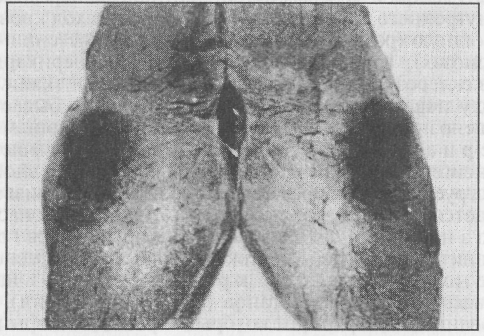 Рис. 7. Инфаркт миокарда у лошади, болевшей инфекционной анемией (Добин, 1968) Исход инфаркта зависит от его величины локализации, а также от состояния животного. Существует такое понятие, как микроинфаркт. Он возникает при закупорке тромбами, эмболами мелких артерий или их длительном спазме. Участки микронекрозов могут сливаться, формировать макроинфаркт, различимый невооруженным глазом. У животных, в частности у лошадей, инфаркты сердца, кишечника заканчиваются летально. При выздоровлении животных вокруг некротической массы развивается воспалительный процесс с последующим замещением мертвой ткани соединительнотканным рубцом. Инфаркты мозга могут осложняться парезами, параличами, заканчиваться летальным исходом. При благоприятном исходе на их месте образуются кисты. Обсеменение некротизированных участков микрофлорой завершается гнойным расплавлением. Инфаркты почек, довольно часто обнаруживаемые у старых животных, не представляют особой опасности для жизни. Они трансформируются в плотную рубцовую ткань, соединенную с капсулой. 8.6. КРОВОТЕЧЕНИЕ Под кровотечением (haemorrhagia, от греч. haema — кровь, rrhagia — течь) понимают выход крови из сосудов или сердца. Покидая кровеносную систему, кровь может изливаться во внешнюю среду, что носит название наружного, или в органы и полости тела — внутреннего кровотечения. Выход крови во внешнюю среду возникает у животных при ранениях кожных покровов и подлежащих тканей, травмах матки и родовых путей при патологических родах, с рвотными или фекальными массами, из легких и мочевых путей, при ушибах, переломах костей. Для внутреннего кровотечения характерен выход крови в полости — брюшную (разрыв ткани при гепатозе, селезенки — при гемоспоридиозах), грудную (венозный застой), перикардиальную (разрыв в склерозированной стенке дуги аорты) и ткани. По виду поврежденных сосудов кровотечение бывает артериальным, венозным, паренхиматозным или капиллярным. Артериальное кровотечение проявляется алым цветом оксигенированной крови, она изливается сильной пульсирующей струей в такт сокращениям сердца, самопроизвольно останавливается с трудом, что может быть смертельно опасным. Венозное кровотечение проявляется равномерным, сравнительно медленным током крови темно-красного цвета. Паренхиматозное кровотечение наблюдают при разрывах внутренних органов (селезенки, печени), мышц, с травмированной поверхности которых через капилляры медленно изливается кровь темно-красного цвета. Оно опасно трудностью прижизненной диагностики и тотальной кровопотерей. Выход крови за пределы сосудов может быть результатом:
Кровотечение может быть первичным, возникающим вслед за ранением, и вторичным, развивающимся спустя несколько часов или суток после остановки первичного. Вторичное кровотечение возможно вследствие инфицирования раны, гнойного расплавления тромба, снятия животным кровоостанавливающей повязки, других причин. Под кровоизлиянием как одной из форм кровотечений понимают выход крови за пределы сосуда и скопление ее в тканях. По величине кровоизлияния подразделяют на:
Кровоизлияния следует отличать от эритемы — разлитого или ограниченного покраснения кожи, слизистых оболочек за счет артериальной гиперемии. Например, при роже свиней красные пятна на коже формируются путем расширения артериальных сосудов (эритемы), а при чуме ограниченные пятна на коже свиней обусловлены кровоизлияниями (петехии). Последствия кровотечений различны. Они зависят от количества потерянной крови, локализации, продолжительности, вида животного, других обстоятельств. Острая потеря крови в количестве 50—60 % общей массы сопровождается уменьшением ударного и минутного выбросов, артериальной гипотензией, гипоксемией, гипоксией, снижением температуры тела. Чем быстрее организм теряет кровь, тем тяжелее последствия. Ранения крупных сосудов, разрыв аневризмы аорты, селезенки, печени, маточные кровотечения при патологических родах приводят к быстрой, не компенсируемой потере большого количества крови, несовместимой с жизнью. Потеря до 30 % объема циркулирующей крови компенсируется срочными рефлекторными реакциями— тахикардией, одышкой, мобилизацией депонированной крови, межклеточной жидкости, стимуляцией эритро-, тромбо-, лейкопоэза гемопоэтинами. Повторное кровотечение переносится легче. Длительная экстравазация крови, например, при язвенной болезни желудка и двенадцатиперстной кишки у свиней, норок приводит к хронической анемии. Кровоизлияния не представляют опасности с точки зрения потери крови. Их главная опасность в локализации. Наиболее тяжелым, а часто и смертельным является кровоизлияние в мозг (солнечный удар у неадаптированных к аридным условиям лошадей). Излившаяся кровь подвергает сдавливанию окружающие ткани, затрудняет их кровоснабжение, приводит к гипоксии, некрозу. Излившаяся кровь свертывается, эритроциты разрушаются, гемоглобин трансформируется в кровяной пигмент — гемосидерин; плазма рассасывается. Масса фибрина при гематомах может прорастать соединительной тканью, организовываться, подвергаясь в дальнейшем петрификации. Тромбическая масса может подвергаться инфицированию и превращаться в очаг гнойного воспаления — абсцесс. Не все животные в равной степени чувствительны к кровопоте-рям. Чувствительность определяется видом животных, возрастом, индивидуальными особенностями. Наиболее тяжело переносят кровопотери свиньи, собаки; сравнительно легче — лошади и крупный рогатый скот. Молодые и старые животные чувствительнее к кровопотерям, чем взрослые. Ожирение животных снижает компенсаторные возможности организма при кровотечениях. 8.7. НАРУШЕНИЯ МИКРОЦИРКУЛЯЦИИ Микроциркуляция (от греч. mikros — мельчайший, лат. circulatio — дуговое движение) представляет собой перемещение крови и лимфы по артериолам, прекапиллярам, капиллярам, посткапиллярам, венулам, артерио-венозным анастомозам (шунтам) и лимфатическим капиллярам. Кровеносная система замкнутая. Лимфатические капилляры представляют собой слепые коллекторы, по которым лимфа поступает в лимфатическую сеть и направляется в венозную систему через грудной (ductus thoracicus) и другие протоки. В понятие микроциркуляции включают, таким образом, перемещение жидкости между кровеносными и лимфатическими капиллярными сетями, по внутриклеточным системам, трансмембранный обмен газами, субстратами и продуктами метаболизма, сигнальными молекулами. Расстройства микроциркуляции вызываются многочисленными факторами, к которым можно отнести расстройство кровообращения сердечного и сосудистого происхождения (гипотензию, гипертензию, артериальную и венозную гиперемию, ишемию), нарушение целостности стенок сосудов микроциркуляторного русла и реологических свойств крови. К типичным нарушениям микроциркуляции относят внутрисо-судистые расстройства, патологические изменения проницаемости сосудов, внесосудистые расстройства. Внутрисосудистые, или интраваскулярные, расстройства микроциркуляции обусловлены замедлением или прекращением тока крови или лимфы. Суспензионная стабильность клеток крови, обусловленная отрицательным зарядом эритроцитов и тромбоцитов, нарушается в результате выхода альбуминов за пределы сосудов. Абсолютное или относительное увеличение содержания в плазме крови микромолекул фибриногена и глобулинов, заряженных положительно, их адсорбция на поверхности клеток крови приводят к дестабилизации суспензии, агрегации эритроцитов, тромбоцитов, лейкоцитов. Сужение сосудов, увеличение вязкости, расстройство гемо- и лимфодинамики, затрудняя перфузию крови через микрососуды, способствует внутрисосудистой агрегации клеток. Развивается так называемый «сладж-феномен» (от англ, sluge — густая грязь, тина). Внутрисосудистое формирование агрегатов из эритроцитов, тромбоцитов, лейкоцитов наблюдают при многих инфекционных заболеваниях, при отморожениях и ожогах, шоке разного происхождения, острой сосудистой недостаточности (коллапсе), отравлениях, заболеваниях, сопровождающихся альбуминурией, в послеоперационном периоде. Сладжирование крови складывается последовательно и начинается с агрегации тромбоцитов с хиломикронами (частицы липидов), а в последующем — с эритроцитами. Агрегация сопровождается адгезией (слипанием) клеток между собой и с клетками эндотелия сосудов, агглютинацией (склеиванием) клеток крови и цитолизом. Различают следующие виды сладжа:
Агрегация эритроцитов ведет к сужению просвета сосудов, полной или частичной обтурации (закупорке) капилляров, замедлению тока крови, турбулентному характеру кровотока. Закупорка эритроцитарными агрегатами микрососудов приводит к тому, что они становятся только плазменными. Освобождающиеся поврежденными клетками гистамин, серотонин, брадикинин повышают проницаемость гистогематических барьеров; гипоксия и ацидоз повреждают сосудистые стенки, создаются условия для возникновения множественных микротромбов. Тяжесть микроциркуляторных расстройств возрастает. Наступает синдром капиллярно-трофической недостаточности, характеризующейся расстройствами метаболизма, трофической обеспеченности функциональной активности клеток, органов, тканей, генерализованной реакцией организма. Своевременное устранение причин сладжа, блокада механизмов его формирования способствуют дезагрегации клеток, восстановлению кровотока и нормализации обменных процессов. Расстройства проницаемости сосудов микроциркуляторного русла, или трансмуральные (от лат. trans — через, англ, mural — стенка), характеризуются нарушениями транспорта веществ и перемещения форменных элементов. В условиях патологии изменяется структура сосудистой стенки. Проницаемость ее для плазмы и крупномолекулярных веществ может быть уменьшенной или увеличенной. Чаще всего изменения структуры сопровождаются повышением проницаемости гистогематических барьеров и увеличением объема жидкости, поступающей в межклеточные пространства. Повышение проницаемости возникает по причинам:
Возрастание проницаемости сосудов микроциркуляторного русла приводит к усилению пассивного транспорта жидкости посредством осмоса, ультрафильтрации, диффузии и активного переноса путем микровезикуляции. При некоторых заболеваниях инфекционной и неинфекционной природы увеличивается трансмуральный перенос форменных элементов крови: эритроцитов, тромбоцитов, лейкоцитов. Основной причиной является повышенная проницаемость сосудов. Выход эритроцитов — диапедез, как полагают, является результатом их пассивного выдавливания из сосудов сквозь межэндотелиальные щели под влиянием повышенного гидродинамического давления. Такие патологические процессы, как воспаление, токсикозы, аллергические реакции, ионизирующие излучения, сопровождаются существенным ростом проницаемости и повышенным выходом за пределы сосудов лейкоцитов, тромбоцитов, эритроцитов. Более грубые повреждения целостности стенок сосудов микроциркуляторного русла завершаются микрокровоизлияниями. Одной из причин диапедеза эритроцитов и микрогеморрагий является тромбоцитопения. Она сопровождается дистрофическими процессами в клетках эндотелия, их гибелью и, как следствие, резким повышением проницаемости. Внесосудистые, экстраваскулярные (от лат. exter — внешний, vas — сосуд) расстройства микроциркуляции выражаются в том, что при повышенной транссудации отток межтканевой жидкости в венозное и лимфатическое русло затруднен. Затруднение оттока при усиленной транссудации приводит к скоплению жидкости в тканях, образованию отека. Повышенный выход жидкости в межтканевое пространства обусловлен усилением гидродинамического давления на стенки артериальной составляющей микроциркуляторного русла, понижением онкотического давления крови (голодание, альбуминурия, потеря белков при ожогах, раневом истощении, ингибиции белковообразовательной функции печени и др.), возрастанием коллоидно-осмотического давления в тканях за счет распада крупных белковых молекул на более мелкие, накопления ионов натрия. Затруднение обратного всасывания жидкости может быть вызвано повышением гидродинамического давления в посткапиллярах и венулах (венозная гиперемия), повышением тканевого коллоидно-осмотического давления, сужением межклеточных щелей. В тех случаях, когда лимфатические узлы не способны обеспечить дренаж интерстиция, говорят о недостаточности лимфатической системы. Рассматривают следующие ее формы:
Затруднение оттока жидкости, ее скопление в интерстиции сопровождаются возрастанием содержания в тканях продуктов нарушенного обмена, биологически активных веществ, ионов, что усугубляет тяжесть патологического процесса. 8.8. ТРОМБОЗ Тромбоз (от греч. thrombosis — свертывание) — прижизненное свертывание крови в просвете сосудов. Образующийся из составных частей крови сгусток называется тромбом. В отличие от посмертных пристеночные тромбы всегда прикреплены к стенке сосуда. Тромбообразование обусловлено в основном тремя факторами: повреждением стенки сосудов, замедлением и нарушением кровотока и изменением свертывающей и фибринолитической систем крови. Повреждение стенки сосудов — одна из наиболее частых причин образования тромбов. Поражение стенок может быть результатом механического повреждения, спазма артериол и артерий, воспаления разного происхождения (эндоартериит, флебит), действия химических веществ, на почве инфекции, сенсибилизации, атеросклеротических изменений как результат нарушения обменных процессов. У животных наряду с перечисленными причинами повреждения сосудистых стенок следует особо отметить роль личиночных, а в некоторых случаях и половозрелых форм паразитирующих организмов. Так, мигрирующие личинки фасциол у жвачных животных способны повреждать сосуды не только печени, но и легких; личинки делафондий травмируют стенки брыжеечных артерий лошадей, стимулируя образование крупных тромботичес-ких наслоений и формирование аневризм; личинки диктиокаулю-сов, перемещаясь из кишечника в легкие, травмируют кровеносные и лимфатические сосуды у телят, ягнят. Повреждения сосудистой стенки, особенно ее внутренней стороны, эндотелия служат началом образования тромба. К структурным компонентам поврежденной базальной мембраны — эластину, коллагену прилипают (адгезия) тромбоциты за счет активации плазматической мембраны и появления псевдоподий. Активированный тромбоцит освобождает АДФ, что способствует накоплению кровяных пластинок в очаге деэндотелизации, активации ферментов гликозилтрансферазы, фосфолипазы С, А и др. В результате последующих каскадных реакций в тромбоцитах синтезируются простагландины (ПГД2, ПГА2), тромбоксан А2. Последний обладает свойствами поддерживать спазм поврежденного сосуда и агрегировать тромбоциты. Адгезией, агрегацией и агглютинацией тромбоцитов завершается клеточная фаза тромбообразования. Агглютинированные тромбоциты в результате аутолитических процессов дезинтегрируются и выделяют тромбоцитарные факторы свертывания, определяющие развитие последующей фазы образования тромба — коагуляции крови. Протеолитический фермент тромбопластин (тромбокиназа), выделяемый тромбоцитами, — внутренний и внешний (плазменно-тканевый), переводит неактивный протромбин в тромбин — высокоспецифичный Протеолитический фермент. В свою очередь, тромбин превращает крупнодисперсный белок крови фибриноген (молекулярная масса 340 000 Да) в нити фибрина (молекулярная масса 5 000 000 Да). В состав образующегося конгломерата входят фибрин, тромбоциты, лейкоциты и эритроциты. Свежеобразованный коагуляционный тромб сжимается под влиянием тромбостенина, выделяемого тромбоцитами. Реакция сочетается с уплотнением массы тромба, выдавливанием из нее жидкости. Сжатие тромба обеспечивается нонами кальция, аденозинтрифосфорной кислотой, наличием глюкозы, другими факторами. Процесс ретракции тромба может быть ингибирован недостаточным количе-ством кальция, воздействием на тромбоциты многих химических и физических факторов. Тромбообразование в венах имеет свою специфику — оно обязано в большей степени активации плазменного звена гемостаза. В артериях же ввиду быстрого тока крови превалирует активация тромбоцитарного звена. Замедление и нарушение тока крови способствуют адгезии, агрегации и агглютинации тромбоцитов у стенок поврежденных сосудов. Этим можно объяснить тот факт, что в венах примерно в 5 раз чаще образуются тромбы, чем в артериях. Ослабление сердечной деятельности, сердечно-сосудистая недостаточность сопровождаются появлением так называемых «застойных» тромбов. Вместе с тем опыты показали, что само по себе замедление тока крови не может рассматриваться как основная причина тромбообразования. Даже двусторонняя перевязка сосуда не сопровождается образованием тромба в изолированном сегменте. Оно возможно лишь при условии травмирования сосуда. Не только замедление, но и характер движения крови имеет большое значение в патогенезе тромбообразования. Шероховатость интимы склерозированных сосудов, аневризмы, варикозные расширения вен изменяют ток крови, возникающие завихрения способствуют разрушению тромбоцитов, освобождению внутреннего тромбоцитарного фактора — тромбопластина. Создаются благоприятные условия для оседания и адгезии кровяных пластинок. В венечных артериях, подверженных склерозу, образование тромба и последующего инфаркта более вероятно, чем в коронарных сосудах с гладкой интимой. Однако само по себе изменение динамики тока крови не рассматривается в качестве ведущей причины образования тромба. Оно может значительно ускорить процесс его формирования. Особое значение в тромбообразовании имеет изменение свертывающей и фибринолнтической систем крови. Стабильное жидкое состояние крови обеспечивается динамическим равновесием двух систем: свертывающей и противосвертывающей. Повышение концентрации в крови компонентов свертывающей системы — прокоагулянтов (тромбопластин, тромбин) может привести к внутрисосудистому свертыванию крови и формированию тромбов. Такая возможность доказана внутривенным введением тромбина подопытным животным, Которые погибали от внутрисосудистого свертывания крови. Прижизненное свертывание крови в сосудах возможно и за счет снижения активности антикоагулянтов (гепарин и др.) и повышенной функции их ингибиторов. Расстройства регуляторных взаимоотношений между двумя системами, нарушение соотношения между свертываемостью крови и фибринолизом лежат в основе внутрисосудистого свертывания крови и тромбообразования. Образование тромбов тесно связано и с рядом обстоятельств. Этому процессу способствуют повышенное содержание в плазме липидов, липопротеидов, фибриногена, тромбоцитов, сгущение крови, чрезмерное умственное и физическое переутомление, хирургические операции, кровопотеря, боль, возбуждение, введение некоторых лекарственных препаратов. Классификация тромбов. По расположению в сосуде различают тромбы:
По механизму образования и строению выделяют тромбы:
Исход тромбоза может быть благоприятным и неблагоприятным. К благоприятному исходу следует отнести рассасывание тромба фибринолитическими ферментами крови и лейкоцитов, организацию тромба — прорастание его соединительной тканью, в которой могут образовываться щели, выстланные эндотелием. Через эти щели частично восстанавливается кровоток. В таких случаях говорят о васкуляризации тромба. При длительном пребывании тромба в сосуде возможна петрификация, т. е. отложение солей, обызвествление массы тромба. Такие образования, находящиеся в венах, носят название флеболитов, в артериях — артериолитов. К неблагоприятному исходу относят септический распад тромбов за счет ферментов гнилостных бактерий. Инфицированные частицы легко отрываются и переносятся током крови в разные органы. Тромбобактериальная эмболия завершается сепсисом. Неблагоприятными последствиями для организма оборачивается отрыв всего тромба или его частей, их превращение в эмболы. Значение тромбоза. В общебиологическом плане тромбоз следует считать эволюционно выработанной защитной реакцией организма, направленной на предотвращение кровопотерь при ранениях, повреждениях сосудов. В патологии в некоторых случаях тромбоз можно рассматривать как приспособительную реакцию, например при заполнении полости аневризмы тромбом уменьшается опасность разрыва стенки сосуда. Тромбоз сосудов тканей, окружающих очаг воспаления, предупреждает поступление в кровь некротоксинов, бактериальных экзо- и эндотоксинов. В большинстве же патологических ситуаций тромбообразование негативно отражается на функциональной активности пораженного органа или угрожает жизнедеятельности всего организма. Так, тромбоз брыжеечных артерий, вызванный личинками делафондий у однокопытных животных, приводит к ишемии кишечника, некрозу его стенок, летальному исходу. Тромбоз венечных артерий сопровождается микро- или макроинфарктами. Тромбоз мозговых сосудов может вызвать в зависимости от локализации и обширности очага поражения такие осложнения, как парезы, параличи, остановка дыхания и прекращение деятельности сердца. 8.9. ЭМБОЛИЯ Эмболия (от греч. embole — вклинивание, вталкивание) — это закупорка сосудов частицами, принесенными током крови или лимфы. Сами частицы (тело) называют эмболами. Они могут попадать в сосуды из внешней среды и формироваться в самом организме. Поэтому различают эмболы эндогенного и экзогенного происхождения. По месту локализации выделяют эмболии большого, малого кругов кровообращения и эмболию воротной вены. Эмболия приводит к возникновению ишемии и некрозу тканей. Эмболии экзогенного происхождения. Воздушная эмболия вызывается попаданием атмосферного воздуха в кровеносные сосуды. Чаще она возникает при ранениях крупных вен, особенно яремной. В венах давление низкое или отрицательное, стенки вен слабо спадаются, возникают условия для засасывания воздуха. Воздушные пузырьки по току крови попадают в правое предсердие, правый желудочек и вызывают эмболию легочных артерий. Причиной может быть случайное попадание воздуха в сосуды при неосторожном внутривенном введении животным лекарственных препаратов. Газовая эмболия развивается в результате закупорки сосудов пузырьками газов. Повышение атмосферного давления создает условия для растворения газов (азот, кислород, углекислота) в биологических жидкостях. Быстрое перемещение организма из среды с повышенным давлением в среду с нормальным ведет к понижению растворимости, десатуризации и образованию в крови пузырьков газа. Пузырьки газа, преимущественно азота, вызывают закупорку капилляров головного и спинного мозга, почек, сердца и других органов. Газовая эмболия возникает и при быстром переводе организма из среды с нормальным атмосферным давлением в среду с пониженным атмосферным давлением. Закупорка сосудов пузырьками газа возможна также при гангрене, вызванной анаэробами (газовая гангрена). Бактериальная эмболия наблюдается при попадании в кровяное русло конгломератов микроорганизмов. Источником бактериальных конгломератов может быть одна из разновидностей гнойного воспаления — эмпиема, абсцесс, флегмона. Паразитарная эмболия возникает при попадании в кровь личиночных форм гельминтов, которые мигрируют по кровеносной системе, например, из кишечника в легкие (аскариды, диктиокаулы). Эмболия паразитарного происхождения возможна и в результате попадания в ток крови возбудителей микозов (актиномикоз и др.). Эмболия инородными телами, попадающими в ток крови при ранениях сосудов большого и малого кругов кровообращения. К такого рода телам относятся осколки мин, снарядов, пули, другие предметы. Масса таких инородных тел высока, поэтому они могут перемещаться ретроградно, против тока крови. Эмболии эндогенного происхождения. По материалу, из которого состоят эмболы, их подразделяют на несколько видов. Тромбоэмболия вызывается кусочками оторвавшегося тромба. Это довольно частая форма эмболии, особенно у непарнокопытных животных, возникающая при заболевании делафондиозом. Личинки этого паразита мигрируют из кишечника, достигают брыжеечных артерий, травмируют стенку сосуда и поселяются в образовавшемся тромбе. Рыхлые массы тромба отрываются и превращаются в эмболы, закупоривающие мелкие ветви брыжеечных артерий. Тромбы как источник эмболов могут образовываться в различных участках кровеносного русла (вены, сердце, артерии). Жировая эмболия следует за поступлением в русло крови капелек жира при операциях на тканях с обилием жировой клетчатки, при переломах трубчатых костей, после механического размозжения жировой ткани. В силу отрицательного давления в венах капельки жира через травмированные участки сосуда поступают в ток крови и останавливаются в сосудах меньшего диаметра (рис. 8). 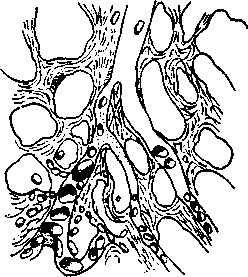 Рис. 8. Жировая эмболия капилляров легких (по Подвысоцкому) Жировую эмболию легко наблюдать под микроскопом в капиллярной сети лапки или брыжейки наркотизированной лягушки после введения в полость ее сердца растительного или вазелинового масла. Тканевая эмболия возникает при попадании в ток крови тканевых элементов из очагов некроза, язвенного распада. Возможна эмболия, вызванная оторвавшимися клетками злокачественной опухоли. Клетки раковой опухоли перемещаются преимущественно по лимфатическим путям, саркоматозные клетки — по кровеносным. Значение такого эмбола не только в нарушении крово- и лимфотока, но и в образовании нового очага опухолевого роста (метастаз опухоли). Инородные частицы способны вызвать эмболию малого, большого кругов кровообращения, сосудов системы воротной вены. Эмболия малого круга кровообращения. Эмболы закрывают просвет легочных артерий. В легочные артерии инородные частицы поступают из венозных сосудов большого круга кровообращения и правой половины сердца. Последствия зависят о.т состава, размеров эмболов, их общей массы. Особенно опасна множественная эмболия мелких легочных артерий. Нарушается кровоток. Повышается давление крови в сосудах малого круга кровообращения, поступление крови в левое предсердие и желудочек ограничено, уменьшается ударный и минутный объемы сердца, резко снижается артериальное давление. Гипотензия — характерный признак массивной эмболии сосудов малого круга кровообращения. Снижение артериального давления негативно сказывается на функциональной активности самого сердца вследствие гипоксии миокарда. Падение артериального давления сочетается со значительным повышением системного венозного давления с развитием острой правожелудочковой недостаточности (синдром острого легочного сердца). Эмболия легочных сосудов сопровождается изменениями газового состава крови. Возникает одышка как рефлекторная реакция на раздражение хеморецепторов рефлексогенных зон большого круга кровообращения и как реакция с рецепторных полей системы малого круга кровообращения. Одышка способствует усилению оксигенации крови и освобождению ее от СО2. Эмболия большого круга кровообращения. Эмболы поступают в сосуды большого круга кровообращения различными путями. Один из них — прохождение пузырьков воздуха через легочную сеть капилляров. Они вытягиваются, принимают форму сосуда и из малого круга кровообращения поступают в большой. Аналогичным путем в ток крови большого круга кровообращения могут проникать капли жира. Поражения левой половины сердца, его клапанного аппарата способны порождать тромбоэмболию, тканевую эмболию. Образование тромбов в артериях большого круга кровообращения, возникающих у животных после внедрения личинок паразитов, служит причиной тромбоэмболии. Артерии большого круга кровообращения могут быть местом локализации опухолевых клеток. Наиболее часто эмболии подвергаются брыжеечные артерии, артерии почек, селезенки, головного мозга, сердечной мышцы. Эмболия воротной вены. В портальную систему печени эмболы поступают из большого числа венозных сосудов органов брюшной полости. Закупорка воротной вены эмболами сопровождается тяжелыми расстройствами гемоциркуляции. Возникает портальная гипертония с венозной гиперемией органов брюшной полости — желудка, тонкого и толстого кишечника, почек, селезенки. Это вызывает нарушение пищеварения и основных функций печени — белково- и желчеобразовательной, дезинтоксикационной. Венозная гиперемия органов брюшной полости, повышение гидродинамического давления в венах и снижение онко-тического давления сопровождаются выходом транссудата в брюшную полость, развитием асцита. Портальная гипертензия характеризуется общими расстройствами кровообращения: ограничивается приток крови к полостям сердца, снижаются ударный и минутный объемы выбрасываемой крови, артериальное давление. Рефлекторно в ответ на гипоксемию и гиперкапнию развивается одышка, за которой в тяжелых случаях следует остановка дыхания. Тяжесть состояния больного определяется тем, что русло воротной вены способно вместить до 90 % объема циркулирующей крови и неспособностью оставшейся части обеспечить нормальное кровоснабжение животного организма. Последствия эмболии различного происхождения зависят от:
|
