Пат физиология. Учебные пособия для студентов высших учебных заведений
 Скачать 7.09 Mb. Скачать 7.09 Mb.
|
|
12.3.1. САХАРНЫЙ ДИАБЕТ Сахарный диабет — хроническое заболевание, обусловленное абсолютной или относительной недостаточностью гормона островкового аппарата поджелудочной железы — инсулина. Сопровождается нарушением обмена веществ, гипергликемией и гликозурией. Сахарным диабетом болеют собаки, лошади, свиньи, редко — крупный рогатый скот. Основной причиной возникновения заболевания считают нарушение функций островков Лангерганса поджелудочной железы, синтезирующих инсулин. Рассматривают инсулинозависимый диабет с уменьшением синтеза гормона и инсулинонезависимый диабет, когда снижена чувствительность рецепторов клеток к инсулину. Способствуют заболеванию наследственная предрасположенность, ожирение, эндокринопатии, длительный эмоциональный стресс, продолжительное потребление избыточного количества углеводистых кормов, сопровождающееся истощением инсулярного аппарата поджелудочной железы, предшествующие инфекционные (вирусные) заболевания. В генезе заболевания ведущим звеном всех нарушений представляется утеря способности клеток тканей использовать глюкозу. Угнетено фосфорилирование глюкозы в связи со снижением активности глюкокиназы. Заторможен синтез гликогена в печени и мышцах в результате ингибиции гликогенсинтетазы. Угнетено окислительное фосфорилирование, преобладает анаэробный гликолиз, что сопровождается лактоцидемией. Преобладание глюко-кортикоидов стимулирует глюконеогенез — образование глюкозы из неуглеводных компонентов — гликогенных аминокислот, жиров, молочной, пировиноградной кислот. Ингибирован переход углеводов в жир. Если у здоровых животных 30 % поступающей глюкозы трансформируется в липиды, то у диабетиков — только 3 %. Для удовлетворения потребности организма в энергии начинает интенсивно использоваться жир. Повышается его содержание в печени. Окисление жира не завершается образованием конечных продуктов (Н2О и СО2), в печени и крови идет накопление межуточных продуктов обмена — кетоновых тел. Развиваются метаболический ацидоз, кетонемия. Глюкоза путем неферментных процессов образует комплексы с белками плазмы и тканей — глюкозилированные протеины. Изменение структуры белков базальной мембраны и клеток эндотелия симулирует образование аутоантител. Развивается микроангиопатия, в том числе тромбоз сосудов микроциркуляторного русла, снижена активность регенерационных процессов. У больных животных повышен распад белка, угнетен его синтез. Аминокислоты трансформируются в углеводы, развивается диспротеинемия с преобладанием глобулинов. Усиленный распад белка сопровождается продукционной гиперазотемией. В крови накапливаются аммиак, мочевина, другие продукты остаточного зота. Развивается вторичный иммунодефицит, резистентность ослаблена. Гипергликемия сопровождается появлением большого количества сахара в моче (глюкозурия). Содержание глюкозы в крови больных животных достигает 200—300мг/100 мл. В моче больных лошади концентрация глюкозы колеблется в пределах 3—8 г/100 мл, у собак — 4—10 г/100 мл, у свиней — до 6 г/100 мл. С каждым граммом глюкозы выделяется 20—40 мл жидкости. Возникает полиурия, количество мочи увеличивается в 3 раза и более, мочеиспускание учащенное. Возрастание содержания глюкозы в крови до 350—400 мг/100 мл и выше, уровня кетонемии до 140 мг/100 мл и более сопровождается тяжелейшим состоянием, которое может завершиться гипергликемической комой. У больного животного появляются сонливость, быстрая утомляемость, депрессия, аппетит подавлен, сильная жажда, полиурия, возникает периодическое дыхание типа Куссмауля. В коматозном состоянии животное принимает боковое положение, не реагирует на окружение, температура тела понижается. Без соответствующего лечения животное погибает. 12.4. НАРУШЕНИЯ ЖИРОВОГО ОБМЕНА Липиды являются важнейшим источником энергии, поступающей в организм. Их калорийность почти в 2 раза выше калорийности углеводов и белков. Сейчас установлено, что роль жира не граничивается поставкой энергии животному организму. В составе липидов находятся полиненасыщенные жирные кислоты, не синтезируемые в организме. Они служат предшественниками простагландинов, предотвращают отложение холестерина в стенках кровеносных сосудов, поддерживают жидкое состояние билипидного слоя клеточных мембран. Эссенциальные, жизненно необходимые полиненасыщенные жирные кислоты (арахидоновая, линолевая, линоленовая) обеспечивают рост и развитие молодых животных, спермиогенез и овуляцию у взрослых животных, их продуктивность. Вместе с жирами в организм поступают жирорастворимые витамины. Липиды являются источником эндогенной воды. Расстройство обмена жира может возникать на всех этапах его ассимиляции: при переваривании и всасывании, транспортировке, межуточном обмене, депонировании. Нарушение переваривания и всасывания жиров. Гидролиз жиров осуществляется в полости кишки и на мембранах щеточной каймы энтероцитов. Нарушение полостного переваривания может быть обусловлено недостаточным поступлением желчи, поджелудочной и кишечной липазы. При гипохолии утилизация липидов затруднена из-за недостатка жирных кислот, необходимых для эмульгирования жиров, активации панкреатической липазы, нейтрализации кислотного содержимого, его механического перемещения. Чем менее эмульгирован жир, тем меньше площадь его контакта с энзимами. Полостное пищеварение может быть нарушено уменьшением поступления панкреатической липазы (панкреатит, механические препятствия, генетический дефицит), недостаточной активностью фермента (ахолия), его инактивацией (кислая среда). Пристеночное переваривание осуществляется преимущественно в проксимальном отделе тонкой кишки под влиянием моноглицеридлипазы, с ее же участием в присутствии желчных кислот и моноглицеридов образуются всасывающиеся мицеллы. Поэтому недостаточность трансмембранного переноса липидов чаще всего вызвана гипо- или ахолией, нарушением структуры желчных кислот, избытком кальция в корме. Кальциевые соли жирных кислот плохо подвергаются метаболизации. Поступивший в энтероциты жир подвергается ресинтезу, включается в состав хиломикронов (триглицериды, фосфатиды, холестерин, белок). Нарушение этой фазы всасывания может быть обусловлено подавлением функциональной активности энтероцитов при авитаминозах, особенно нехватке ретинола, кобаламина; энтеритах; дисбактериозе; токсикозах. Завершается всасывание поступлением в лимфу хиломикронов и тонко эмульгированных моноглицеридов, а в кровь — жирных кислот с короткой цепью (у жвачных — уксусная, пропионовая, масляная). У птиц липиды сразу поступают через портальную систему в печень и общий кровоток. Нарушение переваривания и всасывания сопровождается потерей жира, его выделением с фекальными массами. Хронизация патологии ведет к жировому и витаминному голоданию, кахексии. Дефицит эссенциальных жирных кислот у моногастричных животных тормозит рост и развитие молодняка; приводит к нарушению состава липидов клеточных мембран, синтеза простагландинов, дистрофическим изменениям внутренних органов, кожных покровов. Жвачные животные не испытывают дефицита высоконепредельных жирных кислот. Всосавшийся и ресинтезированный жир в виде хиломикронов (99 % триглицеридов, 1 % белка) через лимфатические сосуды, грудной лимфатический проток поступают в большой круг кровообращения. Часть из них депонируется легкими. Легкие обладают способностью регулировать поступление жира в артериальную кровь. Функциональное состояние легких влияет на липемию. Ускорение тока крови приводит к гиперлипемии, повышенному отложению липидов в жировую ткань. Ограничение дыхательной поверхности легких (ателектаз) сопровождается задержкой хиломикронов легочной тканью. Общее содержание липидов в крови зависит от их поступления извне, уровня потребления тканями и мобилизации из печени и жировых депо. После приема корма содержание жира в крови начинает повышаться и к 6—7-му часу достигает максимальных величин. Возникает алиментарная гиперлипемия, ее выраженность и продолжительность зависят от состава кормового жира, его количества, переваривания, всасывания, поступления в жировые депо и участия в межуточном обмене. Возможна транспортная гиперлипемия, если повышается потребность использования жира как источника энергии. Мобилизация жира стимулируется симпатикоадреналовой системой, повышенным выбросом катехоламинов. Жир транспортируется в виде неэстерифицированных жирных кислот (НЭЖК) и липопротеидов, к которым относятся хил омикроны, содержащие пищевые триглицериды, липопротеиды очень низкой плотности (ЛОНП); в их составе эндогенные триглицериды, липопротеиды низкой плотности (ЛНП) и липопротеиды высокой плотности (ЛВП). Основные липидные компоненты последних представлены эндогенными эфирами холестерина. Жирные кислоты хиломикрона могут использовать любые ткани, имеющие активную, стимулированную гепарином липопротеидлипазу (фактор просветления). Липопротеидлипаза эндотелиоцитов кровеносных сосудов, находящаяся в связанном состоянии, активируется также гепарином. Его недостаточность (гепатит, гепатоз, цирроз) способствует отложению хиломикронов в неизмененном виде. ЛОНП переносят к тканям триглицериды, синтезируемые печенью. ЛНП (бета-липопро-теиды) переносят холестерин плазмы в различные ткани, стенки кровеносных сосудов. ЛВП (альфа-липопротеиды) транспортируют холестерин из тканей и из стенок сосудов. Нарушение соотношений этих фракций липопротеидов является одной из причин расстройств обмена холестерина. Гиперхолестеринемия — важнейший фактор риска атеросклероза. Возникает как результат недостатка в плазме крови липопротеидов высокой плотности, длительного избыточного поступления холестерина с кормами, торможения расщепления эфиров холестерина, нарушения процессов его этерификации. Гиперхолестеринемию наблюдают при болезнях печени, нарушениях обмена веществ, лихорадочных состояниях. Нарушение межуточного обмена жира. Основой межуточного обмена жира являются такие процессы, как липолиз триглицеридов с освобождением жирных кислот, биосинтез липопротеидов, фосфатидов, триглицеридов, жирных кислот. Высшие жирные» кислоты представляют основной субстрат межуточного обмена, иэд уровень неизменно поддерживается за счет липопротеидов и триглицеридов жировых депо. Путем последовательного бета-окисления жирных кислот с образованием ацетилкоэнзима А (ацетил-КоА) молекулы жирных кислот укорачиваются до тех пор, пока вся цепь не распадется до ацетил-КоА. Он поступает в цикл Кребса и подвергается окислению до воды и диоксида углерода. Часть ацетил-КоА превращается в печени в кетоновые тела или используется для ресинтеза жира. У здорового крупного рогатого скота в крови содержится 1 — 6 мг/100 мл кетоновых тел, у овец — 3—7 мг/100 мл. Наиболее значимым для состояния здоровья животных нарушением является образование избытка кетоновых тел в крови — кетоз. Содержание кетоновых тел зависит от уровня поступления в организм углеводов, количества жирных кислот, поступающих в печень, активности их ресинтеза, интенсивности окисления ацетил-КоА в цикле трикарбоновых кислот. Углеводное голодание, характеризующееся низким (0,2—0,6 : 1) относительно оптимального (1—1,5 : 1) сахаро-протеиновым соотношением в рационе дойных коров, сопровождается сниженным образованием щавелевоуксусной кислоты в гепатоцитах. Она не связывает ацетил-КоА для включения в цикл Кребса. Ацетил-КоА конденсируется в ацетоацетил-КоА, который путем гидролиза превращается в ацетоуксусную кислоту. Часть ее декарбоксилируется в ацетон, часть под влиянием дегидрогеназы трансформируется в бета-оксимасляную кислоту. Избыточно образованные кетоновые тела (ацетон, ацетоуксусная и бета-оксимасляная кислоты) вызывают тяжелое заболевание — кетоз. Увеличение кетоновых тел (гиперкетонемию) наблюдают не только при углеводном голодании. Гиперкетонемию выявляют при голодании, сахарном диабете, тиреотоксикозе, тяжелых заболеваниях, сопровождающихся расстройствами окислительных процессов в организме, усиленным распадом липидов, жировой инфильтрации печени (гепатозе). Наиболее часто кетозом болеют высокопродуктивные коровы. Выделяют кетозы первичного (кетоз молочных коров) и вторичного происхождений, наблюдаемые у животных при атониях, переполнении рубца, родильном парезе, эндометритах, гепатозах, кормовых отравлениях. Гиперкетонемия сопровождается токсикозом, нарушением функции центральной нервной системы. Развиваются дистрофические процессы в печени, сердце, почках, поджелудочной железе, яичниках. Кетоновые тела появляются в моче (кетонурия), молоке (кетонолактия), выдыхаемом воздухе. Содержание кетоновых тел в крови и молоке возрастает до 40 мг/100 мл и более, а в моче — до 500 мг/100 мл. Количество же сахара (глюкозы) в крови падает с 40—70 мг/100 мл до 30—18 мг/100 мл. У заболевших кетозом коров снижается молочная продуктивность, что нередко является причиной их выбраковки. Кроме кетоза нарушение межуточного обмена жира может проявиться накоплением продуктов перекисного окисления. Интенсивное окисление ненасыщенных жирных кислот по перекисному механизму, вызванному недостатком токоферолов, селена, отравлением СН4, гипероксией, ионизирующим излучением, ведет к накоплению метаболитов, обладающих высокой биологической активностью. Продукты перекисного окисления липидов интенсивно образуются и накапливаются, если ингибированы антиоксидантные системы. Перекисям жиров придают большое значение в патогенезе многих заболеваний. Нарушение депонирования жира. Нарушение содержания депонированного жира определяется либо как повышенная инфильтрация жира в ткани с последующим ожирением, либо как усиленный липолиз. Под жировой инфильтрацией понимают длительное повышение содержания липидов в тканях (кроме жировой), когда триглицериды не подвергаются расщеплению, окислению или выведению. Ожирение представляет собой результат усиленного поступления липидов в жировую ткань и недостаточной утилизации их как источника энергии. Усиленное отложение жира определяется следующими патогенетическими факторами:
У больных животных отмечают характерные признаки нарушения липидного, белкового и углеводного обменов. В крови выявляют повышение концентрации общих липидов, холестерина, фосфолипидов, триглицеридов, бета-липопротеидов, НЭЖК. Снижены окислительные процессы, тормозится липолиз. Ожирение животных сочетается с жировой инфильтрацией и жировой дистрофией печени (рис. 17). Содержание жира в сухом веществе органа может достигать 20—30 % и более, тогда как у здоровых животных оно колеблется в пределах 8—12 %. Нарушаются все функции печени, снижаются желчеобразование и желчевыведение. Ожирение коров служит предрасполагающим фактором для заболевания кетозом. Такие животные заболевают гораздо чаще, чем коровы средней упитанности. У ожиревших животных снижается половая потенция, задерживается созревание яйцеклеток, нарушается половой цикл, коровы часто остаются бесплодными. Телята, ягнята, поросята, щенки от ожиревших матерей рождаются ослабленными, физиологически неполноценными, склонными к заболеваниям. 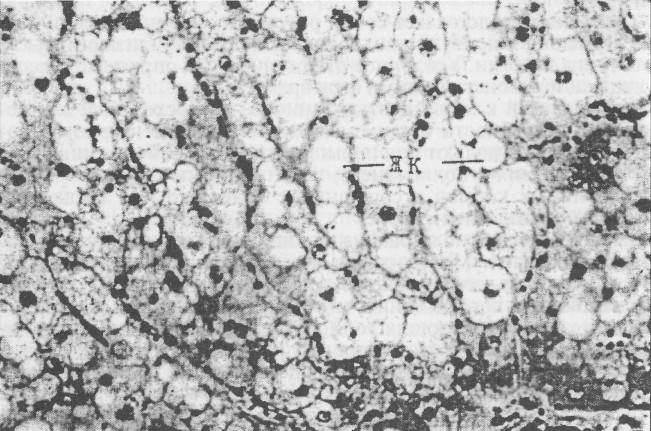 Рис. 17. Жировая дистрофия печени коровы. Накопление жира в гепатоцитах с образованием жировых кист (ЖК). Ув. 220 (по Байматову, 1999). В противоположность ожирению возможно усиление процессов липолиза. Оно наблюдается при сахарном диабете вследствие недостатка инсулина, при голодании, эмоциональном стрессе, гипотермии, повышенной физической нагрузке, стимуляции симпатических нервов, иннервирующих жировую ткань, при усиленном выбросе мозговым слоем надпочечников катехоламинов (адреналин, норадреналин, дофамин). Липолитический эффект усиливают и другие гормоны, повышая аденилатциклазную активность: АКТГ, СТГ, ТТГ, тироксин, тестостерон, глюкагон. Освобождающиеся за счет усиленного липолиза жирные кислоты поступают в кровь и используются для обеспечения повышенных потребностей мышечной и других тканей в энергии. 12.5. НАРУШЕНИЯ БЕЛКОВОГО ОБМЕНА Белок занимает центральное место в обмене веществ, обеспечивая жизнедеятельность организма, его связь с окружающей средой, адекватность реакций на внешние раздражители. Белки формируют структурную организацию всех клеточных элементов, пластическая роль неизмеримо выше энергетической, она незаменима. Без белков, их составных частей — аминокислот — невозможен синтез ферментов и гормонов, обеспечивающих анаболические и катаболические процессы в организме, их регуляцию. С белками связаны иммунная защита, функция опорных тканей, накопление и расходование энергии, сокращение мышц. Белки хранят генетическую информацию, формируемую в ходе эволюционного развития, являются материальными носителями жизни. К основным причинам, вызывающим нарушения белкового обмена у домашних животных, следует отнести неполноценное, несбалансированное питание, заболевания органов пищеварения, почек, легких, нейроэндокринные расстройства, злокачественные новообразования, инвазионные и инфекционные болезни, сопутствующие им лихорадочные состояния. Нарушение переваривания и всасывания белков. В желудочно-кишечном тракте белки подвергаются ферментативному расщеплению до аминокислот, которые подлежат всасыванию. Полноценный гидролиз возможен при нормальном функционировании желудка, кишечника, пищеварительных желез, симбионтной микрофлоры. Уменьшение поступления белков с кормом, нарушение его переваривания приводят к алиментарной белковой недостаточности. Начинается процесс гидролиза крупных белковых молекул в желудке под влиянием пепсина. Снижение содержания хлористоводородной кислоты (гипо-, анацидные гастриты) тормозит превращение пепсиногена в пепсин; переваривающая сила желудочного сока падает. Гидролиз белков еще в большей степени может быть ослаблен при ограниченном поступлении в кишечник панкреатического сока, содержащего трипсин, хемотрипсин, карбок-сипептидазы, пептидазы. Внешнесекреторная недостаточность поджелудочной железы может усугубляться слабой активацией ферментов из-за дефицита энтерокиназы и желчи, разрушением, инактивацией ферментов вследствие роста микрофлоры в проксимальной части тонкой кишки. Заключительный этап переваривания и интегрированное с ним всасывание аминокислот нарушаются при энтеритах, энтероколитах, гиповитаминозе А, лучевой патологии, нарушениях микроциркуляции, отеке слизистой оболочки кишечника. Неутилизированные белки корма поступают в толстый кишечник. Пептиды и аминокислоты подвергаются там бактериальному расщеплению. Результатом гнилостного разложения будут образование, накопление и всасывание токсигенных аминов, таких, как кадаверин, гистамин, путресцин, тирамин; ядовитых ароматических соединений — фенол, крезол, индол; газов — метан, сероводород. Печень не в состоянии обезвредить избыточно образующиеся продукты гниения белка, возникает токсикоз. Нарушение межуточного обмена белка. Аминокислоты, транспортированные через мембрану щеточной каймы энтероцитов, поступают в сосуды кишечной ворсинки, направляются к печени и включаются в обменные процессы. Метаболизм белков складывается из синтеза белковых молекул, их расщепления, превращения аминокислот, образования и выведения из организма конечных продуктов. С момента зарождения в организме происходят синтез белка и распад его составляющих. Интенсивность этих процессов определяется физиологическим состоянием организма и регулируется нейроэндокринным механизмом. После денервации развивается атрофия тканей, их клетки становятся объектом аутоагрессии. Многообразно влияние гормонов на синтез белков. Оно может распространяться на генетический аппарат клетки, стимулируя ее к размножению, на функции органоидов. Одним из важнейших гормонов, участвующих в регуляции метаболизма вообще и белкового обмена в частности, является соматотропин. Усиление белкового синтеза под его влиянием объясняют стимуляцией образования информационной РНК в ядре клетки, формирования рибосом, где синтезируется белок, подавлением внутриклеточных катаболических процессов, повышением проницаемости клеточной мембраны для аминокислот. Необычное повышение содержания гормона в раннем постнатальном периоде ведет к гигантизму, снижение — к противоположному эффекту. Избыток тироксина способствует катаболическим процессам, так же действуют глюкокортикоиды с преимущественным влиянием на лимфоидную, мышечную, соединительную ткани. Анаболическим эффектом, усиленным синтезом мышечного белка, обладают андрогены, тогда к эстрогены стимулируют развитие молочных желез, матки, эпителия влагалища. К анаболическим гормонам следует отнести инсулин, повышающий проницаемость клеточных мембран для аминокислот. Повышенный распад белковых структур клеток (катаболизм) возникает при воспалительных процессах (альтерация, раневое истощение), гипоксии, аутоиммунных реакциях, ожоговой болезни язвенной болезни, злокачественных опухолях (раковая кахексия). Нарушение соотношений между анаболическими и катаболи-жими процессами может сопровождаться изменениями содержания в крови белков и белковых фракций. Количество общего 1ка плазмы крови у здоровых животных колеблется в пределах -8,6 г/100 мл. Гиперпротеинемия — повышение содержания общего белка в плазме крови. Бывает относительной (за счет обезвоживания) и абсолютной. Абсолютная часто сочетается с гиперглобулинемией — повышением глобулиновой фракции белков и соответствующим снижением альбуминов. Такую гиперпротеинемию блюдают у животных, страдающих многими инфекционными заболеваниями, пневмонией, нефрозом, злокачественными но-вообразованиями. Гиперпротеинемию выявляют в поствакцинальном периоде, при многих инфекционных заболеваниях в период нарастания антителогенеза за счет гамма-глобулинов, держание бета-глобулиновой фракции отмечают в случаях заболевания животных нефрозом, миеломой, гепатитом. Гипопротеинемия — уменьшение содержания общего белка в плазме крови. Может быть результатом алиментарной недостаточности, нарушения переваривания и всасывания белка, усиленного деления его почками (нефрит, нефроз). Через почки обычно теряется мелкодисперсный белок — альбумин (альбуминурия). Гипопротеинемию наблюдают у животных с заболеваниями пета, когда снижена ее белковообразовательная функция после кровопотерь. Обильная экссудация, особенно у лошадей, приведет к падению уровня белка в крови, то же у животных, пострадавших от массивного ожога, гнойного распада тканей. Диспротеинемия — многообразные нарушения соотношений жду отдельными фракциями белков крови. Рассматривают дишуноглобулинемию — нарушение нормального соотношения 1ельных иммуноглобулинов (IgG, IgM, IgE, IgA, IgD), дисглобулинемию — нарушение соотношений между отдельными фракции глобулинов (альфа-, бета-, гамма-глобулина), дисгамма-гло-шнемию — они могут быть количественными и качественными. Особую значимость имеет изменение содержания фибрина, зличение его концентрации в крови наблюдают у больных крупозной пневмонией, при острых и хронических воспалительных процессах, опухолях. Этот белок крови синтезируется в печени, поэтому гепатопатии могут вызвать снижение его уровня в крови, что приводит к замедлению свертываемости крови, ангиопатиям. Нарушение конечных этапов белкового обмена. Метаболизм белков сопровождается синтезом и распадом белковых структур. В результате распада часть аминокислот вновь используется для процессов синтеза, а часть превращается в конечные продукты. Такими конечными азотистыми продуктами являются аммиак, мочевина, мочевая кислота, ее соли. Самыми токсичными свойствами обладает аммиак. В обычных условиях он нейтрализуется в печени угольной, фосфорной, другими кислотами с образованием аммонийных солей. Посредством сложных превращений аммиак преобразуется в мочевину. Аммиак, мочевина, мочевая кислота, другие азотистые продукты обмена белка входят в состав остаточного, небелкового азота крови. У домашних животных уровень остаточного азота сыворотки крови колеблется от 26 мг/100 мл (собака) до 34 мг/100 мл (лошадь). Основная его часть представлена мочевиной, немочевинная названа резидуальным азотом. Многие заболевания животных сопровождаются увеличением содержания остаточного азота в крови — гиперазотемией. Различают продукционную гиперазотемию и ретенционную. Продукционная гиперазотемия наблюдается при усиленном патологическом распаде белка тканей (ожог, лучевая патология, травмы) с образованием большого количества безбелковых азотистых продуктов. Сюда же следует отнести последствия эксикоза — высыхания тканей из-за обезвоживания и утери электролитов. Мочевинообразовательная функция печени подавлена. В крови повышается содержание резидуального азота, главным образом за счет аммиака, не преобразованного в мочевину. Аммиак легко преодолевает гематоэнцефалический барьер и способен вызвать уремическую кому. Ретенционная гиперазотемия развивается при заболеваниях почек, нарушениях выделительной функции обеих почек, обусловленных острым диффузным нефритом, механическим препятствием оттоку мочи (уролитиаз, аденома). Количество остаточного азота пропорционально степени тяжести патологического процесса. Возникающая уремия сопровождается токсикозом. Конечный продукт обмена нуклеиновых кислот — мочевая кислота. Избыточное образование и снижение выведения мочевой кислоты возможны при заболеваниях животных лейкозом, поражениях почек. Давно описано заболевание, вызываемое увеличением содержания мочевой кислоты в крови, — подагра. Причины и механизм гиперурикемии изучены недостаточно. К факторам риска относят избыточное поступление пуринов (мясо) в организм, молибденоз. У животных классифицируется как суставная форма мочекислого диатеза. Описана у кур и собак. Образующиеся соли мочевой кислоты начинают усиленно откладываться на суставных поверхностях, в хрящах, связках. Возникает острое воспаление суставов (подагрический артрит), сопровождающийся отечностью, сильной болью, лихорадочной реакцией, хромотой, деформацией суставов. |
