Пат физиология. Учебные пособия для студентов высших учебных заведений
 Скачать 7.09 Mb. Скачать 7.09 Mb.
|
|
Этиология. Первую теорию образования опухолей сформулировал видный немецкий патолог Р. Вирхов (R. Virchov, 1845). На основании собственного опыта и анализа имевшихся сведений он пришел к выводу, что причина опухолевого роста — чрезмерное раздражение тканей. Отсюда теория Вирхова — «теория раздражения». Он установил, что развитию опухоли предшествует длительное воздействие на клетки различных факторов. Было выявлено, что более половины опухолей органов пищеварения и мочеполовых органов приходится на те участки, которые подвергаются наибольшей травматизации — привратник желудка, слепая кишка, прямая кишка, шейка матки. В Индии, других восточных странах крупный рогатый скот используют для обработки полей. Плуг или соху через систему креплений привязывают к рогам. Со временем в области рогов у части животных развивались опухоли. В современных условиях к непосредственным «раздражителям», индуцирующим опухоли, относят физические, химические и биологические факторы. Физические факторы. Способностью бластоматозного превращения нормальной клетки в опухолевую обладают ионизирующая радиация, ультрафиолетовые лучи, тепловая энергия. Ионизирующая радиация в виде гамма- и рентгеновского излучения, заряженных частиц корпускулярного излучения, нейтронов, отрицательных пи-мезонов независимо от внешнего или внутреннего воздействия, общего или местного, однократного или хронического способна вызвать развитие разнообразных опухолей. Под влиянием облучения новообразования могут возникать практически во всех органах. Решающую роль в радиационной трансформации клетки в опухолевую отводят ядру. Облучение приводит к разрыву молекул ДНК. При любом разрыве нарушается считывание информации с молекулы ДНК, изменяется пространственная структура хроматина. ДНК же постоянно связана с белками, участвующими в формировании хромосом и переносе генетической информации. Под влиянием облучения изменяется и эпигеномная (не связанная с ядерным материалом) наследственность клетки, носителями которой являются различные цитоплазматические органеллы. Функциональная активность облученных клеток изменяется, что передается их потомкам. Одно из отдаленных последствий радиационного воздействия на организм — образование неоплазм. Имеются многочисленные клинические наблюдения и экспериментальные данные, подтверждающие роль ионизирующей радиации в канцерогенезе. Рак кожи у рентгенологов известен еще с 1902 г. Легко вызвать остеосаркому у крыс, собак, вводя им радиоактивные изотопы (Pu, Ra, Sr), тропные к костной ткани. Ультрафиолетовые лучи обладают слабым ионизирующим эффектом, поэтому индуцируемый ими опухолевый рост наблюдают только в поверхностных слоях кожного эпителия. Химические факторы. Канцерогенные (от греч. cancer —рак) вещества могут быть экзогенного и эндогенного происхождения. Впервые на роль химических веществ в этиологии опухоли обратили внимание английские врачи (Pott, 1775), обнаружив рак кожи мошонки, подвергавшейся у трубочистов длительному воздействию печной сажи. В 1918г. японские ученые (lamagiva и Ischicava) промоделировали рак уха кролика, длительное время нанося деготь на кожу. Из каменноугольной смолы вскоре были получены чистые вещества, аппликация которых на кожу в 100 % случаев вызывала рак. К настоящему времени определено несколько групп химических веществ, обладающих выраженным канцерогенным эффектом:
К настоящему времени насчитывают более 1300 химических соединений, обладающих канцерогенными свойствами. Впервые мысль о возможном эндогенном образовании блас-томогенных веществ была подтверждена экспериментально (Л. М. Шабад, 1947) инокуляцией желчи, экстрактов ткани печени, легких умерших от рака людей подопытным мышам, у которых возникали опухоли, в том числе злокачественные. В последующем было установлено, что канцерогенами эндогенного происхождения являются многие соединения и гормоны. Это — желчные кислоты, метилхолантрен, образующийся при пиролизе холестерина, дезоксихолиевой кислоты, половых гормонов, других веществ, метаболиты тирозина, триптофана, женские половые гормоны (эстрадиол, прогестерон), тестостерон, дезоксикортикостерон, тропные гормоны. Длительное введение эстрадиола мышам-самцам ведет к развитию рака грудных желез. У хомяков инъекции этого гормона сопровождались развитием рака почек. У самок мышей с помощью фолликулина и экстринбензоата в 100 % случаев можно получить рак молочных желез. Таким образом, получены неопровержимые доказательства роли гормонального дисбаланса в химическом канцерогенезе. Многие химические соединения, не являясь канцерогенами, могут усиливать бластомогенное действие других веществ. Эти соединения экзогенного и эндогенного происхождения получили название проканцерогенов в отличие от истинных, прямых канцерогенов. Выявлено непосредственное влияние химических соединений на геном клетки, превращение под их воздействием протоонкогенов в онкогены, трансформирующие клетку посредством своих белков в бластоматозную. Биологические факторы. Основное значение имеют опухолеродные вирусы, вызывающие у животных развитие спонтанных опухолей. Впервые ветеринарный врач М. А. Новинский в 1873 г. перепривил опухоль от одного животного другому (от собаки — собаке, от лошади — лошади), чем положил начало экспериментальной онкологии. Выявленная возможность перепрививки опухолей была подтверждена другими исследователями в разных странах. Как впоследствии выяснилось, воспроизводство опухоли может быть осуществлено и бесклеточными фильтратами. Первые подтверждения способности вирусов вызывать опухолевый рост были получены в опытах Эллермана и Банга (Ellerman, Bang, 1908) и Рауса (Rous, 1911). Ими было установлено вирусное происхождение некоторых форм лейкозов птиц, ангио- и остеосарком кур. В 1933г. Шоуп (Schope) индуцировал папиллому уха кролика прививкой бесклеточного фильтрата. Биттнер (Bittner, 1934) выделил «фактор молока» у мышей, больных раком молочной железы. Подсадка мышат низкораковых линий самкам высокораковых линий повышала заболеваемость опухолями молочных желез у животных с 1 до 16 %. Была доказана вирусная природа «фактора молока». Опухолеродные вирусы, вызывающие спонтанные опухоли у животных, различаются по типу входящей в их состав нуклеиневой кислоты - ДНК и РНК. ДНК-содержащие вирусы (семейства Papovaviridae, Poxviridae, Parvoviridae) чаще определяют развитие доброкачественных опухолей. К ним относят фибромы, полиомы, папилломы (от лат. papilla — сосок, оmа — опухоль) — бородавчатые разрастания, часто обнаруживаемые на коже, слизистых оболочках у кроликов, собак, крупного рогатого скота, лошадей. Вирусы, вызывающие кроличью папиллому Шоупа, полиомы, разнообразные опухоли у подопытных животных, и вакуолизирующий вирус обезьян объединены в группу Papova. Этот термин составлен из первых слогов наименований трех перечисленных форм опухолей (papilloma, polyoma, vacuolating). РНК-содержащие вирусы вызывают подавляющее большинство новообразований у животных. Главным является семейство ретровирусов (Retroviridae), включающее подсемейства: Oncornaviridae (онкорнавирусы человека и животных), Lentiviridae (вирусы Висны-Маэди), Spumaviridae (пенообразующие вирусы человека, крупного рогатого скота, кроликов, кошек). В подсемейство Oncornaviridae входит 3 разновидности вирусов — С, В, D. Вирусы типа С, выделенные от млекопитающих, подразделяются на две группы: первая — вирусы типа С мышей, крыс, кошек, норок, свиней, обезьян; вторая — вирус лейкоза крупного рогатого скота (ВЛКРС). Он является обязательным, хотя и не единственным фактором развития новообразований лимфоидных органов у крупного рогатого скота. Согласно вирусной генетической теории Л. А. Зильбера (1968) причиной развития опухолей являются вирусы, а химические и физические канцерогенные факторы только стимулируют реализацию их онкогенной потенции, являются патогенетическими, а не этиологическими факторами опухолевой болезни. РНК-содержащие вирусы адсорбируются на поверхности клетки благодаря взаимодействию своих рецепторов с рецепторами мембраны и проникают внутрь. С помощью обратной транскриптазы (ревертазы) на геномной РНК синтезируется ДНК вируса, которая интегрирует в ДНК клетки. Реализуется интеграция вирусного генома с генетическим аппаратом клетки. Основные постулаты вирусно-генетической теории:
По мнению автора, все спонтанные опухоли человека и животных вызываются вирусами, только методические трудности препятствуют их выделению и идентификации. Далее было установлено, что опухолеродные вирусы поступают в организм не только из внешней среды. Существуют также и эндогенные онкогенные вирусы. В естественных условиях они являются интегральной частью генома клетки, однако при провоцирующих воздействиях способны к индукции канцерогенеза. Возникновение некоторых редко наблюдаемых спонтанно возникающих опухолей у животных может быть объяснено теорией «неиспользованных эмбриональных зачатков», созданной Конгеймом (1887). Согласно этой дисонтогенетической теории развитие опухоли происходит из эмбриональных клеточных культур, не получивших должного развития на ранних стадиях онтогенеза. В постнатальный период под влиянием провоцирующих воздействий у взрослых животных эмбриональные зачатки, обладая большой потенцией роста, начинают усиленно размножаться и формировать опухоли. К ним, в частности, относят тератомы (от греч. teras — уродство, оmа — опухоль) — опухоли из эмбриональных зачатков, развивающихся из разных зародышевых листков. Множественность проявлений опухолевого роста при таких видах опухолей, как липомы, фибромы, аденомы, может свидетельствовать о роли и значении неиспользованных эмбриональных клеток в их развитии. Все большее число современных авторов склоняется к мнению о полиэтиологичности канцерогенеза. Согласно полиэтиологической теории превращение клетки в опухолевую происходит в результате воздействий на геном клетки физических, химических, биологических, дисгормональных и других факторов. В пользу многофакторной теории канцерогенеза свидетельствует и возможность взаимного усиления бластоматозного эффекта разных по природе канцерогенов. Например, раковое перерождение эмбриональных клеток крыс нельзя вызвать по отдельности ни динитрозамином, ни вирусом мышиного лейкоза. Совместное же их применение вызывает трансформацию. 11.4.1. ОБЩИЙ ПАТОГЕНЕЗ Процесс преобразования нормальной ткани в опухолевую сложен. Приближение к разгадке интимных механизмов канцерогенеза становится возможным с выявления его молекулярных основ. Изучение генеза трансформирующего влияния на клетку РНК-со-держащих вирусов позволило обнаружить в клеточном геноме человека и животных аналог вирусного онкогена. Идентифицировано уже более 20 аналогов ретровирусных онкогенов, продуцирующих онкобелки. Рассматривают несколько этапов общего патогенеза опухолей. Трансформация. Нормальная клетка приобретает свойства им-мортелизации («бессмертия») — способности беспредельно размножаться и передавать эту способность своим потомкам. Вызвать превращение нормальных клеток в опухолевые способны мутации многих генов, кодирующих белки. Различают две группы таких генов — онкогены и антионкогены. У всех клеток с диплоидным набором хромосом имеется по два гена каждого вида. Онкогены — это гены, мутации которых вызывают преобразование нормальной клетки в бластоматозную потому, что их продукт — онкобелок имеет измененную структуру и накапливается в избыточном количестве. Предшественниками онкогенов являются протоонкогены. Мутации, превращающие протоонкоген (нормальный ген) в онкоген, доминантны, т. е. преобразование даже одного протоонкогена в онкоген достаточно для малигнизации клетки. Антионкогены обладают иными, во многом противоположными свойствами. Для появления или усиления преобразований клетки необходима инактивация каждой пары находящихся в ней антионкогенов. Инактивация одного из антионкогенов не вызывает изменений клетки, так как второй ген пары продолжает нормально функционировать. В генетическом аппарате нормальной клетки млекопитающих и птиц выявлено уже несколько десятков типов протоонкогенов и несколько типов антионкогенов. Развитие опухоли может быть результатом не единственной мутации. Внутри вновь образованного клона бластоматозных клеток могут появляться целые серии поломок разных генов. Активированные клеточные онкогены продуцируют онкобелки, обладающие особыми свойствами. Они сами способны стимулировать рост и размножение клетки, повышать восприятие рецепторных аппаратов к тромбоцитарному, эпидермальному, инсулинподобному факторам роста. Выявлена способность онкобелков снижать чувствительность рецепторов к тормозящим митоз кейлонам, другим ингибиторам роста. Промоция. Нормальные клетки, трансформированные в результате активации протоонкогена или инактивации антионкогена в бластоматозные, могут длительное время находиться в латентном состоянии. К причинам, тормозящим развитие опухоли, относят иммунологический контроль, отсутствие или недостаточность развития локальной сосудистой сети, избыток ингибиторов роста или рецепторов к ним на поверхности опухолевых клеток, недостаток экзогенных или эндогенных промоторов или рецепторов к ним на трансформированных клетках. При гистологическом анализе состояния предстательной железы умерших не от раковых заболеваний людей в 25 % случаев были обнаружены раковые клетки, их число растет с возрастом и у стариков (90 лет) достигает 80 %. Высокая частота обнаружения «дремлющих» опухолей человека имеет место в отношении остео-генной саркомы, меланомы, рака шейки матки, молочной и щитовидной желез. Изменения в клоне злокачественных клеток и организме опухоленосителя могут привести к неконтролируемому бластогенезу. Возмущающими могут быть внешние (физические, химические, биологические) и внутренние факторы. К последним относят иммунодепрессию, иммуностимуляцию, гормональную Дисфункцию, вовлечение промоторов (усилителей) — мобильных генетических элементов, перемещающихся по геному клетки и способных встраиваться в его определенные участки. Прогрессия. Формирование опухоли, нарастание массы сопряжено с меняющимися взаимоотношениями бластоматозных клеток с окружающими тканевыми структурами. Меняются межклеточные отношения, микроциркуляторное русло, нервногуморальная регуляция, вовлекаются иммунные механизмы взаимодействия организма с бластоматозными клетками. В этих меняющихся условиях преимущественное значение приобретают жизнеспособные опухолевые клетки, определяющие интенсивность роста, степень злокачественности опухоли. 11.4.2. ВЗАИМОЗАВИСИМОСТЬ ОПУХОЛИ И ОРГАНИЗМА Развитие опухоли в животном организме тесно связано с его исходным состоянием. В то же время появление бластомы влияет на функциональную активность органов и тканей, всего организма в целом. Поэтому говорят об опухолевой болезни, ее системном проявлении. Суть в том, что резкое возрастание глюконеогенеза в мышцах, паренхиматозных органах как компенсация усиленного потребления глюкозы опухолевой тканью ограничивает возможность нормальных клеток синтезировать собственные белки и липиды. Опухолевая ткань, кроме того, сама является активным потребителем аминокислот, жиров, витаминов, особенно альфа-токоферола, других биологически активных веществ. В результате извращается функция не только пораженного органа, но и координированное функционирование органов и систем всего больного организма. Возникают сопутствующие опухолевому процессу сердечная, почечная, печеночная недостаточность, снижение резистентности к инфекции, что может привести к роковым для организма последствиям. Основными регуляторами, определяющими реакцию организма на бластоматозные факторы, являются нервная, эндокринная и иммунная системы. Их функциональное состояние может ограничить или способствовать развитию опухолевой болезни. Нервная система и опухоли. Чтобы под воздействием определенного фактора начался канцерогенез, он должен найти благоприятствующие развитию условия в организме. Эти условия многообразны, одно из них — состояние нервной системы. Эта система выполняет трофическую функцию, влияя на структуру, функцию, развитие органов и клеток воздействием на обмен веществ. Расстройство иннервации органа приводит к дистрофогенным проявлениям в клетке, свойственным и опухолевым процессам, синтезу необычных для клетки белков. Поэтому дистрофические процессы могут рассматриваться как предраковое состояние. Дистрофии нейрогенного происхождения, как показано нашим крупным патофизиологом А. Д. Сперанским (1937 г.), сопровождались в 15—20 % случаев папилломатозом, преимущественно на слизистой оболочке ротовой полости. Внутривенное введение клеток карциномы кроликам с денервированной селезенкой приводило к малигнизации именно этого органа; при денервации желудка опухоль развивалась в его стенках. Следовательно, состояние иннервации органов, ее нарушения могут стимулировать канцерогенез, метастазирование, способствовать рецидивам. Эксперименты и клинические наблюдения показывают, что у животных с сильным неуравновешенным типом нервной системы и слабым типом высшей нервной деятельности опухоли, индуцируемые химическими канцерогенами, возникают в большем числе случаев, более злокачественны, интенсивнее метастазируют. У животных же с сильным уравновешенным подвижным типом моделировать опухоли труднее, чаще наблюдается самопроизвольная регрессия. М. К. Петровой в лаборатории И. П. Павлова было установлено, что у собак с экспериментальными неврозами существенно повышается спонтанная заболеваемость опухолями разного генеза и локализации (рак щитовидной железы, саркомы челюсти и др.). Индуцирование опухоли химическими канцерогенами у подопытных животных с повышенной возбудимостью было более эффективным, чем у клинически здоровых. Получены прямые доказательства того, что невротические состояния являются факторами риска, значительно повышающими возможность заболевания раком. Возникновение и развитие самой опухоли не остается безразличным для организма, его нервной системы. Опухолевую болезнь сопровождает состояние стресса с фазовыми изменениями функциональной активности коры мозга и подкорковых образований. Первоначально превалирует фаза повышенной возбудимости нервной системы, в последующем нарастает угнетение деятельности головного мозга. Коррекцией нейрогуморального статуса в эксперименте удается существенно повысить противоопухолевую резистентность: тормозится химический канцерогенез, ухудшается прививаемость бластоматозных клеток, возрастает срок выживаемости подопытных животных. Эндокринная система и опухоли. От функционального состояния органов внутренней секреции во многом зависит бластоматозный рост. Основным пусковым механизмом, определяющим гормональное влияние на обмен веществ в клетках, органах, организма в целом, является система гипоталамус—гипофиз. Клетки гипоталамуса синтезируют и выбрасывают в кровь нейросекреты (релизинг-факторы), стимулирующие (либерины) или тормозящие (статины) выработку тропных гормонов гипофиза. Увеличение или уменьшение секреции тропных гормонов влияет на формирование опухолевой болезни. Так, избыточное образование гонадотропных гормонов сопровождается гиперэстрогенизацией организма. В свою очередь, избыточное количество эстрогенов — одна из основных причин возникновения так называемых дисгормональных опухолей. Самыми распространенными бластомами этого рода у животных и человека являются опухоли молочной железы, матки, предстательной железы. Эстрогены и андрогены стимулируют клеточную пролиферацию генов в канцерогенезе. Специфичность подобного влияния объясняют тем, что фолликулостимулирующий гормон (ФСГ) помимо активации синтеза половых гормонов непосредственно влияет на ткани органов-мишеней. Кроме того, избыток гонадотропных гормонов гипофиза приводит к дисфункции яичников, которые начинают вырабатывать гормоны с измененной структурой и функцией, способные активизировать пролиферативные процессы в клетках органов половой сферы. Роль коканцерогенов в развитии опухоли молочной железы играют и гормоны щитовидной железы. Найдено, что гипотиреоз способствует бластоматозной пролиферации, тогда как избыточное количество тиреоидных гормонов ее ингибирует. Таким образом, пролиферация, стимулируемая избыточным содержанием гормонов в крови, становится предрасполагающим фактором бластоматоза. При установлении влияния опухолевой болезни на организм нельзя не учитывать изменений гормонального профиля больного. Локализация опухолей в железах внутренней секреции усиливает или ингибирует их функциональную активность со всеми вытекающими последствиями. Локализация опухолей в гипофизе приводит к гипофизарной кахексии, другим соматическим расстройствам. Развитие опухоли в щитовидной железе может сопровождаться гипертиреозом с негативным влиянием на регуляторные системы организма. Поражение опухолевым процессом любой железы внутренней секреции приводит к ее дисфункции. Такие железы, в частности, способны синтезировать гетерогормоны — гормоны, не свойственные данному органу внутренней секреции. Островковый аппарат поджелудочной железы в условиях малигнизации способен к эктопическому синтезу до семи гормонов, не свойственных нормальному органу. Для опухолевой болезни характерны такие общие сдвиги в гормональном статусе, как повышение уровня адренокортикотропного и соматотропного гормонов в крови, глюкокортикоидов, катехоламинов, глюкагона; уменьшение содержания инсулина с явлениями диабета. Состояние иммунной системы и развитие опухоли. Экспериментаторами и клиницистами накоплен огромный материал о взаимосвязи и взаимозависимости бластоматозного превращения клеток и иммунной системы организма. Генетическое постоянство многоклеточного организма — главная функция иммунной системы. Функция иммунологического надзора обеспечивается согласованным взаимодействием различных элементов системы, их динамической реакцией на изменения контролируемых клеточных систем. Трансформация нормальных клеток в опухолевые, появление в последних онкобелков сопровождаются активной реакцией со стороны иммунной системы. В распознавании и возможном уничтожении трансформированных клеток участвуют различные типы иммунокомпетентных клеток и их медиаторы, вовлекающие в процесс элиминирования разнообразные механизмы. Уже на ранних этапах прогрессии бластоматозные клетки экспрессируют на своей мембране опухолеспецифичные антигены, меняются биофизические характеристики измененных клеток. Возникающие изменения индуцируют миграцию к антигенным опухолевым структурам макрофагов, естественных киллеров (NK), цитотоксических Т-клеток (Т-киллеров), других клеточных элементов (рис. 16). Эффективность натуральных киллеров особенно ярко выражена на ранних этапах развития опухолей, микрометастазов, на поздних их активность подавлена, что четко проявляется при экспериментальном канцерогенезе. 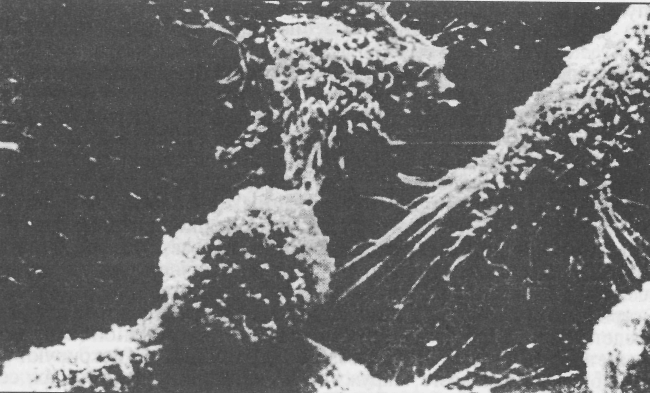 Рис. 16. Взаимодействие макрофагов с опухолевой (внизу) клеткой. СЭМх10000 Контроль за развитием опухоли осуществляют не только клеточные механизмы. Большое значение придают интерлейкинам — группе биологически активных веществ, синтезируемых активированными иммунокомпетентными клетками. Так, активированный макрофаг выделяет так называемый фактор некроза опухолей, способный к регрессии бластоматозных клеток. Интер-лейкин-2, выделяемый Т-лимфоцитами, стимулирует естественные киллеры, лимфоциты, инфильтрирующие опухолевую ткань. Макрофаги, опухолевые клетки, NK-клетки продуцируют интерферон, ингибирующий развитие онковирусов. Торможение онкогенеза обеспечивает синергизм действия альфа-интерферона, интерлейкина-2, фактора некроза опухолей. Стимуляция иммунной системы опухолевыми антигенами приводит не только к активации клеточного иммунитета, но и к дифференциации плазматических клеток из В-лимфоцитов. Плазмоциты начинают продуцировать специфические антитела, обладающие цитотоксичностью. Различают опухоли с высокой чувствительностью к антителам, с низкой чувствительностью к цитотоксическому действию антител и группу опухолей, вовсе не чувствительных к гуморальным антителам. К последней относят саркомы, карциномы, дисгормональные опухоли. По мере роста опухоли нарастает иммунодепрессия. Иммунная система противоопухолевой защиты становится все менее эффективной. Опухоль начинает интенсивно расти и развиваться. Причину иммунодепрессии видят в выработке опухолевыми клетками особых веществ — ненасыщенных жирных кислот, протеаз, эмбриональных антигенов. Стимулируется глюкокортикоидная функция надпочечников. Глюкокортикоиды угнетают активность лимфоидных, иммунокомпетентных органов. Большую роль в ослаблении иммунного ответа организма на развивающуюся опухоль отводят повышению активности Т- и В-супрессоров, которые оказываются более чувствительными к опухолевым антигенам, нежели хелперные клетки. Полагают, что вялотекущие, хронические воспалительные процессы, истощая резервные возможности организма, стимулируют опухолевый рост. 11.4.3. РАСПРОСТРАНЕННОСТЬ ОПУХОЛЕЙ СРЕДИ ЖИВОТНЫХ Спонтанно возникающие опухоли наблюдаются у разных представителей животного мира. Ими поражаются пойкилотермные (рыбы, рептилии, моллюски, лягушки) и теплокровные (млекопитающие, птицы) животные. Особо большое внимание в последние 10—15 лет стали уделять опухолевым заболеваниям после того, как окончательно выявилась вирусная природа гемобластозов (лейкоза, лимфосаркомы) крупного рогатого скота — основной формы злокачественных новообразований у этого вида домашних животных. Острый и хронический лимфолейкоз крупного рогатого скота представляет собой системное заболевание лимфоидной (иммунокомпетентной) ткани. Лейкозные изменения регистрируют в красном костном мозге, наружных и внутренних лимфоузлах, селезенке, иногда в печени. Лимфосаркома — злокачественная опухоль, локально поражающая лимфоузлы без системного вовлечения лимфоидных органов. Из общего количества животных, спонтанно пораженных гемобластозами, на лейкозы приходится 81— 85 %, на гематосаркомы— 15—19 %. Особая опасность этой формы злокачественных новообразований заключается в возможности перезаражения здоровых животных от вирусоносителей. Зарегистрирована даже вероятность перезаражения животных при манипуляции инъекционной иглой, контаминированной кровью от больной лейкозом коровы. На гемобластозы у крупного рогатого скота приходится около 67 %; на опухоли кожи, в основном папилломы, — 14 %; легкие, печень, половые органы поражаются в 4—5 % случаев. Среди 14 пород собак наиболее часто опухоли выявляют у овчарок и боксеров в возрасте около 8 лет. Поражена преимущественно кожа и подкожная клетчатка (32 %), причем 2/3 случаев приходится на рак и саркому. На втором месте молочные железы (20 %), с преобладанием раковых новообразований, на третьем — половые органы (14%), пораженные, как правило, трансмиссивной венерической саркомой. Участились случаи рака щитовидной железы, лейкозов, лимфосарком. Согласно статистическим данным, поражаемость собак опухолевой болезнью с годами существенно возрастает. У свиней гемобластозы составляют около 80 % общего количества опухолевых заболеваний с преобладанием лейкозов. В остальных случаях спонтанные опухоли представляли собой различные типы сарком, аденом, фибром, недифференцированных бластом и рака с локализацией в легких, молочной железе, печени, репродуктивных органах. У овец обнаруживают спонтанные случаи лейкоза, его лимфоидную форму. Доказана вирусная этиология заболевания. Оно протекает бессимптомно, течение хроническое, наиболее часто выявляется у животных в 5—6-летнем возрасте. Другие формы гемобластозов — лимфосаркома, лимфогранулематоз, миелоидный лейкоз встречаются редко. Аденокарцинома легких овец принимает иногда характер энзоотии. У лошадей опухоли встречаются реже, чем у животных других видов. В 80 % случаев у них регистрируют гемобластозы (лимфо- и миелолейкоз) и ретикулезы (ретикулосаркома). Среди лтухолей другого генеза у лошадей выявляют папилломы, рак полового члена, фибросаркомы, гемангиомы. У птиц преобладают контаминированные вирусами гемобластозы. РНК-содержащие вирусы из семейства Retraviridae является этиологическим фактором развития у птиц лейкоза, сарком и карцином. Лейкоз птиц — системное заболевание лимфоидных органов бластоматозного происхождения. По преимущественному поражению рассматривают такие формы лейкоза, как лимфолейкоз, на долю которого приходится до 80 % болеющей лейкозом гтицы, миелоидный лейкоз (миелолейкоз, миелобластоз, миелоз) с увеличением в органах малодифференцированных миелоидных клеток, эритроцидный лейкоз (эритробластоз, эритролейкоз) с преимущественным поражением красного костного мозга, обильным появлением в крови недифференцированных про- и эритробластов и резко выраженной анемией. Лейкоз кур регистрируют во всех странах с развитым промьшн ленным птицеводством, которому он наносит существенный экономический ущерб. Чаще наблюдаемый у кур, лейкоз диагностируют и у других видов домашних (индейки, гуси, утки) и значительно реже диких (голуби, чайки, лебеди, страусы, орлы и др.) птиц. Саркомы — злокачественные опухоли птиц мезенхиматозного происхождения. Поражают соединительную ткань кишечника брыжейки, поджелудочной железы, любого другого паренхиматозного органа и мышц. Характеризуются локальностью процесса. Карциномы — злокачественные опухоли (рак) птиц, поражающие эпителиальную ткань. У кур наиболее часто наблюдают поражение серозной поверхности желудка, кишечника, брыжейки, яйцеводов, яичников. Доброкачественные опухоли у птиц встречаются довольно редко, к ним относят липомы, образующиеся из жировой ткани, фибромы — из соединительной ткани, миомы — из гладких и поперечнополосатых мышц, гемангиомы — из стенок кровеносных сосудов, остеомы — из костной ткани, другие разрастания бластоматозного происхождения. Повышение интереса, проявляемого ветеринарными специалистами к различным аспектам опухолевого роста, привело к созданию (1980г.) Единой международной системы классификации злокачественных опухолей домашних животных. Эта система получила название TNM, от первых букв следующих латинских терминов: Т — tumor — опухоль; N — nodus — лимфатический узел; М — metastasis — метастазы. Таким образом, система TNM основана на анализе степени распространения опухолей по трем категориям: распространению первичной опухоли (Т), состоянию лимфатических узлов (N), наличию или отсутствию отдаленных метастазов (М). Принятая унификация учета степени распространения, клинической стадийности, локализации новообразований у гомойотермных животных, лечебной эффективности позволит теоретикам и практикующим врачам более целенаправленно использовать имеющиеся и перспективные возможности для достижения прогресса в борьбе с разными формами опухолевой болезни. Опухоли рыб наблюдают у свободноживущих особей, а также разводимых в прудах и аквариумах. Сравнительно легко новообразования моделируются при введении в корм аквариумным рыбам (гуппи, данио) таких канцерогенов, как диэтилнитрозамин и дич метиламиноазобензол, нитрозморфолин, других химических бластомогенов. Спустя 11—25 нед после начала их скармливания у рыб регистрировали новообразования в печени, кишечнике, брюшной стенке с преобладанием злокачественных форм. Среди прудовых рыб особенно часто наблюдают новообразования у форелей, иногда принимающие характер эндемий. Описаны также опухоли у рыб, свободно живущих в пресной и соленой воде: щук, окуней, карпов, угрей, сельдей, трески, камбалы, акул и др. У рыб, так же как у млекопитающих, выявляют злокачественные и доброкачественные бластомы с преимущественной локализацией в печени, щитовидной железе, коже, хотя возможны поражения: всех групп тканей, имеющихся в организме. Характер поражений зависит от многих факторов: принадлежности к определенным классам и подклассам, возраста, среды обитания, насыщенности ее канцерогенами, возможности контаминации вирусами и т. д. Исследователи отмечают, что микроскопическое строение новообразований у рыб почти не отличается от такового у млекопигающих, за исключением наличия ядерных эритроцитов. Дополнение: 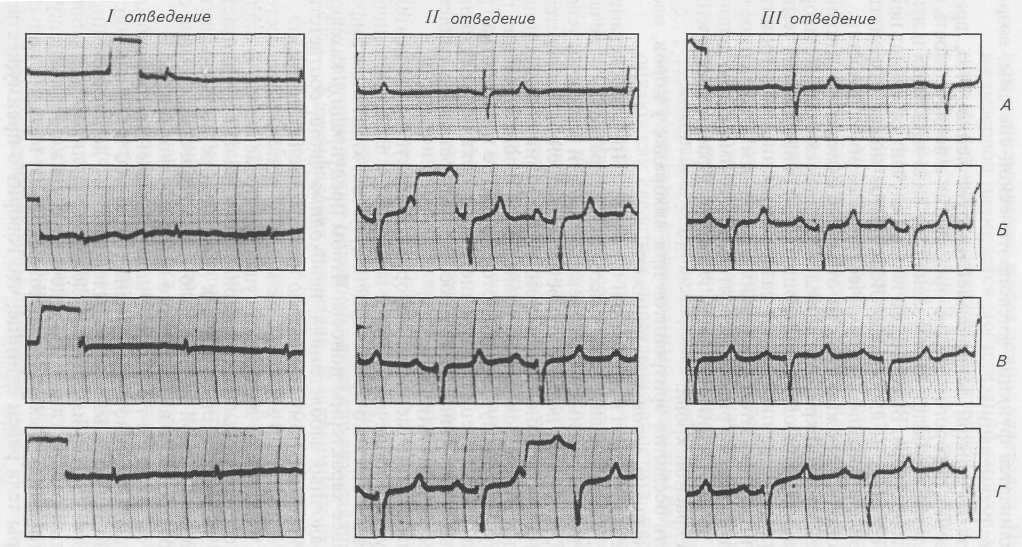 Рис. 13. Изменения сердечной деятельности у свиньи во время лихорадки, индуцированной пирогеналом. Электрокардиограмма в трех сагиттальных отведениях: А- исходное состояние; Б- первая стадия лихорадки; В- вторая стадия; Г- третья стадия Пирогены повышают чувствительность периферических сосудов к ангиотензину и серотонину. В первой стадии лихорадки развивается вазоконстрикция кожных сосудов, особенно ярко выраженная у свиней и лошадей и в меньшей мере у крупного и мелкого рогатого скота. Спазм сосудов кожи сохраняется у лошадей, свиней и во вторую стадию лихорадки. Период снижения температуры тела характеризуется расширением кожных сосудов, нарастанием периферического кровотока. Артериальное давление повышено относительно исходного в первой стадии лихорадки, в период же нормализации температуры тела оно падает, особенно при критическом завершении лихорадочной реакции. Дыхание. Лихорадка у животных сопровождается одышкой. Дыхание становится частым и поверхностным. В первой стадии у коров, овец, свиней, лошадей частота дыхания возрастает в 1,7— 2,3 раза, во второй стадии число дыхательных движений несколько снижается, а в третьей стадии (особенно у овец) вновь увеличивается. Система крови. Введение продуктивным животным бактериальных пирогенов сопровождается лейкоцитарной реакцией, не сочетающейся с температурой. В первой и второй стадиях лихорадки проявляется лейкопения с преимущественным уменьшением числа нейтрофилов и эозинофилов. Число лейкоцитов у крупного и мелкого рогатого скота, свиней может упасть до 60—70 % от исходного уровня, а у лошадей — до 35 %. Одновременно усиливается функция миелопоэтической системы, возрастает индекс регенерации. Вслед за начальной лейкопенией следует лейкоцитоз, время возникновения которого, степень проявления и вовлеченность отдельных элементов белой крови зависят от вида животных и этиологического фактора. Вместе с тем во всех случаях отмечают нейтрофилию со сдвигом ядра влево. Лейкоцитоз может сохраняться до 3 сут после прекращения термической реакции на пироген. У парнокопытных животных не отмечено изменений основных показателей красной крови. У лошадей же во всех стадиях лихорадочной реакции наблюдают эритроцитоз. С прекращением температурной реакции на пирогенное раздражение число эритроцитов у них достигает показателей, близких к исходным. Отмеченное явление следует рассматривать, вероятно, как элиминацию депонированных во внутренних органах, главным образом в селезенке, элементов красной крови. Скорость оседания эритроцитов при лихорадке у коров, овец, свиней повышена, у лошадей понижена. Пищеварительная система. При заболеваниях животных, сопровождающихся высокой температурой, отмечают потерю аппетита, уменьшение перевариваемости и степени усвоения корма, возникает недостаточность пищеварения. В значительной степени это связано с торможением секреции главных пищеварительных желез. Вследствие уменьшения слюноотделения появляется сухость во рту, затрудняются принятие и обработка грубого корма. Гипосекреция желудочного сока, сока поджелудочной и кишечных желез, гипохолия способствуют развитию гнилостных процессов, аутоинтоксикации. При лихорадке изменяется моторная и эвакуаторная деятельность желудка и кишечника. Чаще встречаются запоры атонического или спастического происхождения, но для кишечных инфекций наиболее характерны поносы. Чтобы предупредить кахексию при лихорадочных заболеваниях, необходима диета, соответствующая функциональному состоянию пищеварительного тракта. Выделительная система. Функциональное состояние почек в динамике лихорадки существенно меняется. В стадии озноба вследствие повышения артериального давления усиливается диурез, во второй и третьей стадиях лихорадки резко уменьшается количество выделяемой мочи, ее плотность возрастает. В моче обнаруживают продукты интенсивного обмена белков и жиров. Обмен веществ. Пирогенное раздражение сопровождается повышением основного обмена (на 40—60 %) за счет более интенсивного использования углеводов и депонированного жира. Анализ состояния обмена углеводов при лихорадке выявил повышенный распад гликогена в печени, а также развивающуюся гипергликемию. Дыхательный коэффициент в стадии подъема температуры тела равен единице, что говорит о преимущественном использовании в этот период углеводов. По мере истощения их резервов начинается мобилизация запасов жира. У лихорадящих животных обнаруживают кетонурию, что указывает на интенсивный, но неполный липолиз. Кроме того, установлены существенные изменения в жирно-кислотном составе липидов крови, печени, мозговой ткани. Во второй стадии лихорадки у коров и лошадей в крови уменьшается количество непредельных жирных кислот липидов и возрастает количество насыщенных жирных кислот. Полагают, что усиление теплопродукции и поддержание этого состояния на высоком уровне при лихорадке связаны прежде всего с окислением полиненасыщенных жирных кислот. Лихорадочное состояние характеризуется также первоначальной гипохолестеринемией с последующим увеличением в крови как холестерола, так и фосфолипидов. Лихорадка, сопровождающая инфекционный процесс, обычно характеризуется отрицательным азотистым балансом, что рассматривают как следствие подавления аппетита, недостаточности пищеварения, возникающего алиментарного голодания. Тяжелые деструктивные процессы при некоторых инфекционных и инвазионных заболеваниях сопровождаются усиленным распадом белка, увеличением количества азотистых продуктов в моче, особенно мочевины. Лихорадка же, индуцированная малотоксичным бактериальным липополисахаридом, у крупного и мелкого рогатого скота, лошадей не сопровождалась существенными изменениями белкового обмена. При лихорадке нарушается и водно-солевой обмен. Его основными причинами являются задержка тканями хлоридов и связывание ими воды, что объясняют, в частности, усиленной продукцией антидиуретического гормона. Задержка воды тканями, усиленная перспирация и потоотделение определяют повышенную жажду лихорадящих животных. Классификация лихорадок. В зависимости от степени повышения температуры тела отмечают несколько видов лихорадок:
В зависимости от характера температурных кривых рассматривают следующие типы лихорадок: лихорадка постоянного типа (f. comtinua) характеризуется суточными перепадами температуры во второй стадии в пределах 10 С. Встречается при крупозной пневмонии, паратифе (рис. 14); 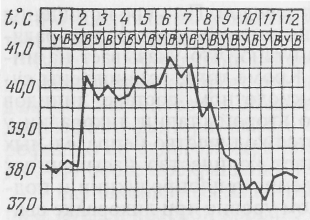 Рис. 14. Температурная кривая при лихорадке постоянного типа у лошади. Крупозная пневмония
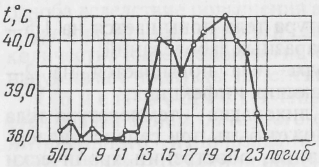 Рис. 15. Температурная кривая при лихорадке возвратного типа у лошади. Ифекционная анемия.
Значение лихорадки для организма. В процессе эволюции борьбы с микромиром лихорадка имела, очевидно, самое прямое отношение к становлению изотермии у млекопитающих и птиц. Возможность дополнительного реактивного повышения теплосодержания делала организм животных более устойчивыми к инфекционному началу, сохраняла жизнь, создавала условия для наследования способности лихорадить. Повышенное содержание тепла в организме при лихорадке само по себе губительно для патогенной микрофлоры. Особенно важно реактивное повышение температуры тела для противовирусной защиты организма. Репродукция вируса в клетках значительно тормозится под влиянием повышенной температуры тела. Лихорадка в этих случаях выступает как один из неспецифических факторов защиты. Высокая температура тела стимулирует обменные процессы, функциональную активность клеточных элементов, особенно клеток ретикуломакрофагальной системы, лейкоцитов. Появляются молодые формы элементов белой крови — юные и палочкоядерные. Они содержат большое количество гранул, богатых ферментами, что повышает фагоцитарную активность микрофагов. Лейкоциты в повышенных количествах начинают продуцировать иммуноглобулины, лизоцим, катионные белки. У лихорадящих коров, овец, лошадей возрастает активность пропердиновой системы, а также неспецифическая устойчивость к инфекционному началу. Микроорганизмы при высокой температуре среды обитания теряют устойчивость к антибиотикам, другим лекарственным препаратам, что создает условия для эффективного лечения. Поэтому в ветеринарных клиниках все большее применение находят малотоксичные, очищенные бактериальные пирогены, стимулирующие естественную резистентность организма и понижающие сопротивляемость патогенной микрофлоры к антибактериальным препаратам. Естественная резистентность при лихорадке возрастает во многом благодаря многофункциональности эндогенных пирогенов и, прежде всего ИЛ-1. Этот продукт активированных макрофагов стимулирует иммунную, эндокринную, нервную системы, определяющие устойчивость организма по отношению к патогенному фактору. Искусственное подавление лихорадочной реакции, как показали многочисленные опыты, начатые еще в лаборатории И. И. Мечникова, отягощает течение инфекции, создает условия для появления рецидивов, может способствовать преждевременному летальному исходу болезни. Лихорадка, являясь в своей основе защитной реакцией, вызывает и определенные нарушения в жизнедеятельности организма. В отдельных случаях, в связи с индивидуальными особенностями животных, высокая температура тела вызывает и нежелательные, вредные последствия. Так, тяжело переносят лихорадку животные с больным сердцем, поскольку высокая температура существенно повышает нагрузку на сердечную мышцу. Лихорадку, неадекватную силе пирогенного раздражения, наблюдают у истощенных лошадей. Их гиперчувствительность к пирогенам может быть причиной быстрой гибели. Весьма своеобразна реакция на бактериальные пирогены у животных, страдающих эмфиземой легких. Угнетение аппетита, гипосекреция пищеварительных желез, расстройство моторики создают недостаточность пищеварения, способствуют снижению продуктивности животных, особенно молочной. Значительные суточные перепады температуры во время лихорадки у крупных сельскохозяйственных животных быстро приводят к кахексии со всеми последствиями. Критическое падение температуры в заключительной стадии лихорадки может завершиться коллапсом, связанным с перераспределением крови. Указанные и другие негативные стороны лихорадочной реакции не ставят, однако, под сомнение ее приспособительный, защитный характер в общебиологическом, эволюционном плане. |
