Пат физиология. Учебные пособия для студентов высших учебных заведений
 Скачать 7.09 Mb. Скачать 7.09 Mb.
|
|
Инфаркт миокарда. Под инфарктом миокарда понимают некроз, омертвение участка сердечной мышцы. Причины некротизации миокарда — длительные приступы стенокардии, обусловленные центрогенным или рефлекторным повышением тонуса парасимпатических нервов, внутрисосудистым свертыванием крови, эмболией, субинтимальным кровоизлиянием. Важнейшую роль в возникновении инфарктов играет атеросклероз венечных артерий. Атеросклероз обнаруживают у подавляющего большинства (до 98 %) больных с инфарктом миокарда. Развитию некротизации сердечной мышцы способствуют следующие особенности склерозированных венечных артерий:
Инфаркты миокарда могут быть и некороногенного происхождения. Некротизация сердечной мышцы возникает под влиянием токсигенов, прямо действующих на кардиомиоциты. Миокардиты (ревмокардит) способны осложняться инфарктами из-за непосредственного воздействия патогена на ткань и развивающегося воспалительного отека, ограничивающего кровоснабжение сердечной мышцы. Доказана вероятность возникновения некрозов миокарда под влиянием избыточного содержания в крови гормонов коры надпочечников в сочетании с гиперкалиемией. Значительное повышение содержания катехоламинов (адреналин, норадреналин) при эмоциональных напряжениях сопровождается их гистотоксическим эффектом. Он проявляется резко возросшим потреблением миокардом кислорода, доставка которого не обеспечивается коронарными артериями. Развивается гипоксия, приводящая к некрозу. У домашних животных инфаркты миокарда встречаются довольно редко. Так, собаки не страдают атеросклерозом, гипертонической болезнью. У них не встречается обширных коронарногенных инфарктов. Инфаркты у животных этого вида наблюдают в случаях тяжелых травматических повреждений, при массивных кровопотерях и гиповолемии из-за падения уровня коронарного кровотока, в результате эмболии, заболевания лейкозом, лептоспирозом. Некоронарногенные микроинфаркты регистрируют в условиях застой- ной кардиомиопатии, при пороках атриовентрикулярных клапанов, сопровождающихся гипертрофией сердечной мышцы. Инфаркты миокарда у собак проявляются острой сердечной недостаточностью, аритмией с нарушениями возбудимости и проводимости. На электрокардиограммах больных животных регистрируют расширение комплекса QRS, расщепление зубцов, расположение сегмента S — Т ниже изоэлектрической линии, инверсию зубца Т. Кроме собак инфаркты миокарда обнаруживают при вскрытии трупов старых лошадей, эксплуатировавшихся в городских условиях; у лошадей, перенесших инфекционную анемию; у свиней, переболевших рожей. Исход инфаркта миокарда зависит от величины некротизированного участка, его локализации, повторяемости, возраста больного животного, определяющего адекватные свойства сердца. Если некротизация миокарда не привела к летальному исходу, то пораженные кардиомиоциты замещаются соединительной тканью, образуется рубец. Адаптивные возможности такого сердца существенно ограничены. 15.1.4. НАРУШЕНИЯ РИТМА СЕРДЦА Аритмии (от греч. arrhythmia — отсутствие ритма) — нарушения ритма сердечной деятельности, проявляющиеся изменениями последовательности, частоты и силы сокращений миокарда. Возникают у животных в результате многих острых и хронических заболеваний сердца с вовлечением проводящей системы. Рассматривают аритмии, развивающиеся как следствие нарушения кардинальных свойств сердечной мышцы: автоматизма, возбудимости, проводимости и сократимости. Нарушения ритма сердца возникают как синдром, характерный для многих кардиопатий, таких, как пороки, инфаркты, ишемическая болезнь, атеросклероз коронарных сосудов, миокардит и миокардоз. Аритмии сердца наблюдают при нейрогуморальных, функциональных устройствах, при интоксикациях разного происхождения. Аритмический синдром наилучшим образом выявляют по подателям электрокардиограмм (рис. 23). Из двух способов отведения электрических потенциалов сердца — от конечностей и туловищных (фронтальных и сагиттальных) — предпочтение в отношении копытных животных отдают туловищным отведениям (по Рощевскому). 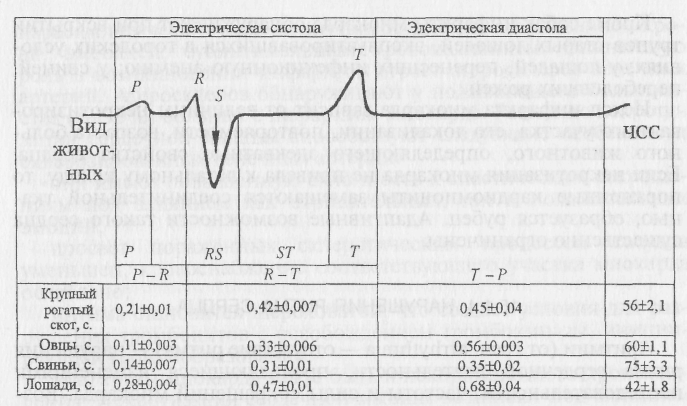 Рис. 23. Основная форма электрокардиограмм, снятых у животных разных видов в сагиттальных отведениях, их средние показатели (с.) (данные автора) Аритмии сердца, возникающие при нарушении автоматизма. Свойство сердечной мышцы к сокращению обусловлено появлением в особых клетках — водителях ритма электрического импульса, распространяющегося по проводящей системе и вызывающeгo сокращение миокарда. Импульс изначально спонтанно зарождается в синусовом узле — водителе ритма («пейсмекере»). Частота зарождения импульса, лежащего в основе автоматизма сердца, может меняться под влиянием кардиопатий или внешних воздействий, таких, как страх, боль, физическая перегрузка, анемии, кислородное голодание, поражение других органов за счет патологических висцеро-висцеральных рефлексов. Синусовая тахикардия характерна увеличением числа сердечных сокращений относительно нормальных показателей, свойственных животным конкретного вида, возраста, пола, физического состояния. Возникает под влиянием повышения тонуса симпатических нервов или ослабления парасимпатического воздействия на сердце. Синусовая тахикардия развивается и под непосредственным влиянием на водитель ритма токсических веществ, пирогенных и других субстанций. Тахикардия — наиболее часто встречающаяся аритмия у продуктивных и комнатных животных. Частота сердечных сокращений, как правило, увеличивается в 1,5—2 раза относительно исходной. Наибольшей реакцией сердца на неблагоприятные факторы отличаются лошади. Учащение ритма сердца проявляется на ЭКГ сокращением интервалов Р — Q, Q — Т и особенно Т — Р, т. е. уменьшением продолжительности диастолического периода. У кур тахикардия сопровождается исчезновением интервала — Р в пределах регистрируемости обычным электрокардиографом. Нежелательные последствия тахикардии вытекают из недостаточности времени для восстановления энергетического потенциала сердечной мышцы. Тахикардия не представляет собой какую-то самостоятельную болезнь, она сопровождает лихорадочную реакцию, возникает как компенсаторная реакция при пороках сердца, анемиях, гипоксемиях разного происхождения. Может быть следствием висцеровисцеральных рефлексов при патологии почек, печени, кишечника, других органов и систем. Пароксизмальная тахикардия характерна внезапным приступом резкого повышения числа сердечных сокращений до 150—220 в минуту. Патологическая импульсация исходит из эктопического очага с высокой частотой самовозбуждения, сопровождающегося сокращением сердечной мышцы. Диастола значительно укорочена, ресинтез макроэргических соединений сведен к минимуму, быстро истощаются энергетические ресурсы ми-окарда. Отсутствие времени для достаточного наполнения полостей сердца резко снижает ударный и минутный объемы даже при чрезмерно выраженной тахикардии. Развивается артериальная гипотензия. Приступы пароксизмальной тахикардии продолжаются от нескольких секунд до нескольких часов. Пароксизмальную тахикардию наблюдают в первые дни инфаркта миокарда, при раздражении симпатических центров, регулирующих сердечную деятельность, тяжелых интоксикациях. Синусовая брадикардия характерна урежением сердечного ритма относительно физиологической нормы для животных определенного вида, возраста, пола, физиологического состояния. Она возникает от повышения парасимпатического влияния на сердце или ослабления симпатической иннервации при сохраняющейся импульсации, исходящей из синоаурикулярного зла. На сам узел способны оказывать ингибирующее влияние ме-ханические повреждения, инфаркты, гипотиреоз, токсигены различного происхождения, в том числе избыточное количество метаболитов. Сравнительно редкий сердечный ритм проявляется на ЭКГ уширением интервалов Р — Q, Q — Т, Т — Р. Брадикардия свидетельствует об истощении функциональных возможностей сердечной мышцы, ее угнетении. Синусовая аритмия характеризуется учащением сердечной деятельности во время вдоха и замедлением в период выдоха. Повышение физической нагрузки, особенно у собак, снимает такую аритмию. Связь с актами вдоха и выдоха дала повод назвать синусовую аритмию дыхательной. Синусовая аритмия может быть и не дыхательного генеза при изменениях чувствительности сердца к холинергическим и адренергическим влияниям, при на-коплении в организме метаболитов (остаточный азот, желчные кислоты); значительных колебаниях в крови кислорода и углекислоты, под непосредственным воздействием физических и механических факторов (опухоли, кровоизлияния, травмы). Аритмии сердца, возникающие при нарушении возбудимости, носят название экстрасистолий. Экстрасистолия — внеочередное сокращение всего сердца или его отделов. Она развивается в ответ на возбуждение, исходящее не из номотопного (обычного) водителя ритма, а из гетеротопного очага. Эти очаги могут возникнуть в различных участках проводящей системы. Определяют возбудимость миокарда в обычных физиологических условиях три фактора:
Экстрасистолии возникают при изменении электролитного баланса в клетках, результатом чего является нарушение электрогенеза. Во время диастолы в обычных условиях нарастают процессы деполяризации как в синусовом узле, так и в миокарде, но в миокарде деполяризация не достигает критического уровня, не сопровождается возникновением потенциала действия и сокращением. Экстрасистолии же возникают в условиях существенного изменения метаболизма в миокарде и баланса электролитов. Избыточное поступление Са2+ в клетку и уменьшение там К+ ускоряют нарастание деполяризации, сокращают рефракторный период. Возбудимость миокарда возрастает, создаются благоприятные условия для возникновения потенциала действия вне связи с предыдущим возбуждением, исходящим из синусного узла как водителя ритма. Основные причины появления экстрасистолии следующие:
В зависимости от локализации эктопического очага различают минусовые, предсердные, пограничные, желудочные и политопные экстрасистолы. Если внеочередные сокращения закономерно следуют друг за другом, то говорят об экстрасистолии. Неравномерное чередование обычного сокращения с внеочередным называют аллоритмией. Аллоритмии проявляются бигеминией, если каждое нормальное сокращение чередуется с экстрасистоличес-ким; тригеминией, если после двух обычных систол регулярно ре-гистрируется внеочередная; квадригеминией, если каждые три систолы чередуются с экстрасистолой. Синусовая экстрасистолия развивается в ответ на возникновение необычного импульса из не функционирующих в норме групп клеток, расположенных в окружении очага номотонного ритма. Минусовая экстрасистола сопровождается внеочередным сокращением всей мышцы сердца, и на ЭКГ регистрируют появление желудочкового комплекса QRST сразу после обычного, без компенсаторной паузы. Предсердная экстрасистолия сопровождается внеочередным сокращением сердца и компенсаторной паузой, более продолжительной, чем обычная диастола. Атриовентрикулярная, или пограничная, экстрасистолия — результата появления очага возбуждения в узле Ашофа—Тавары. Оно ретроградно передается на предсердие и, перемещаясь по атриовентрикулярному пучку, ведет к одновременному возбуждению желудочков. Происходит синхронное сокращение и предсердий, и желудочков. На ЭКГ сразу за обычным желудочковым комплексом следует внеочередной, за которым наступает компенсаторная пауза. Предсердный зубец Р отсутствует. Желудочковая экстрасистолия проявляется дополнительными сокращениями желудочков в ответ на добавочные импульсы, возникающие по ходу атриовентрикулярного пучка. Характер изменений ЭКГ будет зависеть от места возникновения «очередного импульса в пучке Гиса (рис. 24). В любых случах желудочковая экстрасистолия сопровождается компенсаторной паузой, объясняемой тем, что очередной импульс застает желудочки в рефракторной фазе и они не отвечают на раздражение. 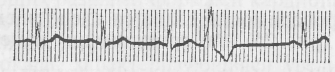 Рис. 24. Электрокардиограмма при желудочковой экстрасистолии Расстройства кровообращения при экстрасистолии сводятся к тому, что при внеочередных сокращениях сердца или его отделов желудочки не успевают наполняться кровью, систола не сопровождается выбрасыванием крови в сосуды, в том числе коронарныe. Мерцательная аритмия (фибрилляция) характерна потерей соподчиненности кардиомиоцитов водителю ритма и взаимосвязи друг с другом. Наступает дискоординация сокращений миокардиальных волокон предсердий и желудочков. Отдельные группы волокон сокращаются в независимом друг от друга ритме после выхода из периода рефракторности. Частота сокращений отдельных мышечных волокон достигает 300—500 в минуту. Причины, вызывающие фибрилляцию сердца, многообразны, мерцательную аритмию вызывает электрический ток, проходящий через область сердца. Фибрилляцией сердца может сопровождаться острый инфаркт миокарда. Ее наблюдают при ревмокардитах, тромбозах и эмболиях коронарных сосудов, отравлениях сердечными гликозидами. Фибрилляцией может быть охвачена вся сердечная мышца либо только предсердия или желудочки. Фибрилляция, охватывающая некоординированными сокращениями предсердия и желудочки при поражении, например, электрическим током, завершается прекращением насосной функции сердца, падением артериального давления. Мерцание предсердий существенно не сказывается на наполняемости желудочковых камер и синхронной сократимости кардиомиоцитов их стенок. Артериальное давление поддерживается на уровне, обеспечивающем сохранение жизни. Мерцание желудочков ведет к потере способности их миокардиальных волокон к координированному сокращению. Выброс крови в малый и большой круги кровообращения прекращается, что несовместимо с жизнью. С целью выведения сердца из состояния фибрилляции в период клинической смерти прибегают к дефибрилляции. Для этого используют источник мощного электрического импульса, подведенного к сердцу. Кратковременный электрический стимул создает условия для восстановления номотопного ритма, сократительной и насосной функции сердца. Аритмии сердца, возникающие при нарушении функции проводимости. Электрические импульсы, зарождающиеся в синусовом узле, по проводящей системе распространяются по предсердиям и желудочкам, вызывая их последовательные сокращения. Скорость проведения импульса и возможность его прохожая зависят от свойств клеток проводящей системы и потенциала действия. Нарушения проводимости, таким образом, возникают как результат структурных изменений в проводящей системе и как следствие расстройств электрофизиологических процессов, происходящих прежде всего в синоаурикулярном узле — водителе ритма. Уменьшение содержания К+ в клетке и замедленное поступление туда Na+сопровождаются снижением скорости проведения возбуждения. На скорость проведения влияют и такие факторы, как стимуляция блуждающих нервов, инактивация ферментов проводящей системы, изменение концентрации внеклеточных и внутриклеточных Са2+, Na+, K+. Прохождение электрических импульсов, зарождающихся в си-ноаурикулярном узле, может быть замедленным или прерванным на разных участках проводящей системы сердца. Полное прекращение проведения возбуждения получило название блокады. Замедление проведения импульсов в сердце называют частичной блокадой. Нарушение проводимости является следствием функциональных расстройств (рис. 25) или органических изменений в сердечной мышце. 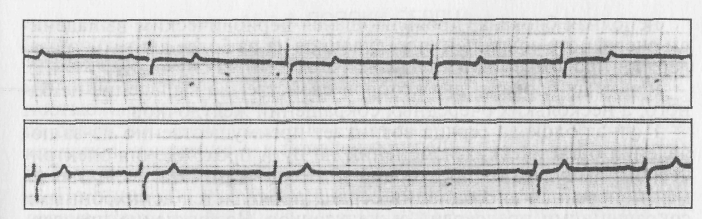 Рис. 25. Электрокардиограмма у свиней в третьем сагиттальном отведении: вверху – ЭКГ здорового животного; внизу – при синоаурикулярной блокаде сердца нейрогенного происхождения Функциональные расстройства возникают в результате резкого повышения тонуса парасимпатического нерва, способного менять проведение импульса. Они наблюдаются при ишемизации и токсическом влиянии на миокард, при заболеваниях инфекционной и паразитарной этиологии. Блокада легко моделируется гиперкалиемией. К факторам органического происхождения, порождающим блокаду сердца, следует отнести инфаркты миокарда, опухоли, хронические воспалительные процессы, кардиосклероз. Препятствия, возникающие на пути проведения электрических импульсов в сердце, имеют разную локализацию. Выделяют синоаурикулярную, внутрипредсердную, атриовентрикулярную и желудочковую блокады. Синоаурикулярная блокада вызвана прерыванием прохождения импульса от синусного узла к предсердиям. Импульс, зарожденный в этом узле, не доходит до мышц предсердий и не распространяется по нижележащим путям, поэтому полностью выпадают очередные сокращения предсердий и желудочков. На ЭКГ это проявляется отсутствием полного сердечного цикла (PQRST). Нерегулярность сердечных сокращений сказывается на характере кровотока, с выпадением очередной пульсовой волны. Внутрипредсердная блокада может быть обусловлена замедлением прохождения импульсов от синусового узла к предсердиям. На ЭКГ выявляется по уширению, изменению конфигурации и вольтажа зубца Р. Атриовентрикулярная блокада может быть неполной или полной. При неполной, частичной блокаде замедляется проведение электрического импульса из предсердий к желудочкам. Это наиболее часто регистрируемая форма аритмий, возникающих у животных, страдающих разными формами кардиопатий. Рассматривают три разновидности неполной блокады в зависимости от степени повреждения:
Полная блокада сердца возникает преимущественно из-за появления органических изменений на пути прохождения электрического импульса от предсердий к желудочкам. Эта так называемая поперечная диссоциация сердца проявляется асинхронными сокращениями предсердий и желудочков. Возбуждение предсердий определяется импульсами, исходящими из синусового узла, а сокращение желудочков — за счет самовозбуждения, исходящего из гетеротропных очагов их проводящей системы. На два сокращения предсердий может приходиться только одно сокращение желудочков. Сокращения предсердий и желудочков могут совпадать, кровь из предсердий в этих случаях ретроградно направляется в вены, вызывая застойные явления; желудочки же, не наполненные кровью, сокращаются вхолостую. Поперечная диссоциация сердца резко нарушает кровообращение, ведет к его недостаточности. Внутрижелудочковая блокада развивается как следствие возникновения препятствий при прохождении волны возбуждения по одной из ножек пучка Гиса. Развивается продольная диссоциация сердца, отличающаяся дискоординацией сокращений правого и левого желудочков. Такая блокада никогда не бывает полной, электрический импульс, зарождающийся в синусовом узле, перемещается по проводящим путям к желудочку с неповрежденной ножкой пучка Гиса, а затем уже окружным путем стимулирует сокращение желудочка с патологически измененной проводящей системой. Некоординированные сокращения правого и левого желудочков сопровождаются значительными расстройствами гемодинамики в системе малого и большого кругов кровообращения. Аритмия сердца, возникающая при нарушении функции сократимости. Нарушение функции сократимости сердца сопровождается появлением альтернирующего пульса (pulsus alternans). Для данной патологии характерно чередование малых и больших пульсовых волн (рис. 26), отражающих нормальные и ослабленные сердечные сокращения. Является следствием миокардитов, тяжелой интоксикации, перенапряжения, переутомления сердечной мышцы. 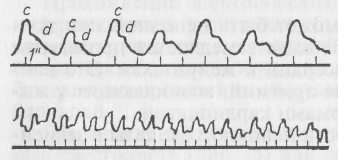 Рис. 26. Альтернирующий пульс: вверху – схема; внизу – натуральная сфигмограмма (по Домрачеву) 15.1.5. ПОРОКИ СЕРДЦА Под пороками сердца (vicia cordis) понимают органические изменения в его клапанном аппарате. Характеризуются недостаточностью клапанов (insufficientia) или сужением (stenosis) клапанного отверстия. Недостаточность сводится к неполному закрытию клапанов, а сужение — к появлению препятствий для нормального тока крови через отверстия клапанного аппарата. По этиологии различают врожденные и приобретенные пороки. Насчитывают более 200 врожденных аномалий развития сердца. Они имеют видовую специфику. Так, особенностью кардиопатий у крупного рогатого скота являются врожденные пороки трехстворчатого клапана. У собак, кошек врожденные пороки составляют 2,4% общего количества сердечно-сосудистых заболеваний. Из собак 30 % приходится на незаращение боталлова протока, 20% - на стеноз устья легочной артерии, 15 % — на стеноз устья аорты. 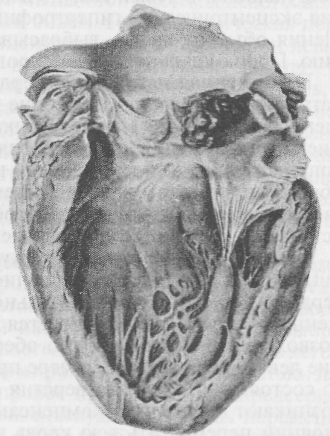 Рис. 27. Бородавчатый эндокардит аортального клапана Приобретенные пороки. Появляются у животных после рождения. К заболеваниям, которые осложняются пороками сердца, относят ревмокардит, атеросклероз, бруцеллез, эндокардиты бактериальной природы. Например, у свиней, заболевших рожей, нередко отмечают развитие бородавчатого эндокардита, приводящего к расстройствам гемодинамики из-за поражения клапанного аппарата (рис. 27). Помимо того, что микроорганизмы, поселяясь на эндокарде, вызывают воспалительный процесс, они могут продуктами жизнедеятельности сенсибилизировать организм и делать эндокард чувствительным к повторным по-паданиям антигена, особенно стрептококкового происхождения. В этом случае преобладает аллергический компонент воспаления эндокарда, что имеет место, в частности, при ревматизме. Эндокардиты завершается отложениями фибрина на створках клапанов, его организацией, рубцеванием, деформацией клапанного аппарата и фиброзных колец, формирующих клапанные отверстия. Кроме эндокардитов развитие пороков сердца может быть результатом склеротических процессов в стенке аорты, патологии папиллярных мышц, дилатации полостей сердца, когда клапаны не в состоянии полностью закрыть расширенное отверстие. Приобретенные пороки чаще возникают в левой половине сердца, функциональная нагрузка которой наибольшая, реже — в правой, имеющей во время систолы в 2,5—3 раза меньшее мышечное напряжение. Поражен может быть один клапан (изолированный порок) или несколько (сочетанный порок). Многообразие структурных изменений, порождаемых патологией эндокарда, приводит к формированию преимущественно сложных, комбинированных пороков, сочетающих недостаточность клапанов и сужение отверстий. Для лучшего понимания расстройств гемодинамики, сопровождающих поражение клапанного аппарата, рассматривают восемь простых пороков сердца. Недостаточность двустворчатого клапана (insufficientia valvulae mitralis). Встречается наиболее часто. Во время систолы кровь направляется в аорту и через неплотно закрытый клапан ретроградно в левое предсердие. Левое предсердие переполняется, давление в нем повышается, усиливается мышечное напряжение. Развиваются расширение (дилатация) предсердной полости и гипертрофия мышечной стенки. Компенсаторно возрастает объем крови, поступающей в левый желудочек. Это создает условия для развития эксцентрической гипертрофии, сохранения обычного соотношения объемов крови, выбрасываемой в аорту и легочную артерию. Порок клапана компенсирован. Повышенная нагрузка на сердце, прогрессирование пролиферативных процессов, растяжение клапанного кольца, сопутствующего дилатации левого желудочка, сопровождаются декомпенсацией порока. Удлиняется продолжительность систолы желудочка, сопровождающаяся гипотензией в системе большого круга кровообращения, гипертонией в системе легочной артерии, венозным застоем в малом круге кровообращения. Правый желудочек, встречая повышенное сопротивление, гипертрофируется. Сужение левого атриовентрикулярного отверстия (stenosis ostii mitralis). Ведет за собой скопление излишней крови в левом предсердии. Требуется дополнительное усилие для преодоления суженного отверстия. Развивается эксцентрическая гипертрофия, позволяющая первоначально обеспечивать нормальное наполнение левого желудочка. По мере прогрессирования патологического состояния (просвет отверстия может быть сужен почти вдвое) возникают признаки декомпенсации порока. Предсердие не в состоянии переместить всю кровь в желудочек, оно растягивается, его стенка истончается (миогенная дилатация). В желудочек поступает все меньше крови, ударный объем уменьшается. Развивающийся застой в малом круге кровообращения приводит к компенсаторному спазму легочных артерий, гипертрофии правого желудочка. Недостаточность клапанов аорты (insufficientia valvulae aortae). Проявляется тем, что левый желудочек наполняется кровью не только из предсердия, но и кровью, возвращающейся из аорты вследствие неполного смыкания створок полулунных клапанов при каждой диастоле. В полости желудочка оказывается крови больше, чем обычно. Полость увеличена, мышечная система усиливает сократительную способность. В начальной стадии развития порока его компенсация обеспечивается эксцентрической гипертрофией левого желудочка. Выброс очередной порции крови в аорту увеличен, и хотя часть ее ретроградно возвращается, кровообращение обеспечивает потребности организма. Декомпенсация наступает тогда, когда полость желудочка все более увеличивается, а мышца не справляется с нагрузкой и истончается (миогенная дилатация). Переполнение кровью левого желудочка и затруднения в ее изгнании влекут за собой относительную недостаточность кровообращения в легких. Характерным для этого порока является высокий, скачущий пульс (pulsus celer et alms). Существенно повышенное систолическое давление сменяется низким диастолическим. Стеноз аортального отверстия (stenosis ostii aortae). Создает препятствие для нормального поступления крови в аорту. Необходимо дополнительное напряжение мышечной системы левого желудочка, чтобы обеспечить ударный объем. Гемодинамическая перегрузка определяет развитие концентрической гипертрофии левого желудочка. Во время систолы вся кровь поступает в аорту. По мере развития стеноза в полости появляется остаточная кровь, ее количество постепенно возрастает. Несмотря на то, что компенсаторные возможности левого желудочка велики, прогрессирование стеноза ведет к декомпенсации порока. Развивается миогенная дилатация, полость увеличивается, мышца истончается. Снижается артериальное давление, нарушается кровообращение в венечных артериях. Ишемизация сердечной мышцы усугубляет тяжесть заболевания. Недостаточность правого атриовентрикулярного клапана (insufficientia valvulae tricuspidalis). Врожденный порок сердца, нередко встречающийся у крупного рогатого скота. Расстройство кровообращения, свойственное данной патологии, определяется выбросом крови во время систолы правого желудочка не только в легочную артерию, но и через деформированный, не полностью захлопнувшийся клапан назад, в правое предсердие. Из предсердия ретроградно выброшенная правым желудочком кровь перемещается по полым венам и создает легко определяемый визуально в яремном желобе положительный венозный пульс, синхронный с артериальным. Компенсируется порок за счет слабо выраженной эксцентричной гипертрофии правого предсердия и правого желудочка. При декомпенсации развивается застой в системе большого круга кровообращения. Неблагоприятные последствия прогрессирующего застоя проявляются в циррозе печени, катаральном воспалении кишечника, снижении диуреза, отеках нижних частей тела: подгрудка, живота, конечностей. Застой в системе большого круга кровообращения негативно сказывается на функциональной активности центральной нервной системы. Стеноз правого атриовентрикулярного отверстия (stenosis ostii atrioventriculares dextri). Создает препятствие для нормального тока крови из правого предсердия в желудочек. В начале развития порок компенсируется слабой гипертрофией правого предсердия, но из-за его ограниченной возможности быстро появляются признаки декомпенсации — застойные явления в системе большого круга кровообращения, одышка, цианоз слизистых оболочек, отеки. Недостаточность клапанов легочной артерии (insufficientia valvulae arteriae pulmonalis). Приводит к тому, что во время диастолы в правый желудочек поступает кровь из легочной артерии через неплотно сомкнувшиеся створки полулунных клапанов и из предсердия. Компенсация изначально происходит за счет эксцентричной гипертрофии правого желудочка. В последующем развивается миогенная дилатация, стенка желудочка истончается, возникают застойные явления в системе большого круга кровообращения, нарушается гемодинамика в легких. Стеноз отверстия легочной артерии (stenosis ostii arteriae pulmonalis). Затрудняет перемещение крови из правого желудочка в легочные сосуды. Порок встречается сравнительно редко. Компенсируется концентрической гипертрофией мышц правого желудочка. По мере прогрессирования сужения клапанного кольца в полости желудочка при каждой систоле остается все больше крови, не попавшей в сосуды легких. Полость увеличивается, стенка истончается. Возникают застойные явления в системе большого круга кровообращения. Недостаточное кровоснабжение легких проявляется сильно выраженной одышкой, цианозом слизистых оболочек. Врожденные пороки. Незаращение боталлова протока. У развивающегося плода между легочной артерией и аортой в ее нисходящей части находится так называемый боталлов проток, через который проходит кровь, минуя нефункционирующие легкие. После рождения этот проток спадается и в течение нескольких дней облитерируется. Незаращение боталлова протока приводит к смешиванию артериальной и венозной крови. У больных животных наблюдают резкую гипоксию, цианоз, одышку, асцит. Страдают преимущественно собаки (овчарки, пудели, колли). Без хирургического вмешательства животные обречены на гибель, хотя жить они могут даже до трех лет. Дефект межжелудочковой перегородки. Его возникновение зависит от отставания в развитии анатомических структур, формирующих перегородку во время эмбрионального развития. Кровоток через межжелудочковые отверстия направляется из левого желудочка в правый. Гипоксия и цианоз не возникают. Сильно выраженный дефект компенсируется гипертрофией правого желудочка сердца. Дефект межпредсердной перегородки. Кровь из левого предсердия поступает в правое сквозь незакрывшееся овальное отверстие. Компенсируется порок гипертрофией правого желудочка, сопровождается расширением ствола и ветвей легочной артерии. Гипоксия и цианоз при этом пороке не бывают. 15.2. НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ СОСУДИСТОГО ПРОИСХОЖДЕНИЯ Нарушения кровообращения зависят не только от деятельности сердца, но и от системы кровеносных сосудов. Важнейшим показателем состояния кровообращения, поддерживающего адекватное потребностям организма снабжение органов и тканей кровью является уровень артериального давления. Он зависит от ударного и минутного выбросов сердца, массы циркулирующей крови, тонуса кровеносных сосудов. Таким образом, уровень артериального давления — суммарный показатель, отражающий состояние сердечно-сосудистой системы животного организма. Эта физиологическая константа обеспечивается взаимодействием регулирующих механизмов. Колебания артериального давления могут быть в сторону повышения или понижения. Повышение давления в кровеносных сосудах носит название гипертензии (от греч. huper — сверх, лат. tensio — напряжение), снижение — гипотензии. Повышение или снижение давления в артериальных сосудах часто является результатом влияния обычных физиологических раздражителей (бег, половая охота, нервное возбуждение, гипертермия). В таких случаях говорят о гипер- или гипотензивных реакциях, которые исчезают по мере прекращения действия на организм адекватного раздражителя. Гипертензией и гипотензией принято обозначать соответствующие состояния изменения артериального давления, вызванные патогенными факторами. 15.2.1. АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ Артериальная гипертензия (АГ) — стойкое повышение артериального давления (систолического и диастолического) по отношению к условной норме для животных каждого вида. Выделяют симптоматические артериальные гипертензии и отличную от них гипертоническую болезнь. Симптоматические артериальные гипертензии. Симптоматическое, или вторичное, повышение артериального давления сопровождает основное заболевание — преимущественно поражение какого-либо органа. Важный патогенетический признак, зачастую определяющий клиническое проявление основного заболевания. К наиболее часто встречающимся вторичным артериальным гипертензиям относят почечную, эндокринную и нейрогенную. Почечную гипертензию наблюдают при многих заболеваниях почек, особенно протекающих хронически. Еще в 1934г. Гольдблатт в опытах на животных показал, что частичное сужение просвета почечных артерий сопровождается хронической артериальной гипертензией. В условиях спонтанной патологии ишемизация почки — следствие острого или хронического гломерулонефрита, компрессии почечных артерий извне опухолью, рубцовой тканью, уменьшения просвета склерозированных сосудов, образования тромбов, попадания эмболов. Во всех случаях снижения кровотока в артериях почечных клубочков повышаются синтез и поступление в кровь ренина, вырабатываемого клетками юкстагломерулярного аппарата. Сам по себе ренин не влияет на уровень артериального давления. Он вступает в реакцию с белком плазмы крови альфа-2-глобулином—гипертензиногеном, синтезируемым гепатоцитами. Взаимодействие ренина с гипертензиногеном завершается образованием ангиотензина I, не влияющего на тонус сосудов. Ангиотензин I расщепляется превращающим фактором плазмы, в результате освобождается мощный прессорный фактор — ангиотензин II. Этот процесс взаимодействия происходит в плазме крови, в интерстиции почек, легочной ткани. Ангиотензин II повышает уровень артериального давления, стимулируя сокращение гладких мышц стенок артериол, потенциирует их чувствительность к вазопрессорным веществам. Ангиотензин II в процессе метаболизма трансформируется в ангиотензин III, который, в свою очередь, способствует дальнейшему развитию гипертензии, стимулируя сердечную деятельность. Развивающаяся компенсаторная реакция со стороны ишемизи-рованной почки приводит к общему подъему артериального давления и соответственно к улучшению кровоснабжения самой почки. Такая реакция со стороны волюморецепторов юкстагломерулярного аппарата может быть расценена как защитно-приспособительная при ишемии, связанной с кровопотерей. Повышенный же выброс ренина, обусловленный уменьшением просвета почечных артерий разной этиологии, приведет к длительной гипертензии со всеми неблагоприятными последствиями. Гипертензия почечного происхождения возможна не только за счет повышения синтеза ренина ишемизированным органом, но и из-за недостаточного поступления в кровь антипрессорных вазоактивных веществ, таких, как простагландины А и Е, кинины — каллидин, брадикинин. Почечные простагландины, синтезируемые в клетках мозгового вещества, в обычных физиологических условиях препятствуют прессорному эффекту катехоламинов. Угнетение инкреторной гипотензивной функции почек способствует развитию симптоматической артериальной гипертензии. Эндокринные артериальные гипертензии обязаны своему появлению патологии желез внутренней секреции, влияющих на тонус кровеносных сосудов и объем циркулирующей крови. Гипоталамо-гипофизарная система, секретируя в кровь антидиуретический гормон (АДГ) вазопрессин, участвует в регуляции артериального давления. Повышение синтеза АДГ нейронами гипоталамуса, избыточное накопление его в задней доле гипофиза и поступление в кровь сопровождаются гиперволемией — увеличением объема циркулирующей крови за счет усиленной реабсорбции жидкости из системы извитых канальцев почек. Кроме того, вазопрессин, выбрасываемый в необычно больших количествах, вызывает мощный сосудосуживающий эффект и стойкое, длительное повышение артериального давления. Артериальную гипертензию наблюдают при расстройствах функции надпочечников, сопровождающихся повышенной секрецией минералокортикоидов (альдостерон), синтезируемых в корковом слое надпочечников, и катехоламинов (адреналин, норадреналин, дофамин), вырабатываемых в мозговом веществе. Увеличение в крови концентрации основного минералокортикоида — альдостерона сопровождается артериальной гипертензией, которая обязана повышенной реабсорбции натрия в извитых канальцах почек. Гипернатриемия влечет за собой гиперосмию, возрастание объема циркулирующей крови и соответственно гипертензию. Кроме того, альдостерон потенциирует чувствительность сосудов и сердца к адреналину и норадреналину. Гиперпродукция катехоламинов чаще всего следствие гиперплазии мозгового вещества надпочечников. Адреналин обладает выраженным сосудосуживающим эффектом благодаря непосредственному влиянию на гладкомышечный аппарат сосудистой стенки. Он стимулирует сердечную деятельность; возрастают ударный и минутный объемы. Катехоламины, вызывая спазм почечных сосудов и ишемизацию почек, провоцируют ответную реакцию. Почки начинают продуцировать в повышенных количествах ренин, запускающий каскад реакций, направленных на повышение уровня артериального давления. Причиной артериальной гипертензии эндокринного происхождения становится и тиреотоксикоз. Гиперпродукцию тироксина, трийодтиронина наблюдают при гиперплазии или опухолевом росте щитовидной железы. Гормоны железы обладают кардиотоническим эффектом, вызывают выраженную тахикардию с возрастанием минутного объема выбрасываемой крови. Развивается гипертензия гиперкинетического происхождения. Гипертензии нейрогенного происхождения возникают либо в результате первичного перевозбуждения кардиовазомоторного центра, либо рефлекторно как результат раздражений рецепторных (болевых) зон при патологии различных органов и систем. Первичное возбуждение сосудодвигательного центра чаще всего обусловлено неврозом — функциональным нарушением высшей нервной деятельности животных под влиянием отрицательных скоротечных (предстартовое состояние у лошади) или длительно протекающих стрессовых воздействий (техногенный стресс). Невротические состояния сопровождаются возбуждением кардиовазомоторного центра и симпатических образований гипоталамуса с избыточным выбросом адреналина и норадреналина. Увеличенный минутный объем крови и повышение тонуса гладкомышечного аппарата артерий стимулируют повышение артериального давления. Этому способствует одновременная активизация подкорковых образований с вовлечением в реакцию гипоталамо-гипофиз-надпочечниковой системы и дополнительного выброса в кровь катехоламинов, минерале- и глюкокортикоидов. Рефлексогенные артериальные гипертензии обязаны чрезмерному раздражению рефлексогенных зон и нервных стволов (каузалгия), передачей патологического импульса в кардиовазомоторный центр и появлением эффекторной импульсации, вовлекающей в ответную реакцию сердце, кровеносные сосуды, эндокринные железы. Неоднократное сочетание рефлекторной гипертензии с индифферентным раздражителем (голос, звук, свет, обстановка и др.) может сопровождаться условнорефлекторным повышением артериального давления. Гипертоническая болезнь. Самостоятельное заболевание, характеризующееся длительным, стойким повышением артериального давления, которое является ведущим признаком. Основной фактор, вызывающий гипертоническую болезнь, по мнению большинства ученых, — психоэмоциональное перенапряжение процессов высшей нервной деятельности, длительно действующие отрицательные раздражители. Стрессы психогенной направленности наблюдают у животных, содержащихся в помещениях с акустическим фоном 65— 100дБА, при перегруппировках, превышении оптимального числа животных в стаде, группе, других неблагоприятных условиях. В развитии гипертонической болезни выделяют три стадии:
В опытах на животных (собаки, обезьяны) была показана принципиальная возможность моделирования гипертонической болезни путем создания тяжелых невротических расстройств. Использование столкновения наиболее сильных врожденных рефлексов — полового и оборонительного приводило к невротическим состояниям со стойкими соматическими нарушениями в виде стабильного повышения артериального давления. В этих и других опытах было установлено, что сердечно-сосудистая патология, гипертоническая болезнь как ее изначальное проявление — наиболее частое соматическое проявление неврозов. Предложено несколько гипотез, объясняющих механизм появления и развития гипертонической болезни. Их сущность сводится к следующему:
По-видимому, не может быть единого представления о генезе гипертонической болезни. В каждом отдельном случае инициальный механизм развития артериальной гипертензии будет иметь свои особенности. Вместе с тем установлено, что стабилизация высокого уровня артериального давления определяется вовлеченностью многих компонентов, регулирующих гомеостаз: стимуляцией симпатоадреналовой системы, повышением сердечного выброса крови, ответным возрастанием тонуса гладкомышечного аппарата артериол, снижением уровня питания стенок сосудов, их склерозированием. Атеросклероз. Под атеросклерозом (от греч. athere — кашица, лат. sclerosis — уплотнение) понимают самостоятельное, хроническое заболевание, характеризующееся уплотнением и утолщением стенок артерий, потерей ими эластичности, сужением просвета, сосудистой недостаточностью. Развитие болезни представляет собой сложный процесс, складывающийся из имбибиции сосудистой стенки жирами (липидоз), белками, углеводами, разростом соединительной ткани, отложением солей кальция. Поражаются артерии эластического и мышечно-эластического типов. Меняются основные свойства сосудистых стенок — эластичность, гладкость интимы, растяжимость и прочность. Снижение эластичности и растяжимости склерозированных сосудов повышает сопротивляемость их пульсовой волне, увеличивает уровень системного артериального давления. Интима склерозированных сосудов становится шероховатой, что сопровождается появлением вихревых потоков, способствующих разрушению тромбоцитов и внутрисосудистому тромбообразованию. Снижение прочности приводит к спонтанным разрывам артериальных сосудов с последующим кровоизлиянием в окружающую ткань. Возможно возникновение инсультов как результат излияния крови в ткань мозга, механической ишемизации его участков с последующим нарушением функций органов и систем, появлением парезов и параличей или смертельным исходом. Этиологические факторы, определяющие развитие атеросклероза у домашних животных, весьма разнообразны. Дистрофические обызвествления сосудов обнаруживают в участках воспаления, некроза, петрифицированных тромбов. Так, у лошадей атеросклеротические изменения выявляют на фоне артериитов, вызванных кровепаразитарными болезнями или гельминтозами. Спорадические случаи обызвествления средней оболочки артерий могут воз-никать вследствие повышения концентрации кальция и фосфора в крови, например, у собак с почечной недостаточностью, у лошадей при избыточном поступлении в организм витамина D. Склерозирование сосудов у крупного рогатого скота наблюдают при хронических инфекционных болезнях (паратуберкулез), после отравления токсинами растительного происхождения, например 1,2,5-дигидрооксихолекальциферолом или его соединениями. Склерозированию сосудов способствуют метаболические и структурные изменения в их стенках, индуцируемые половой цикличностью и плодоношением. Отмечена положительная корреляция между площадью пораженной аорты и возрастом животных. Наиболее выраженными находят атеросклеротические изменения сосудов у коров старше 5 лет, чаще в сочетании с гепатозом, циррозом печени, хроническими эндометритами. Выявляют разные степени пролиферативно-гиперпластических процессов в артериях мышечного и мышечно-эластического типов с образованием фиброзных бляшек. Наряду с белками и полисахаридами плазмы крови в стенках артерий у животных накапливается преимущественно нейтральный жир с последующим разростом соединительной ткани и выпадением солей кальция. Согласно классической алиментарно-инфильтрационной теории атеросклероза, экспериментально доказанной Н.Н.Аничковым, преобладающее значение в развитии заболевания придается гиперхолестеринемии. По современным представлениям основная роль в генезе атеросклероза принадлежит не только общему количеству циркулирующих в крови липидов, но главным образом преобладанию плазменных липопротеидов низкой плотности над липопротеидами высокой плотности. Липидный компонент липопротеидов низкой и очень низкой плотности представлен холестерином, а у липопротеидов высокой плотности — фосфолипидами. Поставляются в клетку липопротеиды, содержащие холестерин, излишки которого выводятся липопротеидами высокой плотности. Дисбаланс в пользу липопротеидов низкой и очень низкой плотности ведет к задержке липидов клетками и накоплению холестерина, липидозу, образованию атероматозных бляшек на стенке сосудов. К основным патогенетическим факторам, определяющим воз-никновение атеросклероза, следует отнести:
В зависимости от преобладающих поражений сосудов большого и малого кругов кровообращения выделяют атеросклероз сосудов головного мозга, коронарных, почечных, кишечных артерий, атеросклероз аорты. Как уже отмечалось, наиболее часто у животных (коровы) регистрируют атеросклероз аорты, брыжеечных артерий (лошади), венечных артерий (собаки). 15.2.2. АРТЕРИАЛЬНАЯ ГИПОТЕНЗИЯ Под артериальной гипотензией понимают стойкое снижение артериального давления, обусловленное преимущественным падением тонуса сосудов, объема циркулирующей крови или ослаблением сердечной деятельности. Рассматривают физиологическую артериальную гипотензию, не сопровождающуюся симптомами какой-либо болезни, и патологическую. Патологическая может представлять собой первичную нейроциркуляторную гипотензию и наиболее часто вторичную, наблюдаемую при многих инфекционных и других заболеваниях. Первичная гипотензия. Причинами ее считают перенапряжение процессов возбуждения и торможения в коре головного мозга. Преобладает торможение, распространяемое на подкорковые образования, особенно на кардиовазомоторный центр. Ослаблено сосудосуживающее и повышено холинергическое, т. е. вазодилатационное, влияние центра. Таким образом, расширение сосудов приводит к падению давления — развитию нейроциркуляторной артериальной гипотензии первичного происхождения. Вторичная гипотензия. Сопровождает инфекционные заболевания при критических падениях температуры, сердечную недостаточность, вызванную инфарктом, миокардитом, тампонадой, декомпенсированными пороками, анемией, заболеваниями эндокринной (эндемический зоб) и нервной (инсульт) системы. Острое падение артериального давления наблюдают при шоке, коллапсе, коме (см. главу 7). |
