Пат физиология. Учебные пособия для студентов высших учебных заведений
 Скачать 7.09 Mb. Скачать 7.09 Mb.
|
|
Глава 9. ВОСПАЛЕНИЕ Под воспалением (inflammatio, от лат. inflammare — воспаление) следует понимать сложную защитно-приспособительную реакцию организма в ответ на действие вредящего фактора, характеризующуюся наличием функциональных и структурных сосудисто-тканевых изменений. Эта ответная реакция на повреждение отличается тремя основными взаимосвязанными процессами: альтерацией, расстройствами микроциркуляции с экссудацией и эмиграцией, пролиферацией. Воспаление — предмет изучения всех отраслей ветеринарной медицины. 9.1. КРАТКАЯ ИСТОРИЯ УЧЕНИЯ О ВОСПАЛЕНИИ Воспаление издавна привлекало к себе внимание врачей. Его четыре внешних признака (боль, жар, краснота, припухлость) были описаны в трудах римлянина Цельса более 2000 лет назад, а пятый — нарушение функции — добавлен греком Галеном в начале нашей эры. Однако к научному пониманию механизмов воспалительной реакции ученые стали продвигаться благодаря успехам естествознания. Открытие строения органов и тканей, возможность изучения возникающих изменений структуры и функции клеточных образований привели к появлению нутритивной теории воспаления Р. Вирхова (1858 г.). Согласно его воззрениям реакция тканей в ответ на флогогенный агент реализуется в виде повышенной жизнедеятельности клеток, их особого нутритивного раздражения. В клетках появляются необычные включения в виде глыбок, зерен белковой природы, наличие которых автор объяснял притяжением (аттракцией) питательных веществ из крови. Сторонники нутритивной теории полагали, что клеточные изменения первичны, вторичными же называли усиленный приток крови и другие явления. Воспаление рассматривалось исключительно как местный процесс, местная тканевая реакция. Другая концепция, развившаяся в начальный период научной разработки проблемы, принадлежала Конгейму (1878 г.). В основе изменений, возникающих под влиянием воспалительного агента, он видел первичные расстройства крово- и лимфотока. Эта теория воспаления получила название сосудистой. Изменения со стороны сосудов были известны еще до появления этой теории, но Конгейм расширил и углубил существовавшие до него представления о значении сосудов в генезе воспаления. Он выявил совокупность возникающих расстройств микроциркуляции — расширение артериол, капилляров и малых вен, ускорение тока крови с последующими застойными явлениями вплоть до стаза. Особое внимание автор уделял проницаемости стенок кровеносных сосудов и явлению выхода лейкоцитов за их пределы — эмиграции. Таким образом, сторонники сосудистой теории основой патогенеза воспаления считали нарушение кровообращения и повышение проницаемости сосудистой стенки. Эти расстройства первичны, они определяют все последующие явления. Значение нервной системы исключалось наблюдениями, якобы показавшими возможность развития воспаления после перерезки спинного мозга. Однако при этом не учитывалась вазомоторная роль вегетативной нервной системы. Клеточная и сосудистая теории, несмотря на очевидные успехи в изучении патогенеза воспаления, не могли объяснить весь комплекс изменений, сопровождающий альтерацию, сосудистые расстройства, инфильтрацию и пролиферативные процессы. Воспаление все еще рассматривалось как местная реакция, без учета общей реактивности целостного организма. Биологическую, фагоцитарную теорию воспаления создает И.И.Мечников (1892г.). Согласно новой концепции воспаление — это защитная реакция на повреждение, сформировавшаяся в процессе эволюционного совершенствования организма. Лейкоцитоз, фагоцитоз, химиотаксис с точки зрения И. И. Мечникова — основа воспаления и отражают вовлеченность всего организма в защиту от повреждающего, флогогенного фактора, особенно микробиального происхождения. Воспалительные явления зависят от реактивности организма, его иммунобиологических свойств. Биологическая теория научно обосновала взаимосвязь очага воспаления с организмом. Она сблизила воспалительную реакцию с иммунитетом. Была доказана роль воспаления как общей защитной реакции организма, реакции приспособления к меняющимся условиям существования. Углублению понятия о воспалении способствовали исследования Шаде (1923г.), выявившие физико-химические сдвиги в очаге поражения. Это Н-гипертония (тканевой ацидоз), гипериония (увеличение ионной и молекулярной концентрации), гиперонкия (возрастание дисперсности коллоидов). Было установлено, что в центре очага гнойного воспаления кислотность увеличивается в 40—50 раз, что способствует расширению сосудов и понижению поверхностного натяжения лейкоцитов. Гипериония и гиперонкия — важнейшие условия развития воспалительного отека. А.Д.Сперанский (1935г.) изучал роль трофической функции нервной системы в генезе многих заболеваний. Он считал, что воспаление — нервнодистрофический процесс, а очаг поражения представляет собой мощный источник патологической им пульсации с последующими рефлекторными расстройствами микроциркуляции и клеточного метаболизма. Менкин (1940, 1956 гг.), внеся очередной вклад в понятие о воспалении, развивал концепцию о патогенетической роли продуктов нарушенного тканевого обмена и жизнедеятельности микробов, обладающих высокой биологической активностью. Особо важными являются продукты белкового распада, протеиногенных аминов (гистамин), активных белков и ферментов. Им были выделены характерные для воспалительного процесса вещества типа лейкотоксина, обеспечивающего эмиграцию лейкоцитов; термостабильного и термолабильного факторов лейкоцитоза; некрозина, вызывающего некроз тканей и тромбоз сосудов; пирексина, ответственного за появление лихорадки; экссудина, способствующего повышению проницаемости капилляров и экссудации; фактора роста, стимулирующего пролиферацию. Последователи Менкина значительно расширили представления о роли эндогенных факторов в развитии воспаления, углубили учение о медиаторах. Г. Селье (1953 г.) рассматривает воспаление как основной вид реакции организма на стресс. По его представлениям ведущее значение в регуляции воспаления принадлежит системе гипоталамус—гипофиз—надпочечники. Каждая из изложенных и других концепций не может претендовать на полноту представлений о механизмах воспаления. Однако при рассмотрении их в совокупности вырисовывается современное представление о воспалении как об эволюционно выработанной, защитно-приспособительной, многоуровневой реакции организма на повреждающие факторы различного происхождения. 9.2. ЭТИОЛОГИЯ Воспаление сопровождает заболевания, вызываемые самыми различными этиологическими факторами. Их условно можно разделить на экзогенные, действующие из внешней среды, и эндогенные, возникающие в самом организме. К экзогенным причинам следует отнести следующие:
К эндогенным причинам, вызывающим воспаление, относят тромбообразование, некроз тканей, отложение солей в стенках сосудов, образование камней, кровоизлияния, формирование цитотоксических иммунных комплексов и др. Такое разделение несколько условно, так как внутренние причины воспалительной реакции нередко сочетаются с влиянием внешних раздражителей. Так, образование камней в почечных лоханках и мочевом пузыре с последующим воспалением может быть воспроизведено в эксперименте на крысах, норках путем исключения из их рациона витамина А, а недостаток тиамина в корме птиц сопровождается полиневритом. Отрицательный эмоциальный стресс может привести к инфаркту миокарда с последующим воспалением окружающих его тканей. Причина, вызывающая воспаление, может одномоментно воздействовать на ткань, запуская воспалительный процесс, и может действовать на ткань длительно, являясь перманентным источником раздражения. Например, действие высокой температуры может быть весьма кратковременным, но сопровождаться интенсивным воспалительным процессом. Инородное же тело, попавшее в ткани, может оставаться там всю жизнь, вызывая слабую ответную реакцию со стороны окружающих структур. Несмотря на то что воспаление — типичная патологическая реакция организма, по особенностям ее течения могут быть установлены причины. Характерно течение воспаления при отморожении, электротравме, некоторых инфекционных и инвазионных болезнях. В то же время разные по характеру причины могут вызывать однотипные воспалительные процессы. Так, гнойное воспаление у лошадей может быть воспроизведено инъекцией под кожу скипидара или гноеродных бактерий. При попадании в воспаленную ткань микроорганизмов говорят о септическом воспалении, если же оно протекает без участия инфекционного начала, то говорят об асептическом воспалении. От свойств вредящего агента и реактивности самого организма зависят интенсивность и длительность воспалительной реакции. Выраженность и длительность воспаления определяются также во многом специфическими видовыми особенностями реакции животных на один и тот же раздражитель. Разные ткани неоднозначно отвечают на повреждение, что зависит от их анатомо-физиологических характеристик. Попадание инородного тела под кожу сопровождается сравнительно длительной воспалительной реакцией, тогда как его внедрение в слизистую оболочку области носоглотки вызовет бурно протекающее воспаление, опасное для жизни. 9.3. СИМПТОМАТИКА Воспаление характеризуется рядом местных и общих признаков. Внешние, клинически зримые признаки были давно известны врачам как пентада Цельса — Галена. Признаки эти следующие:
Описанные признаки отражают лишь местные изменения в воспаленных тканях. Однако нервные и гуморальные связи определяют взаимодействие целостного организма с очагом поражения. Поэтому наряду с местно проявляющимися признаками существует и общая симптоматика. Нередко воспаление сопровождается лихорадочной реакцией, непременно меняется картина крови, очаг воспаления является источником патологической импульсации, с вовлечением в патологический процесс различных органов и тканей, эндокринной и иммунной систем. 9.4. ПАТОГЕНЕЗ В формировании очага воспаления с момента его возникновения до исхода вне зависимости от причин, локализации, видовых и индивидуальных особенностей организма животного выделяют три основных компонента. Они взаимосвязаны и по мере выраженности определяют характер развивающегося патологического процесса. Развитие воспаления определяется контактом тканей с флогогенным агентом и последующей альтерацией, расстройствами микроциркуляции, возрастанием проницаемости гистогематических барьеров, скоплением в тканях воспалительной жидкости — экссудата, эмиграцией лейкоцитов, ростом молодых клеточных элементов — пролиферацией. Все эти явления взаимозависимы, их трудно разграничить, тем не менее они имеют свои характерные особенности, знание которых помогает лучше понять механизм реализации изучаемой патологии. Альтерация (от лат. alterare — повреждать). Под альтерацией понимают функциональные и структурные изменения в тканях, вызванные флогогенным агентом. Повреждение клеточных элементов крови, тканей, нервных рецепторных образований, не являясь, по существу, компонентом воспаления, служит пусковым, триггерным (от англ, trigger — пусковой крючок), механизмом ответной реакции организма в виде воспалительной реакции. Рассматривают первичную и вторичную альтерацию. Первичная альтерация возникает в рамках гистиона — территории, включающей клетки, ткани, нервные элементы в зоне микроциркуляторного русла, состоящего из артериол, прекапилляров, капилляров, посткапилляров и венул. Она вызывается контактом гистиона с повреждающим фактором — механическим, термическим, химическим, микробиальным и другими, а чаще их сочетанием. В очаге повреждения сразу можно наблюдать мозаичную картину морфологических изменений. Одни клетки подвергнуты полному разрушению — некрозу, другие могут находиться в состоянии некробиоза, третьи — с той или иной формой дистрофии. Нарушаются обменные процессы и функциональная активность клеток, органов, тканей. Меняется возбудимость рецепторов. Их прямое и опосредованное раздражение является источником патологической импульсации, вовлекающей в ответную реакцию регуляторные системы — нервную, эндокринную, иммунную, сердечно-сосудистую. Вторичная альтерация может быть обусловлена продолжающимся действием флогогена (бактериальные и другие токсигены) и факторами первичной альтерации, активными даже после прекращения действия причины. Изначальная травматизация тканей приводит к разрушению мембранных структур клетки и субклеточных образований. Особую значимость в развитии вторичной альтерации приобретают ферменты лизосом. Они определяют аутолиз («самопереваривание») поврежденных клеток, а освободившиеся внеклеточные лизосомальные ферменты продолжают процесс альтерации, деструкции клеток уже вне зависимости от присутствия воспалительного агента. Разрушенные и стимулированные клетки становятся источником поступления в гуморальные среды большого количества биологически активных веществ — медиаторов и модуляторов воспаления. Медиаторы — обычные вещества, регулирующие жизнедеятельность организма, в избытке появляющиеся при альтерации тканей. Они становятся основой причинно-следственных отношений, стимулируя, например, при воспалении повышение проницаемости гистогематических барьеров, за которым следует выход, форменных элементов и белка за пределы сосудов. Эмигрировавшие микро- и макрофаги приступают к фагоцитозу и элиминации возбудителя. В динамике воспаления концентрация одних медиаторов уменьшается, других — возрастает. Таким образом, медиаторы обнаруживают признаки модуляторов, усиливая или снижая проявления воспалительного процесса. Медиаторы воспаления в зависимости от происхождения делят на две группы. Вещества, синтезируемые клетками, названы клеточными медиаторами, а образующиеся в межклеточной среде, лимфе, плазме крови — гуморальными. С усовершенствованием методик и углублением представлений о биохимических трансформациях, происходящих в альтерированных тканях, становится известным все большее число соединений, обладающих свойствами медиаторов (модуляторов) воспаления. В качестве примера отметим наиболее значимые из них. Клеточные медиаторы воспаления:
Жидкие среды организма (кровь, лимфа, тканевая жидкость) также активно участвуют в реализации воспалительного процесса. Наиболее значимыми медиаторами гуморального происхождения являются:
Экссудация, эмиграция, диапедез. Альтерация сразу же приводит к расстройству лимфо- и кровообращения в очаге воспаления, на территории гистеона. Первоначальным этапом запуска ответных реакций организма на повреждение является медиаторная реакция из двух взаимодополняющих звеньев: нейро- и липидомедиаторного. Выявлено, что уже в первые секунды после альтерирующего влияния флогогена сенсорные нервные волокна, участвующие в ноцицепции (от лат. посео — повреждаю, receptivus — восприимчивый), выделяют особые сенсорные нейропептиды: субстанцию Р, пептид гена, родственного кальцитонину, и пептид протеинового гена. Выделенные вещества обладают мощным сосудорасширяющим эффектом. Вазодилатация усиливается благодаря синергическому влиянию второго медиаторного звена. Вслед за нейрон медиаторами в следующие минуты после повреждения основную роль в развитии воспаления берут на себя липидные медиаторы, образованные из липидов мембран поврежденных клеток. Путем биохимических превращений из содержащейся там арахидоновой кислоты образуются простагландины, простациклины, тромбоксаны, лейкотриены, перекиси и гидроперекиси жирных кислот. Простагландины выступают как синергисты таких медиаторов воспаления, как гистамин, брадикинин. Они обладают сосудорасширяющими свойствами, определяя развитие артериальной гиперемии. Усилению вазодилатации способствует повышение концентрации NO-радикалов в очаге воспаления. Со временем артериальная гиперемия переходит в венозную. Это обусловлено механическим препятствием оттоку крови вследствие образования тромбов в венах. Повреждения сосудистой стенки активируют фактор Хагемана, который инициирует систему свертывания крови. Выход плазмы за пределы сосудов ведет к их сдавливанию; снижается тонус нервно-мышечного аппарата, Увеличивается площадь сечения вен из-за лизирования дермосом. Ток крови замедляется, затем переходит в маятникообразные движения с последующим стазом. Стаз ведет к агрегации эритроцитов, стиранию границ между ними. Наблюдаемый феномен «сладжа» необратим. Экссудация (от лат. exsudo — выпотеваю, выделяю) — выход плазмы крови и форменных элементов за пределы кровеносных сосудов. Жидкость, выходящая за пределы сосудов, носит название экссудата, который отличается сравнительно высоким содержанием белка (до 5 %), обилием ферментов, форменных элементов крови, интерлейкинов, продуктов распада тканей. При септическом воспалении экссудат содержит микроорганизмы. В числе факторов, определяющих экссудацию, первостепенное значение имеет проницаемость сосудов микроциркуляторного русла. Повышают сосудистую проницаемость липидные медиаторы, гистамин, брадикинин, фосфолипидный фактор активации тромбоцитов, эндогенные оксиданты — гипохлорит и хлорамин. Разрыв клеточных контактов путем ретракции цитоскелета эндотелиальных клеток, вызываемый эндогенными оксидантами, делает возможным выход плазмы за пределы сосудов, эмиграцию лейкоцитов. Этому способствует гепарин, выделяемый околососудистыми тканевыми базофилами. Экссудация также определяется нарастанием гидростатического давления в венозной части капилляра, повышением осмотического и онкотического давления в межклеточном матриксе, микровезикулярным транспортом. Микропиноцитоз энергозависим, представляется самостоятельным компонентом экссудативного процесса. Интенсивность воспалительной реакции, степень проницаемости гистогематического барьера определяют количественный и качественный состав белков экссудата. При малых повреждениях наблюдается преимущественная экссудация жидкости и низкомолекулярных соединений, усиление повреждения приводит к выходу высокомолекулярных соединений и клеток крови. Сквозь стенку кровеносных сосудов начинают мигрировать лейкоциты, которые передвигаются в направлении фокуса воспалительного очага. Выход лейкоцитов за пределы стенок сосудов носит название эмиграции. Эмиграция начинается с краевого состояния лейкоцитов, когда они замедляют движение вдоль стенки сосудов, а затем останавливаются. Установлено, что при гнойно-воспалительных заболеваниях нейтрофилы еще до поступления в очаг воспаления приходят в состояние гиперактивности. Снижается гранулированность их цитоплазмы, на поверхности появляются филоподиоподобные выросты. Интима сосудов при воспалении выстилается тончайшей пленкой, в состав которой входят фибрин, гликопротеиды, сиаловые кислоты, другие соединения. Это способствует повышенному контакту лейкоцитов с клетками эндотелия сосудов гистеона. Краевому стоянию содействуют электрохимические связи, появление «кальциевых мостиков». Лейкоцит может мигрировать сквозь стенку сосуда либо путем микропиноцитоза эндотелиоцитом, либо преодолевая преграду между двумя округлившимися клетками эндотелия путем образования псевдоподий. Базальную мембрану полиморфноядерные лейкоциты преодолевают, выделяя протеазы гиалуронидазу, эластазу, коллагеназу — ферменты, увеличивающие ее проницаемость. Эмигрировавшие из сосудов лейкоциты начинают амебовидное движение по межклеточному матриксу к предмету взаимодействия — микроорганизмам или поврежденным клеткам (рис. 9). 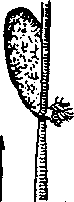  Рис. 9. Эмиграция лейкоцитов при воспалении брыжейки лягушки: 1- краевое стояние лейкоцитов; 2- эмиграция лейкоцитов; 3- эмигрировавшие лейкоциты; 4- эритроциты По наблюдениям, краевое стояние лейкоцитов может продолжаться до 30 мин, переливание сквозь стенку сосуда занимает 20— 40 мин, передвижение по тканевым щелям к конечной цели может длиться часы и сутки. Лейкоциты, противостоящие возбудителям заболеваний, освобождающие организм от собственных, генетически чуждых клеток, их обломков, инородных тел, были названы И. И. Мечниковым (1892г.) фагоцитами (от греч. phagos — пожиратель, kytos — клетка), а способность бороться против чужеродного начала — фагоцитозом. Фагоциты подразделяют на микрофаги и макрофаги. К микрофагам относят гранулоциты (базофилы, эозино-филы, нейтрофилы) и лимфоциты, к макрофагам — моноциты крови, гистиоциты мезенхимальной (соединительной) ткани, альвеолярные, плевральные и перитонеальные макрофаги, свободные и фиксированные макрофаги красного костного мозга, селезенки, лимфоузлов, клетки Купфера в печени, макрофаги синовиальных оболочек суставов, клетки микроглии нервных образований, остеокласты. Процесс фагоцитоза сложный, многоэтапный. Начинается он сближением фагоцита с возбудителем, затем наблюдают «прилипание» микроорганизма к поверхности фагоцитирующей клетки, поглощение с образованием фагосомы, внутриклеточное объединение фагосомы с лизосомой (лизофагосома), переваривание объекта фагоцитоза лизосомальными ферментами и его полную элиминацию (от лат. elimino — выношу за порог, удаляю). Однако не всегда клетки взаимодействуют по подобному сценарию. Вследствие ферментативной недостаточности лизосомальных протеаз фагоцитоз может быть неполным, т. е. микроорганизмы могут сохраняться в фагоците в латентном состоянии. При неблагоприятных для макроорганизма условиях бактерии становятся способными к размножению и, разрушая фагоцитарную клетку, вызывать реинфекцию. При гнойно-септических процессах, острой травме в очаге воспаления накапливаются преимущественно нейтрофилы. Их появление рассматривается как важный фактор борьбы с патогенными возбудителями. Однако в инфицированной ране, где стимулируется метаболическая активность нейтрофилов, их важнейшей функцией, как выяснилось, является не только фагоцитоз микробов, но и разрушение погибших тканевых элементов за счет активной секреции ферментов во внеклеточную среду. Секреция нейтрофилами протеиназ, миелопироксидазы, катионных белков, эластазы, коллагеназы приводит к деградации межклеточного матрикса очага воспаления. Нейтрофилы инициируют каскад реакций воспалительного процесса, выбрасывая и медиаторы, вызывающие хемотаксис макрофагов, активацию системы комплемента, калликреин-кининовой системы, системы свертывания крови. В последующем гистогематический барьер преодолевают моноциты. В очаге воспаления они активизируются и приобретают свойства макрофагов, тканевых фагоцитирующих клеток. Их мембрана становится «липкой», в цитоплазме накапливаются гранулы, наполненные протеазами. Фагоциты усиленно поглощают кислород и генерируют («кислородный взрыв») активные формы кислорода — пероксид водорода (Н2О2), оксид азота (NO), гипохлорит (Сl-), синглетный кислород О-2 и др. Эти высокореактивные соединения обладают выраженной бактерицидностью и широким спектром биологической активности: NO--радикалы регулируют тонус сосудов, ингибируют адгезию гранулоцитов к эндотелию сосудов и агрегацию тромбоцитов; Н2О2 и гипогалоиды важны для микробоцидного действия нейтрофилов; О2 индуцирует, a NO ингибирует пролиферацию лимфоцитов. В условиях повреждения нарушается баланс кислородные метаболиты — антиоксиданты. Возрастает продукция первых, уменьшается активность ферментативных и неферментативных антиоксидантов. Эта диспропорция приводит к активации деструктивных процессов — «окислительному стрессу». При их превалировании стали говорить о «свободнорадикальной» патологии. Кроме того, активированные макрофаги начинают выделять в окружающую среду мощные медиаторы воспаления, среди которых особо активны так называемый фактор некроза опухолей, α-интерферон (Int α) и интерлейкин-8 (ИЛ-8). Фактор некроза опухолей инициирует синтез на мембране эн-дотелиоцитов сосудов специфических «белков прилипания», способствующих адгезии нейтрофилов и моноцитов. Интерлейкин-8 наряду с другими факторами стимулирует нейтрофилы и моноциты к диапедезу и миграции в очаг воспаления. Фагоциты имеют рецепторы к ИЛ-8, воспринимающие изменения его концентрации, и направляют свое движение по оси максимального отличия. Интерлейкин-8 — «многоцелевой» медиатор воспаления с главной функцией — активацией нейтрофилов и аутоактивацией макрофагов. В лизосомах фагоцитов резко усиливается синтез протеаз, стимулируется «кислородный взрыв» с освобождением высокотоксичных для микроорганизмов активированных кислородных метаболитов, увеличивается рецепторное поле поверхности макрофагов, что способствует «прилипанию» бактерии. Фагоцитоз — не единственный механизм защиты, реализуемой в очаге воспаления. При разных формах воспаления увеличивается продукция кининов. Им придают исключительное значение при воспалениях аллергического происхождения. Особо важная защитная роль принадлежит системе комплемента (С). Система комплемента распознает чужеродную клетку и запускает цепную реакцию активации составляющих ее белков (С1 — С9), обладающих энзиматическими свойствами. Фиксируясь на оболочке бактерии, они погружаются в мембрану, полимеризуются в кольцо, образуя поры, «продырявливающие» оболочку бактерии, что ведет ее к гибели. Система комплемента многофункциональна: ее пептиды активируют тучные клетки, выделяющие гистамин, генерируют медиаторы воспаления, усиливают фагоцитоз. При воспалениях септического происхождения в защиту вовлекается иммунная система. Микроорганизмы поглощаются антигенпрезентующими клетками — макрофагами, клетками лимфоузлов, селезенки, эндотелия. Антиген подвергается энзиматическим превращениям, и его фрагменты появляются на внешней мембране фагоцита. Здесь он взаимодействует с белками главного комплекса гистосовместимости и презентуется Т- и В-клеткам. Активированный макрофаг становится источником цитокинов, регулирующих функции иммунокомпетентных клеток и органов. Инициируется образование провоспалительных интерлейкинов (ИЛ) —ИЛ-1, ИЛ-6, ИЛ-8, фактора некроза опухолей. Спустя 2 ч их обнаруживают уже за пределами антигенпрезентующих клеток. Концентрация интерлейкинов достигает максимального уровня через 24—48 ч. Под влиянием провоспалительных интерлейкинов активируются разные типы лейкоцитов, клетки эндотелия, фибробласты, кератиноциты, усиливаются основные функции нейтрофилов, цитотоксичность естественных киллеров, выброс гистамина тучными клетками, синтез простагландинов Е2 кератиноцитами. Интерлейкины активны не только в очаге поражения. Ими (ИЛ-1, ИЛ-6, ФНОα) стимулируется пролиферация Т- и В-лимфоцитов — хелперов. В свою очередь, Т-хелперы начинают выбрасывать последующие серии интерлейкинов (ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5), регулирующих дальнейший ход иммунных преобразований. В конечном итоге В-лимфоциты трансформируются в клоны плазмоцитарных клеток, синтезирующих иммуноглобулины (IgG, IgA, IgM, IgE) — антитела, направленные на нейтрализацию антигенного раздражителя (микробы, генетически чужеродные субстанции). Последующий ход развития воспаления определяется взаимоотношением гематогенных (лимфоциты, тромбоциты, эритроциты) и гистиогенных клеток (эпителий, лаброциты, адвентициальные и эндотелиальные клетки сосудов, фибробласты, ретикулярные клетки), интерлейкинов и факторов роста. |
