Пат физиология. Учебные пособия для студентов высших учебных заведений
 Скачать 7.09 Mb. Скачать 7.09 Mb.
|
|
Гипофункция задней доли гипофиза. Нейрогипофиз содержит два гормона — вазопрессин, или антидиуретический гормон (АДГ), и окситоцин. Оба гормона пептидной природы, синтезируются клетками переднего гипоталамуса, по их аксонам перемещаются в клетки гипофиза, откуда секретируются в кровь. АДГ обеспечивает реабсорбцию воды в системе извитых канальцев. Гормон делает стенку дистального конца канальцев водопроницаемой, вода всасывается в кровь по осмотическому градиенту. Дефицит АДГ затрудняет проницаемость мембран канальцев для воды. Почки начинают выделять первичную, неподверженную концентрации мочу. Развиваются полиурия, несахарный диабет. Из-за большого объема выделяемой мочи это состояние называют мочеизнурением. Симптом несахарного мочеизнурения, вызванный поражением гипоталамо-гипофизарной системы, может наследоваться по рецессивному типу. У собак проявляется резко усиленной жаждой. Они способны потреблять несколько литров воды в сутки, страдают полиурией. Моча низкой относительной плотности—ниже 1,005 вместо обычных 1,02—1,05. Гиперсекреция АДГ сопровождается усилением реабсорбции воды из почек в кровь. У больных животных заболевание проявляется олигурией, гиперволемией, склонностью к появлению отеков и водянок. Снижение секреции окситоцина ослабляет сокращение матки во время родов, ведет к задержанию последа, эндометритам. Гормоны желтого тела (прогестерон) защищают мышцы матки от действия окситоцина во время плодоношения. Недостаточность гормона может сказаться на молокоотдаче. Он вызывает сокращение миоэпителиальных клеток, сдавливающих альвеолы, с последующим выведением молока. При акте сосания окситоцин выделяется рефлекторно, что способствует молоковыделению. 21.2. НАРУШЕНИЯ ФУНКЦИЙ НАДПОЧЕЧНИКОВ Надпочечники представляют собой парный витальный орган, удаление которого несовместимо с жизнью. Надпочечник состоит из коркового и мозгового веществ. Корковый слой надпочечников продуцирует в своей пучковой зоне (zona fasciculata) глюкокортикоиды, в клубочковой (zona glomerulosa) — минерало-кортикоиды, в сетчатой (zona reticularis) — мужские (андрогены) и женские (эстрогены) половые гормоны. Мозговой слой надпочечников секретирует в кровь катехоламины — адреналин, нор-адреналин и дофамин. Гормоны надпочечникjв обладают широким спектром действия. Они влияют на обменные процессы, регуляцию функций организма в естественной среде существования животных, адаптацию к меняющимся условиям этой среды и при воздействии на организм неадекватных патогенных факторов. Гиперфункция коркового вещества надпочечников может быть результатом:
Гиперкортицизм сопровождается избыточным выбросом в кровь глюкокортикоида кортизола, минералокортикоида альдостерона, андрогенов или эстрогенов. Повышенная секреция кортизола приводит к развитию так называемого синдрома гиперкортизолизма. В организме больного нарушается обмен углеводов, глюкозы, белков, водно-солевой обмен. Под влиянием глюкокортикоидов активируется гликонеогенез из гликогенных аминокислот, в печени нарастает содержание гликогена, повышается активность глюкозо-6-фосфатазы, развивается стойкая гипергликемия (стероидный диабет). Одним из характерных признаков синдрома является изменение отложения липидов в различных частях тела, обусловленное гипергликемией, активирующей синтез триглицеридов и ингибирующей катаболизм в жировой ткани. Кроме того, возрастание содержания гликогена в печени тормозит окисление гепатоцитами жирных кислот. Нарушения белкового обмена проявляются отрицательным азотистым, балансом, свидетельствующим о преобладании катаболических, процессов над анаболическими. Интенсификация деструктуризации белков сопровождается дистрофическими процессами в мышцах, суставах, костной ткани. Развивающийся остеопороз способствует спонтанным переломам костей. Усилен распад нуклеопро-теидов в лимфоидной ткани, развиваются лимфоцитопения и эозинопения. Угнетается антителогенез, подавляется фагоцитарная активность. Снижается резистентность к возбудителям инфекционных заболеваний. Нарушение водно-солевого обмена обязано более интенсивному процессу реабсорбции натрия в системе извитых канальцев почек и снижению обратного всасывания ионов калия. Развивающаяся гиперволемия приводит к гипертензии, возникновению которой способствует и сенсибилизация сосудистой стенки к адреналину и норадреналину. Повышенная секреция минералокортикоидов клетками клубочковой зоны надпочечников — гиперальдостеронизм — сопровождается нарушениями обмена ионов натрия и калия. Избыточное влияние альдостерона на канальцевый аппарат почек приводит к задержке натрия и воды в организме. Калий же реабсорбируется и выводится с мочой. Эпителиальные клетки извитых канальцев подвергаются дистрофическим изменениям, они теряют способность реагировать на антидиуретический гормон. Развивается полиурия. Накопление натрия в клетках сосудистых стенок делает их более чувствительными к катехоламинам — адреналину и норадреналину. Повышается тонус сосудов, возникает артериальная гипертония. Избыточное выведение ионов калия и хлора под влиянием альдостерона становится причиной мышечной слабости, парезов, параличей, снижения сократительной функции сердечной мышцы. Наблюдается гипокалиемический алкалоз. секреция андрогенов и эстрогенов клетками сетчатой зоны коры надпочечников проявляется андрогенитальными (кортикогенитальными) синдромами. Встречаются две основные их разновидности:
Излишнее влияние андрогенов на женский организм может возникнуть в период внутриутробного развития, тогда у новорожденных проявляются признаки женского псевдогермафродитизма. Избыток кортикальных андрогенов у взрослых особей женского пола приводит к маскулинизации. Преобладание синтеза эстрогенов над андрогенами у мужских особей сопровождается феминизацией — исчезновением вторичных половых признаков. Избыточное образование кортикоидных андрогенов у мужских особей приводит к раннему половому созреванию, аналогично реагируют женские индивиды на повышенное выделение надпочечниками эстрогенов. Гиперфункция мозгового вещества надпочечников сопровождается усилением продукции и выделения в кровь адреналина и; норадреналина. Их избыток стимулирует деятельность сердца, вызывает спазм сосудов и гипертензию, появляется гипергликемия. Повышенный выброс катехоламинов может быть следствием опухоли мозгового вещества надпочечника (феохромоцитома), болевых ощущений, физического перенапряжения, психогенных и иных факторов. Гипофункция мозгового вещества надпочечников снижает концентрацию катехоламинов в крови, что проявляется брадикардией, гипотензией, миастенией, снижением общей возбудимости. 21.3. СТРЕСС И ОБЩИЙ АДАПТАЦИОННЫЙ СИНДРОМ Эндокринные железы активно участвуют в ответной реакции организма на адекватные и неадекватные (болезнетворные) раздражители. Особо важное значение в этой реакции имеет гипота-ламо-гипофизарно-надпочечниковая система. Изучению роли гормонов в адаптации организма к действию вредоносных факторов посвятил свои исследования известный ученый Ганс Селье (Н. Selye). В 1936г. он впервые изложил свою концепцию о стрессе. Под понятием «стресс» (от англ, stress — напряжение) подразумевают неспецифическую реакцию организма, развивающуюся под воздействием самых разных причинных факторов. К ним могут быть отнесены инфекции, хирургические травмы, ожоги, эмоциональное возбуждение (у беговой лошади), переутомление, боль, страх, интоксикация лекарствами или токсинами из окружающей среды, холод, транспортировка, перегруппировка животных и многие другие. Все экзогенные и эндогенные факторы, создающие повышенные требования к организму, получили название стрессоров. Несмотря на их разнообразие, организм отвечает стереотипной формой биохимических, функциональных и структурных изменений, адаптацией к новым ситуациям. Наряду со стереотипной ответной реакцией раздражитель вызывает и специфический ответ, характерный для конкретного патогена (рис. 33). 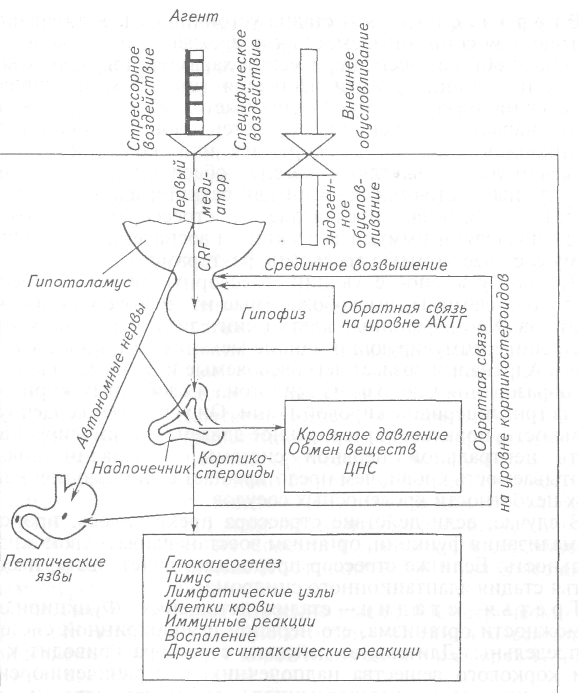 Рис. 33. Схема специфического и неспецифического (стрессорного) воздействия вредоносного агента на организм (по Селье, 1976) Таким образом, этиологические факторы, действуя на организм, вызывают неспецифические, общие для разного вида агентов реакции и специфические, свойственные каждому из них. Стресс, как было установлено, сопровождается характерной триадой: увеличением массы коры надпочечников;
Эти три типа изменений представляют собой объективные показатели стресса. Они стали основой для его изучения. Стресс проявляется развитием общего адаптационного синдрома с последовательно развивающимися тремя стадиями: реакцией тревоги, стадией устойчивости (адаптации) и стадией истощения. Первая стадия (реакция тревоги — alarm reaction) возникает в начале действия стрессора на организм. Реакция тревоги слагается из фазы шока и противошока. Фаза шока характерна быстрой мобилизацией и обильным выбросом в кровь кортикостероидов. Глюкокортикостероиды стимулируют гликонеогенез, который обеспечивает организм источником готовой к использованию энергии. Избыток гормонов вызывает катаболические изменения с потерей массы тела, инволюцию тимуса, других лимфоидных органов, лимфопению, эозинопению, нейтрофильный лейкоцитоз, угнетение иммунных и воспалительных реакций, эрозии и кровоточащие язвы в желудочно-кишечном тракте. Если животное выживает после контакта со стресс-фактором, то начинается вторая фаза — фаза противошока. Под влиянием кортикотропина стимулируется функция коры надпочечников, усиливаются выработка и выведение в кровь глюкокортикоидов, повышается содержание сахара, мобилизуются защитные силы, повышается артериальное давление, восстанавливается общий тонус организма. Вторая стадия — стадия устойчивости. Устанавливается повышенная сопротивляемость к повреждающему фактору, которая носит общий, неспецифический характер при любых воздействиях на организм. Активизируется гипоталамо-гипофизарно-надпочечниковая система. Увеличивается масса коры надпочечников, нарастает секреция кортикостероидов, в основном глюкокортикоидов, таких, как кортизол или кортикостерон. Они вызывают усиленный глюконеогенез, обеспечивая тем самым легкодоступный источник энергии для реакций адаптации соответственно требованиям, предъявляемым стрессорами. Глюкокортикоиды подавляют иммунные реакции и воспаление, помогая организму сосуществовать с вредными факторами. Второй путь, опосредующий стрессорную реакцию, обеспечивают катехоламины, высвобождаемые из мозговой ткани надпочечников. Хромаффинные клетки синтезируют главным образом адреналин, стимулирующий общие механизмы в процессах адаптации. Адреналин создает легкоусвояемые источники энергии путем образования глюкозы из гликогена и свободных жирных кислот из триглицеридов жировой ткани. Он усиливает сердечную деятельность, повышает артериальное давление, стимулирует активность центральной нервной системы. Адреналин повышает свертываемость крови, чем предотвращает ее потерю при нарушениях целостности кровеносных сосудов. В случае, если действие стрессора прекратилось, происходит нормализация функций, организм восстанавливает свою жизнедеятельность. Если же стрессор продолжает действовать, наступает третья стадия адаптационного синдрома. Третья стадия — стадия истощения. Функциональные возможности организма, его нервной и эндокринной систем небеспредельны. Длительное действие стрессора приводит к атрофии коркового вещества надпочечников, ограничению синтеза кортикостероидов, катехоламинов, соматотропного и других стрессорных гормонов. Анализируя значимость стрессорной реакции для организма животных, следует обратить внимание на тот факт, что частью общего адаптационного синдрома наряду с активацией защитных механизмов является угнетение многих функций, не связанных непосредственно с обеспечением адаптации к неблагоприятным факторам. Тимолимфатическая инволюция способствует снижению резистентности и иммунобиологической реактивности. Вак-цинопрофилактика не сопровождается полноценным иммунитетом, если животные были привиты в состоянии стресса. Часть из них после контрольного заражения вирулентным возбудителем погибает. У животных, подвергшихся стрессу, снижаются прирост массы, воспроизводительная способность и продуктивность, особенно молочная. Стресс у предубойных животных ухудшает качественные показатели мясной продукции. Стресс в условиях современного ведения животноводства (скученность, ранний отъем молодняка, перегруппировки, транспортировка, инфекционные и инвазионные болезни, токсигены окружающей среды, повышение радиационного фона и др.) становится патогенетической основой нарушения жизнедеятельности организма. Предупреждение длительного воздействия стресса на сельскохозяйственных животных возможно только при соблюдении санитарно-гигиенических норм содержания, кормления и ухода. 21.4. НАРУШЕНИЯ ФУНКЦИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У млекопитающих щитовидная железа состоит из двух долей, расположенных вблизи гортани вдоль боков трахеи. Она обильно снабжается кровью, что создает благоприятные условия для быстрого и полного снабжения организма гормонами. Основной структурной единицей является фолликул, полость которого заполнена коллоидом. Секретирует железа два гормона — тетрайодтиронин (тироксин) и трийодтиронин. Основной функцией этих гормонов является обеспечение процессов окисления в клетках. В молекулах гормонов обязательно присутствие йода. Он поступает с водой и кормами в виде йодитов, чистого йода или органических соединений с йодом. Иод включается в молекулу белка, образуя моно- и дийодтирозины, их молекулы участвуют в образовании тироксина и трийодтиронина. Последний в 5—10 раз более активен, чем тетрайодтиронин. Важное диагностическое значение имеют биометрические характеристики этого эндокринного органа. Средняя масса щитовидной железы колеблется у коров и лошадей в пределах 17—30 г, у свиней— 11—30 г. Гормонообразовательная функция железы контролируется ти-реотропным гормоном аденогипофиза и парагипофизарно с участием парасимпатической и симпатической нервной систем. Образование и поступление гормонов в кровь зависят от баланса йода. Гипофункция щитовидной железы. С целью установления роли этого эндокринного органа производят полную или частичную тиреоидэктомию, вводят тиреостатические препараты (метилтиоурацил) и радиоактивный йод, который кумулируется железистой тканью (рис. 34).  Рис. 34. Овцы в 11-месячном возрасте: слева – нормальная; справа – тиреоиодэктомированная Наиболее эффективным экспериментальным методом является тиреоидэктомия. Проведенная в раннем постнатальном периоде, она ведет к резкой задержке роста ягнят, щенков, крольчат, поросят, цыплят; появлению карликовости. Это вызвано задержкой роста в длину трубчатых костей из-за слишком раннего окостенения эпифизов. Нарушен метаболизм белков, жиров, углеводов. Основной обмен снижен на 25—40 %. Терморегуляция становится несовершенной, температура тела на 0,5—1,5 °С ниже нормальной, животные легко переохлаждаются и могут погибнуть от гипотермии. Они слабо реагируют на пирогены, инфекционные заболевания у них протекают с незначительным повышением температуры тела. В тканях задерживается вода, развивается микседема — слизистый отек кожи. Волосы истончаются и выпадают. Шерсть теряет блеск. Однако у козлят, подвергнутых тиреоидэктомии, иногда вырастает пышный волосяной покров. Половой аппарат у тиреоидэктомированных животных остается недоразвитым. У самок овариальные фолликулы атрофируются, у самцов семенники не опускаются в мошонку. Половой инстинкт утерян. Животные бесплодны. Они малоподвижны, апатичны, слабо реагируют на внешние раздражители. Нарушения высшей нервной деятельности проявляются затрудненной выработкой условных рефлексов, преобладанием тормозных процессов. У взрослых животных, подвергнутых тиреоидэктомии, развивается прогрессивное истощение — тиреоидпривная кахексия. Окислительные процессы у них подавлены, основной обмен понижен на 12—35 %. Температура на нижней границе нормы. Аппетит резко снижен, пищеварение затруднено. Животные анемичны, больше лежат, утрачиваются ранее приобретенные условные рефлексы. Шерсть начинает выпадать. Наиболее распространенная причина недостаточности щитовидной железы у продуктивных животных, в первую очередь у коров, — дефицит йода, поступающего в организм с кормом и водой. Не исключено влияние на организм и таких растений, как белый клевер, рапс, турнепс, свекла, брюква, горох, содержащих тиреостатические вещества. Снижают эффективность использования йода организмом высокий уровень кальция, магния, марганца и недостаток в рационе кобальта и цинка. Особенно высока потребность в йоде у высокопродуктивных коров, когда с каждым литром молока выводится от 30 до 130 мг йода. Эти и другие условия могут создать относительную йодистую недостаточность, снижение уровня тиреоидных гормонов в крови. Помимо алиментарных возможны и другие причины гипотиреоза. К ним могут быть отнесены возможные аномалии развития железы — гипоплазия и аплазия, воспалительные и аутоиммунные процессы, поступление в организм и накопление тиреоцитами радиоактивного йода. Низкий уровень тиреоидных гормонов в крови влечет за собой по принципу обратной связи усиление синтеза и секреции тиреоидного гормона аденогипофизом. Этот гормон стимулирует увеличение массы щитовидной железы за счет разроста соединительной ткани, слизистые же элементы подвергаются атрофии. Это заболевание получило название эндемического зоба (рис. 35).  Рис. 35. Зоб у собаки Эндемический зоб возникает спорадически у животных биогеохимических зон с недостаточным содержанием йода в почве, воде, кормах. Очаги йодной недостаточности встречаются во всех странах, в том числе на территории России (Алтай, Амурская, Читинская, Ярославская и многие другие области). Дефицит тиреоидных гормонов негативно сказывается на обмене углеводов, белков, жиров, минеральных веществ и воды. Окислительные процессы в тканях снижены. Уменьшены потребление кислорода и выведение углекислого газа. Недостаток тиреоидных гормонов приводит к снижению плодовитости, внутриутробной смертности, рождению слабых, физиологически недоразвитых плодов. Молодняк рождается с низкой массой тела: телята—12—15кг, ягнята —0,7—1,5 кг. Щитовидная железа при остром дефиците йода гипертрофирована, достигает у телят 500 г, у ягнят, поросят 150г. Сдавлены гортань, трахея, пищевод, что затрудняет дыхание, прием пищи. У взрослых животных заболевание проявляется энофтальмом (западение глаз) и слизистым отеком (микседема) области межчелюстного пространства. Снижена молочная и мясная продуктивность. Нарушена воспроизводительная функция. Маточное поголовье страдает бесплодием, перегулами, абортами, рождением слабого или мертвого приплода. Добавление в рацион животных йода (KI) профилактирует заболевание. У коров с гипофункцией щитовидной железы йодная подкормка восстанавливала уровень тиреоидных гормонов. Гиперфункция щитовидной железы. Гипертиреоз у животных встречается редко. Повышение продукции тиреоидных гормонов может быть следствием нарушения их метаболизма, гиперплазии железистых клеток при опухолевом росте. Развивающийся тиреотоксикоз возможен и из-за повышения чувствительности тканевых рецепторов к тироксину. Гиперфункция щитовидной железы проявляется развитием диффузного токсического зоба, что получило название базедовой болезни. Для нее характерен симптомокомплекс в виде увеличения массы железы, пучеглазия (экзофтальм), тахикардии, возрастания основного обмена, кахексии, повышенной возбудимости. Ведущими патогенетическими факторами в развитии тиреотоксикоза считают нарушения иммунологических процессов. Как установлено, в крови больных тиреотоксикозом циркулирует длительно действующий стимулятор щитовидной железы, отнесенный к иммуноглобулину типа Ig G. Токсическое действие избытка тетрайодтиронина и трийодтиронина заключается прежде всего в повышении проницаемости митохондриальных мембран, разобщении дыхания и фосфорилирования, уменьшении аккумуляции энергии в макроэргических соединениях (АТФ и др.). Энергия свободного окисления выделяется в виде тепла и бесцельно рассеивается. Катаболизм преобладает над анаболизмом, о чем свидетельствует отрицательный азотистый баланс. Усилен распад гликогена в мышцах и печени, стимулируется липолитическая активность адреналина. Интенсивное окисление жира в печени приводит к кетозу. Корм используется неэффективно, развивается истощение. Тиреотоксикоз резко нарушает сердечную деятельность. Как следствие метаболических нарушений в миокарде появляются дистрофические изменения, нарушается проведение импульса от предсердий к желудочкам. Активация симпатико-адреналовой системы сопровождается тахикардией. Характерное для базедовой болезни пучеглазие вызывается эк-зофтальмическим фактором гипофизарного происхождения. t 21.5. НАРУШЕНИЯ ФУНКЦИЙ ОКОЛОЩИТОВИДНЫХ ЖЕЛЕЗ Околощитовидные (паращитовидные) железы представлены у млекопитающих в виде одного (свинья, крыса, мышь) или двух (лошадь, овца, коза, собака, кролик) парных органов, расположенных на поверхности щитовидной железы или погруженных в ее ткань. Этот эндокринный орган продуцирует паратгормон и кальцитонин. Оба они регулируют обмен кальция, причем паратгормон повышает его содержание в крови, тогда как кальцитонин понижает. Такое взаимодействие обеспечивает постоянство концентрации кальция во внутренней среде. Нарушения функциональной активности околощитовидных желез могут проявляться усилением или ослаблением их деятельности. Расстройства могут быть следствием воспалительных процессов, опухоли (аденомы), нарушений функции печени, почек, острого дефицита кальция в рационе или усиленного его выделения. Гипофункция околощитовидных желез. Наиболее полно их недостаточность может быть выявлена после хирургического удаления (рис. 36).  Рис. 36. Полное расслабление мышц после удаления околощитовидных желез – слева; справа – собака после инъекции паратгормона У паратиреоидэктомированных собак появляется ряд характерных признаков. Спустя 2—3 дня после операции у животных пропадает аппетит при усиленной жажде. Они становятся легковозбудимыми. Появляется непроизвольное подергивание лицевых мышц и хвоста. Потом наступают тонические сокращения. Вначале они захватывают задние конечности, потом — все тело и передние конечности. Тонические судороги переходят в клонические, приступы которых продолжаются до получаса. Во время припадка появляются тахикардия, гипертензия, одышка, повышается температура тела. Приступы судорог могут прерываться, но со временем они делаются сильнее и продолжительнее. Развивается опистотонус — выгибание туловища с запрокинутой головой. Если не принять необходимых мер, то животное спустя 7—12 дней погибает. К возможным лечебным мерам относятся пероральные или внутривенные введения кальция, обеспечивающие его должный уровень в крови. Поэтому следует считать, что основная причина, приводящая к непроизвольным судорогам, сводится к резкому сокращению содержания кальция в крови. Если его нормальная концентрация равна 2,5—3,25 ммоль/л, то после паратиреоидэк-томии она снижается до 1—1,25 ммоль/л. В результате меняется соотношение одновалентных ионов (Na, Mg) с двухвалентными (Са, Мn). Это ведет к резкому повышению нервно-мышечной возбудимости. Теряется способность забирать кальций и фосфор из костей, не функционируют остеокласты. В патогенезе страдания большое значение придают дезинтоксикационной функции печени. Собаки, содержащиеся на мясной пище, быстрее погибают, чем собаки, содержащиеся на растительной пище, что объясняют потерей способности гепатоцитов превращать аммиак в мочевину. Относительная гипофункция желез развивается при интенсивном росте, плодоношении, повышенной лактации, других состояниях, связанных с дефицитом кальция. Гиперфункция околощитовидных желез. Развивается как следствие аденомы или гиперплазии. Возникающий избыток паратгормона при дефиците кальцитонина приводит к повышению концентрации кальция в крови до 4,99 ммоль/л. Развивается остеодистрофия. Минеральные вещества вымываются из костяка и откладываются в мягкие ткани («перемещение скелета в мягкие ткани»). Из-за склероза сосудов повышается артериальное давление, снижается кровоснабжение тканей. Костяк становится хрупким, легко травмируется. Появляются сведения о том, что гиперпаратиреоз приводит к нефрокальцинозу и развитию мочекаменной болезни (уролитиазу). 21.6. НАРУШЕНИЯ ЭНДОКРИННОЙ ФУНКЦИИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Поджелудочная железа представляет собой орган с двойной секрецией. Внешний секрет в виде поджелудочного сока выводится в двенадцатиперстную кишку, а продукты внутрисекреторной части, панкреатических островков (Лангерганса), в виде гормонов поступают в кровь. Островковый аппарат по массе составляет около 10 % железы (лошади, крупный рогатый скот, свиньи) и состоит из клеток четырех видов. Бета-клетки — основные, продуцируют инсулин, альфа-клетки вырабатывают глюкагон, гамма- и дельта-клетки образуют панкреатический гастрин. Среди этих гормонов главное значение в физиологических условиях и при патологических состояниях имеет инсулин. Действие циркулирующего в крови инсулина определяется взаимосвязью гормона с рецептором на поверхности клетки, последующим возникновением многочисленных внутриклеточных сигналов и проявлением их биологического эффекта. Взаимодействие молекулы инсулина с рецептором сказывается на состоянии клеточной мембраны. Развивается ее гиперполяризация (кроме гепатоцита), выводятся ионы водорода, поглощаются ионы натрия, повышается рН клетки, ингибируется кальциевый насос, что приводит к задержке внутриклеточного кальция. Клеткой поглощаются ионы калия, усиливается транспорт глюкозы. Инсулин через 3,5-циклический аденозинмонофосфат регулирует активность клеточных ферментов путем их высокоизбирательного фосфорилирования или дефосфорилирования. Он активирует фосфатазу, которая способствует синтезу гликогена и тормозит его распад. Кроме того, инсулин одновременно влияет на многие биохимические процессы, облегчающие липогенез и тормозящие глюконеогенез. Проявляется и его быстрый эффект на синтез белка путем агрегации рибосом в полисомы, противодействия протеолитическим системам. Известно, что антагонисты инсулина гликагон, катехоламины, кортизол оказывают на синтез белка тормозящее влияние. Выявлен митогенный эффект инсулина, реализуемый благодаря его метаболической активности. Однако для стимуляции синтеза ДНК требуются более высокие концентрации гормона, чем для ускорения транспорта глюкозы или других быстрых метаболических проявлений его действия. Сахарный диабет — это эндокринное заболевание, в основе которого лежит абсолютная или относительная недостаточность инсулина, приводящая к расстройствам обменных процессов и функций органов и систем. Диабет может возникнуть под влиянием наследуемых дефектов островкового аппарата, его разрушения (панкреатит, травма), перенапряжения, избытка антагонистов инсулина (катехоламины, глюкокортикоиды, глюкагон). Развитие заболевания может определяться и такими факторами, как гиподинамия, ожирение, несбалансированность рациона, нервно-психическое перенапряжение. Инсулин относится к важнейшим гормонам, регулирующим обмен веществ в организме. Поэтому при его недостатке нарушены метаболизм углеводов, жиров, белков, процесс обмена энергии. Нарушение обмена углеводов связано с прекращением поступления глюкозы в инсулинзависимые ткани и органы (мышцы, печень, почки, легкие), активации гликогенолиза в печени и глюконеогенеза. Нарушения углеводного обмена проявляются полиурией, потерей организмом электролитов (натрия, калия), повышенным аппетитом и жаждой. Нарушается использование углеводов для синтеза липидов. У здоровых животных около 30 % поступающей в организм глюкозы трансформируется в жир, а у больных диабетом — только около 3 %. Нарушение обмена жира выражено в ограничении транспорта жирных кислот и кетокислот в клетки, усиленном липолизе, увеличении синтеза холестерина, интенсификации кетогенеза — избыточного образования ацетоуксусной, бета-оксимасляной кислот и ацетона. Проявляются нарушения жирового обмена липемией, гиперхолестеринемией, гиперкетонемией, кетоацидозом, кетонурией, потерей массы тела. Нарушение обмена белка связано с явлениями катаболизма (преобладание распада над синтезом), торможением синтеза рибонуклеиновой кислоты, включением аминокислот в глюконеогенез. Последствия проявляются в нарушениях процессов регенерации, угнетении гемопоэза, иммунодефиците, возникновении условий для сравнительно легкого инфицирования. Нарушения энергетического обмена обусловлены образованием недоокисленных продуктов (лактата, перувата), дефицитом энергоемких соединений (макроэргических фосфатов, в том числе АТФ), недоокислением жиров, излишним образованием кетоновых тел. Расстройства энергетического обмена проявляются гипоксией, дефицитом энергетического обеспечения обмена веществ, особенно в жизненно важных органах, ацидозом, лактацидемией, снижением адаптационных возможностей организма. Расстройства обмена веществ, обусловленные недостаточностью инсулина, могут клинически проявляться разнообразными признаками. Для сахарного диабета характерна ангиопатия — поражение мелких артериальных сосудов с нарушениями микроциркуляции и трофическими расстройствами вплоть до гангрены. Развивающийся атеросклероз сопровождается гипертензией, ишемизацией сердечной мышцы вплоть до инфаркта миокарда. Поражение нервной системы при диабете проявляется энцефалопатией, снижением чувствительности, трофическими расстройствами. Диабетическая нефропатия (гломерулосклероз) сопровождается отеками, протеинурией. Поражения костно-мышечной системы складываются из остеопороза и мышечной дистрофии. Могут быть поражены и органы зрения как результат диабетической микроангиопатии. Это одна из причин слепоты. 21.7. НАРУШЕНИЯ ЭНДОКРИННОЙ ФУНКЦИИ ПОЛОВЫХ ЖЕЛЕЗ Половые железы (гонады) продуцируют половые клетки. Половые железы самцов (семенники) — тестикулы вырабатывают спермии, самок (яичники) — яйцеклетки. Эти клетки обеспечивают репродуктивную функцию животных. Вместе с тем половые железы представляют собой и эндокринные органы, гормоны которых регулируют половую активность, определяют развитие первичных и вторичных признаков пола, влияют на метаболические процессы и поведенческие реакции животных. Мужские половые гормоны — андрогены (от греч. andros — мужчина) синтезируются интерстициальными клетками Лейдига, сконцентрированными между канальцами семенников. Основной андроген — тестостерон, а его предшественник — эфир холестерола. Образование тестостерона у развивающейся мужской особи стимулируется хорионическим гонадотропином, а в последующем — гипофизарным лютеонизирующим гормоном. Тестостерон в процессе метаболизма, происходящего главным образом в печени, превращается в менее активный андроген — андростерон. Женские половые гормоны — эстрогены. Эндокринную функцию яичников выполняют клетки внутренней оболочки фолликулов, гранулезные клетки, выстилающие их полость и желтое тело. Основной эстроген, вырабатываемый фолликулами, — 17β-эстрадиол. В равновесии с ним находится другой эстроген — эстрон, который в печени и плаценте превращается в третий женский половой гормон — эстриол. Желтое тело, формирующееся после овуляции из клеточных элементов разорвавшегося фолликула, представляет собой временную эндокринную структуру. Если не происходит оплодотворения, то желтое тело рассасывается, если яйцеклетка оплодотворена, то оно функционирует весь период плодоношения. Клетки желтого тела продуцируют прогестерон. Этот гормон необходим для роста и развития плода. Реализуется биологический эффект половых гормонов связыванием их рецепторами клеток-мишеней с последующей активацией системы циркулирующего аденозинмонофосфата (цАМФ). В печени природные андрогены и эстрогены конъюгируют с глюкуроновой и серной кислотами. Конъюгаты лишены биологической активности, они растворимы в воде, выводятся из организма с мочой. Гипофункция половых желез самцов. Эндокринная недостаточность половых желез самцов может быть причиной их удаления хирургическим путем (кастрация), развития воспалительных процессов в семенниках (орхиты), придатках (эпидидимиты), неопущения семенников в мошонку (крипторхизм), воздействия токсинами, радиоактивным излучением, снижением гипоталамо-гипофизарной активности в выработке гонадотропинов, генетически обусловленной гипоплазии. Наиболее яркая картина гонадоидальной гипофункции выявляется после кастрации. Двустороннее удаление семенников у молодых неполовозрелых животных сопровождается снижением интенсивности роста и развития. Экстерьер таких животных приобретает черты интерсексуальности, т. е. сглаживаются особенности мужских и женских организмов. Недоразвиты вторичные половые признаки: у птиц меняется оперение, у кастрированных петушков меняется тембр издаваемых звуков, тормозится развитие головного убора — гребня, сережек, бородки; у оленей не вырастают рога. Скелет у кастрированных животных оказывается удлиненным за счет задержки окостенения эпифизов. Половые инстинкты не проявляются, агрессивность резко снижена, животные в группах растут без взаимной травматизации. Основной обмен у кастратов на 10—20 % ниже, чем у некастрированных животных. После кастрации начинает преобладать отложение липидов в тканях, мышечные же волокна у них утончены. Поэтому, если кастрация хряков экономически целесообразна, то кастрация бычков приводит к снижению полноценности получаемой от них мясной продукции из-за более низкого содержания белка. Кастрация взрослых самцов сопровождается менее выраженными явлениями. Наблюдается в основном торможение окислительных процессов, животные становятся менее агрессивными, легкоуправляемыми. Волы, мерины используются обычно как послушные тягловые животные. Понижение функции половых желез у самцов-производителей может быть результатом воспалительных процессов, вызванных механическим повреждением, внедрением микрофлоры (бруцеллез); алиментарной недостаточности, особенно дефицита незаменимых аминокислот, витамина Е. У животных патология половых желез самцов наиболее часто проявляется орхитами (воспаление семенников) и эпидидимитами (воспаление придатка семенника), нередко встречаются сочетанные поражения — орхитоэпидидими-ты, ибо эти органы как структурно, так и функционально тесно взаимосвязаны. Заболевания встречаются у всех домашних животных. У баранов число больных особей может достигать 22%, у быков-производителей — 19%, с наибольшей поражаемостью животных в возрасте от двух до четырех лет. У больных снижаются не только выработка половых клеток (спермиев), их способность оплодотворять яйцеклетки, но и падает гормональная активность. Тормозится половой рефлекс, самцы теряют половую потенцию. Нередкой аномалией развития полового аппарата является крипторхизм. У больных самцов семенники не опускаются из брюшной полости через паховый канал в полость мошонки. Крипторхизм диагностируется у свиней, лошадей, овец, собак, реже — у крупного рогатого скота, козлов. Если семенники и их придатки остаются в брюшной полости, то говорят о брюшном крипторхизме; если в паховом канале, то о паховом. Помимо возможных механических факторов, препятствующих перемещению семенников в мошонку, важное значение в развитии этой патологии отводят недостаточности гонадотропных гормонов аденогипофиза, особенно при двусторонней задержке семенников. Самцы-крипторхи неспособны к оплодотворению. Эта неспособность к оплодотворению обусловлена недоразвитием гонад, оставшихся в брюшной полости, нарушением сперматогенеза из-за сравнительно высокой температуры. Разница между температурой в брюшной полости и полости мошонки составляет у кролика 2,3 0С, у крысы 3,5, а у человека 6,7 °С. Если искусственно создать условия, ограничивающие теплоотдачу с кожи мошонки у барана, то образование и качество спермиев резко снижаются, они утрачивают подвижность и способность к оплодотворению яйцеклетки. В большинстве случаев, как установлено, крипторхизм у домашних животных обусловлен генетически. Одна из возможных причин гипофункции гонад самцов определяется гипоплазией половых желез наследственного происхождения. Эта генетическая аномалия встречается у быков, жеребцов, баранов, козлов, хряков, петухов, самцов норок клеточного содержания. Гипоплазия гонад самцов может носить односторонний или двусторонний характер. Несмотря на возможность сохранения полового рефлекса, сперматогенез нарушен, спермин в эякуляте деформированы, имеют ограниченную подвижность или мертвы. Больные животные непригодны для воспроизводства. Гиперфункция половых желез самцов. Усиление функции половых желез у самцов (гипергонадизм) может быть результатом повышенной секреции релизинг-факторов гипоталамусом и гонадотропинов аденогипофизом при развитии опухолевых процессов или появлении гормональноактивной опухоли семенников. Гипергонадизм сопровождается преждевременным половым созреванием. У таких животных половые органы гипертрофированы. Рано появляется половой рефлекс. Животные вначале очень быстро растут, но из-за преждевременного окостенения эпифизарных хрящей рост останавливается. Увеличение содержания андрогенов в организме самцов приводит к генерализованному анаболическому влиянию этих гормонов на белковый обмен. Общая масса мышц увеличивается, мышечная сила возрастает. Высокая концентрация тестостерона стимулирует сперматогенез. Однако если подавить секрецию гонадотропинов аденогипофиза экзогенно введенным тестостероном, то при сохранении вторичных половых признаков клетки Лейдига атрофируются, сперматогенез прекращается, утрачивается половой рефлекс, животные становятся бесплодными. Поэтому запрещено применение анаболических препаратов (тестостерон и его производные) для стимуляции мышечной активности у спортивных лошадей и животных других видов. Гипофункция половых желез самок. Удаление яичников хирургическим путем — овариоэктомия — сопровождается бесплодием и выпадением гормональной функции женских гонад. Кастрация самок животных различных видов (свиней, крольчих, крыс, мышей и др.) в молодом возрасте ведет к тому, что матка и влагалище остаются инфантильными, половой цикл не проявляется. Не развиваются вторичные половые признаки. Кастрация взрослых самок приводит к атрофии матки. Она уменьшается в размерах, исчезают матричные железы, эпителий, выстилающий матку, уплощается, ее мышцы атрофируются. Полностью прекращаются спонтанные ритмические сокращения матки. Подвергаются инволюции и вторичные половые признаки: постепенно атрофируются молочные железы, меняются внешний вид и поведение животных. У кастрированных коров рост тела несколько усилен, а у подвергнутых кастрации морских свинок — ослаблен. Снижение эндокринной функции половых желез наблюдают при поражениях гипоталамо-гипофизарной системы, сопровождающихся недостаточностью гонадотропных гормонов аденогипофиза, первичной недоразвитостью гонад (гипоплазия), острым или хроническим воспалением яичников (оофорит, овариит) или покрывающих его тканей (периоофорит). Причиной воспаления чаще всего становится инфекция, переходящая с матки, брюшной стенки. Хроническое воспаление может быть обусловлено бруцеллезом. Развивающееся снижение продукции овариальных гормонов (эстрадиол, эстрон и эстриол) сопровождается угнетением функции размножения: нарушается фазность полового цикла, фолликулы и яйцеклетки не развиваются до стадии зрелости, они могут подвергаться атрезии, обратному развитию, резко ослаблены половой и материнский рефлексы. Отсутствие овуляций сопровождается бесплодием. Гиперфункция половых желез самок. Причинами повышения секреторной функции яичников могут быть усиление гонадотропной активности аденогипофиза, развитие опухоли яичника, продуцирующей избыточное количество овариальных гормонов, гормонально-активной опухоли сетчатой зоны коры надпочечника, кисты яичников. Повышение концентрации эстрогенов в крови у самок препу-бертатного периода приводит к преждевременной половой зрелости, раннему формированию первичных (яичники, яйцеводы, матка, влагалище) и вторичных (молочные железы, характерный скелет, внешний вид, издаваемые звуковые сигналы) половых признаков. Рост молодых самок вначале усилен, а затем затормаживается. Усиленная выработка овариальных гормонов у взрослых животных может быть результатом образования персистентного фолликула (киста яичника). Фолликул увеличен в размерах, не достигая, однако, полного физиологического созревания. Стенка такого фолликула не разрывается, яйцеклетка остается в его полости, овуляция не наступает. Клетки гранулезной зоны и внутренней теки такого фолликула продуцируют большое количество эстрогенов. Повышенная секреция овариальных гормонов ведет к нарушениям полового цикла, бесплодию. Такие самки страдают нимфоманией, которую чаще наблюдают у кобыл, коров, свиней. У больных животных резко повышается половая возбудимость. Признаки половой охоты появляются через короткие промежутки времени и продолжаются несколько дней. У коров наблюдают потерю аппетита, половое возбуждение, активное проявление обни-мательных и совокупительных рефлексов, агрессивность. Нарушения функции желтого тела. На месте разорвавшегося фолликула образуется желтое тело яичника, продуцирующее гормон прогестерон. Он препятствует созреванию фолликулов путем снижения их чувствительности к гонадотропинам, способствует имплантации оплодотворенной яйцеклетки, необходим для нормального развития плода, подготовки молочных желез к лактации. В тех же случаях, когда оплодотворение не произошло, желтое тело рассасывается, прекращается его гормональная активность. Однако нередко, особенно у коров, если оплодотворение яйцеклетки не произошло, оно не подвергается инволюции. Повышенное содержание прогестерона в крови таких животных подавляет созревание фолликулов и выработку ими овариальных гормонов. Одним из возможных последствий появления персистентного желтого тела является анафродизия, для которой характерны неполноценность или полное прекращение половых циклов, отсутствие овуляции, полового возбуждения. Животные становятся бесплодными. 21.8. НАРУШЕНИЯ ФУНКЦИЙ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ Вилочковая железа (thymus) принадлежит к центральным органам иммуногенеза. В ее корковом и мозговом слоях дифференцируются и созревают субпопуляции Т-лимфоцитов, обладающих хелперной, супрессорной и киллерной активностью. Тимус тесно взаимодействует с гипофизом, надпочечниками, щитовидной и поджелудочной железами, гонадами, другими органами внутренней секреции. Тимэктомия, проведенная в раннем постнатальном периоде, приводит к торможению роста и развития подопытных животных, потере массы, кахексии. Экстракты, приготовленные из тканей зобной железы, устраняли негативные последствия экстирпации тимуса. К настоящему времени сформировалось представление о тимусе как об одном из эндокринных органов. К наиболее изученным биологически активным препаратам тимуса относят тимозин. У тимэктомированных мышей он обеспечивал увеличение массы тела, абсолютное число лимфоцитов крови, размеры лимфоидных органов, восстановление структуры лимфатических узлов и селезенки, предупреждал смертность у оперированных животных. Установлено, что тимозин влияет на дифференциацию претимических, тимических и посттимических клеток. Он обусловливает превращение стволовой претимической Т-клетки в тимическую, активирует лимфоциты, генетически запрограммированные к дифференциации в Т-клетки. В самом тимусе тимозин обеспечивает превращение незрелых Т-лимфоцитов в зрелые, иммуно-компетентные клетки. Для проявления действия тимозина в отношении эффекторной функции Т-клеток требуется наличие специфического для этих клеток антигена. В присутствии тимозина (гуморальный контроль) и антигенной стимуляции появляются «обученные» Т-клетки. Тимозин, как полагают, проявляет высокую активность на разных стадиях дифференцировки лимфоидных клеток, потому что он химически неоднороден, состоит из нескольких биологически активных компонентов. В механизме стимулирующего действия тимозина на клетку большую роль отводят взаимодействию гормона со специфическими рецепторами и последующей активации аденилатциклазной системы, регулирующей уровень циклического аденозинмонофосфата (цАМФ). Посредниками между специфическими рецепторами для тимозина и аденилатциклазы могут быть простагландины Е1 или Е2. Представления о физиологической функции гормонов тимуса к настоящему времени далеко не полные. Однако уже сейчас многие биологически активные препараты, полученные из тимуса (тималин), или их синтетические аналоги (тимоген) с успехом используются для коррекции тимусзависимых первичных (гипотрофичные телята, поросята, ягнята, цыплята, щенки норок) и вторичных (влияние промышленных токсигенов, многие незаразные, инфекционные и инвазионные заболевания) иммунодефицитных состояний. 21.9. НАРУШЕНИЯ ФУНКЦИЙ ЭПИФИЗА Эпифиз (шишковидная, или пинеальная, железа) расположен между передними буграми четверохолмия головного мозга, он связан при помощи ножки с третьим желудочком. Масса эпифиза у лошадей достигает 350 мг. Он хорошо развит у кур, гусей, что делает их хорошим объектом для эпифизэктомии. С возрастом активность эпифиза снижается, орган постепенно приобретает характер рудимента, содержащего известковые отложения. Паренхима состоит из пинеалоцитов — богатых цитоплазмой клеток с большим ядром и мелких — с темным ядром и узкой полосой цитоплазмы. Пинеалоциты поставляют в русло крови мелатонин, серотонин, другие биологически активные вещества. Предполагают, что этот орган участвует в компасной ориентации животных, миграционном поведении птиц. Эпифиз тесно взаимосвязан с гипоталамо-гипофизарной системой регуляции обменно-вегетативных функций и приспособительных реакций организма. Экстирпация эпифиза у цыплят приводит к преждевременному половому созреванию, увеличению массы гонад, усилению развития вторичных половых признаков. Проведение пинеалэктомии у млекопитающих сопровождается гипертрофией семенников, увеличением предстательной железы, стимуляцией сперматогенеза. У самок удаление эпифиза вызывает увеличение матки, удлинение сроков функционирования желтых тел яичников. Оперированные животные увеличивают массу тела, у них наблюдают преждевременное развитие костной ткани и остановку роста. Инъекции экстрактов железы приводят к уменьшению массы гонад, торможению сперматогенеза и развития вторичных половых признаков. Кастрация активирует функцию эпифиза, а введение эстрогенов — тормозит. Антагонизм между эпифизом и гонадами обусловлен снижением секреции гонадотропинов аденогипофизом. Установлено, что антигонадотропное и антиандрогенное действие эпифизарных полипептидов не связано с мелатонином. Полипептидный экстракт, полученный из эпифизов крупного рогатого скота, снижал уровень тестостерона в плазме и семенниках, тогда как мелатонин не вызывал статистически значимых изменений. Под влиянием эпифиза тормозится не только выделение гипофизом гонадотропинов, но и тиреотропного гормона. Пинеалэктомия приводит к гипертрофии клеток щитовидной железы, усиливает поглощение ею йода. Белковые экстракты эпифиза влияют на обмен углеводов и жиров. Экстирпация вызывает гипергликемию, а инъекции экстракта — гипогликемию. Эндокринная функция пинеальной железы у здоровых и больных животных разных видов выявлена недостаточно и подлежит дальнейшему изучению. |
