Пат физиология. Учебные пособия для студентов высших учебных заведений
 Скачать 7.09 Mb. Скачать 7.09 Mb.
|
|
Глава 19. ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ ПЕЧЕНИ Функции печени сложны и многообразны, ее деятельность направлена на поддержание гомеостаза. Этот орган активно участвует в белковом обмене. В печени происходят дезаминирование и синтез белков плазмы крови— фибриногена, альбуминов, альфа-и бета-глобулинов. В углеводном обмене печень занимает центральное положение. Там из моносахаридов образуется глюкоза, осуществляются синтез, накопление и расщепление гликогена. Печень участвует в регуляции уровня сахара в крови. Она является главным органом, регулирующим синтез, эстерификацию и выведение холестерина, синтез и содержание в крови нейтрального жира и выделение желчи, главными составными частями которой являются желчные кислоты и билирубин. Кроме того, печень участвует в обезвреживании токсических веществ, поступивших с кровью воротной вены, в свертывании крови, синтезируя многие необходимые факторы в антисвертывающей системе, продуцируя гепарин. Важна и экскреторная функция печени. С желчью выделяются различного происхождения токсические вещества, лекарственные препараты, а в некоторых случаях и микроорганизмы. Печень активно участвует в водном (инактивация антидиуретического гормона, альдостерона) и минеральном (депонирование железа, меди, калия и др.) обменах. Поражение печени приводит к ослаблению функциональной активности органа, нарушению гомеостаза. Последствия функциональной недостаточности печени для организма изучают различными эксперименталь-ными методами. Существуют также многочисленные биохимические и клинические тесты, дающие представление о состоянии той или иной функции печени, ее активности в целом. 19.1. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ИЗУЧЕНИЯ ФУНКЦИЙ ПЕЧЕНИ Частичное удаление ткани печени. Было установлено, что экстирпация даже 70 % массы органа не сопровождается печеночной недостаточностью, а спустя 8 нед орган восстанавливается до исходной величины за счет размножения оставшихся клеточных структур. Полное удаление печени. Проводят в два этапа. Вначале создают соустье между портальной и задней полой веной с перевязкой ее выше анастомоза. Вся кровь от органов брюшной полости и задней части тела направляется к печени, но ее кровеносная система не обеспечивает оттока и спустя 4 нед развиваются коллатерали в обход этого органа. Второй этап операции заключается в перевязке портальной вены выше соустья и экстирпации всей массы печени. Проведением этой операции на собаках была установлена продолжительность жизни подопытных животных. Они погибали спустя 4—8 ч после операции. Смерти предшествовала быстро нарастающие слабость, адинамия и судороги. Внутривенное введение глюкозы продлевало жизнь до 34 ч. Установлено, что гипогликемия у оперированных собак сочетается с увеличением содержания в крови аминокислот, уменьшением содержания мочевины. Были выявлены роль печени в свертывании крови, терморегуляции, обмене холестерина, дезинтоксикации, другие ее функции. 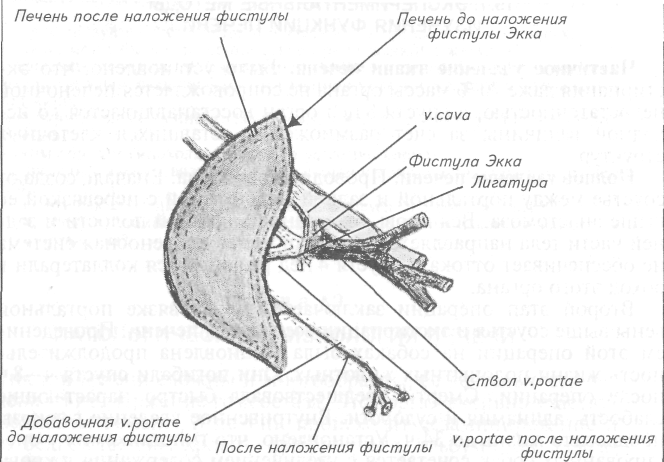 Рис. 31. Фистула Экка Фистула Экка. Значительной вехой в изучении физиологии и патологии печени была разработка фистулы Экка (1877г.). Ее суть — создание соустья между задней полой и воротной венами с перевязкой последней выше анастомоза (рис. 31). Через этот анастомоз кровь от органов брюшной полости, собранная в воротную вену, минует печень и сразу через заднюю полую вену поступает в большой круг кровообращения. Было выявлено, что оперированные собаки быстро, на 3—4-й день, погибают, если в их рацион вводят сырое мясо. В крови при этом резко возрастает количество аммиака и его солей. Таким образом была установлена мочевинообразующая и дезинтоксикационная роль печени. Оперированные подобным образом собаки, содержавшиеся преимущественно на углеводной диете, длительное время имели удовлетворительное состояние. Обратная фистула Экка—Павлова. И. П. Павлов (1893г.) предложил после создания анастомоза между воротной и задней полой венами перевязывать не воротную вену выше соустья, а заднюю полую. В этих условиях кровь от задней половины туловища и от органов брюшной полости поступает через портальную вену в печень. Оперированные животные годами могут быть использованы для выявления физиологической роли печени. Метод ангиостомии. Важным этапом в изучении печени был разработанный Е. С. Лондоном метод ангиостомии. Суть метода в том, что к стенке воротной вены, приносящей кровь к печени, и к стенке печеночной вены, выносящей кровь из печени, подшивались тонкие серебряные трубочки, концы которых выводились наружу. В условиях хронических опытов по химическому составу притекающей и оттекающей крови можно было судить о процессах, происходящих в печени. Благодаря ангиостомированию была установлена роль этого органа в белковом, углеводном, жировом, солевом обменах, в билирубинообразовании, в выполнении других функций. Перевязка воротной вены. Уже через 1—2 ч при перевязке воротной вены животное гибнет при явлениях венозной гиперемии и обильных кровоизлияниях в кишечник, органы брюшной полости. Лигирование печеночной артерии. Спустя 24—48 ч лигирование печеночной артерии сопровождается летальным исходом с явлениями интоксикации, развитием тонических и клонических судорог. У подопытных животных регистрируют резкую гипогликемию, значительное снижение содержания мочевины. Разработана методика фистулирования желчного пузыря и перевязки желчевыводящих путей, имитирующей механическую желтуху. Токсикоз печени моделируют путем введения подопытным животным гепатотропных ядов (хлороформ, ацетон, четыреххлористый углерод, фосфор, дубильная кислота, тринитротолуол), вызывающих некроз гепатоцитов. Методом перфузии изолированной печени изучают ее участие в биохимических процессах путем введения в состав перфузата испытуемых ингредиентов и анализа их в вытекающей жидкости. В научно-исследовательских и клинических целях используют биопсию печени, легко выполнимую на крупных животных (лошади, крупный рогатый скот), с последующим изучением биоптата; лапароскопию, биохимические и иммунологические методики. 19.2. ОБЩАЯ ЭТИОЛОГИЯ НЕДОСТАТОЧНОСТИ ПЕЧЕНИ Основные причины, вызывающие поражение печени и недостаточность ее функций, — инфекционные, инвазионные и алиментарные. Вирусный гепатит выявляют у собак, пушных зверей, свиней, лошадей, уток. Гепатит бактериального происхождения осложняет такие заболевания, как сальмонеллез телят, лептоспироз. Весьма распространены поражения печени продуктивных животных, вызванные паразитами. Это фасциолез крупного и мелкого рогатого скота, дикроцелиоз, цистицеркоз, описторхоз, токсо-кароз, кокцидиоз, дипилидиоз. Помимо инфекций и инвазий немалое значение в происхождении патологии печени (гепатоз, гепатит, цирроз) играют алиментарные факторы. Выявлено патогенное влияние на печень перекорма коров концентратами при низком (0,75 и ниже) сахаро-протеиновом соотношении, избытка масляной кислоты в силосе, избытка мочевины. Большое содержание жира, особенно окисленного, в рационе и алиментарная белковая недостаточность также приводят к гепатопатиям. Патологию печени могут вызвать токсины, образующиеся в воспаленном кишечнике, при почечной недостаточности, распаде белков злокачественных опухолей, нарушениях жирового, белкового, углеводного обменов, сахарном диабете. Хроническая недостаточность кровообращения сердечного происхождения нередко осложняется циррозом печени, особенно у собак. 19.3. ОБЩИЙ ПАТОГЕНЕЗ ГЕПАТОПАТИЙ Общий патогенез заболеваний печени может быть охарактеризован следующим образом. Патогенные факторы (микроорганизмы, токсические соединения, гипоксия, физические и другие воздействия) стимулируют перекисное окисление липидов. Продукты перекисного окисления повреждают мембраны гепатоцитов, их лизосом, митохондрий, микросом, ядерные мембраны. Повышается их проницаемость, что ведет к нарушению функций субклеточных структур. Выходящие за пределы лизосом энзимы в еще большей степени повреждают клеточные мембраны. Белки клеток становятся антигенами, доступными для макрофагов, которые презентуют их Т-хелперам и Т-киллерам. Стимулируется аутоантителогенез, сенсибилизируются лимфоциты. В крови и тканях появляются антиядерные, антимитохондриальные антитела, аутоантитела к специфическому липопротеиду печени. Фиксируясь на мембране гепатоцитов, аутоантитела способствуют воздействию сенсибилизированных лимфоцитов. Аутоиммунная реакция развивается по принципу гиперчувствительности замедленного типа. Степень поражения паренхимы печени зависит от характера повреждающего фактора, продолжительности его воздействия на гепатоциты, видовых особенностей, индивидуальной устойчивости организма. В зависимости от этих условий возможна определенная последовательность в развитии гепатопатий. Так, изначально возникший гепатоз, характеризующийся дистрофическими процессами в гепатоцитах, может трансформироваться в гепатит (воспаление печеночной ткани), завершающийся, в свою очередь, циррозом (гибель гепатоцитов, разроет и уплотнение соединительной ткани). Рассматривая общий патогенез гепатопатий, следует выявлять как состояние самого органа, так и влияние недостаточности печени на гомеостаз, обменные процессы в организме больного животного, функциональную активность других органов и систем. 19.4. НАРУШЕНИЯ УЧАСТИЯ ПЕЧЕНИ В ОБМЕНЕ ВЕЩЕСТВ Нарушение углеводного обмена, вызванного недостаточностью печени, проявляется сниженной способностью гепатоцитов к глюконеогенезу — образованию глюкозы из неуглеводных предшественников и последующему синтезу гликогена. Содержание его в печени уменьшено, что негативно сказывается на детоксикационной функции органа. Одновременно клетки печени замедляют расщепление гликогена до глюкозы. Уровень сахара в крови, становится нестабильным, возможно развитие гепатогенной гипогликемии. Падение уровня сахара у моногастричных животных; ниже 0,4—0,6 г/л сопровождается гипогликемической комой. Уровень содержания гликогена в печени зависит от нейрогумо-ральной регуляции. Адренокортикотропный гормон, глюкокортикостероиды, инсулин стимулируют образование и увеличение содержания гликогена в печени, а соматотропный гормон, адреналин, тироксин и глюкагон способствуют распаду гликогена, усиленному поступлению глюкозы в кровь. Нарушение нейрогенных и гормональных влияний на печень сопровождается расстройствами ее гликогенобразовательной функции. Нарушение жирового обмена при недостаточности печени проявляется в изменениях уровня холестерина в крови. Гиперхолестеринемия возникает как результат усиленного синтеза при замедлении или прекращении поступления желчи в кишечник. Чаще поражение гепатоцитов сопровождается гипохолестеринемией. Недостаток холестерина снижает синтез витамина D, стероидных гормонов. Холин является структурным компонентом основного фосфолипида печени — лецитина; он входит в молекулу липопротеидов и выносится из гепатоцитов. Недостаточный синтез холина, одного из липотропных веществ, приводит к жировой дистрофии печени (гепатозу). К липотропным веществам, кроме холина, относятся витамин В12, фолиевая кислота, метионин, бетаин, полноценные белки как источник белкового компонента липопротеидов. Гепатоз представляет собой универсальную реакцию печени на повреждения. Сопутствующее большинству из них падение содержания гликогена вызывает патологическую афферентную импульсацию, достигающую гипоталамуса. Оттуда по эфферентным нервным волокнам раздражение передается надпочечникам и клеткам жировых депо. В кровь усиленно начинают поступать хиломикроны; они захватываются клетками Купфера, не превращаются в фосфолипиды, не выносятся из печени липопротеидами, а накапливаются в ней. Замедление окисления жира в печени сопровождается кетонемией, кетонурией. Гепатоз — наиболее часто встречающаяся патология печени у животных, особенно у высокоудойных коров, откормочного молодняка крупного рогатого скота, овец. Нарушение белкового обмена заключается в снижении способности печени к дезаминированию и переаминированию аминокислот. Подавлена функция синтеза мочевины из аминогрупп и аммиака, снижено ее содержание в крови и моче. Заболевания печени сопровождаются падением уровня образования гепатоцитами альбумина, альфа- и бета-глобулинов. Снижается онкотическое давление крови. Гипоальбуминемия и гипоонкия способствуют образованию отеков и водянок, особенно асцита при портальной гипертензии. Снижен синтез ферментов и белков, участвующих в свертывании крови: фибриногена, протромбина, проконвертина, проакцелерина. Появляются признаки коагулопатий: геморрагический синдром, склонность кровоточивости. Ослабленные желчеобразовательная и желчевыделительная функции становятся причиной нарушений утилизации и всасывания жиров, жирорастворимых витаминов. Поврежденные гепатоциты (гепатит, цирроз печени) выделяют в кровь избыточные количества трансаминаз — аспарт-атамино-трансферазы и аланинаминотрансферазы. Определение их активности в сыворотке крови имеет важное значение для диагностики; и дифференциальной диагностики болезней печени. Гиперферментемия — тонкий индикатор остроты и активности патологических процессов в печени. Нарушение обмена витаминов, свойственное патологии печени, складывается из снижения всасывания жирорастворимых витаминов A, D, Е, К в кишечнике и развития у больных соответствующей симптоматики, подавления выработки каротиназы, трансформирующей каротин в активный ретинол, уменьшения возможности депонирования почти всех витаминов и особенно важного для гемопоэза цианкобаламина. При гепатопатиях тормозится процесс трансформации витаминов в коферменты: из тиамина — кокарбоксилазы пирувата, из пантотеновой кислоты — ацетилкоэнзима А. Кофермент А участвует в реакции цикла трикарбоновых кислот, окислении жирньгх кислот, биосинтезе холестерина, ацетилхолина; является связующим звеном между углеводным, жировым и белковым обменом. Нарушение обмена гормонов при функциональной недостаточности печени приводит к тому, что эстрогены, андрогены, кортикостероиды, тироксин, инсулин не подвергаются инактивации. Так, при гепатопатиях у мужских особей возможна гинекомасти из-за избытка женских половых гормонов, не инактивированных гепатоцитами. Избыточное количество других гормонов меняет, нейрогуморальную регуляцию. 19.5. НАРУШЕНИЯ БАРЬЕРНОЙ ФУНКЦИИ ПЕЧЕНИ В барьерную функцию печени входит недопущение токсинов, поступающих из кишечника в системный кровоток, и обезвреживание метаболитов, образующихся в процессе обмена веществ. Обезвреживание токсических продуктов осуществляется путем окисления, восстановления, дезаминирования, гидролиза, метилирования, ацетилирования, образования парных соединений. Так, наиболее токсические продукты метаболизма белка (индол, скатол, крезол, фенол) инактивируются путем соединения с серной и глюкуроновой кислотами. Гепатопатии сопровождаются поступлением этих токсигенов в общий кровоток, вызывая тяжелые отравления. Они усугубляются тем, что больной орган не синтезирует мочевину, в крови нарастает концентрация аммиака, преодолевающего гематоэнцефалический барьер и оказывающего патогенное воздействие непосредственно на клетки крови. Возрастает опасность развития печеночной комы. Купферовские клетки относятся к макрофагальной системе, они участвуют в фагоцитозе микроорганизмов, инородных веществ, в фиксации иммунных комплексов. Эти клетки, активированные антигенами, участвуют в развитии специфического иммунного ответа на генетически чужеродные белковые субстанции. Недостаточная функциональная активность купферовских клеток сопровождается снижением иммунологической реактивности и неспецифической защиты. 19.6. РАССТРОЙСТВА ЖЕЛЧЕОБРАЗОВАНИЯ И ЖЕЛЧЕОТДЕЛЕНИЯ Печень наряду с поджелудочной железой выполняет основную роль в пищеварении. Затруднение (гипохолия) или полное прекращение (ахолия) поступления желчи в кишечник сопровождается нарушением полостного, мембранного переваривания кормовых субстратов и всасывания конечных продуктов гидролиза жиров, белков, углеводов. Активные компоненты желчи — желчные кислоты. Они синтезируются и секретируются гепатоцитами. Исходным материалом служит холестерин. Холевая, дезоксихолевая, хенодезоксихолевая, литохолевая желчные кислоты эмульгируют жиры в кишечнике, создают условия для расщепления и всасывания не только липидов, но и белков, углеводов. Недостаточное желчеотделение не обеспечивает утилизации субстратов корма. С желчью выделяются желчные пигменты биливердин и билирубин. Эти пигменты образуются из гемоглобина распадающихся эритроцитов главным образом в печеночных клетках. Билирубин нерастворим в биологических жидкостях, транспортируется альбумином плазмы крови. Поступая в печень, первоначально образованный непрямой билирубин освобождается от белка, вступает в соединение с глюкуроновой кислотой и становится «прямым» водорастворимым билирубином, непосредственно поступающим в желчь и далее в кишечник, где под влиянием бактериальных ферментов превращается в стеркобилиноген и уробилиноген. На воздухе выводимые из организма с калом и мочой они подвергаются окислению, трансформируются в уробилин и стеркобилин, придавая выделениям специфическую окраску. Нарушение желчеобразования и желчевыведения повышает содержание желчных кислот и пигментов в крови и тканях, что получило название желтухи. Желтуха. Желтуха (icterus) — это симптомокомплекс, характеризующийся отложением желчных пигментов в коже и слизистых оболочках, окрашиванием их в желтый цвет. Отложению желчных пигментов предшествует гипербилирубинемия. Она может быть результатом заболеваний печени, желчных протоков или патологии системы эритропоэза. Желчный пигмент билирубин образуется главным образом в клетках печени, селезенки, красного костного мозга путем ферментативного восстановления биливердина — соединения, предшественником которого является прото-порфирин, входящий в структуру тема. В крови циркулирует непрямой, связанный с транспортным белком билирубин. Он токсичен, не фильтруется в клубочках почек, не выводится с мочой даже при больших концентрациях в крови. Этот непрямой билирубин захватывается гепатоцитами и превращается в прямой путем соединения с глюкуроновой кислотой. Он водорастворим, секретируется клетками печени в желчные ходы и поступает в кишечник. Расстройство обмена желчных пигментов проявляется в развитии желтух разного генеза. Ранее выделяли гемолитическую, паренхиматозную, механическую желтуху. В настоящее время благодаря расширению и углублению представлений об образовании и обмене билирубина стала популярной патогенетическая классификация. Согласно этой классификации желтухи дифференцируют на надпеченочные, печеночные и под печеночные. Надпеченочная (гемолитическая) желтуха развивается в результате гиперпродукции гемобилирубина. Его содержание в крови превышает возможности нормального захвата и конъюгационных механизмов гепатоцита. Этиологическими факторами являются гемолитические анемии, неэффективный эритропоэз, ферментопатия, аутоиммунный гемолиз, отравления мышьяком, свинцом, змеиным ядом, рассасывание обширной гематомы, переливание несовместимой крови, сепсис, злокачественные опухоли (лейкоз). Наиболее часто надпеченочную желтуху наблюдают у животных, больных гемоспоридиозами, такими, как бабезиоз крупного и мелкого рогатого скота, пироплазмоз лошадей, других однокопытных животных. Кровепаразиты внедряются в эритроциты, размножаются и разрушают клетку. Повышенное образование непрямого билирубина сопровождается интенсивным захватом его гепатоцитами и выведением с желчью в виде прямого гепатобилирубина. Содержимое кишечника включает значительно большее, чем обычно, количество желчных пигментов — уробилиногена и стеркобилиногена, что сопровождается повышенным выделением стеркобилина и уробилина с фекалиями (гиперхолия) и мочой. Пищеварение существенно не нарушается ввиду достаточного поступления в кишечник желчи и желчных кислот. Гиперпродукция непрямого билирубина, невозможность его конъюгации гепатоцитами приводят к отложению пигмента в коже, слизистых оболочках. Желтушность обнаруживается прежде всего на склере. Она появляется у коров при концентрации билирубина в крови 1,6 мг/100 мл и выше. У крупного рогатого скота, лошадей, овец и свиней желтушность наиболее заметна на непигментированных участках кожи. У собак и кошек она может проявляться и на пигментированной коже. Печеночная (паренхиматозная) желтуха развивается как результат прямого повреждения клеток печени токсинами инфекционного (вирусный гепатит плотоядных, лептоспироз крупного рогатого скота, инфекционный энцефаломиелит лошадей), инвазионного (кокцидиоз, фасциолез) и неинфекционного (отравления животных хвощом, госсиполом, афлатоксинами, другими гепатотропными ядами) происхождения. В результате нарушается возможность захвата гемобилирубина гепатоцитами, снижена их способность к конъюгации, экскреции пигмента в желчные капилляры. Из-за резкого повышения проницаемости цитоплазматических мембран гепатоцитов, их некроза непрямой и прямой билирубин поступает в общий ток крови. Гепатоциты начинают выделять желчь не только в желчные, но и в лимфатические и кровеносные капилляры. В крови появляются свободные желчные кислоты. Холемии способствует повышение давления в желчных капиллярах из-за их сдавливания отечными гепатоцитами. Уменьшается поступление желчи в кишечник. Гипохолия нарушает пищеварение. В случае тяжелого тотального поражения печени гепатоциты теряют способность захватывать и трансформировать непрямой билирубин в прямой. Уровень гемобилирубина начинает нарастать, а прямого — падать. В моче исчезает уробилиноген, так как в кишечник практически не поступает прямой билирубин. Фекалии приобретают светлую окраску из-за отсутствия стеркобилина. Холемия негативно сказывается на состоянии высших отделов нервной системы, сердечно-сосудистой системы. Подпеченочная (механическая, обтурационная) желтуха обусловлена частичным или полным нарушением оттока желчи из желчных капилляров, желчного пузыря и его протока в двенадцатиперстную кишку. Механическое препятствие может быть вызвано закупоркой желчевыводящих путей или сдавливанием их извне. Причинами обтурации могут быть печеночные камни, паразиты (чаще фасциолы, дикроцелии), воспалительные процессы, опухоли. Желчевыводящие пути могут быть сдавлены извне эхинококковым пузырем, опухолью, абсцессом, гиперплазированными лимфатическими железами, пролиферирующей тканью при хроническом течении энтерита. Замедление или прекращение оттока желчи (холестаз) ведет к повышению давления в желчных путях, расположенных выше возникшего препятствия. Механическое препятствие оттоку пузырной желчи (у лошадей, верблюдов, северных оленей желчный пузырь отсутствует) повышает давление в желчных протоках. Желчные капилляры переполняются, их стенки растянуты, проницаемость резко повышена. Начинается диффузия желчи в лимфатические и кровеносные капилляры. Более того, желчные капилляры под влиянием возрастающего давления могут разрываться, что дает начало развитию воспалительного процесса (билиарный гепатит). Поступление желчи в кишечник значительно уменьшено (гипохолия) или прекращено (ахолия). По мере прогрессирования заболевания гепатоциты теряют способность захватывать непрямой билирубин и преобразовывать его в прямой. Появление в крови всех компонентов желчи (холемия) определяет высокую токсичность подпеченочной желтухи. Для нее характерны резко выраженная иктеричность, брадикардия, гипотермия, кожный зуд, снижение скорости свертывания крови, существенные расстройства пищеварения, гипотензия с возможным переходом в печеночную кому. 19.7. ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ Желчнокаменная болезнь (холелитиаз) — обменное заболевание гепатобилиарной системы, характеризующееся образованием желчных камней в печеночных желчных протоках (внутрипеченочный холелитиаз), в желчном пузыре (холецистолитиаз) и общем желчном протоке (холедохолитиаз). Камни чаще формируются в желчном пузыре. Образование камней связано с нарушением метаболизма холестерина и желчных кислот (холестериновые камни) или с превращениями билирубина (билирубиновые или пигментные камни, состоящие в основном из билирубината кальция). В настоящее время акцент в изучении генеза болезни делается на саму печень как источник секреции желчи с измененным химическим составом. Холестерин у здоровых животных благодаря желчным кислотам и фосфолипидам сохраняется в растворенном состоянии в виде макромолекулярных агрегатов, называемых смешанными мицеллами. Если в составе желчи количество этих двух холестеринудерживающих факторов падает ниже критического уровня, то создаются благоприятные условия для выпадения холестерина в осадок, формирования холестериновых камней. Образование этих конкрементов может быть связано также с усиленной секрецией холестерина. Его концентрация в желчи повышается при ожирении, гипотиреозе, инсулярной недостаточности, нерациональном кормлении животных, нарушениях печеночно-кишечной циркуляции основных составных частей желчи. Установлена генетическая предрасположенность к холелитиазу. Генез образования пигментных камней, состоящих из билирубината кальция («коричневые» камни) или билирубина и его компонентов («черные» камни) изучен недостаточно, хотя известно, что в образовании этих камней определенное значение имеет инфекция. Бактериальный фермент бета-гидроуронидаза приводит растворимый в воде билирубин глюкороноид в нерастворимый неконъюгированный билирубин, который соединяется с ионом кальция и выпадает в осадок. Последующий процесс камнеобразования связан с появлением желчно-пузырных факторов, таких, как дискинезия желчных путей, застой желчи с повреждением слизистой оболочки, повышающим проницаемость стенки пузыря для желчных кислот, с развитием воспаления, нарушением кишечно-печеночной циркуляции желчных кислот. Проявления холелитиаза зависят от расположения желчных камней, их размеров, состава и количества, активности воспалительного процесса, функционального состояния желчевыделительной системы. Камни желчного пузыря не дают явных клинических симптомов пока лежат на его дне («немая» зона), но как только они обтурируют выход, сразу же появляется симптомокомплекс подпеченочной желтухи. |
