2 мартынов терапия 01. Учебник для вузов москва гэотарм вд уд к6 16. 1. 4 (075. 8) Ббк 54. 1 я73 В56 Рецензенты
 Скачать 6.88 Mb. Скачать 6.88 Mb.
|
АПЛАСТИЧЕСКИЕ АНЕМИИ Апластические анемии — группа патологических состояний, характеризующихся панцитопенией, уменьшением клеточности (абсолютного содержания клеток) костного мозга при содержании бластов менее 5%. Термин «анемия» в данном случае неточно отражает суть патологического процесса, потому, что помимо уменьшения содержания эритроцитов в крови и костном мозге, уменьшается количество и других клеточных элементов. Апластические анемии требуют чёткого отличия от гемобластозов и терапии у специалистов, ориентированных в данной патологии. Терапию преднизолоном не назначать. Апластические анемии подразделяют на врождённые (анемия Фанкони), приобретённые, идиопатические (причина заболевания неясна). Обычно причину заболевания выявить не удаётся, поэтому ставят диагноз идиопатической апла-стической анемии. В остальных случаях этиологическими факторами могут быть: • воздействие химических веществ (бензол, соединения свинца, пестициды, токсины); • воздействие ЛС [хлорамфеникол (часто), стрептомицин, пенициллины, тетрациклины, сульфаниламиды, фенитоин (часто), амфотерицин В, карби-мазол, противодиабетические средства, фенилбутазон (часто), ацетилсалициловая кислота, индометацин, соединения золота (часто), пеницилламин, препараты висмута]; • аутоагрессия и появление AT к кроветворным клеткам; • воздействие радиоактивного излучения; • инфекционные заболевания (вирусные гепатиты В и С, инфекционный мононуклеоз, цитомегаловирусная и редко PV В19-инфекция, туберкулёз); • другие заболевания (тимома, лимфома, хронический лимфобластный лейкоз); • фоновые генетические синдромы (врождённый дискератоз, синдром Дауна). Причина анемии Фанкони — генетические аномалии. Известно не менее четырёх генов, мутация любого из которых ведёт к развитию врождённой апла-стической анемии. ПАТОГЕНЕЗ Во всех случаях апластической анемии основной патогенетический механизм — нарушение созревания частично детерминированной стволовой клетки в результате генетических нарушений, воздействий некоторых веществ, иммунной реакции. Количество стволовых клеток уменьшается. При трансплантации костного мозга нормальные донорские гемопоэтические клетки способны делиться и пролиферировать в костном мозге реципиента. тела, слабость. Наличие желтухи, спленомегалии и отсутствие физикальных симптомов пневмонии позволили правильно выставить диагноз. Устранение предполагаемого этиологического фактора позволило быстро добиться положительной динамики заболевания. Анемии КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА Приобретённая анемия Заболевание может развиваться постепенно или начинаться остро, с быстро нарастающей панцитопенией, тяжёлым геморрагическим синдромом, инфекционными осложнениями. Анализ крови: нормохромная анемия, содержание ретикулоцитов может быть очень низким или несколько повышенным (обычно не более 2—3%), общее число лейкоцитов и тромбоцитов снижено. В пунктате костного мозга: очень малая клеточность. В трепанобиоптате: костномозговые пространства почти целиком заполнены жиром, очаги кроветворения редки и малоклеточны. Трепанобиопсия с иммунофенотипированием клеток костного мозга необходима для точной диагностики заболевания. Анемия Фан кон и Начало клинических проявлений — в 5—10 лет. Характерны низкий рост, врождённые дефекты скелета (микроцефалия, возможно отсутствие лучевой кости или фаланг пальцев), аномалии мочеполовой системы (например, подковообразная почка), гипер- или гипопигментация кожи, умственная отсталость. Анализ крови: макроцитарная анемия, повышено содержание HbF, отсутствует выраженная панцитопения до 3—8-летнего возраста. Характерны ломкость хромосом, дефекты репарации, повышенная чувствительность хромосом к диэпоксибутану, митомицину и УФО. При пункции костного мозга часто не обнаруживают изменений. На рентгенограмме: аномалии развития лучевой кости и больших пальцев кистей. УЗИ внутренних органов: пороки развития мочеполовой системы. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА При цитостатической болезни (угнетение костного мозга вследствие приёма цитостатиков) аплазия обратима, гемопоэз обычно восстанавливается самостоятельно. Приём колониестимулирующих факторов ускоряет процесс. При лейкозах, миелодиспластических синдромах характерны изменения костного мозга (увеличено содержание бластов, изменена морфология клеток), также характерны цитогенетические (хромосомные) изменения и наличие клеточных маркёров патологических клонов (выявляемые иммуногистохи-мическими методами). Дефицит фолиевой кислоты или витамина Bi2 влияет на все три ростка гемопоэза. Но костный мозг в случае мегалобластной анемии всегда гиперклеточный, содержит мегалобласты. Пароксизмальная ночная гемоглобинурия характеризуется ретикулоцитозом, признаками внутрисосудистого гемолиза, положительными специфическими тестами (например, исследование мочи на гемосидерин). ЛЕЧЕНИЕ Тактика ведения Стационарное лечение в гематологическом отделении. При нейтропении (гранулоцитопении) показана строгая изоляция больного для предупреждения возможного инфицирования. Исключение причинных факторов (отмена ЛС). Поиск донора для трансплантации костного мозга (исследование Аг системы HLA больного и членов его семьи). ВНУТРЕННИЕ БОЛЕЗНИ Глава 65 Трансплантация стволовых клеток периферической крови или костного мозга Трансплантация стволовых клеток периферической крови или костного мозга — успешный метод лечения у больных моложе 20 лет даже при тяжёлом течении апластической анемии (содержание нейтрофилов <0,2 109/л). Пятилетняя выживаемость молодых больных составляет 60—70%. Зависимым от гемотрансфузий больным (необходимость в трансфузиях возникает чаще 1 раза в месяц) абсолютно показана трансплантация костного мозга. • Донора подбирают по Аг HLA-системы, идентичным реципиенту. Обычно донором становится брат (сестра) больного. • До трансплантации костного мозга проводят химиотерапию. Обычно применяют циклофосфамид в сочетании с тотальным облучением тела (TBI, от англ. total body irradiation). С целью профилактики реакции «трансплантат против хозяина» назначают циклоспорин, преднизолон, азатиоприн, антилимфоцитарный глобулин. Консервативное специфическое лечение Консервативное специфическое лечение начинают после поступления больного в стационар и подтверждения диагноза. Для больных старше 20 лет и при лёгком течении заболевания — это основной метод лечения, поскольку аллогенная трансплантация стволовых клеток не всегда выполнима. Кроме того, консервативное лечение проводят во время подбора совместимого донора. • Иммуноглобулин антитимоцитарный (тимоглобулин). 20 мг/кг/сут в день на протяжении 5 дней в/в капельно в условиях стерильного бокса с адекватной поддерживающей терапией — компоненты крови, антибиотики, стерилизация кишечника антибиотиками широкого спектра, противогрибковыми и противовирусными препаратами. На время проведения лечения больной обязательно должен быть госпитализирован. • Циклоспорин в начальной дозе 5 мг/кг/сут внутрь или 3 мг/кг в/в. Далее дозы подбирают исходя из концентрации циклоспорина в крови, определяемой ежедневно. При отсутствии эффекта в течение 4 мес препарат отменяют. • Метилпреднизолон по 2 мг/кг/сут в/в с 1-го по 14-й день, по 1 мг/кг/сут с 15-го по 21-й день лечения. • Колониестимулирующие факторы назначают при неэффективности тимо-глобулина или циклоспорина. Препарат выбора — молграмастим; начальная доза 5 мкг/кг/сут п/к до увеличения количества гранулоцитов более 1 ■ 109/л. При отсутствии эффекта в течение 14 дней дозу удваивают. • Андрогены эффективны при некоторых вариантах анемии Фанкони, приобретённой апластической анемии, хотя случаи успешного лечения крайне редки. При отсутствии эффекта в течение 4—6 мес препарат отменяют. Спленэктомия Спленэктомия наиболее эффективна при нетяжёлой апластической анемии. ОСЛОЖНЕНИЯ, ИХ ПРОФИЛАКТИКА И ЛЕЧЕНИЕ • Геморрагический синдром может быть проявлением самого заболевания или осложнением иммуносупрессивной терапии. С профилактической целью назначают гемостатики, ангиопротекторы. Количество тромбоци Анемии тов как перед началом лечения, так и на фоне введения антитимоцитарно-го глобулина или циклоспорина должно превышать 30- 109/л. При угрозе развития внутренних кровотечений на фоне тромбоцитопении показано переливание тромбоцитной массы. • Анемический синдром. Переливают отмытые, облучённые в дозе 25 Гр эритроциты для поддержания НЬ на уровне 70—80 г/л. • Лечение инфекционных осложнений, вызванных гранулоцитопенией: изоляция больного, туалет слизистых оболочек (чистка зубов поролоновыми щётками, полоскание растворами антисептиков), деконтаминация кишечника, антибиотики широкого спектра действия (например, ципрофлоксацин 15 мг/кг/сут, цефотаксим 2—4 г/сут), противогрибковые препараты (например, амфотерицин В в/в 250—500 ЕД в сутки, орунгал 0,5—1 млн ЕД 3 раза в сутки) назначают при местных грибковых поражениях (стоматиты). • Гемосидероз осложняет переливания крови, поэтому при определении показаний к трансфузиям следует ориентироваться на самочувствие больного и клинические проявления. Например, при адаптации пациента к уровню НЬ 70 г/л переливать эритроцитнуто массу не стоит. Если частые трансфузии неизбежны, целесообразно профилактическое применение дефероксамина в дозе 0,5—1 г/сут в/в капельно. • Сердечная недостаточность. Следует ограничить объём инфузий. • Почечная недостаточность. Необходимо контролировать функциональное состояние почек, провести гемодиализ (по показаниям). • Вирусные гепатиты лечат инфекционисты по общим программам. ОЦЕНКА ЛЕЧЕНИЯ • Полная гематологическая ремиссия: НЬ 110 г/л и более, тромбоциты более 100- 109/л, гранулоциты более 1,5- 109/л. • Частичная гематологическая ремиссия: НЬ 90—110 г/л, тромбоциты 30— 100- 109/л, гранулоциты 0,5-1,5 • 109/л. • Минимальный гематологический ответ: НЬ 80—90 г/л; тромбоциты 10— 20 • 109/л при отсутствии необходимости в трансфузиях или сокращении частоты переливаний препаратов крови в 2 раза. ТЕЧЕНИЕ И ПРОГНОЗ Анемия Фанкони:на фоне изолированной заместительной терапии выживаемость не превышает 4 года. Приобретённые анемии: пятилетняя выживаемость без трансплантации костного мозга — 20—30%. Прогноз значительно благоприятнее при лечения андрогенами (анемия Фанкони) или трансплантации костного мозга. • Благоприятные факторы: лёгкое течение, положительный эффект консервативной терапии (достижение полной или частичной ремиссии через 3 мес от начала лечения), возраст больного моложе 20 лет. • Неблагоприятные факторы: тяжёлое течение, сохраняющаяся трансфузи-онная зависимость, минимальный гематологический ответ на лечение, присоединение инфекционных осложнений. ГЕМОБЛАСТОЗЫ В этой главе рассмотрены лейкозы, истинная полици-темия, лимфогранулематоз и множественная миелома. ЛЕЙКОЗЫ Лейкоз — опухоль кроветворной системы, первично поражающая кроветворные клетки костного мозга. Лейкозы подразделяют на две основные группы — острые и хронические. Клеточным субстратом острых лейкозов являются бластные клетки, хронических лейкозов — в основном зрелые элементы. Острый лейкоз Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев. Если проводить лечение, прогноз для детей часто благоприятен. Острые лейкозы подразделяют на миелоидные и лимфоидные. Хронический лейкоз Больные живут без лечения в течение нескольких месяцев и лет. Хронические лейкозы подразделяют на миелоидные, лимфатические и мегакариоцитарные. ЭТИОЛОГИЯ Этиология лейкозов неизвестна. Факторы риска К факторам риска острых лейкозов относят ионизирующее излучение, воздействие химических (в том числе лекарственных) веществ (бензол, продукты перегонки нефти, цитостатики и некоторые другие ЛС). Вероятность возникновения острых лейкозов среди больных, получавших цитостатическую терапию (так называемые вторичные лейкозы), повышается в сотни раз. Интервал до появления лейкоза после облучения составляет 5— 10 лет, а после химиотерапии — 2 года с максимумом в 19 Гемобластозы течение 6-10 лет. Описаны наблюдения доминантного и рецессивного наследования хронического лимфолейкоза (ХЛЛ), отмечена низкая заболеваемость этим лейкозом в некоторых этнических группах и повышенная в других. Чаще в этих случаях наследуется не сам лейкоз, а нестабильность генома, предрасполагающая родоначальные миелоидные или лимфоидные клетки к лейкозной трансформации. ВИЧ-инфицированные страдают первичной лимфомой ЦНС в сотни раз чаще, чем в остальной популяции, причем в большинстве случаев эта опухоль связана у них с инфицированием вирусом Эпстайна—Барр. ПАТОГЕНЕЗ Основную роль играют хромосомные нарушения. В большинстве случаев острых лейкозов они определяют прогноз болезни и тип специфического лечения. Нестабильность генома лейкозных клеток приводит к появлению в первоначальном опухолевом клоне новых субклонов, среди которых в процессе жизнедеятельности организма, а также под воздействием лечения «отбираются» наиболее автономные. Этим феноменом объясняют прогредиентность течения лейкозов, их уход из-под контроля цитостатиков, изменение места опухолевого роста, что и составляет суть опухолевой прогрессии, свойственной злокачественному росту. Постепенно угнетается нормальное кроветворение. Острый лейкоз Острый лейкоз — злокачественное заболевание кроветворной системы, морфологический субстрат — бластные клетки. Различают острый лимфобластный лейкоз (ОЛЛ) и острый миелоидный лейкоз (ОМЛ). Частота Частота острого лейкоза 13,2:100000 среди мужчин и 7,7:100000 среди женщин. ОЛЛ чаще развивается в детском возрасте и после 40 лет. Частота ОМЛ одинакова во всех возрастных группах. Патогенез Патогенез обусловлен пролиферацией клона опухолевых клеток с характерными цитогенетическими нарушениями, угнетением нормального кроветворения, выходом бластных клеток в кровь, метастазированием их в другие кроветворные (селезёнка, печень, лимфоузлы) и некроветворные (кожа, ЦНС, яички, лёгкие) органы. КЛАССИФИКАЦИЯ ОСТРОГО ЛЕЙКОЗА В основу классификаций острых лейкозов положены внешний вид и цитохимические особенности бластных клеток, их иммунофенотип и генетические особенности. Так, франко-американо-британская (FAB) классификация основана на морфологии лейкемических клеток (строение ядра, соотношение размеров ядра и цитоплазмы). Острый миелоидный лейкоз Интенсивное изучение цитогенетических и иммунологических особенностей гемобластозов привело к принятию классификации ОМЛ (табл. 66-1). ВНУТРЕННИЕ БОЛЕЗНИ Глава 66 Об уровне дифференцировки лимфоидных клеток свидетельствует экспрессия на поверхности их ядерной мембраны, в цитоплазме и на цитоплазмати-ческой мембране различных Аг, «кластеров дифференцировки», обозначаемых аббревиатурой CD (от англ. cluster of differentiation). Иммунофенотипическая характеристика миелобластных лейкозов приведена в табл. 66-2. Таблица 66-2. Иммунофенотипическая характеристика миелобластных лейкозов Иммуноподвариант лейкоза Доминирующий клеточный фенотип Реже коэкспрессируемые Аг Мо (острый малодиффе-ренцированный лейкоз) Mi (острый миелобластный лейкоз без созревания) Мг (острый миелобластный лейкоз с созреванием) Мз (острый промиелобластный лейкоз) М4 (острый миеломонобластный лейкоз) М5 (острый монобластный лейкоз) Мб (острый эритромиелоз) М7 (острый мегакариобластный лейкоз) HLA-DR+, CD15+/-, CD13+/", CD33+/- HLA-DR+/-, CD38+/-, CDlla+/", RFB-1+/-, CD53+, CDllb+/-, CD15+/-, CD7+/- HLA-DR+/-, CD72+ (ИПО10), CD38+/-, CD53+, RFB-1++/-, CDlla+/-, CDllb++/-, CD15++/" CD53+, RFB-1+/-, CDllb+/-, -CD15+/-, -HLA-DR+/-, -THY-1" CD38-, CD2-, CD3-, CD4 |
| Тип и частота | Иммунофенотип | Цитогенетические нарушения |
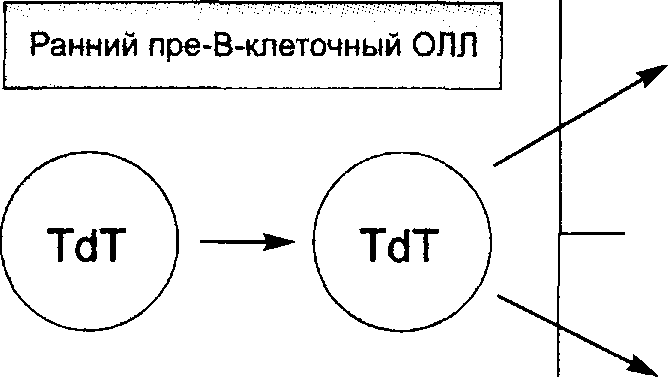
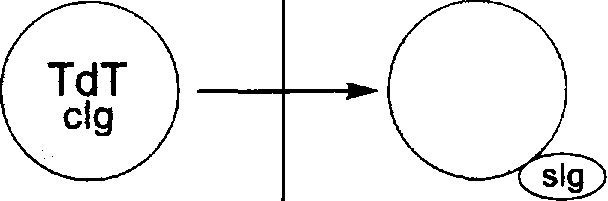
| Пре-пре-В-ОЛЛ (ранний пре-пре-В: 5—10% и Common: 40-45%) | HLA-DR, TdT+; CD34+; CD10+/-; CD19+; clg-; slg-; CD20-/+; CD24+/-; | t(12;21) в 20-25%, t(9;22), аномалии llq23 |
| Пре-В-ОЛЛ (20%) | HLA-DR, CD19, CD20+/-, CD24, CD9, CD10, CD34-, clgM, TdT+/ | t(l;19) |
| В-ОЛЛ (4-5%) | HLA-DR, CD19, CD20, CD22, CD24, CD10+/-?, CD34-, TdT", slg | t(8;14), t(2;8), t(8;22) |
| Т-ОЛЛ (20-31%) | HLA-DR+/-, CD1, CD2, cCD3, CD5, CD7, CD4/CD8, CD10+/", CD34-/+, CD45+/-, TdT | t(l;14) в 15-25% |
Примечание, clg — цитоплазматический Ig; slg — мембранный Ig; TdT —терминальная дезосинуклеотидилтрансфераза; (+) — выраженная экспрессия Аг; (+/—) — вариабельная экспрессия Аг; (—) — отсутствие экспрессии Аг._
ВНУТРЕННИЕ БОЛЕЗНИ