ФТИЗИОПУЛЬМОНОЛОГИЯ. Учебник для вузов Рекомендуется Учебнометодическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебника для студентов медицинских вузов
 Скачать 3.97 Mb. Скачать 3.97 Mb.
|
|
ГЛАВА 14 ОСЛОЖНЕНИЯ ТУБЕРКУЛЕЗА ОРГАНОВ ДЫХАНИЯ Среди осложнений туберкулеза органов дыхания наиболее серьезными и частыми являются инфекционно-токсический шок, кровохарканье и легочное кровотечение, спонтанный пневмоторакс, легочно-сер-дечная недостаточность (хроническое легочное сердце) и амилоидоз внутренних органов. ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ шок Инфекционно-токсический шок вызван массивным поступлением в кровеносное русло МБТ. Это происходит при остро прогрессирующих формах туберкулеза с обширными казеозными поражениями легочной ткани и массивным бактериовыделением с высоким уровнем лекарственной устойчивости МБТ, такими как острейший туберкулезный сепсис, острый милиарный и крупноочаговый диссеминированный туберкулез, казеозная пневмония и прогрессирующий фиброзно-кавернозный туберкулез легких. Токсины МБТ ведут к снижению энергетических ресурсов и функ- циональной активности иммунокомпетентных клеток, которые переста- ют реагировать на медиаторы. При этом нарушаются межклеточные взаимодействия и интегральные функции организма (регуляция ге- модинамики, микроциркуляции, гемостаза). Биологически активные вещества — гистамин, серотонин, кинины, компоненты системы ком- племента, гемостаза и фибринолиза, производные арахидоновой кис- лоты (простагландины и лейкотриены), медиаторы полиморфно- ядерных лейкоцитов и кислые протеазы, монокины, лимфокины, интерлейкины, лизосомальные ферменты, и др. начинают дей- ствовать как вторичные повреждающие агенты. Инфекционно-токси-ческий шок служит клиническим эквивалентом этих патофизиологических реакций. Наиболее важные клинические проявления инфекционно-токсического шока:
Нарушение гемодинамики в раннем периоде развития инфекционно-токсического шока и характеризуется спазмом периферических сосудов, прежде всего артериол и прекапилляров. Клинически это проявляется похолоданием конечностей, развитием акроцианоза. При дальнейшем течении шока снижается сократительная функция миокарда и уменьшается объем циркулирующей крови (ОЦК), что приводит к падению АД и декомпенсации кровообращения. Расстройствамикроциркуляции сопровождаютсятканевой гипоксией и метаболическим ацидозом. Важное значение имеют также повышение проницаемости сосудистой стенки, выход во внесосудистое пространство жидкой части крови, сладжирование эритроцитов, активация тромбоцитов и тканевых факторов свертывания крови с образованием фибриновых сгустков. При прогрессировании шока вазоконстрикция сменяется вазодилатацией, прежде всего венул и венозной части капилляров с депонированием в них крови и уменьшением ОЦК. Нарушения системы гемостазатакжеимеютфазовыйхарактер. В начале развития шока наблюдается гиперкоагуляция, обусловленная ги-перфибриногенемией и подавлением фибринолиза. В условиях нарушения микроциркуляции, попадании в кровь тканевых и тромбоцитарных факторов свертывания крови, активации тромбоцитов формируются микротромбы и нарушение микроциркуляции прогрессирует. Полиорганные дисфункция/недостаточность развиваются уже на раннем этапе инфекционно-токсического шока еще до декомпенсации гемодинамики. Это обусловлено тем, что токсины МВТ повреждают клеточные мембраны, нарушают в них энергетические процессы, что приводит к развитию синдрома системного мембраноповреждающего эффекта и генерализованного цитолиза. Синдром проявляется повышением количества в крови многих цитоплазматических ферментов: трансфераз, лактатдегидрогеназы, креатининфосфокиназы, щелочной и кислой фосфатазы и др. Нарушение микроциркуляции, внутрисосу-дистое тромбообразование, энергетический дефицит и гипоксемия приводят к развитию сначала полиорганной дисфункции, а затем недостаточности. Дыхательная недостаточность развивается в результате резкого уменьшения дыхательной поверхности легких, обусловленной распространенным туберкулезным поражением и сопровождается тяжелой гипоксией. Недостаточность миокарда обусловлена всеми указанными выше факторами, а также метаболическими особенностями сердца, его высокими энергетическими и кислородными потребностями. Хотя токсины МБТ не проникают в вещество мозга через ГЭБ, так как являются мак-ромолекулярными соединениями, инфекционно-токсическая энцефалопатия служит характерным проявлением инфекционно-токсического шока. На ранних этапах шока деятельность мозга стимулируется, что проявляется двигательным беспокойством, эйфорией. В дальнейшем функции мозга угнетаются в результате кислородного и энергетического дефицита (нарушение микроциркуляции, падение перфузионного давления). Повышение сосудистой проницаемости сопровождается увеличением количества внеклеточной жидкости, т. е. отеком мозга. Развивается синдром отека — набухание мозга вплоть до стволовой дислокации и нарушения жизненных функций. Клиническая картина инфекционно-токсического шока отражает фаз-ность развития его патофизиологических механизмов. Шок возникает на фоне тяжелого течения заболевания с выраженной гипертермией и резко выраженными бронхолегочными проявлениями болезни. Первая фаза инфекционно-токсического шока (компенсированный шок) характеризуется эйфорией, состоянием тревоги, двигательным беспокойством, гиперстезией кожи. При осмотре отмечаются бледность кожных покровов, высокая температура тела, цианоз губ и ногтевых пластинок, тахикардия, одышка; АД обычно близко к норме. Выявляют небольшую гипоксемию, гиперкапнию, компенсаторный метаболический ацидоз, гиперкоагуляцию. Вторая фазаинфекционно-токсическогошока(субкомпенсирован-ный шок) характеризуется снижением АД в пределах до 50% нормы, уменьшением диуреза, падением температуры тела до нормы, нарастанием цианоза (акроцианоз, цианоз носогубного треугольника). При лабораторных исследованиях обнаруживают нарастание гипоксемии, суб-компенсированный метаболический ацидоз, гипокапнию; появляются электролитные нарушения, в системе гемостаза — разнонаправленные изменения: снижение функциональной активности тромбоцитов, появление продуктов деградации фибриногена. Третья фазаинфекционно-токсического шока(декомпесированный шок) характеризуется гипотермией, разлитым цианозом, повышенной кровоточивостью, сопором, анестезией, глухостью тонов сердца, тахиа-ритмией, олиго- и анурией, одышкой. АД составляет менее 50% от нормы, часто не определяется, однако при введении прессорных аминов возможно его повышение. Частота дыхания превышает нормальную в 2—3 раза. Лабораторные исследования выявляют резко выраженную ги-поксемию, снижение артерио-венозной разницы по кислороду, деком-пенсированный метаболический ацидоз, гипокоагуляцию, повышение уровня креатинина и мочевины; возможна гиперкалимия. Вчетвертойфазеинфекционно-токсического шока (рефрактерный, необратимый шок) доминируют проявления полиорганной недостаточности, возможно развитие комы, центральных нарушений дыхания, отсутствуют реакции на введение лекарственных средств. Лечение инфекционно-токсического шока комплексное с обязательным одномоментным воздействием на важнейшие патогенетические механизмы:
• лечение тромбогеморрагического синдрома. Химиотерапия туберкулеза является основным методом, позволяющим при специфическом воздействии на МБТ снизить явления токсемии, и тем самым купировать развитие синдрома системного мембра-ноповреждающего эффекта и генерализованного цитолиза. Восстановление центральной гемодинамики осуществляют путем капельного введения вазопрессоров (добутамин, дофамин) в дозах, не нарушающих почечный кровоток. С целью восстановления микроцир- куляциии и борьбы с тромбогеморрагическим синдромом вводят кри- оплазму, реополиглюкин. Назначение преднизолона при казеозной пневмонии в дозе 15—20 мг повышает эффективность борьбы с шоком. Оксигенотерапию осуществляют 30% смесью через носовые катетеры. Коррекцию водно-электролитных нарушений проводят путем инфузии полиионных растворов с добавлением калия при гипокалемии. Введение коллоидных, полиионных растворов, а также глюкозокалиевой смеси обеспечивает детоксицирующий эффект. Коллоидные и электролитные растворы вводят в соотношении 1:2— 1:3. Одновременно (при нормальных показателях гемодинамики) диурез стимулируют лазиксом. При удовлетворительной сердечной деятельности, отсутствии застоя в легких и достаточном диурезе оптимальный объем инфузий составляет 80—100 мл/кг/сут. По показаниям применяют и экстракорпоральные методы детокси-кации. Коррекцию метаболического ацидоза осуществляют введением расчетных доз гидрокарбоната натрия. КРОВОХАРКАНЬЕ И ЛЕГОЧНОЕ КРОВОТЕЧЕНИЕ Кровохарканье и легочное кровотечение являются грозными осложнениями в клинике пульмонологии и фтизиатрии, при которых не только ошибки, но даже промедление в оказании врачебной помощи могут привести к летальному исходу. В связи с этим врач любой специальности должен уметь оказать неотложную помощь при возникновении кровотечения. Количество крови может варьировать от прожилок до массивного профузного кровотечения. Основными причинами кровохарканья и кровотечения являются разрывы стенок кровеносных сосудов легких вследствие гипертензии в малом круге кровообращения, нарушения свертывающей системы крови (гипокоагуляция), активации фибринолиза и повышения проницаемости стенок сосудов на участке патологического процесса. Обычно во время легочных кровохарканий и кровотечений имеет место сочетание нескольких причинных факторов, однако наиболее постоянным из них является гипертензия в системе легочной артерии. Легочным кровотечением называется выделение из дыхательных путей значительного количества крови в чистом виде или в виде обильной примеси к мокроте. Кровотечения при заболеваниях легких чаще всего протекают с кашлем и возникают при повреждении артериальных или венозных сосудов. Они различаются по цвету: кровь из легочных артериальных сосудов темная, венозная; из бронхиальных сосудов — алая. Кровохарканье — откашливание крови из дыхательных путей в виде отдельных прожилок или небольшой примеси в мокроте ярко-красного цвета. Кровохарканье — признак легочного кровотечения, и разница между ними только количественная: если выделилось до 50—100 мл — это кровохарканье; если больше — кровотечение. Легочное кровотечение и кровохарканье являются симптомами различных заболеваний органов дыхания. Предрасполагающими моментами являются травма груди, острое повышение внутригрудного давления, психоэмоциональное напряжение, нарушение целости сосудистой стенки. Кровотечение из дыхательных путей следует отличать от носового, из ротовой полости и гортани. Если кровотечение появляется без кашля, возможно, это истечение крови из варикозно расширенных вен пищевода или из желудка. При воспалительном процессе под влиянием интоксикации или местном нарушении кровообращения возможно кровотечение через интакт-ную стенку сосуда. Выделение слизистой мокроты, смешанной с кровью, позволяет считать, что это результат диапедеза форменных элементов крови, возникающий при повышенной проницаемости стенок капилляров и мелких сосудов. Такое кровохарканье следует отличать от легочного кровотечения, обычно связанного с аррозией сосуда. Кровохарканье — серьезный диагностический признак. Клиническое обследование может установить, что источником являются больные десны, носовая часть глотки, пищевод, желудок. После них кровь отхаркивается из носовой части глотки, быстро свертывается, как правило, не сопровождается кашлем. Кровотечение из варикозно расширенных вен пищевода чаще всего связано с циррозом печени. Оно возникает внезапно и носит профузный характер. Кровотечение из язвы желудка сопровождается рвотой темной кровью с примесью желудочного сока и сгустков крови. Среди заболеваний легких туберкулез остается одной из самых час- тых причин возникновения геморрагических осложнений. Реже крово- харканье и легочные кровотечения отмечаются при пневмосклерозе раз- личной этиологии, хроническом бронхите, пневмонии и абсцессе легких, а также при всех других заболеваниях легких. Почти всегда они наблю- даются у больных бронхолитиазисом, при синдроме Ра- нью-Ослера. Кровохарканье может появляться при пороке митрального клапана, кардиосклерозе, аневризме аорты и желудочка сердца, авита- минозе С и гемофилии. Оно возникает при травмах, повреждающих лег- кое, некоторых отравлениях и вдыхании отравляющих веществ. Факторами, способствующими возникновению кровохарканья и легочного кровотечения, являются холод, колебания атмосферного давления, гиперинсоляция, пребывание в высокогорной местности, применение антикоагулянтов (реже — протеолитических ферментов), лихорадка, острое и хроническое алкогольное опьянение. Горчичники и банки редко вызывают кровохарканье. Кровохарканье возникает также вследствие повышенной проницаемости сосудов, вызванной наличием воспаления, или вследствие разрыва мелких сосудов. При воспалении в альвеолах формируются грануляции из тонких сосудистых сплетений типа гемангиом, располагающихся непосредственно под эпителием, которые легко ранимы. У больных с хроническими нагноительными процессами в стенке полостей имеются грануляционная ткань и сосудистые аневризмы, при разрыве которых возникают кровохарканье и легочное кровотечение. При раке легкого кровохарканье обусловлено повреждением мельчайшей сети новообразованных сосудов. Кроме того, оно возникает вследствие разрушения артерий в результате некроза и распада опухоли. При разрыве сосуда в легких остановка кровотечения зависит от состояния гемокоагуляции и фибринолиза у данного больного. Состояние свертывающей системы крови зависит от тяжести и длительности течения воспалительного процесса в легких, функции печени и других систем организма. Длительная интоксикация при заболевании легких, часто возникающая дыхательная недостаточность и нарушение гемодинамики в малом круге кровообращения отражаются на функциональном состоянии органов и систем. В частности, страдают функции печени и легких, вследствие чего нарушаются синтез и регуляция факторов системы свертывания крови, уменьшается количество тромбоцитов, протромбина и фибриногена. Повышается фибринолитическая активность крови, что затрудняет борьбу с кровотечением, так как образовавшийся на месте кровотечения фибриновый сгусток легко подвергается лизису и кровотечение повторяется. Имеет место гипокоагуляция, обусловленная низкой тромбопластической активностью. Образование первичного тромба в месте нарушения целости стенки сосуда замедляется, так как время агрегации тромбоцитов удлиняется в 1,5—2 раза. Одновременно повышается содержание гепарина в крови, поэтому для нейтрализации эндогенного гепарина и усиления агрегации тромбоцитов показано применение гемофобина, протамина сульфата. Для правильного и своевременного лечения легочного кровотечения у больных туберкулезом необходимо отчетливо уяснить, какие патогенетические и функциональные изменения лежат в основе этого осложнения. Большая частота кровотечений туберкулезной этиологии объясняется множеством причин: распространенностью туберкулезного процесса в легких, хроническим течением, периодическими обострениями, наличием в легких деструкции с разрастанием грануляционной ткани в их стенках, перифокальным воспалением и поражением туберкулезом кровеносных сосудов, а также характером химиотерапии. Тяжесть кровотечения оценивают, основываясь на его характере (артериальное, венозное), скорости излития и объеме излившейся крови. В клинической практике чаще используют оценку кровотечения из легкого, основанную на количестве выделившейся крови. В основном кро- вотечения делятся на малые (100—300 мл), средние (300-700 мл) и обиль- ные (профузные) — более 700 мл. Малые и средние кровотечения встре- чаются при очаговых формах туберкулеза легких в случаев; при инфильтративных — в 20—30% случаев. Они свидетельствуют об активно- сти процесса, редко осложняются аспирацией, ателектазом. При этой форме кровотечения необходимо применять этиотропную и патогенети- ческую терапию вместе со средствами, уменьшающими воспалительно- -аллергические процессы, а также проницаемость стенок сосудов. В ряде случаев морфологическую основу кровотечения у больных туберкулезом составляет перифокальное воспаление гиперергического типа с одновре- менной деструкцией мелких сосудов, преимущественно вен. Периодичес- кое кровохарканье может быть связано с поражением бронхов при тубер- кулезе внутригрудных узлов. Причиной кровохарканья в этих случаях могут являться эрозии, мелкие изъязвления слизистых оболочек и пер- форация стенки бронхов. За последние годы в связи с увеличением дли- тельности жизни больных туберкулезом, применением длительной хими- отерапии наблюдается нарастание числа случаев кровохарканья и связанных с ними смертельных исходов. При туберкулезе легких источ- ником обильных кровотечений могут быть капилляры различного калиб- ра и анастомозы между бронхиальными и легочными сосудами в стенке туберкулезной каверны. Кровотечение в связи с циркуляторными изме- нениями может быть и не связано непосредственно с туберкулезной ин- фекцией. Иногда причиной его становятся посттуберкулезный пневмо- склероз, бронхоэктазы. Чаще всего (50—70% случаев) кровотечение бывает при кавернозных, и формах тубер- кулеза. Среди всех клинических форм по частоте геморрагических ослож- нений на первом месте стоит туберкулез. Клиническая картина кровохарканья и кровотечения довольно яркая. При кашле появляется ощущение сдавления за грудиной, чувство удушья и затем с характерным клокотанием изо рта выделяется алая пенистая кровь без сгустков. При кровохарканье и кровотечении трудно прогнозировать их длительность, и нет уверенности, что они не повторятся вновь, в связи с чем больных даже с небольшим кровохарканьем следует госпитализировать в стационар. В обязательном порядке проводят рентгенологическое обследование в двух проекциях; при показаниях — КТ; иногда — селективную ангиографию бронхиальных артерий. Бронхоскопию применяют как диагностический метод, а при необходимости — как терапевтический (тампонада бронха). Консервативные терапевтические мероприятия находят широкое применение при малых и средних легочных кровотечениях. Лечение заключается прежде всего в назначении больному покоя в полусидячем положении для лучшего откашливания мокроты или его усаживают с наклоном на больной бок, чтобы предотвратить затекание крови в другое легкое. Назначают малопоточную оксигенотерапию 2—3 л/мин через носовой катетер, транквилизаторы и противокашлевые средства в малых дозах. Не следует давать больному кодеин и другие наркотические вещества: они способствуют подавлению кашлевого рефлекса и угнетению дыхательного центра, что приводит к застою сгустков крови и мокроты в дыхательных путях с последующим развитием аспирационной пневмонии. Для уменьшения давления крови в сосудах малого круга кровообращения (если кровь темная) вводят атропин, внутривенно 10 мл 2,4% раствора эуфиллина, накладывают жгуты на нижние конечности. При откашливании крови алого цвета показаны ганглиоблокирую-щие препараты: внутривенно капельно 5% раствор пентамина по 1 —2 мл; 1,5% ганглерона подкожно или перорально, бензогексония по 0,1-0,2 г 2 раза в сутки в течение 2—3 дней. При отсутствии этих препаратов можно осторожно ввести клофелин. С целью снижения проницаемости стенки капилляров и получения десенсибилизирующего эффекта внутривенно вводят 10 мл раствора кальция хлорида, пипольфен или димедрол подкожно или перораль-но, а также 3—5 мл 5% раствора аскорбиновой кислоты внутримышечно или по 0,1 г перорально 3—5 раз в сутки. Если у больного одномоментно выделилось более 500 мл крови, показано переливание нативной, сухой или свежезамороженной плазмы крови под контролем гематологических показателей (гемоглобин, эритроциты, гематокритное число и др.). Для восполнения О ЦК переливают растворы с высокой коллоидно-осмотической активностью: полиглюкин, реополиглюкин, желатиноль, полифер, альбумин; при необходимости — эритроцитарную массу, фибриноген. При неэффективности вышеперечисленных мероприятий накладывают пневмоперитонеум или искусственный пневмоторакс (в зависимости от формы процесса) или (при возможности) проводят оперативное вмешательство. При кровотечении у больного туберкулезом наряду с другими нео- тложными мероприятиями оправдано назначение фибри- нолиза как патогенетических средств, способствующих уменьшению протеолитических процессов и более быстрой репарации деструкции в легочной ткани. Наибольшее распространение получило введение 5% раствора эпсилонаминокапроновой кислоты (ЭАКК) по 100 мл внутривенно капельно с переходом в последующие дни на пероральный прием по 5 г 4—6 раз в сутки или антипротеолитических ферментов — кон-трикал (трасилол) в дозе 40—60 тыс. ЕД, гордокс — 500 тыс. ЕД. Излившаяся кровь, попавшая в дыхательные пути, может вызвать аспирационную пневмонию, поэтому при повышении температуры тела, развитии лейкоцитоза, появлении стойких хрипов обязательным явля- ется рентгеновское исследование. При обнаружении пневмонии необ- ходимо провести лечение антибиотиками. При отсутствии симптомов аспирационной пневмонии неспецифическую терапию не назначают, но продолжают лечение ингибиторами вместе с противо- туберкулезными и десенсибилизирующими препаратами. Современные средства гемостатической терапии весьма эффективны и позволяют добиться прекращения кровохарканья или легочного кровотечения у 80—90% больных. Непрекращающиеся легочные кровотечения и кровохарканья являются показаниями к операции. Основной операцией при легочных кровотечениях является резекция и удаление пораженной части легкого и источника кровотечения. Значительно реже показаны коллапсотерапевтические вмешательства (торакопластика, экстраплевральный пневмолиз), окклюзия бронха, перевязка бронхиальных артерий, кавернотомия с перевязкой кровоточащих сосудов. На высоте легочного кровотечения хирургические вмешательства связаны с высоким риском. Послеоперационная летальность при различных заболеваниях легких, осложненных кровотечением, остается достаточно высокой, составляя, по современным статистическим данным 15%, а при профузных легочных кровотечениях — 60—80%. Результаты лечения таких больных во многом зависят от точности и быстроты определения локализации источника кровотечения, выяснения причины и степени поражения легких, выбора метода лечения. При профузных легочных кровотечениях ухудшение состояние больных и неблагоприятные исходы обусловлены не только кровопотерей, но и дыхательной недостаточностью в результате аспирации крови в интактные отделы легких. Основное лечение направлено на восстановление проходимости дыхательных путей, предотвращение асфиксии и остановку кровотечения. Для профилактики и лечения дыхательной недостаточности используют различные приемы, направленные на освобождение трахеобронхиального дерева и защиту здоровых отделов легких от поступления крови. Наиболее целесообразна в этой ситуации экстренная бронхоскопия. Современные возможности бронхоскопии позволили расширить показания к эндоскопическому исследованию на высоте легочного кровотечения. Бронхоскопия является диагностическим вмешательством, позволяющим конкретизировать источник кровотечения, установить долевую или более мелкую анатомическую единицу легкого. Эндоскопия бронхов дает возможность временно остановить кровотечение путем окклюзии кровоточащего бронха различными искусственными обтураторами, пропитанными гемостатическими препаратами (феракрил, амифер). Феракрил — гемостатический препарат местного действия, вызывающий коагуляцию белков крови. По степени коагуляции он в 10— раз активнее гемофобина и тромбина. Вместе с тем феракрил обладает выраженным антибактериальным действием. Эффективная окклюзия позволяет защитить интактные сегменты легких от аспирации излившейся крови, а также выиграть время для подготовки больного к операции и выполнить ее в плановом порядке. Если хирургическое вмешательство противопоказано, окклюзия бронха может быть процедурой, окончательно останавливающей кровотечение. При массивных кровотечениях показана гемотрансфузия на фоне падения уровня гемоглобина, гематокритного числа и наличии ортоста-тических явлений. В этот период как во время легочного кровотечения, так и после его остановки используют свежезамороженную плазму и дицинон (1—2 ампулы внутривенно или внутримышечно). Профилактика легочных кровотечений заключается в своевременном и эффективном лечении туберкулеза легких. СПОНТАННЫЙ ПНЕВМОТОРАКС Одним из тяжелых осложнений туберкулеза легких является спонтанный пневмоторакс, развивающийся вследствие плевропульмональ-ной перфорации с образованием сообщения плевральной полости с воздухоносными путями, когда воздух поступает в свободную плевральную полость. Различают идиопатический, или первичный, и симптоматический, или вторичный, спонтанный пневмоторакс, возникающий при воспалительных и разрушающих легкое процессах. При туберкулезе легких спонтанный пневмоторакс имеет место у 15-20% больных. Опасность спонтанного пневмоторакса при тубер- состоит в том, что после его возникновения вследствие прорыва в плевральную полость туберкулезной каверны у больных развиваются пневмоплеврит и эмпиема, причем последняя характеризуется высокой летальностью. При лечении искусственным пневмотораксом вследствие разрыва плевральных сращений, своевременно не разрушенных хирургическим путем, также может возникнуть спонтанный пневмоторакс. Спонтанный пневмоторакс чаще развивается у больных с остро прогрессирующими формами туберкулеза, но может возникнуть также и при любой другой клинической форме. Причиной спонтанного пневмоторакса является главным образом перфорация субплеврально расположенного очага, реже — стенки каверны. Перфорация субплеврально расположенного туберкулезного очага может быть ничтожной по размеру и закрыться тотчас же после возникновения или функционировать короткий срок, но в ряде случаев на ее месте формируется плевропульмональ-ная фистула. При нарушении целости стенки каверны перфорация достигает значительных размеров. Во всех случаях спонтанный пневмоторакс следует рассматривать как следствие неблагоприятного течения туберкулезного процесса в легком. Клинические проявления, течение и исход его зависят от механизма возникновения, состояния плевры, легкого и сердечно-сосудистой системы. Распад субплеврально расположенного небольшого и изолированного очага ведет в большинстве случаев к быстрому закрытию перфорации — образуется закрытый пневмоторакс. Величина газового пузыря при закрытом пневмотораксе зависит от наличия или отсутствия плевральных сращений и эластичности легочной ткани. Плевральные сращения ограничивают возможность большой компрессии легкого, и спонтанный пневмоторакс может протекать без выраженных клинических симптомов. В зависимости от наличия и характера плевральных сращений различают частичный, или пристеночный, и полный спонтанный пневмоторакс. При отсутствии плевральных сращений возможно значительное поджатие легкого с образованием полного пневмоторакса. Быстрое выключение функции одного легкого и уменьшение емкости малого круга кровообращения приводит к недостаточной артериа-лизации крови и гипоксии. Внезапное выключение половины и более дыхательной поверхности влечет за собой тяжелые клинические проявления. Наиболее опасными для жизни являются первые часы спонтанного пневмоторакса. Перфорация висцерального листка плевры является следствием обширного казеозного некроза легочной ткани; при пониженной эластичности легкого в этом участке она не закрывается. В таких случаях создается открытый пневмоторакс. Клапанный (напряженный, компрессионный, или вентильный) спонтанный пневмоторакс развивается вследствие образования щелевидной перфорации, которая может закрываться эластическим легким в момент сокращения, и тогда воздух, поступивший в плевральную полость во время вдоха, не выходит из полости во время выдоха. То же происходит при извилистости сообщения плевральной полости с легким, когда в момент вдоха извилистый ход спадается на каком-то участке. Особенно опасен разрыв субплеврально расположенной каверны. В этих случаях спонтанный пневмоторакс очень быстро осложняется эмпиемой плевры. Функционирующий бронхопульмональный свищ может эпителизироваться, что делает невозможным самостоятельное закрытие фистулы. Легкое долгое время остается коллабированным, ткань его перерождается, развивается фиброз и постепенно исчезает способность к растяжению; плевра теряет эластичность. Возникает так называемый ригидный (неподвижный) пневмоторакс. Течение и исход каждого из трех видов спонтанного пневмоторакса различны. Ограниченный закрытый пневмоторакс может протекать бессимптомно, гемодинамических расстройств обычно не наблюдается. Перфорация висцеральной плевры при мало измененном легком быстро закрывается, инфекция в плевральную полость не поступает, и через некоторый срок газовый пузырь исчезает бесследно. Наиболее частой причиной закрытого спонтанного пневмоторакса яв -ляется распад отдельных туберкулезных очагов, локализующихся в плевральной ткани, или разрушение истонченных участков плевры при бул-лезной эмфиземе; окружающая истонченный участок легочная ткань мало изменена и эластична. Общим симптомом для начала закрытого, открытого или клапанного пневмоторакса является внезапная боль в боку, возникающая обычно кашле, смехе, физическом напряжении, редко без видимой причины. При большом газовом пузыре появляется одышка. Боль и одышка могут быть весьма интенсивными. В отдельных случаях они сопровождаются коллаптоидным состоянием, признаками которого являются резкая слабость, бледность слизистых и кожных покровов, холодный пот, частый и слабый пульс, падение АД, набухшие шейные вены, усиленное, напряженное дыхание. Такие грозные симптомы развиваются главным образом при внезапном поджатии легкого и смещении органов средостения в противоположную сторону. На стороне пневмоторакса грудная клетка расширена, межреберья сглажены, дыхательные движения резко ограничены. При перкуссии определяется коробочный или тимпаническии звук в зависимости от количества воздуха в плевральной полости и высоты внутриплевраль-ного давления. Голосовое дрожание при наличии громкого перкуторного тона ослаблено или иногда отсутствует. При значительном повышении внутриплеврального давления перкуторный тон приглушен, имеет металлический оттенок. Такой же перкуторный звук определяется при левостороннем пневмотораксе на месте обычной сердечной тупости. Нижняя граница измененного перкуторного звука доходит до реберной дуги. Селезеночная тупость при левостороннем пневмотораксе и печеночная при правостороннем исчезают. Соответственно печень и селезенка смещены и выступают из-под реберной дуги; нижняя граница печени доходит до пупочной Усиленные дыхательные движения, которые могли бы служить компенсаторным целям, еще больше усугубляют указанные выше нарушения. вдохе здоровое легкое присасывает через трахею не только внешний воздух, но частично, и в первую очередь, остаточный воздух из спавшегося легкого. При выдохе некоторая часть воздуха из здорового легкого таким же путем через бифуркацию трахеи нагнетается в спавшееся легкое, возникает так называемое маятникообразное качание воздуха. Таким образом, при каждом вдохе в здоровое легкое накачивается многократно отработанный воздух — обстоятельство, весьма неблагоприятно влияющее на легочный газообмен. Неполное поджатие легкого, быстрое закрытие перфорированного отверстия и прекращение поступления воздуха в плевральную полость сопровождаются менее выраженными и кратковременными симптомами. При клапанном механизме пневмоторакса одышка и гемодинамичес-кие расстройства усиливаются, создавая напряженный пневмоторакс с нарастающим положительным давлением в плевральной полости. Спонтанный пневмоторакс обычно распознается уже на этапе сбора анамнеза и физикального исследования. Локализованная боль в грудной клетке на стороне поражения связана с поступлением воздуха в плевральную полость или натяжением спаек. Впоследствии боль постепенно утихает. Выраженность одышки не всегда коррелирует с объемом пневмоторакса. У 1/3 больных появляется кашель — сухой или с мокротой, что в свою очередь определяется сопутствующими заболеваниями. К другим жалобам относятся общая слабость, головная боль, сердцебиение, кровохарканье, боль в надчревной области и др. Эти жалобы непостоянны и не имеют большого значения для диагностики; до 6% больных вообще не предъявляют жалоб. При спонтанном пневмотораксе выявляются три основных физикальных признака — отсутствие или значительное снижение голосового дрожания, тимпанический звук при перкуссии над этими участками, аускультативно отсутствие или ослабление дыхательных шумов. При сопутствующем плевральном выпоте — шум плеска; иногда больные сами ощущают жидкость в плевральной полости. Пато-гномоничным признаком является подкожная эмфизема в любом месте в области груди или шеи. Окончательно подтвердить диагноз (обнаружение воздуха в плевральной полости) позволяют лучевые методы исследования — рентгенография, рентгеноскопия, КТ. Рентгенография грудной клетки, производимая на вдохе и выдохе, выявляет наличие воздуха в плевральной полости по отсутствию сосудистого рисунка в латеральных отделах пораженной стороны и наличию четкой границы коллабированного легкого (рис. 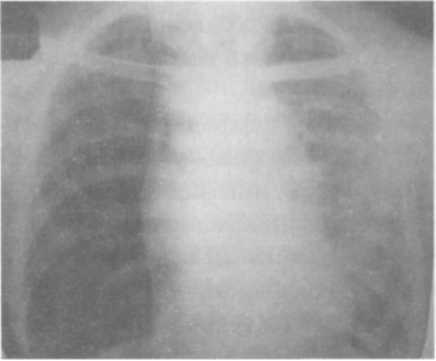 Воздух, проникший в полость плевры, обычно окутывает легкое в виде светлой полосы, которая при исследовании в переднем положении проецируется вдоль латеральной стенки грудной клетки. Висцеральная плевра коллабированного легкого иногда хорошо выделяется. В связи с компенсаторным увеличением кровенаполнения легочной рисунок более интенсивен на здоровой стороне, нередко смещение сердца в противоположную сторону, а при осложнении пневмоторакса экссу-дативным плевритом — горизонтальный уровень жидкости. В последнее время стандарт- ным методом диагностики спон- танного пневмоторакса стала КТ грудной клетки. Она позволяет Рис. 14.1. Рентгенограмма больного лучше, чеМрентгенография, рас- кавернозным туберкулезом легких, ос- познать болезни плевры, кистоз- ложненным спонтанным пневмото- ные и буллезные образования в раксом легких. К дополнительным мето- дам исследования относится торакоскопия, с помощью которой у пациентов со спонтанным пневмотораксом в 2/3 случаев находят плевральные сращения, небольшие пузырьки (до 2 см) на плевре, а иногда многочисленные большие буллы (более 2 см). Места разрывов при торакоскопии обнаруживают редко, что связано, во-первых, с «самогерметизацией» плевры; во-вторых, с нахождением дефектов не на висцеральной плевре, а на париетальной в области средостения; в-третьих, с малым размером дефектов. К косвенным признакам перфорации некоторые исследователи относят локальные фибриновые наложения на висцеральной плевре и пенящийся выпот в плевральной полости. Очень существенны для диагностики показания манометра пневмо-тораксного аппарата. Изменение внутриплеврального давления дает возможность определить тип спонтанного пневмоторакса. Отрицательное давление характерно для закрытого спонтанного пневмоторакса; бронхиальное близкое к атмосферному (колебания между —2 и +2 или -1 и + 1) — для открытого, и нарастающее положительное — для напряженного клапанного пневмоторакса. Закрытый спонтанный пневмоторакс редко осложняется экссудатив-ным плевритом. Открытый спонтанный пневмоторакс, а также вентильный пневмоторакс, всегда осложняются гнойным плевритом со смешанной микробной флорой. Клиническое течение открытого спонтанного пневмоторакса более длительное, чем закрытого, главным образом вследствие быстрого (через 2—3 сут) появления выпота в плевральной полости. Наиболее тяжело протекает клапанный пневмоторакс. Нарастающее положительное давление в плевральной полости увеличивает одышку, больной в первые часы после образования вентильного пневмоторакса возбужден, что является характерным симптомом начального периода гипоксии. Клапанный (напряженный) пневмоторакс обычно приводит к ослаблению сердечной деятельности. Осложнение спонтанного пневмоторакса гнойным туберкулезным плевритом, тем более смешанной этиологии, утяжеляет состояние больного и ухудшает прогноз. При возникновении спонтанного пневмоторакса больной нуждается в строжайшем покое. Усиленные дыхательные движения, кашель способствуют дальнейшему повышению внутриплеврального давления. Больного, который в первый момент находится в возбужденном состоянии, необходимо успокоить, уложить в постель, придав ему возвы- положение ввести морфин, при наличии выраженной гипок-семии дать дышать кислородом, ввести камфору, кофеин. Лечение спонтанного пневмоторакса преследует две цели — выведение воздуха из плевральной полости и снижение вероятности развития рецидива, и зависит от механизма его возникновения. По объему воздуха в плевральной полости выделяют следующие виды пневмоторакса — небольшой (менее 20% гемоторакса); средний (легкое коллабировано до половины расстояния между латеральным краем плевральной полости и границей сердца) и большой спонтанный пневмоторакс. Небольшой пневмоторакс обычно не нуждается в лечении, если только у пациента дыхательная функция не скомпрометирована предшествующим заболеванием. Средний пневмоторакс нуждается в удалении. Чаще используют метод повторных аспирации с помощью иглы и шприца объемом 50—100 мл. Иглу вводят под местной анестезией во втором межре-берье по среднеключичной линии или в четвертом-шестом — по средней подмышечной линии. При большом пневмотораксе необходимо введение дренажной трубки. Анатомические ориентиры те же, что при аспирации. Дренаж соединяют с сифонной системой (с подводными замками), действующей как однонаправленный клапан, или аппаратом вакуумного отсасывания. Можно также использовать дренажную трубку, снабженную клапаном. Закрытый спонтанный пневмоторакс, протекающий без экссудатив-ного плеврита, можно оставить без внутриплевральтных вмешательств, если газовый пузырь не нарушает деятельность сердечно-сосудистой системы. Постепенно воздух в плевральной полости рассасывается, легкое расправляется, и плевральные листки вновь соединяются. Наиболее тяжелые состояния, угрожающие жизни пациента, возникают при развитии клапанного пневмоторакса, когда в плевральной полости накапливается очень большое количество воздуха под все повышающимся давлением. Состояние больного ухудшается с каждым часом, может наступить смертельный исход. По жизненным показаниям необходимо экстренное дренирование. Если таковое в данный момент технически невозможно, то, не теряя времени, следует ввести в плевральную полость большую «внутривенную» иглу для уменьшения внутриплевраль-ного давления (не дожидаясь резульатов рентгенографии). Вместе с тем в случаях с тяжелыми расстройствами дыхания и кровообращения, независимо от формы пневмоторакса, а особенно часто при клапанном пневмотораксе, срочное откачивание большого количества воздуха противопоказано, если нет витальных показаний. В некоторых случаях достаточно ввести в плевру толстую иглу для плевральной пункции, в результате чего достигается выравнивание внутриплеврального и атмосферного давления, то есть закрытый пневмоторакс превращается, в известной мере, в открытый. При пневмотораксе всегда следует помнить о возможности инфицирования. При бронхоплевральном свище, не закрывающемся в результате дренирования, показано оперативное лечение. Пациентам с повторными пневмотораксами показан плевродез путем введения в полость плевры раздражающих веществ (доксициклин, тальк), которые провоцируют асептическую воспалительную реакцию. Альтернативой плевродезу является плеврэктомия, которая заключается в удалении одного слоя плевры, что приводит к облитерации полости. Для профилактики рецидива используют плевродез склерозирующими веществами, в частности тетрациклином в дозе 20 мг/кг внутриплеврально при расправленном легком. Хирургические вмешательства носят характер закрытых или открытых. Закрытым является плевроскопия (торакоскопия), которую можно соче- тать с плевродезом. Во время плевроскопии иногда удается обнаружить дефект висцеральной плевры и прижечь участок дефекта до образования струпа. Открытое хирургическое вмешательство обязательно в тех случа- ях, когда спонтанный пневмоторакс обусловлен разрывом каверны. В этих случаях резекция пораженного отдела легкого (сегмент, доля) в сочета- нии с одномоментной торакопластикой и возможно быстрым последую- щим расправлением оставшихся отделов легкого предотвращает развитие эмпиемы. При наличии хронического спонтанного пневмоторакса, ослож- ненного эмпиемой и бронхопульмональным свищем, показана операция по удалению всего плеврального мешка — с одновремен- ной резекцией пораженного участка легкого. Лечение спонтанного пневмоторакса у больных туберкулезом проводят на фоне комбинированной химиотерапии туберкулеза. Неблагоприятные исходы спонтанного пневмоторакса в настоящее время весьма редки. ЛЕГОЧНОЕ СЕРДЦЕ Изменения сердечно-сосудистой системы при туберкулезе легких развивается в основном у больных остро прогрессирующими и хроническими формами туберкулеза легких и обусловлены различными патогенетическими механизмами, ведущими к развитию легочного сердца. Согласно современным представлениям, к основным причинам его развития при туберкулезе относятся:
Развитию гипертензии в малом круге кровообращения в свою очередь способствуют:
• повышение внутриальвеолярного давления вследствие обструк-тивных нарушений; • факторы, повышающие вязкость крови и затрудняющие ее циркуляцию в малом круге кровообращения. Низкое Р02 в альвеолах приводит к неполному насыщению артериальной крови кислородом, наступает гипоксемия, в результате которой компенсаторно увеличивается количество эритроцитов, что влияет на вязкость крови, повышается сопротивление кровотоку. Клиническая картина легочного сердца складывается из симптомов, обусловленных туберкулезом легких, а также признаков легочной и сердечной недостаточности. Чаще всего наблюдаются одышка, кашель, чувство удушья, цианоз, хрипы в легких. Для выявления начальных признаков легочной гипертензии используют УЗИ сердца и сосудов. При профессировании туберкулеза легких у больных на фоне тяжелой гипоксии и гиперкапнии возможно развитие токсико-аллергических васкулитов. При повышении проницаемости сосудов головного мозга образуются кровоизлияния, развивается отек мозга и возникает энцефалопатия — диффузное мелкоочаговое поражение дистрофического характера. При этом отмечаются повышенная возбудимость, агрессивность, головокружение, упорная и интенсивная головная боль по утрам. Лечение включает комбинированную химиотерапию туберкулеза, окси-геноторапию, витаминотерапию, применение селективных ров, ингибиторов АПФ, метаболических и седативных средств. АМИЛОИДОЗ ВНУТРЕННИХ ОРГАНОВ Амилоидоз — системное заболевание, в основе которого лежат изменения, приводящие к внеклеточному выпадению в ткани амилоида — сложного белково-полисахаридного комплекса, вызывающего в конечном итоге нарушение функций органов. Фибриллярный белок амилоида в одних случаях имеет ряд свойств, сближающих его с иммуноглобулинами, в других, не обладая этими свойствами, имеет антигенное сродство с сывороточным белком, считающимся предшественником амилоида. Амилоидоз внутренних органов развивается при длительном хроническом течении туберкулеза и проявляется отложением амилоида в тканях. При окрашивании Конго красным при поляризационной микроскопии амилоид обнаруживают по зеленому цвету. Электронная микроскопия позволяет установить окончательный диагноз. Клиническая картина амилоидоза отличается полиморфизмом проявлений, которые зависят от локализации амилоидных отложений, степени их распространенности в органах, длительности течения заболевания, наличия осложнений. Клиническая картина становится развернутой при поражении почек — наиболее частой локализации процесса, а также кишечника, сердца, нервной системы. Больные амилоидозом почек долго не предъявляют каких-либо жалоб, и только появление отеков, их распространение, усиление общей слабости, резкое снижение диуреза, развитие почечной недостаточности, артериальной гипертензии, присоединение осложнений (например, тромбозы почечных вен с болевым синдромом и анурией) заставляют больных обратиться к врачу. Иногда наблюдается диарея. Важнейший симптом амилоидоза почек — протеинурия. Она развивается при всех его формах, но наиболее характерна для вторичного амилоидоза. С мочой за сутки выделяется до 40 г белка, основную часть которого составляют альбумины. Продолжительная потеря белка почками приводит к гипопротеинемии (гипоальбуминемия) и обусловленному ею отечному синдрому. При амилоидозе отеки приобретают распространенный характер и сохраняются в терминальной стадии уремии. Диспротеинемия проявляется также значительным ускорением СОЭ и изменением осадочных проб. При выраженном амилоидозе возникает гиперлипидемия за счет увеличения содержания в крови холестерина, Р-липопротеидов, триглицеридов. Сочетание массивной протеинурии, гипопротеинемии, ги-перхолестеринемии и отеков (классический нефротический синдром) характерно для амилоидоза с преимущественным поражением почек. При исследовании мочи, помимо белка, в осадке обнаруживают цилиндры, эритроциты, лейкоциты. К другим проявлениям амилоидоза относятся нарушения функции сердечно-сосудистой системы (прежде всего в виде артериальной гипо-тензии, редко гипертензии, различных нарушений проводимости и ритма сердца, сердечной недостаточности), пищеварительного тракта (синдром нарушения всасывания, мальабсорбция). Часто отмечается увеличение печени и селезенки, иногда без явных признаков изменения их функции. Основой лечения амилоидоза при туберкулезе является комбинированная химиотерапия. Больным ограничивают потребление белка и соли, рекомендуют длительный (1,5—2 г) прием сырой печени по 100—120 г/сут. В начальных стадиях процесса назначают препараты 4-амино-хино-линового ряда (делагил по 0,25 г 1 раз в день внутрь). Возможно сочетание мелфалана и преднизолона, иногда с присоединением колхицина или только колхицин. Применяют курсы введения 5% раствора унитиола по 5—10 мл внутримышечно в течение 30—40 сут. Объем симптоматической терапии определяется выраженностью тех или иных клинических проявлений (мочегонные при значительном отеч- ном синдроме, гипотензивные средства при наличии артериальной ги- пертензии и др.). Спленэктомия состояние больного вследствие уменьшения количества амилоида, образующегося в организме. |
