физиология экзамен. Физиология мои ответы экзамен. 40. Детектирование сигналов и опознание образов. Детектирование сигналов
 Скачать 4.25 Mb. Скачать 4.25 Mb.
|
|
204. Почечный эндокринный контур регуляции АД: ренин-ангиотензин-альдостероновая система. Ренин образуется в виде г роренина и секретируется в юкстагломерулярном аппарате (ЮГА) (от латинских слов juxta — около, glomerulus — клубочек) почек миоэпителиоидными клетками приносящей артериолы клубочка, получившими название юкстагломерулярных (ЮГК). Структура ЮГА приведена на рис. 6.27. В ЮГА кроме ЮГК также входит прилегающая к приносящим артериолам часть дистального канальца нефрона, многослойный эпителий которого образует здесь плотное пятно — macula densa. Секреция ренина в ЮГК регулируется четырьмя основными влияниями. Во-первых, величиной давления крови в приносящей артериоле, т. Е. степенью ее растяжения. Снижение растяжения активирует, а увеличение — подавляет секрецию ренина. Во-вторых, регуляция секреции ренина зависит от концентрации натрия в мочедистального канальца, которая воспринимается macula densa — своеобразным Na-рецептором. Чем больше натрия оказывается в моче дистального канальца, тем выше уровень секреции ренина. В-третьих, секреция ренина регулируется симпатическими нервами, ветви которых заканчиваются на ЮГК, медиатор норадреналин через бета-адре-норецепторы стимулирует секрецию ренина. В-четвертых, регуляция секреции ренина осуществляется по механизму отрицательной обратной связи, включаемой уровнем в крови других компонентов системы — ангиотен-зина и альдостерона, а также их эффектами — содержанием в крови натрия, калия, артериальным давлением, концентрацией простагландинов в почке, образующихся под влиянием ангиотензина. 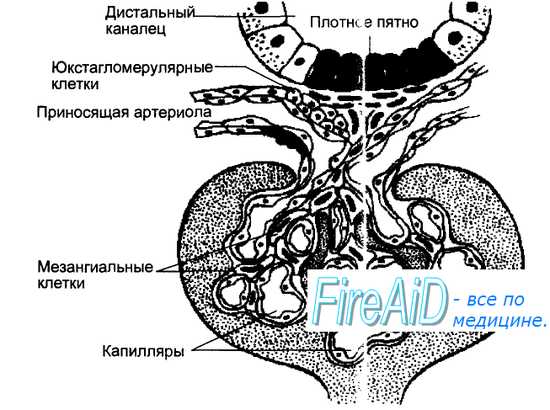 Рис. 6.27. Схема юкстагломерулярного аппарата почек, включающего юкстагломерулярные клетки стенки приносящей артериолы, клетки плотного пятна (macula densa) стенки дистального канальца и мезангиальные клетки. Основное место выработки ренина — юкстагломерулярные клетки приноящей артериолы клубочка. 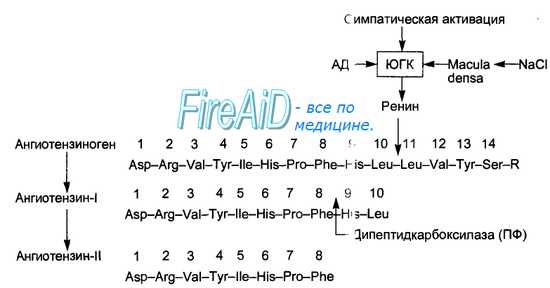 Рис. 6.28. Активация секреции ренина и образование в крови ангиотензина-II. Показаны три вида стимулов для секреции ренина юкстагломерулярными клетками почек: снижение АД в приносящей артериоле клубочка, повышение симпатической активности, влияния macula densa, вызванные сдвигами уровня натрия. Под влиянием фермента ренина от молекулы белка ангиотензиногена отщепляется декапептид — ангиотензин-I. Этот пептид подвергается воздействию превращающегося фермента (ПФ) дипептидкарбоксилазы клеток эндотелия сосудов легких, почек и др., отщепляющей две аминокислоты. Образующийся октапептид является ангиотензином-II. Ангиотензин-II, кроме стимуляции продукции альдостерона, обладает следующими эффектами: • вызывает сужение артериальных сосудов, • активирует симпатическую нервную систему как на уровне центров, так и способствуя синтезу и освобождению норадреналина в синапсах, • повышает сократимость миокарда, • увеличивает реабсорбцию натрия и ослабляет клубочковую фильтрацию в почках, • способствует формированию чувства жажды и питьевого поведения. Таким образом, ренин-ангиотензин-альдостероновая система участвует в регуляции системного и почечного кровообращения, объема циркулирующей крови, водно-солевого обмена и поведения. 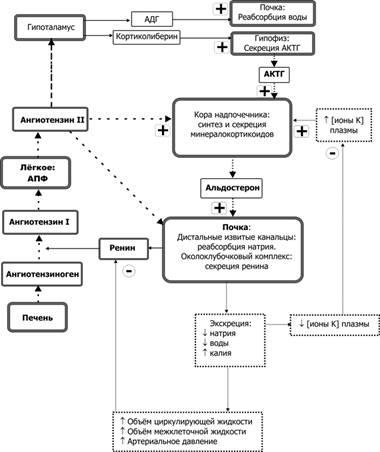 205. Морфофункциональные особенности коронарного кровообращения, методы его исследования. Важнейшими показателями кровоснабжения сердца являются достаточность коронарного кровотока и коронарный резерв. Критерием достаточности коронарного кровотока служит отношение доставки О2 к потребности миокарда в нем. Его величина ниже 1,2 указывает на критическое уменьшение оксигенации миокарда, что наблюдается, например, при коронарной недостаточности. Критерием коронарного резерва – максимально возможного увеличения коронарного кровотока при вазодилатации коронарных артерий – является отношение разницы между максимально возможной доставкой О2 к активно работающему сердцу и потреблением О2 в покое к величине потребления О2 в покое. В норме, в зависимости от уровня метаболической потребности миокарда, коронарный резерв может обеспечить сердце до 5 раз большим количеством О2 по сравнению с потреблением в условиях функционального покоя. В оценке коронарного резерва наиболее информативны методы трансторакальной эхокардиографии и позитронной эмиссионной томографии, с помощью которых измеряется максимальная скорость диастолического кровотока в разных ветвях венечных артерий, в частно- сти, в нисходящей ветви левой коронарной артерии. При этом используются тесты с дозированной. физической нагрузкой на тредмиле. Пробы с физической нагрузкой позволяют определить толерантность пациента к ней, изучить характер изменений АД и ЧСС. При определении дилататорного резерва коронарных артерий также используют частую чреспищеводную электростимуляцию предсердий, во время которой увеличение протребления О2 миокардом происходит только за счет прироста ЧСС без значительного изменения АД. Прекращение электростимуляции предсердий сопровождается почти мгновенным восстановлением ЧСС и исходных показателей гемодинамики, что свидетельствует о безопасности данной пробы для пациента. Гемодинамические основы интенсивности коронарного кровотока, как и в других органах, может быть описисана уравнением Q = ΔP/R, согласно которому объемная скорость кровотока (Q) прямопропорциональна перфузионному градиенту давления в сосудах (ΔP) и обратнопропорциональна сопротивлению сосудистого русла (R). Зависимость объемной скорости коронарного кровотока от перфузионного давления в сосудах сердца значительно более сложна, чем в сосудах других органов. Перфузионный градиент в сосудах циклически сокращающегося сердца определяется не только разностью между АД на входе в его сосудистое русло и венозным давлением на выходе из него. Он зависит и от циклических изменений внесосудистого давления в различных участках миокарда и полостях сердца, поэтому уровень перфузионного давления в коронарном сосудистом русле определяется взаимодействием трех основных видов давления и описывается формулой: ΔP=PАД –PВД –PТК, (3) где РАД – артериальное давление, РВД – венозное давление, РТК – тканевое (внесосудистое) давление, развивающееся во время систолы и при сокращении миокарда, сдавливающее его сосуды. Входное давление для перфузии сердца генерируется непосредственно самим сердцем, поскольку кровяное давление в проксимальном отделе аорты одновременно служит входным давлением для коронарной циркуляции. В свою очередь, аортальное давление, создающее сопротивление у выхода из левого желудочка (постнагрузка левого желудочка), влияет на уровень механической работы сердца и тем самым определяет потребность миокарда в питательных веществах и кислороде, т.е. в адекватном кровоснабжении. Поэтому повышение аортального давления при физической работе способствует увеличению перфузионного давления в сосудах сердца и, соответственно, возрастанию коронарного кровотока. Источник формирования и природа венозного давления в коронарном сосудистом русле остаются невыясненными. Очевидно, оно не равно венозному давлению в месте перехода коронарного синуса в правое предсердие, поскольку известно, что при снижении входного АД, приток крови в коронарные сосуды прекращается, если давление в аорте составляет 50-20 мм рт.ст., т.е. значительно превышает таковое в правом предсердии. Считается, что наличию этого давления, названного «давление нулевого кровотока», могут способствовать два основных фактора: 1) периодически возникающее частичное спадение коронарных сосудов, обусловленное действием на них возрастающего в систолу тканевого давления; 2) наличие в коронарном русле емкостного сопротивления, проявляющегося для поддержания перфузии миокарда при пульсирующем токе крови. Значение тканевого внесосудистого давления в создании перфузионного давления в коронарных сосудах отличается фазовостью, поскольку сдавление венечных сосудов происходит периодически при сокращениях миокарда, а степень этого сдавления, вызывающего систолическое ограничение притока артериальной крови, максимальна в глубоких слоях миокарда левого желудочка, куда кровь поступает преимущественно во время диастолы. Известно, что кровоток в левой коронарной артерии в период систолы желудочка составляет примерно 1/6 часть такового в диастолу. В мышце правого желудочка интенсивность кровотока также подвержена фазным изменениям, однако выраженность систолического ограничения артериального кровотока здесь меньше, так как развиваемое им в систолу давление существенно меньше аортального. Таким образом, фазовый характер участия внесосудистого давления в коронарной перфузии обусловливает специфическую функциональную особенность кровоснабжения сердца, заключающуюся в том, что коронарный кровоток зависит от периода сердечного цикла. Интенсивное кровоснабжение сердца наблюдается в диастолу, тогда как во время механической систолы (самый напряженный период его деятельности) коронарный кровоток уменьшается почти полного его прекращения и даже появления ретроградного кровотока в субэндокарде левого желудочка. Единого мнения о механизмах компенсации энергетического обмена в миокарде при систолическом ограничении кровотока в нем не существует. Предполагается, что метаболические потребности сердца в этих условиях удовлетворяются несколькими факторами: высокой экстракцией кислорода миоглобином мышцы сердца, содержание которого в кардиомиоцитах в 1.5-2 раза превышает таковое в скелетной мышце, высокой растяжимостью сосудов сердца, примерно в 6 раз превышающей таковую в скелетной мышце, а также резким ускорением оттока венозной крови в период систолы. Методы исследования коронарного кровообращения. Коронарография -рентгенологический метод исследования венечных сосудов путем их контрастирования, используемый с целью выяснения пропускной способности коронарных сосудов, а также оценки коллатерального кровотока. При ишемической болезни сердца коронарография служит для уточнения локализации и протяженности стенозов и окклюзии коронарных сосудов. Неинвазивную количественную оценку венечного кровотока можно осуществить с помощью специальных вариантов метода компьютерной томографии коронарных артерий (электронно-лучевая компьютерная томография и однофотонная эмиссионная компьютерная томография). Наибольшее распространение получили допплерографические методы исследования сосудистой системы сердца. Современные эхокардиографические методы представлены трансторакальной эхокардаографией и чреспищеводной эхокардиографией. Оба метода позволяют неинвазивно визуализировать коронарные сосуды. Однако возможности первого из них ограничены локацией только проксимальных участков венечных артерий, тогда как при чреспищеводной эхокардиографии, являющейся более современным вариантом стандартного эхокардиографического исследования с применением многопланового эндоскопического датчика, вероятность визуализации коронарных артерий на большем протяжении намного выше. Перспективной из этой группы методов исследования коронарного кровообращения представляется контрастная чреспищеводная эхокардиография, позволяющая исследовать кровоток не только в артериях сердца, но и оценивать функцию венечных шунтов и анастомозов, а также потоковые характеристики коронарного кровотока. Наиболее полную информацию о состоянии кровоснабжения сердца дает метод позитронной эмиссионной томографии, позволяющий определить количественные характеристики коронарного кровотока и, что очень важно, оценить коронарный резерв у человека в норме и при патологии сердца. Перфузионная сцинтиграфия - точный метод изучения кровоснабжения миокарда, предполагающий использование пирофосфата, меченного 99mTc, накапливающегося в рубцовой ткани, очагах ишемии и некроза, а также 201TI (таллия), обладающего тропностью к нормально кровоснабжаемому миокарду. По аналогии с радионуклидной вентрикулографией исследование выполняют с помощью гамма-камеры, в покое и при нагрузках. Доступными методами оценки коронарного резерва (способность коронарных артерий пропускать количество крови, адекватное возросшим потребностям миокарда) являются пробы с дозированной физической нагрузкой на велоэргометре и/или тредмиле (бегущая дорожка). В процессе их выполнения методом контроля служит электрокардиография, обычно в отведениях по Небу, в которых контролируется положение сегмента ST по отношению к изоэлектрической линии. Пробы с физической нагрузкой позволяют определять толерантность обследуемого к ней, изучать характер изменений АД и ЧСС. Наряду с пробами с физической нагрузкой при определении расширительного резерва коронарных артерий используют тест с частой чреспищеводной электростимуляцией предсердий. При этом увеличение протребления кислорода миокардом происходит только в результате прироста ЧСС без значительных сдвигов АД. Прекращение электростимуляции предсердий сопровождается почти мгновенным восстановлением ЧСС и исходных показателей гемодинамики, что делает данную пробу более безопасной. Поскольку данное исследование проводят в положении лежа на спине в состоянии физического покоя, легко удается регистрировать стандартную электрокардиограмму без существенных искажений. 206. Регуляция коронарного кровообращения. Обязательным условием адекватной насосной функции сердца является поддержание гомеостаза, что обеспечивается регуляторными процессами в системе коронарного кровообращения, к которым относятся функциональная гиперемия, ауторегуляция коронарного кровотока, сосудистые реакции на изменение газового состава крови, а также постокклюзионная гиперемия, по-видимому, принимающая участие в диастолическом увеличении коронарного кровотока. Важную роль в регуляции кровоснабжения сердца играет изменение сопротивления коронарного русла, зависящее от величины просвета коронарных сосудов. К местным факторам регуляции сократительной активности ГМК коронарных сосудов относятся кислородный режим ткани и содержание продуктов клеточного метаболизма, образующихся при работе сердца. Наряду с рО2 и метаболитами, активное влияние на просвет коронарных сосудов оказывают факторы, определяющие уровень осмолярности и рН интерстициальной жидкости, а также вазоактивные вещества, продуцируемые сосудистым эндотелием и тромбоцитами. К дистанционным факторам регуляции коронарных сосудов относятся влияния вазомоторных нервных волокон (нейрогенная регуляция) и содержащихся в крови биологически активных веществ (гуморально-гормональная регуляция). Местные метаболические факторы регуляции. Гипоксия. Снижение кислородного снабжения миокарда сопровождаются дилатацией коронарных сосудов и развитием в сердце гиперемии, что связывают с чрезвычайно высокой чувствительностью сосудов миокарда к недостатку кислорода. Снижение рО2 нарушает метаболизм в тканях сердца и сосудистой стенки, что приводит к активации местных тканевых метаболитов, оказывающих расслабляющее действие на гладкие миоциты сосудов и выступающих в роли посредников между изменением рО2 и развитием в миокарде гиперемии. Регулирующая роль рО2 в контроле коронарного кровотока проявляется также и в его способности модулировать действие других вазоактивных факторов. Гиперкапния и ацидоз. Следствием увеличения работы сердца, как и снижения миокардиальной перфузии является увеличение рСО2, который обладает высокой способностью к диффузии, и быстро достигает равновесия во внутриклеточном, интерстициальном и внутрисосудистом пространствах. Вазодилатирующий эффект рСО2 невелик и сопоставим с влиянием других кислых продуктов метаболизма, например, молочной кислоты, аденозина и сопутствующих изменений рН. Гиперосмолярность, К+ и Са2+ . В качестве определяющей причины гиперосмолярности, наблюдаемой при увеличении работы сердца, как и сопутствующей ей вазодилатации, можно рассматривать увеличение в периваскулярном пространстве концентрации К+ , избыток которого приводит к гиперполяризации мембран сосудистых гладких миоцитов, снижая их функциональную активность и тем самым тонус коронарных сосудов. При активации работы сердца содержание К+ в интерстициальном пространстве характеризуется только начальным и вскоре преходящим возрастанием и, следовательно, может выступать лишь в роли одного из факторов, вызывающих функциональную гиперемию в сердце. Уровень внеклеточного Са2+ представляется важнейшим фактором поддержания повышенного тонуса коронарных сосудов, поскольку известно, что другие регуляторные факторы и вещества, блокирующие трансмембранный вход Са2+ в сосудистую гладкомышечную клетку, вызывают коронарную вазодилатацию. Тем не менее, в норме во время развития в сердце разнообразных вазомоторных реакций концентрация Са2+ в интерстициальном пространстве выходит за физиологические пределы. Аденозин. На молекулярном уровне аденозин является одним из мощных коронарных вазодилататоров, уступая в этом лишь брадикинину. Содержание аденозина в интерстициальном пространстве эффективно контролируется, поскольку доказано наличие в коронарных артериолах специфических аденозиновых А2-рецепторов. Аденозин быстро диффундирует из цитозоля кардиомиоцита в интенстициальное пространство, откуда часть его молекул расходуется для воздействия на специфические рецепторы коронарных артериол, а другая часть переносчиком транспортируется обратно в кардиомиоцит и рефосфорилируется. Проникая через сосудистую стенку, он связывается эндотелиальными клетками сосудистой стенки или эритроцитами с последующим превращением в вазонеактивные катаболиты. Аденозин является источником локальной положительной обратной связи для регуляции кардиомиоцитами собственного кровоснабжения. Если содержание АТФ уменьшается, то аденозин образуется в повышенном количестве и, диффундируя к артериолам, способствует увеличению кровотока и доставке необходимого количества кислорода. Считается также, что при ишемии молекулы аденозина выступают в роли естественного ингибитора адренорецепторов кардиомиоцитов, и поэтому становятся невосприимчивыми к симпатической стимуляции. В крови содержатся многие вазоактивные вещества, которые при изолированном действии на ГМК оказывают либо сосудорасширяющее (β-агонисты, простагландин PGI2, предсердный натрийуретический пептид, субстанция Р, вазоинтестинальный пептид и т.д.), либо сосудосуживающее (α1 и α2-агонисты, серотонин, эндотелин, ангиотензин II и др.) влияние. Так, например, β-агонисты и PGI2, стимулируя аденилатциклазу, увеличивают содержание цАМФ, что приводит к уменьшению свободного внутриклеточного Са2+ и релаксации сосудов. NO и натрийуретический пептид, активируя гуанилатциклазу, накапливают цГМФ, который тормозит увеличение внутриклеточной концентрации кальция и способствует его выходу из клетки, что также приводит к расслаблению сосудов. α2-агонисты сдерживают аденилатциклазу и таким образом препятствуют вазодилатирующему действию β-агонистов и PGI2. В свою очередь, α1-агонисты, серотонин, эндотелин и ангиотензин II, активируя фосфолипазу С, стимулируют образование инозитолтрифосфата, который увеличивает в клетках концентрацию Са2+, что приводит к активации их сокращений. В физиологических концентрациях, вышеуказанные факторы (за исключением катехоламинов и ангиотензина II) на тонус коронарных сосудов существенного влияния не оказывают. Однако при их повышенных концентрациях возможны дозозависимые реакции. Так, например, вазопрессин оказывает дилатирующее действие на крупные коронарные артерии при одновременном сужении артериол, в результате чего восрастает общее коронарное сопротивление. |
