МОНОГРАФИЯ Гепатит и последствия гепатита. Майер К.-П (в word). Гепатит и последствия гепатита Практич рук. Пер с нем. Под ред. А. А. Шепулина. М. Гэотар медицина, 1999. 432 с
 Скачать 6.25 Mb. Скачать 6.25 Mb.
|
|
Лечение в острой фазе печеночной энцефалопатии Гиперглюкагонемия ответственна (по меньшей мере, частично) и за повышение уровня аммиака в крови, поскольку избыток глюкагона стимулирует глюконеогенез из аминокислот с целью образования глюкозы как субстрата для многочисленных функций организма. Можно предположить, что уменьшение содержания гликогена в цирро-тической печени в значительной мере способствует типичному для таких больных повышению уровня аммиака в крови. Следовательно, с терапевтических позиций целесообразно остановить с помощью рациона соответствующей энергетической ценности катаболические процессы в мышцах, происходящие при глюконеогенезе. С этой целью больным ПСЭ (по крайней мере, в острую фазу) рекомендуется инфузионная терапия концентрированными растворами глюкозы. Давно установлено, что при ограничении потребления белка течение ПСЭ улучшается, а при увеличении его потребления, наоборот, ухудшается. У всех больных с острой фазой ПСЭ сначала лучше полностью отказаться от введения белка с пищей и вводить необходимые энергетические субстраты внутривенно в виде концентрированных растворов глюкозы. Если неврологический статус больного улучшается и больной может вновь принимать пищу, то ему дают сначала 20—30 г белка в день. Затем с интервалами 5—10 дней мы повышаем содержание белка в пищевом рационе (каждый раз на 10 г), доводя его количество до 50 г в день. В практическом плане чрезвычайно важно распределить суточное количество белка на несколько приемов пищи и одновременно назначить лактулезу с целью предотвращения острой перегрузки ферментной системы, участвующей в метаболизме азотистых веществ. Менее известно, что у больных, которых считали непереносящими белок, клинические признаки ПСЭ продолжали отсутствовать, если суточное потребление белка повышалось очень и очень медленно. Удивительно, что эти больные могли в конце концов переносить 80 г белка в сутки и более. Вместе с тем у больных декомпенсированным циррозом печени и особенно у пациентов, перенесших шунтирующие операции, диапазон между хорошо переносимым и способным вызвать явления ПСЭ количеством белка оказывается очень узким (one meatball syndrome — «синдром одной фрикадельки»). Такие больные нуждаются в самом тщательном клиническом наблюдении с проведением простого теста связывания чисел. Даже более старый тест с оценкой письма, когда больной каждый день пишет одну и ту же фразу, отражает возможное ухудшение церебральных функций. У больных с длительным строгим ограничением потребления белка (менее 40 г/сут) общее содержание белка можно восполнить с помощью смеси аминокислот с разветвленными цепочками [торговое название препарата фалькамин (Falkamin)]. Эта рекомендация основывается на данных американских гепатологов, которые обнаружили, что у небольшой группы больных эти протеины обеспечивали положительный азотистый баланс в той мере, в какой его обеспечивает эквивалентное количество белков, потребляемое с продуктами питания. Однако проявления ПСЭ у таких пациентов не развиваются. Говоря о диете, следует напомнить давно известный факт, что развитие ПСЭ обусловливается не только количеством белка, но и его 12-2437 видом. Более благоприятный эффект растительных белков по сравнению с белками животного происхождения связан в первую очередь с тем, что азот, содержащийся в растительных белках, в значительной мере инкорпорируется кишечными бактериями и выделяется с калом. Диету нужно составлять вместе с опытным специалистом по диетическому питанию, с тем чтобы пища, рекомендуемая больному (на длительный срок!), была бы еще и вкусной. Необходимо отметить, что ограничение потребления белка показано лишь больным с подтвержденной ПСЭ. Больным циррозом печени безданного осложнения бульшую пользу в смысле улучшения регенерации гепатоцитов принесет, по-видимому, повышенное (по сравнению со средним уровнем) потребление белка. Им ни в коем случае не следует уменьшать содержание белка в пищевом рационе! Очищение кишечника («стерилизация кишечника»). В кишечнике образуются азотистые продукты. Только сравнительно недавно стало известно, что эти вещества, причем в достаточно значительном количестве, могут образовываться в кишечнике и эндогенно. Очищения кишечника можно достичь с помощью лактулезы. Этот синтетический дисахарид (6-галактоза-5-глюкоза) не расщепляется кишечными дисахаридазами и не всасывается в тонкой кишке. Лактулеза расщепляется до молочной кислоты анаэробными бактериями в слепой кишке. Доза лактулезы повышается постепенно и составляет от 60 до 150 мл/сут. Дозу подбирают таким образом, чтобы она обеспечивала стул мягкой консистенции 2—3 раза в сутки. При острой печеночной энцефалопатии, например, в случаях кровотечения из варикозных вен пищевода при циррозе печени, мы начинаем лечение с введения лактулезы в клизме (250 мл лактулезы и 750 мл воды). Условием эффективного действия лактулезы является ее правильное применение. Клизму ставят при приподнятом положении таза. Затем больной повррачивается сначала на левый, а потом на правый бок. После этого он должен, по возможности, выпрямиться. Уже с помощью этой меры, которая во многих клиниках является первым лечебным мероприятием при острой ПСЭ, у значительной части больных можно улучшить состояние сознания. Эффект лактулезы, возможно, объясняется большей частью тем, что она служит «источником калорий» для бактерий кишечника, ассимилирующих аммиак. Выработку аммиака в кишечнике подавляют антибиотики типа паро-момицина (Paromomycin), выпускаемого под торговым названием гуматин (Humatin), и неомицин. Стандартная доза составляет для обоих препаратов 1 г 3—4 раза в сутки. Комбинированное применение лактулезы и неомици-на на первый взгляд выглядит нерациональным, поскольку логично предположить, что антибиотик снижает эффективность лактулезы в результате подавления метаболизма бактерий. Однако экспериментальные исследования показали, что комбинированное применение обоих препаратов приводит к более выраженному снижению выработки аммиака в кишечнике, чем изолированное использование каждого препарата. Клинически, однако, не доказано, что комбинированная терапия эффективнее, чем монотерапия. В случае выбора комбинированной терапии ее целесообразно проводить лишь в течение первых 2—3 дней после возникновения острой фазы ПСЭ. Мы в настоящее время применяем антибиотик для лечения острых эпизодов ПСЭ только тогда, когда не удается улучшить состояние сознания пациентов с помощью других методов. Несмотря на незначительное всасывание неомицина (1—3%), этот препарат с учетом ототоксического действия можно применять недолго или заменять паромомицином. Последние данные показывают, что в случаях ПСЭ, резистентных к терапии лактулезой, может быть эффективным ванкомицин (2 г/сут). Б) СПЕЦИАЛЬНЫЕ МЕТОДЫ ЛЕЧЕНИЯ Здоровая печень «защищает головной мозг». У больных циррозом печени и ПСЭ отмечаются гемодинамические изменения, обусловленные пор-тосистемными анастомозами, по которым кровь из портальной вены попадает в системный кровоток, а также метаболические расстройства, связанные со значительным нарушением специфической функции печени по метаболизму мочевины (образование нетоксичной мочевины из аммиака). Предложены многочисленные гипотезы, объясняющие патогенез печеночной энцефалопатии. В числе факторов, способствующих ее развитию, называли аммиак, жирные кислоты, фенол и меркаптан, «неправильные нейро-трансмиттеры», а также изменения физиологической нейротрансмиссии и ее рецепторов (табл. 120). Эти гипотезы частично послужили основанием для применения специальных методов лечения. Гипотеза о «неправильных нейротрансмиттерах» привела к тому, что нарушение соотношения между ароматическими аминокислотами и аминокислотами с разветвленными цепочками стали пытаться восстанавливать с помощью применения последних. Полагали, что благодаря введению инфузионных растворов, богатых аминокислотами с разветвленными цепочками, удастся подействовать на причину патологических изменений. Однако после того как было установлено, что у больных циррозами печени нарушенное соотношение между ароматическими аминокислотами и аминокислотами с разветвленными цепочками существует независимо от наличия или отсутствия ПСЭ, этот метод лечения утратил свое значение. Только в одной работе удалось отметить улучшение состояния сознания больных, а также снижение летальности (табл. 121). Исследования у больных хронической энцефалопатией (4 работы), а также при субклинической Таблица 120 Гипотезы патогенеза печеночной энцефалопатии
Таблица 121 Лечение острой печеночной энцефалопатии. Проспективные рандомизированные исследования с внутривенным вливанием растворов, содержащих аминокислоты  с разветвленными цепочками форме энцефалопатии (2 работы) дали различные результаты. Результаты двух мета-аналитических исследований применения аминокислот с разветвленными цепочками нужно оценивать с большой осторожностью, учитывая значительные различия в подборе пациентов, проведении работы и причинах развития ПСЭ. Несмотря на то, что с помощью соответствующих растворов можно восстановить нарушенное соотношение указанных аминокислот, нет данных о большей эффективности этого метода лечения по сравнению со стандартной терапией. Мы ограничиваем применение этого очень дорогостоящего препарата немногочисленными случаями ПСЭ, когда больные, несмотря на интенсивное лечение, проводимое в течение 72 ч, не могут принимать пищу. Сообщалось о применении подобных растворов у больных с хроническими заболеваниями печени, не имеющих проявлений печеночной энцефалопатии. Целесообразность применения указанных препаратов вместо обычных растворов аминокислот не установлена. Возможно ли применение кетоаналогов аминокислот с разветвленными цепочками? Кетоаналоги большинства эссенциальных аминокислот могут найти терапевтическое применение как предшественники эссенциальных аминокислот, не содержащие азота, при лечении синдромов гипераммониемии. Суть подобного метода лечения сводится к снижению концентрации аммиака и одновременному синтезу эссенциальных аминокислот. Первоначальные неконтролируемые попытки применения данных препаратов у больных ПСЭ оказались эффективными в плане улучшения состояния сознания. Одновременно наблюдалось и умеренное уменьшение концентрации аммиака в артериальной крови. Однако контролируемые исследования, проведенные у больных хронической ПСЭ, не подтвердили достоверного клинического улучшения при применении кетоаналогов. Целесообразно ли применение антагонистов бензодиазепина в лечении печеночной энцефалопатии ? В отличие от всех других методов лечения при применении антагонистов бензодиазепина (флумазенил) можно добиться быстрого улучшения состояния больных ПСЭ. Однако период полураспада данного препарата очень короткий, поэтому признаки ПСЭ часто незамедлительно рецидивируют. Желательно создание новых антагонистов бензодиазепина с более длительным периодом полураспада. При применении препарата при 20 эпизодах ПСЭ у 17 пациентов с острым или хроническим поражением печени в 12 случаях под действием флумазенила, как правило, быстро улучшалось состояние сознания. Однако после окончания терапии в 75% случаев достигнутая положительная динамика исчезла. Согласно имеющимся в настоящее время скудным данным кратковременный благоприятный эффект антагонистов бензодиазепина отмечается скорее всего только у больных ПСЭ, связанной с приемом диазепина. Возможна ли терапия бензоатом натрия ? В неконтролируемых исследованиях бензоат натрия применяли в качестве нового препарата при лечении хронической ПСЭ. Этот метод терапии основывается на результатах лечения больных с врожденными дефектами ферментов синтеза мочевины, у которых применение бензоата натрия может привести к существенному улучшению клинического течения и выживаемости. Первое двойное слепое перекрестное исследование, проведенное у 8 взрослых больных циррозом печени и стабильной хронической ПСЭ, показало, что у 6 из них церебральные функции улучшились или оставались такими же, как при применении обычной медикаментозной терапии. Индийское исследование, в котором применяли бензоат натрия в дозе 5 г при острой ПСЭ, подтвердило эффективность этого (дешевого) препарата, не уступающую таковой при использовании лактулезы. Проспективное рандомизированное двойное слепое исследование показало клиническое улучшение у 80% больных, получавших бензоат натрия, и у 81% пациентов, получавших лактулезу. При использовании бензоата натрия аммиак, связанный в виде гиппу-ровой кислоты, может обезвреживаться и выводиться с мочой в обход нарушенного печеночного цикла синтеза мочевины. Заключая этот раздел, можно сказать, что бензоат натрия представляет собой новый дешевый препарат, эффективность которого идентична таковой лактулезы. Этот препарат почти лишен побочных свойств и может использоваться в лечении острой фазы ПСЭ. Когда и в какой последовательности мы должны использовать при лечении больных латентной, острой или хронической ПСЭ имеющиеся в нашем распоряжении общие и специальные методы терапии? Практическое применение различных методов лечения представлено в табл. 122 и 123. 14.2.3. ПРОФИЛАКТИКА Профилактика острой ПСЭ у больного циррозом печени предполагает прежде всего установление индивидуально переносимого количества белка. Нормальный азотистый баланс достигается при потреблении минимум 50 г белка в день. Больные циррозом печени класса С по Чайльду иногда переносят значительно меньшее количество белка. В таких случаях целесообразно заменить животный белок растительным, назначить дополнительно лактулезу или заместительный прием внутрь аминокислот с разветвленными цепочками. Профилактика ПСЭ включает в себя также очень осторожное применение седативных препаратов, особенно барбитуратов и производных бензодиазепина. То же относится и к использованию диуретиков. Врач должен Таблица 122 Алгоритм лечения ПСЭ I степени 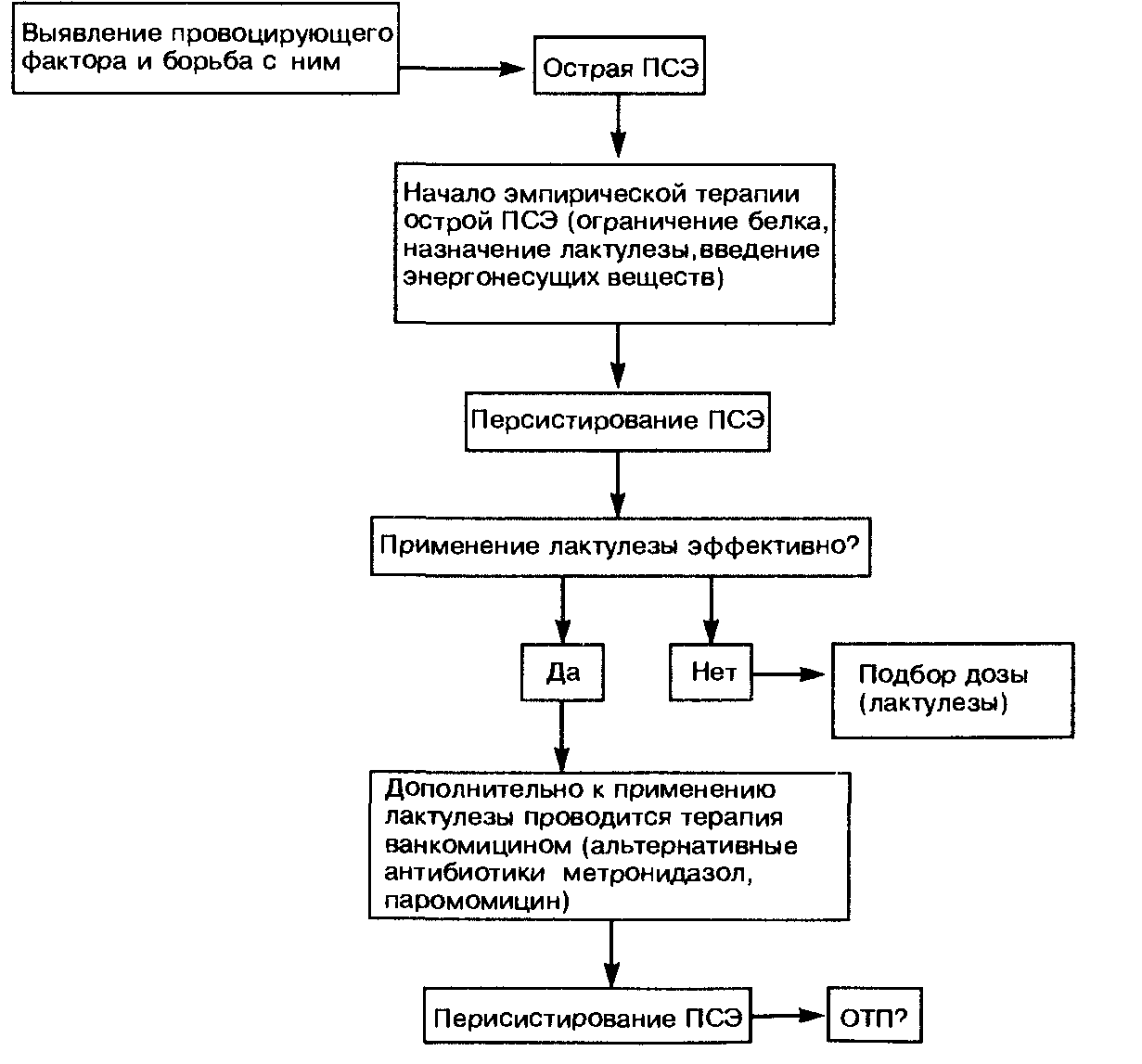 Таблица 123 Алгоритм лечения ПСЭ II степени 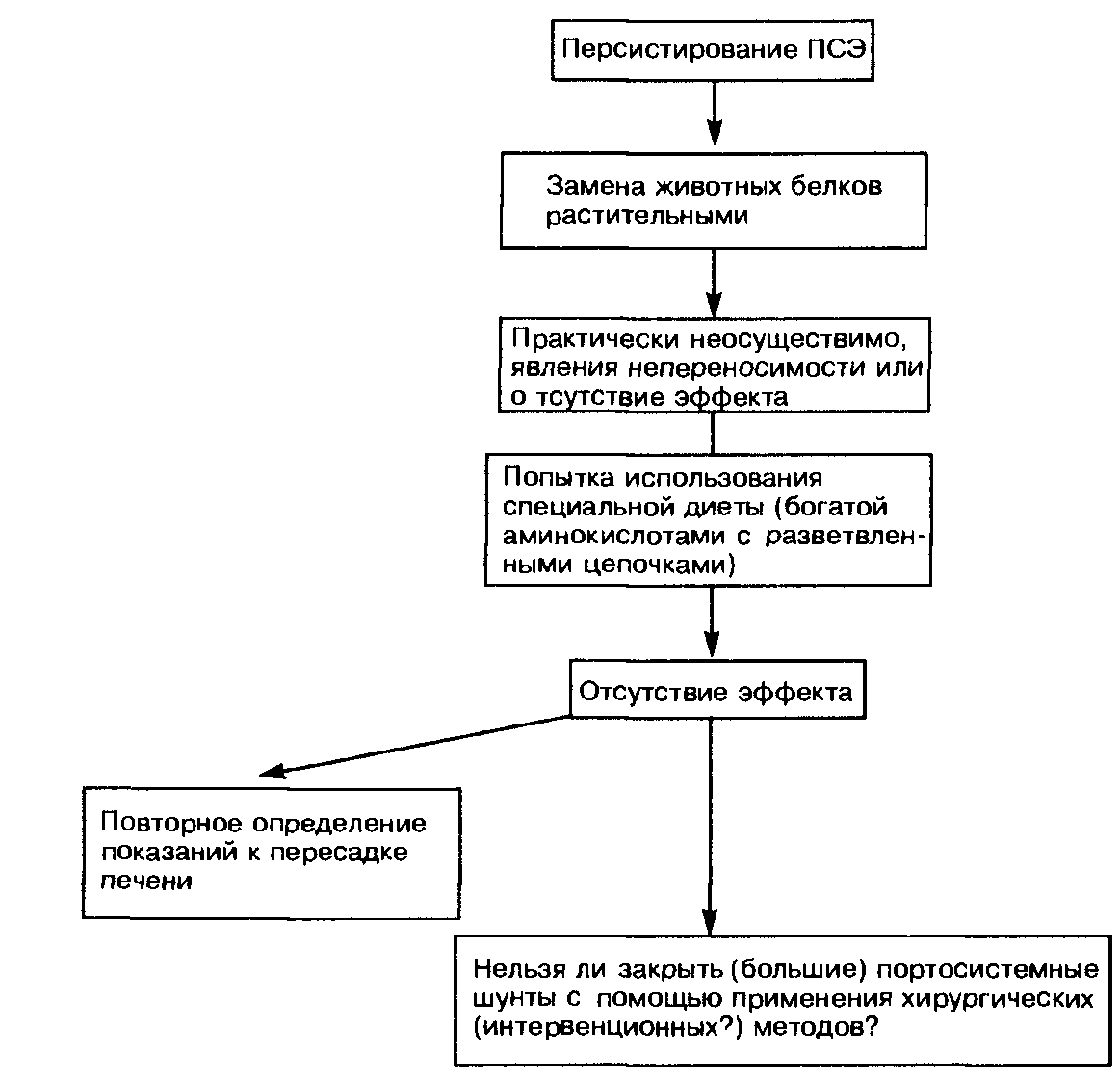 всегда стараться обойтись возможно более низкими дозами. Нередко ПСЭ провоцируется кровотечениями из варикозных вен и инфекционными заболеваниями. Это означает, что в случае развития у больного циррозом печени инфекционного заболевания необходимо быстро начинать интенсивную антибиотикотерапию. При лечении кровотечений из варикозных вен пищевода также не следует забывать о необходимости одновременного проведения профилактической терапии ПСЭ. 14.2.4. ПРАКТИЧЕСКИЕ ВЫВОДЫ Диагноз печеночной комы (печеночная энцефалопатия, ПСЭ) на ранних стадиях может быть достаточно трудным. Латентные, субклинические формы печеночной энцефалопатии, которые встречаются у многих пациентов с циррозом печени, нередко просматриваются. Снижение концентрации внимания, в более позднем периоде — летаргия и дезориентация, наконец, гиперсомния и кома создают основу для диагностики и дифференциальной диагностики. Типичный «порхающий тремор» появляется только при выраженных стадиях комы и ослабевает на стадии глубокой комы (IV степень). Лечение ПСЭ строится по ступенчатому принципу. При латентной ПСЭ рекомендуют молочно-растительную диету и прием лактулезы в дозе, обеспечивающей регулярный (2 раза в сутки) стул мягкой консистенции. При острой ПСЭ необходимо, по возможности, быстро и целенаправленно найти и устранить провоцирующие факторы (прием седативных препаратов и диуретиков, кровотечение из варикозных вен пищевода, инфекционные заболевания, запоры). В дальнейшем наиболее эффективным методом лечения на острой стадии ПСЭ является одна или несколько высоких клизм с лактулезой, а также дополнительное назначение лактулезы внутрь. В редких случаях при острой ПСЭ может обсуждаться вопрос о комбинированном применении лактулезы и антибиотиков (паромомицин, неомицин, метронидазол, ванкомицин) Диуретические препараты и седативные средства следует отменить. Больным, находящимся в бессознательном состоянии, показано проведение инфузионной терапии растворами с высокой концентрацией глюкозы. Растворы белка, богатые аминокислотами с разветвленными цепочками, обычно для лечения не используются. Их применение в острой фазе ПСЭ представляется излишним. Когда больной приходит в сознание, возобновляется прием белка с пищей. Начинают с 20—30 г белка в сутки в несколько приемов. В дальнейшем содержание белка в пищевом рационе повышают каждые 5 дней на 10 г (под контролем возможного возникновения клинических проявлений ПСЭ), доводя его до 50 г/сут. Если больной, как это часто бывает, хорошо переносит большее количество белка, то лучше скорее разрешать ему прием большего количества белка, нежели ограничивать его потребление. Максимально можно рекомендовать до 60— 80 г белка в сутки. В случаях острой печеночной энцефалопатии при фульминантной печеночной недостаточности, нередко осложняющихся отеком головного мозга, необходимо применение специальных методов лечения вплоть до экстренной трансплантации печени (см. главу «Фульминантный гепатит»). При лечении больных хронической ПСЭ можно пользоваться следующими установками. Выясняют то количество белка, которое хорошо переносится данным пациентом. Нужно стремиться к тому, чтобы потребление белка составляло 50 г/сут. Если белок животного происхождения плохо переносится больным, то его можно заменить растительными белками. Весь суточный рацион должен быть распределен на несколько небольших приемов пищи. Необходимо длительное применение лактулезы. Кристаллическая лак-тулеза имеет более приятный вкус и, по-видимому, лучше переносится больными. Доза должна быть подобрана таким образом, чтобы обеспечивался регулярный (2—3 раза в день) стул мягкой консистенции. Следует избегать назначения седативных препаратов и диуретиков. Большое внимание нужно уделять превентивному устранению факторов, провоцирующих ПСЭ. Повторное склерозирование варикозных вен пищевода может предупредить рецидивы кровотечения из варикозных вен и тем самым предотвратить повторные эпизоды ПСЭ. При повторном ухудшении течения ПСЭ поступают так же, как и в случаях острой печеночной энцефалопатии. У этих больных нужно ставить вопрос о трансплантации печени. Относительно новым методом лечения является применение бензоата натрия, который по эффективности не уступает лактулезе. Напротив, применение антагонистов бензодиазепина целесообразно лишь у тех больных, которые раньше (иногда несколько недель назад!), например, при эндоскопическом исследовании, получали бензодиазепин. Применение препаратов этой группы в остальных случаях пока остается на стадии эсперимен-тальных исследований. 14.3. АСЦИТ И ОСЛОЖНЕНИЯ АСЦИТА 14.3.1. ПАТОГЕНЕЗ Понимание патофизиологии возникновения асцита при циррозе печени существенно облегчает проведение терапевтических мероприятий. Под этим углом зрения мы изложим механизмы образования асцита у больных циррозом печени. Важную роль в развитии асцита при заболеваниях печени играют гемо-динамические и метаболические факторы, которые начинают действовать на фоне морфологической перестройки печени (рис. 77). 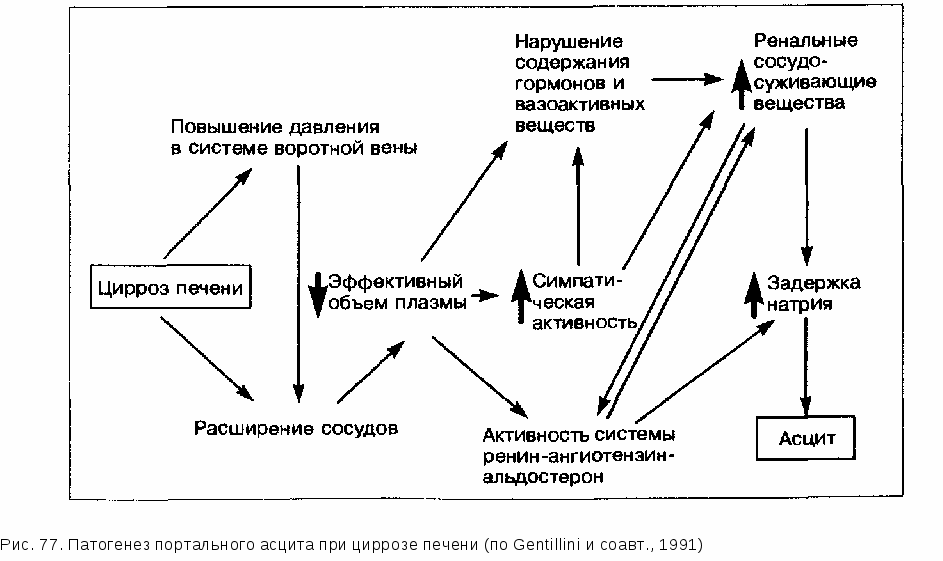 Еще в 40-х годах было отмечено, что у больных циррозом печени, несмотря на потребление даже большого количества поваренной соли, выделение натрия с мочой резко снижено. В моче некоторых больных с деком-пенсированным циррозом печени и асцитом в моче почти полностью отсутствует натрий. По современным представлениям увеличенная задержка натрия почками играет центральную роль в происхождении асцита, причем для объяснения этого феномена предложено несколько гипотез. Эти гипотезы, рассмотренные во временнуй последовательности, позволяют в значительной мере понять развитие асцита при циррозах печени. Результаты многочисленных исследований указывают на то, что печень сама является местом образования асцита. Уже в 1954 г. американские авторы смогли собрать асцитическую жидкость в целлофановые мешочки непосредственно с поверхности печени, тогда как с поверхности других органов этого сделать не удалось. Гепатологам старшего поколения хорошо знакома лапароскопическая картина «плачущей печени» с бесчисленными лимфатическими кистами и выделяющейся по каплям лимфой. Стенки синусоидов печени по сравнению со стенками капилляров имеют очень много отверстий. Наконец, развитие асцита весьма необычно при внепеченочной портальной гипертензии. Экспериментальная перевязка печеночных вен или надпеченочной V. cava приводила к быстрому возникновению асцита, а при перевязке воротной вены асцит не развивался. Кроме того, уже в 50-е годы были получены успешные результаты лечения резистентного асцита с помощью наложения портокавального шунта. В эпоху имплантации TIPS с целью лечения асцита об этом интересном факте часто забы вают! Можно сделать заключение, что центральную роль в патогенезе асцита играют гормональные и гемодинамические факторы. В настоящее время существуют 3 гипотезы, в которых предпринимаются попытки связать между собой множество отдельных факторов. Традиционно развитие асцита при циррозе печени рассматривается как причинный фактор задержки натрия и воды почками (гипотеза «недостаточного наполнения») или, наоборот, нарушение функции почек в результате гепаторенального рефлекса выдвигается как причина асцита (гипотеза «переполнения»). Фактически многочисленные гемодинамические и гормональные изменения хорошо укладываются в первоначальную концепцию о сниженном наполнении сосудистой системы (гипотеза «недостаточности наполнения»). Правда, эти изменения наблюдаются, как правило, до возникновения асцита. В настоящее время исходят из того, что изменения, обнаруживаемые при портальном асците в клинических и экспериментальных исследованиях, лучше всего объясняются с помощью третьей гипотезы — гипотезы о периферической артериальной вазодилатации (гипотеза «вазодилатации»). Эта гипотеза считает сниженное наполнение сосудистого русла в органах брюшной полости первичным звеном в возникновении портального асцита. Однако в отличие от гипотезы «недостаточного наполнения» снижение объема жидкости в интравазальном пространстве рассматривается не как абсолютное, а как относительное, связанное с неадекватной дилатацией артериальных сосудов, обусловленной, по-видимому, вазоактивными веществами, которые недостаточно инактивируются при нарушении метаболизма в печени. Когда снижается внутрисосудистое давление, включаются компенсаторные механизмы, выражающиеся в повышении концентрации ренина, альдостерона, норадреналина и вазопрессина, а также в увеличении сердечного выброса. Сужение сосудов почек, сопровождающееся задержкой натрия и воды, может, таким образом, рассматриваться как компенсаторный процесс. Согласно гипотезе вазодилатации, при нарастающем ухудшении функции печени (декомпенсированный цирроз печени) усиливающаяся артериальная вазодилатация, несмотря на значительно увеличенную концентрацию гормонов и повышенную адренергическую активность, не может компенсировать имеющиеся нарушения. Кроме того, ухудшение функции печени ведет к снижению уровня альбуминов в плазме, а следовательно, и к уменьшению онкотического давления. Вместе с повышением гидростатического давления, обусловленным прогрессирующим циррозом печени, эти изменения приводят в конце концов к выходу жидкости, которая в тех случаях, когда резорбционная способность лимфатической системы оказывается исчерпанной («плачущая печень»), и создает картину асцита. В отличие от принятой раньше точки зрения, имеющийся при циррозе печени гиперальдостеронизм нужно, скорее, рассматривать как дополнительный феномен при периферической вазодилатации, появляющийся на далеко зашедших стадиях поражения печени. Другим патофизиологически важным аспектом, который часто неправильно оценивается в клинике и, соответственно, недостаточно учитывается при проведении лечения, является гипонатриемия у больных на далеко зашедших стадиях цирроза печени. Последние исследования выявили признаки повышенной активности антидиуретического гормона (АДГ). Поскольку при сохраненной осмотической регуляции гипонатриемия способствует подавлению выработки АДГ, можно исходить из неосмотической стимуляции выработки АДГ, обусловленной (относительно) сниженным эффективным внутрисосудистым объемом. Объясняется ли эта неосмотическая стимуляция секреции АДГ при выраженной периферической вазодилатации нарушенной функцией осморецепторов печени, пока окончательно не установлено. Замедление метаболизма АДГ в печени представляется маловероятным. При оценке роли патологически повышенной секреции АДГ в возникновении гипонатриемии у больных циррозом печени представляет интерес «естественный эксперимент»: у больных циррозом печени в сочетании с несахарным диабетом центрального генеза (отсутствие АДГ) гипонатриемии не отмечается. Другим важным патофизиологическим аспектом, имеющим значение щ\я адекватной терапии, является оптимальное удаление жидкости и натрия без уменьшения внутрисосудистого объема. Исследования, проведенные в начале 70-х годов, показали, что больной с асцитом и отеками без опасности недостаточности внутрисосудистого объема может терять не более 1 кг массы тела вдень. Если, однако, у пациента есть только цирроз печени и асцит без периферических отеков, то реабсорбция асцитической жидкости лимитирует скорость ее потери. Она колеблется в достаточно широких границах (100—1000 мл/сут), составляя в среднем 300—500 мл в день. 14.3 2. ДИАГНОСТИКА И ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА Большое скопление жидкости в брюшной полости можно обнаружить с помощью перкуссии, выявляющей типичное притупление в боковых отделах живота. Асцитическую жидкость объемом менее 2 л (особенно у больных с ожирением) определить клиническими методами не удается. В таких случаях можно обнаружить асцит с помощью ультразвукового исследования. Минимальное количество жидкости, которое выявляется указанным методом, составляет около 200 мл. У больных с асцитом ультрасонография в ряде случаев позволяет установить заболевание, послужившее причиной его развития (цирроз печени, опухолевые изменения и др.). Однако уже здесь следует подчеркнуть, что дифференцировать специфические формы асцита с помощью непрямых методов исследования не удается. 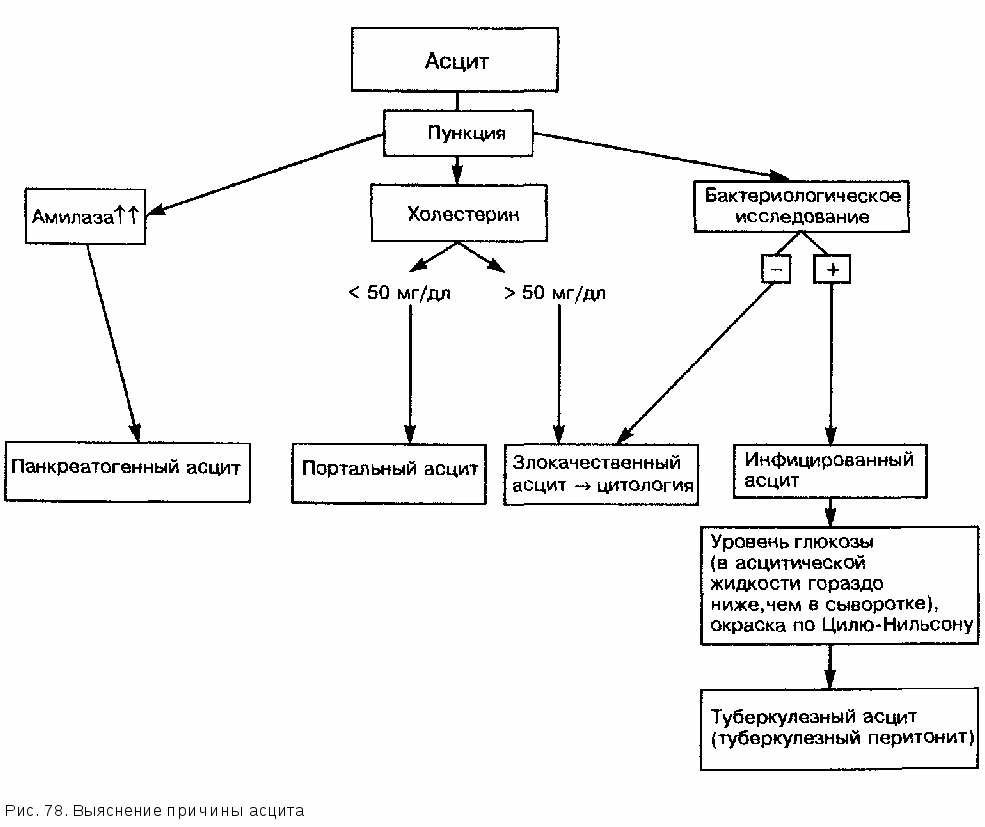 Непосредственно после клинического обнаружения асцита целесообразно проведение диагностического парацентеза. С помощью тонкой иглы берут 50—250 мл асцитической жидкости, которую затем исследуют (рис. 78). Цель такого исследования заключается, с одной стороны, в том, чтобы своевременно выявить больных со спонтанным бактериальным перитонитом (см. ниже), который клинически часто протекает малозаметно, и назначить им лечение, а с другой — в том, чтобы дифференцировать асцит, возникающий при доброкачественных заболеваниях и злокачественных поражениях. Такая дифференциальная диагностика имеет значение в отношении не столько лечения, сколько прогноза. В табл. 124 представлены важнейшие дифференциально-диагностические признаки злокачественного и портального асцита, а также их чувствительность и специфичность. Для дифференциальной диагностики указанных форм асцита в клинической практике достаточно определения содержания фибронектина или холестерина в асцитической жидкости. Как правило, при подозрении на злокачественную природу асцита проводится дополнительное цитологическое исследование, которое, однако, из-за низкой чувствительности (около 60%) имеет небольшое диагностическое значение. Как можно исключить спонтанный бактериальный перитонит ? Как уже говорилось, у больного спонтанным бактериальным перитонитом могут полностью отсутствовать клинические симптомы. Однако у 10— 27% больных циррозом печени при поступлении в клинику выявляется это опасное для жизни осложнение. Его свое временная диагностика имеет чрезвычайно большое значение. Важную роль здесь играет исследование асцитической жидкости. Как поступают на практике? У больных с портальным асцитом количество нейтрофилов не превышает 250 в 1 мм3, а у 90% пациентов со спонтанным бактериальным перитонитом этих клеток больше. Как правило, содержание гранулоцитов оказывается выше 500 в 1 мм3. E.coli, содержащаяся в асцитической жидкости, способна образовывать лактат. В результате возрастает содержание лактата в асцитической жидкости и ее рН падает ниже 7,3. Дифференциальная диагностика при асците (по J.Scholmerich: Internist, 28, 1987, 448)  В подобной ситуации целесообразно ориентироваться на результаты исследования культуры бактерий, полученной из асцитической жидкости. Спонтанный бактериальный перитонит представляет собой монобактериальную инфекцию, часто с небольшим числом бактерий. Для выявления возбудителя в высеянной культуре асцитическую жидкость необходимо брать точно так же, как и кровь для бактериологического анализа, т.е. непосредственно у постели больного. Материал, взятый таким образом для бактериологического исследования, во многих случаях позволяет получить положительный результат. Высокая диагностическая ценность обнаружения полиморфноядерных гранулоцитов в асцитической жидкости (чувствительность 87%, специфичность 95%) обусловливает важную роль этого простого метода исследования в дифференциальной диагностике. В диагностике асцита туберкулезного происхождения исследование асцитической жидкости имеет существенно меньшее значение, чем в диагностике портального, злокачественного и инфицированного асцита. При туберкулезном асците кислотоустойчивые палочки очень редко обнаруживаются в мазке асцитической жидкости, а получить культуру микобактерий туберкулеза удается лишь в половине случаев. В указанной ситуации полезно определить концентрацию глюкозы в асцитической жидкости, которая оказывается заметно более низкой, чем в плазме. Наконец, специфическая (туберкулезная) природа асцита устанавливается в большом числе случаев лишь при лапароскопическом осмотре брюшины и гистологическом исследовании биоптатов. |
