УЧЕБНИК Инфекционные и паразитарные болезни. Том 1. Возианова Ж.И. (в word). УЧЕБНИК Инфекционные и паразитарные болезни. Том 1. Возианова Ж.. Инфекционные и паразитарные болезни в трех томах Том первый
 Скачать 6.07 Mb. Скачать 6.07 Mb.
|
|
Порядок выписки из стационара. Лечение больных ВГА проводят в нашей стране пока только в стационаре, хотя во многих западных государствах этих больных лечат амбулаторно, госпитализации подлежат лишь больные с тяжелым течением и наличием осложнений. Длительность пребывания в стационаре зависит от тяжести течения болезни, но обычно она не менее 3 нед. Основанием для выписки является исчезновение клинических симптомов, нормализация уровня билирубина (допускается его превышение не более чем в 1,5 раза). Активность АлАТ, АсАТ при выписке не должна превышать норму более чем в 2 раза. После выписки из стационара за реконвалесцентом наблюдает лечащий врач (контрольный осмотр через каждые 10—14 дней) до полного выздоровления. При малейших признаках обострения необходима госпитализация. При нормализации всех показателей реконвалесценты могут быть выписаны на работу. Даже если у реконвалесцента при вы писке все показатели нормальны, то на работу его допускают не ранее чем через 2 нед. Возможно продление больничного листка на 1 мес и более после выписки, если в этом возникает необходимость. Порядок госпитализации, диспансеризации и выдачи больничных листков ре-конвалесцентам регламентируются как и при других ВГ специальными санитарными актами, которые периодически пересматриваются. Профилактика ВГА. Общая профилактика заключается в соблюдении санитарных норм и правил, выявлении и лечении больных. Специфическая профилактика осуществляется путем вакцинации. Известны плазменная и рекомбинантная вакцины. Во Франции изготавливают плазменную вакцину из цельного вириона, адсорбированного на гидроокиси алюминия. Вакцина испытана в 1988 г. в 11 странах, подтверждена ее высокая иммуногенность. Вводят вакцину внутримышечно или подкожно. После однократного введения ее антитела появляются уже через месяц и сохраняются до года, при ревакцинации (через 6—12 мес) иммунитет пролонгируется до 10 лет. Схемы вакцинации определяются особенностями используемой вакцины. Показаниями к вакцинации служат проживание в эпидемически неблагоприятных по ВГА регионах, выезд в такие места на работу или в командировку на длительное время, при эпидемических вспышках ВГА. В настоящее время вакцинацию против ВГА начали проводить и в нашей стране. Пассивную иммунизацию проводят донорским иммуноглобулином, содержащим анти-HAV IgG в высоких титрах. Вводят его внутримышечно в дозе 0,02 мг/кг массы тела. Препарат не противопоказан и беременным женщинам. Наиболее эффективно применение иммуноглобулина в первые дни после контакта с больным, но введение его уже через 2 нед и позже малоэффективно. Полагают, что во многих случаях иммуноглобулин не защищает от ВГА, а значительно облегчает его течение (возникают стертые, легкие формы). ,_, СПЕЦИАЛЬНАЯ ЧАСТЬ ООО вирусный гепатит в ВирусныйгепатитВ,син.—сывороточныйгепатит(лат. —hepatitisserosa,hepatitisВ;англ.—hepatitisВ). Этиология. Возбудитель ВГВ относится к семейству Hepadnaviridae. Это небольшой (d = 42 нм), ДНК-содержащий вирус со сложной антигенной структурой (рис. 27). 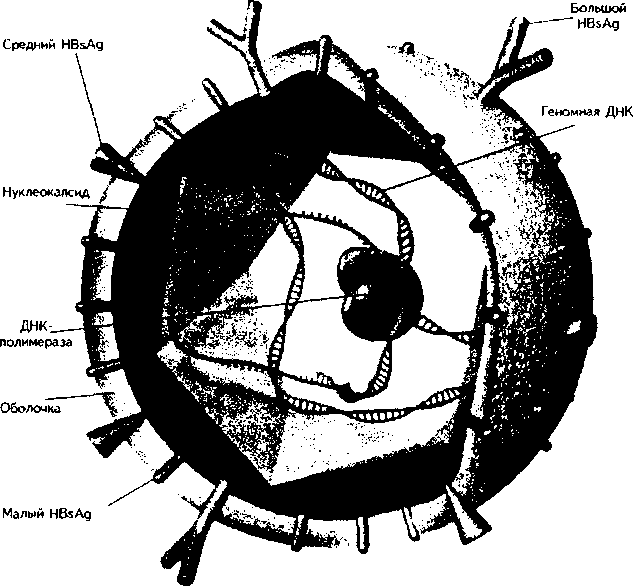 Рис. 27 Структура вируса гепатита В (по изд. GlaxoWellcome; схема) HBV (частица Дейна) имеет оболочку и нуклеокапсид. Основным антигеном оболочки является HBsAg — поверхностный антиген вируса. Различия в биохимических и физико-химических свойствах HBsAg позволяют выделить несколько серологических субтипов вируса, которые, тем не менее, не различаются морфологически и создают при заражении перекрестный иммунитет. Имеются, однако, данные о возможности возникновения гибридной инфекции при одномоментном или последовательном заражении разными субтипами. Различные регионы имеют свои субтипы HBsAg, что позволяет четче проводить эпидемиологический анализ. HBsAg имеет различную структуру (нитчатую, сферическую). В состав его входят белки, липиды, углеводы. HBsAg обнаруживают в цитоплазме пораженного гепатоцита, где происходит его образование, в сыворотке крови больного и вирусоносителя. Доказана возможность репликации вируса в клетках селезенки, костного мозга, лимфатических узлов, мононуклеарах и в других органах и тканях. Обычно HBsAg образуется в избыточном количестве, поэтому такой антиген, не входящий в состав частицы Дейна, не инфекциозен. По своей антигенной структуре HBsAg неоднороден. Антигенный комплекс «S» (от «superficial» — поверхностный) имеет 4 основных субтипа — adw, adr, ayw, аут, в которых одна детерминанта (а) — группоспе-цифическая. Но изучение этих субтипов имеет значение главным образом для эпидемиологов, поскольку частота выявления их в разных регионах неодинакова. Значительно большее значение имеет появление среди обычных («диких») штаммов вируса мутантных вариантов. Особенностью их является замена HBsAg стандартной аминокислоты в определенном положении на какую-либо другую. Этого уже становится достаточно для того, чтобы мутантный штамм не улавливался циркулирующими антителами, что имеет особенно важное значение при проведении вакцинаций. Сейчас во многих регионах земного шара вирусы-мутанты (pre-s-мутантные штаммы) обнаруживают даже чаще, чем «дикие» штаммы. Кроме HBsAg оболочка вируса содержит особый альбуминовый рецептор, облегчающий проникновение вируса в гепа-тоцит. Нуклеокапсид (ядро) HBV окружен двухслойной оболочкой. Он содержит генетический материал вируса — ДНК и ДНК-полимеразу, которая принимает участие в репликации вирусной ДНК при проникновении их в ядро гепатоцита. Существуют так называемые дефектные вирусы, не имеющие в ядре ДНК. Такие вирусы лишены инфекционных свойств. В ядре вируса содержится еще один компонент — ядерный антиген НВсАд, отличный по структуре от HBsAg, не имеющий типов и подтипов. Он не обнаруживается в крови в свободном виде, его можно выявить лишь в ядрах гепатоцитов инфицированной печени, где происходит его образование. Он тоже подвержен мутациям, но в меньшей степени, чем другие антигены HBV. В ядре HBV содержится еще один антиген — НВеАд, существуют по меньшей мере 3 серотипа его. НВеАд состоит из белков, растворимых в сыворотке, поэтому его можно обнаружить в крови больного. НВеАд обычно связан с ДНК-полимеразой, что дает основание считать НВеАд антигеном инфекционности. Его наличие в крови свидетельствует об активной репликации вируса, активности процесса. НВеАд кодируется pre-соге геном и подвержен тоже значительным мутациям. В результате этих мутаций нарушается структура НВеАд, который тоже «ускользает» от иммунологического надзора. Такие мутанты чаще формируют хронические формы заболеваний. Сборка вируса и образование полноценной вирусной частицы происходят в протоплазме гепатоцита. В настоящее время считают, что сведения о структуре HBV, количестве и свойствах его антигенов еще далеко не полные. Известно более 15 маркеров HBV, патогенетическую и диагностическую роль которых изучают. Выделен Х-Ag, который, как полагают, ответствен за раковое перерождение печени. Доказано, что геном HBV, содержащий Х-Ag, не только усиливает малигнизацию в гепатоцитах, но и способствует быстрому росту опухолей любой локализации. HBV обладает высокой степенью изменчивости под влиянием различных факторов, в том числе длительного противовирусного лечения. Образующиеся при этом вирусы-мутанты не распознаются циркулирующими в крови антителами, что способствует длительной персистенции вирусов, формированию хронических гепатитов. Антигены HBV (кроме НВсАд) и антитела к ним можно обнаружить в крови больных и вирусоносителей. Наличие тех или других антигенов и антител, сроки их появления имеют диагностическую и прогностическую ценность. HBV устойчив: при замораживании до температуры —20 °С он сохраняет инфекционность до 15 лет, устойчив при размораживании и повторных замораживаниях. Он сохраняет активность при температуре 30— 32 °С в течение 6 мес. Выдерживает кипячение в течение 30—40 мин, ав-токлавирование в течение 30 мин. Обнаружены интересные взаимоотношения между гепадна- и ретровирусами. Так, при ассоциации HBV и ВИЧ более чем в 10 раз повышается активность репликации ВИЧ. Эпидемиология. Источник инфекции — больной ВГВ, носитель HBV. Больной наиболее заразен в последние недели инкубационного периода и первые 2—3 нед болезни. Механизм заражения — парентеральный. Все биологические жидкости больного и вирусоносителя содержат вирус, хотя концентрация различна. Наибольшее количество вируса содержится в крови. Заразиться можно при переливании инфицированной крови, при различных парентеральных манипуляциях. Группы риска по ВГВ составляют медицинские работники хирургических специальностей, манипуляционные сестры, больные и врачи отделений гемодиализа, а также наркоманы, гомосексуалисты. Факторы передачи HBV — кровь, плазма, человеческие иммуноглобулины (при современных технологиях — в меньшей степени). Вирус может содержаться в материнском молоке. Плохо простерилизован-ные иглы, системы для переливания крови могут привести к заражению ВГВ. Описаны случаи возникновения ВГВ при использовании при проведении массовых прививок безыгольных инъекторов (вспышка ВГВ в Калифорнии), так как возможна контаминация насадки инъекто-ра кровью или тканевой жидкостью. Основные пути передачи ВГВ—инъекции, операции, парентеральные манипуляции, работа с различными выделениями больных. Инфицированная беременная женщина может инфицировать плод до и во время родов, после родов — грудного ребенка во время кормления грудью (при наличии трещин сосков, ссадин на слизистой оболочке полости рта у ребенка). Вирус может содержаться, хотя и в небольшом количестве, в материнском молоке. Вероятность передачи ВГВ половым путем усугубляется и тем, что вирус может обнаруживаться в сперматозоидах. Частота здорового носительства HBsAg в некоторых регионах (Азия) очень высока и достигает 50 %. Особенности патогенеза ВГВ. Механизм передачи возбудителя обеспечивает проникновение его непосредственно в кровь, таким образом возникает первичная вирусемия. В диссеминации вируса принимают участие инфицированные лимфоциты и мононуклеары первого звена защиты. С помощью имеющихся на поверхности рецепторов вирусы фиксируются на клетках-мишенях (гепатоцитах) — наступает паренхиматозная диффузия. Оставляя на поверхности гепатоцита оболочку, вирус проникает в клетку и затем в ядро гепатоцита. У вирусной частицы, проникшей в ядро, есть 2 основных пути развития:
Таким образом, повреждение гепатоцитов при ВГВ обусловлено: — иммунным цитолизом. В этом случае Т-киллеры разрушают клетки, содержащие НВсАд и HBsAg, если последний содержится на поверхности гепатоцита. У больных ВГВ с легким течением («малым повреждением печени») HBsAg обнаруживается преимущественно в цитоплазме; — антителозависимым иммунным цитолизом. В этом варианте Т-лимфоциты разрушают клетки, на которых фиксирован комплекс антиген + антитело. К тому же В-лимфоциты стимулируют продукцию аутоантител к печеночному липопротеиду, что способствует усилению гибели клеток; — непосредственным действием вируса, нарушающего метаболизм инфицированной клетки. Аутоиммунные процессы на ранних этапах направлены на уничтожение вирусиндуцированных компонентов клеток. Однако в дальнейшем по мере прогрессирования заболевания они приобретают патологические черты, уничтожая не только инфицированные вирусом клетки, но и здоровые. При аутоиммунных процессах отмечено повышенное содержание Т-супрессоров, низкое — Т-хелперов. Острый ВГВ возникает в условиях адекватного иммунного ответа. В различные периоды и фазы болезни в печеночных инфильтратах меняется соотношение цитотоксических и супрессорных клеток, что влияет на остроту и тяжесть болезни. При злокачественном течении болезни резко снижено количество Т-хелперов, отмечена гиперпродукция антител. Аутоиммунные процессы в свою очередь усиливают повреждение гепатоцитов. Для тяжелого течения болезни характерно наличие большого количества циркулирующих ИК. При ВГВ развиваются обычно более массивные зоны некроза, чем при ВГА (наряду с зональным нередко обнаруживается и мостовидный тип некроза), что в значительной мере объясняет большую тяжесть течения ВГВ. Конечным результатом взаимодействия вируса и организма является либо очищение его от возбудителя, либо сохранение вируса в клетках печени в форме носительства или хронического процесса. Длительная циркуляция вируса ассоциируется с развитием хронического гепатита, цирроза печени, первичной гепатокарциномы и внепеченоч-ных иммунокомплексных заболеваний (полиартрит, гломерулонефрит, поли артериит и др.). После перенесенного ВГВ формируется стойкий, по-видимому пожизненный, иммунитет. Получены данные о том, что вирусная ДНК может проникать в сперматозоид, в результате чего происходит интеграция вирусной ДНК в геном сперматозоида. Такой ген, передаваясь потомству, способствует внутриутробному повреждению печени плода, ребенок рождается с хроническим ВГВ. Хронический ВГВ может формироваться у ребенка, рожденного от матери — носителя HBsAg или перенесшей ВГВ во время беременности. У ребенка, инфицированного во время родов, длительно, в течение многих лет, может определяться антигенемия и повышается риск развития гепатоцеллюлярной карциномы. При здоровом вирусоносительстве в цитоплазме гепатоцита образуется только HBsAg, при этом повреждение гепатоцита практически отсутствует. Но если возникает в результате каких-то факторов активация процесса и начинается продукция НВсАд в ядре, развивается заболевание со всеми присущими ему механизмами повреждения гепатоцитов. Иммунный клеточный ответ направлен против НВсАд и НВеАд в большей степени, чем против HBsAg. Клиника. ВГВ присущи все клинические формы, перечисленные в разделе «Классификация». По сравнению с ВГА при ВГВ значительно чаще встречаются затяжные формы, ациклическое течение, холестатические и фульминантные формы. Инкубационный период при ВГВ длительный — он может достигать 6 мес (в среднем 2—3 мес). Наиболее частыми вариантами преджелтушного периода являются артралгический, диспепсический и аллергический. Лихорадка в преджелтушный период не характерна, хотя и возможна (чаще при наличии выраженной сенсибилизации). Тем не менее к такой лихорадке следует всегда относиться настороженно, поскольку чаще она бывает проявлением смешанной патологии. Преджелтушный период нередко протекает по смешанному типу. Заболевание обычно начинается постепенно, иногда первые признаки болезни настолько нерезко выражены, что началом болезни многие больные считают день появления желтухи. Желтушный период, в отличие от такового при ВГА, характеризуется нарастанием клинических симптомов. Интоксикация обычно выражена сильнее (нередко соответствует среднетяжелому течению). В большинстве случаев астеновегетативный синдром, отсутствие аппетита сохраняются в течение всего периода нарастания желтухи. Кожный зуд, наблюдающийся примерно у 1/4—1/3 больных, в эти сроки связан либо с аллергическими проявлениями (в этом случае он может сопровождаться различной интенсивности и характера кожными высыпаниями), либо холестатическим компонентом. У большинства больных удается пальпировать увеличенную не только печень, но и селезенку. Общая длительность желтушного периода составляет обычно 3—4 нед. В период реконвалесценции у больных могут длительно (до 6 мес и более) сохраняться гепатомегалия, умеренная гиперферментемия. 21 Ж. Возианова Осложнения. ВГВ протекает более тяжело, чем ВГА, осложнения при этом заболевании регистрируются чаще и они более тяжелые. Так, значительно чаще возникают фульминантные формы, летальность при которых достигает 30—50%. При ВГВ могут возникать такие же осложнения, как и при ВГА, но возможны и осложнения другого характера. ^ У людей, уже имеющих хроническое заболевание печени, возможно появление отеков, асцита (отечно-асцитическая форма). Основная причина — нарушение синтеза альбуминов, изменения онкотического давления, портальная гипертензия. Они встречаются при подостром гепато-некрозе. Кроме асцита, отеков при этом выявляют резко выраженную спленомегалию, расширение вен на передней брюшной стенке. Повреждение костного мозга ИК приводит к развитию апластичес-кой анемии. Это довольно редкое осложнение, но прогноз всегда неблагоприятен. Отложения в почках комплемента и иммунных комплексов с НВеАд у лиц с длительным течением ВГВ, длительной циркуляцией в крови НВеАд сопровождаются развитием мембранозного гломерулонефрита, в сосудах — узелкового периартериита. Описывают и более редкие осложнения — синдром Гийена — Барре, поражение эндокринных желез (поджелудочной, щитовидной, половых), миокардит, перикардит, фиброзирующий альвеолит и др. В основе большинства внепеченочных поражений лежат аутиммунные процессы, хотя возможность внепече-ночной репликации вируса не исключает непосредственного действия вируса и ИК. Исходы. Циклическое течение ВГВ с нормальной реконвалесценци-ей наблюдается у 80—85 % больных. У подавляющего большинства из них болезнь заканчивается полным выздоровлением. Особенностью ВГВ является вероятность формирования носительства HBsAg как при легком и бессимптомном течении, так и при тяжелом. Вероятность формирования носительства даже больше при легком течении, что обусловлено недостаточным иммунным ответом и как следствие — неполной элиминацией возбудителя. Кроме того, HBV содержит пептиды, которые способны защищать инфицированную вирусом клетку от лизиса, что способствует сохранению HBV в печени. При носительстве вирус персистирует в гепатоцитах, не разрушая их. Хроническое носительство формируется у 6—15 % лиц, перенесших ВГВ. К носительству HBsAg отношение неоднозначное. В настоящее время все большее подтверждение находит мнение, что «здоровое носительство» — это наиболее доброкачественно протекающий вариант хронического ВГВ—НВеАд-негативного. У 15—20 % больных ВГВ с затяжным течением нередко формируется хроническийгепатит.Переходу в хроническую форму способствуют алкоголизм, нарушение питания, наличие сопутствующих заболеваний и другие факторы, в том числе генетические, при этом существенную роль играют не только генетические особенности вируса (его генотип, субтип), но и человека. Велика роль и вирусов-мутантов, которые не распознаются специфическими противовирусными антителами. Особенности течения инфекционного процесса на раннем этапе развития болезни определяются цитотоксичностью Т-лимфоцитов: если они перестают контролировать этот процесс, создаются условия для хронизации. Вероятность хронизации иногда можно предсказать. Ее возможными предшественниками являются:
До последнего времени хронический ВГВ было принято делить на хронический активный гепатит (ХАГ) и хронический персистирующий гепатит (ХПГ). В 1994 р. Международная рабочая группа (IWP) и Всемирный конгресс гастроэнтерологов (WCOG) признали эти термины неприемлемыми, заменив их общим термином «хронический гепатит В». По определению WCOG, «хронический вирусный гепатит — воспалительное заболевание печени, вызываемое HBV, длящееся 6 мес или более и способное привести к циррозу или быть ассоциированным с циррозом». Выражение «быть ассоциированным с циррозом» наиболее вероятно означает следующие возможности:
О степени активности процесса можно судить по уровню и динамике специфических печеночных ферментов, белка, наличию и соотношению маркеров ВГВ, однако эти показатели сейчас не считаются достаточно убедительными. Оценить активность процесса в печени поможет исследование пунктатов печени с определением индекса гистологической активности. При хроническом ВГВ в крови появляются специфические антитела к клеткам печени, отдельным фрагментам клеток печени, а также к другим тканям (щитовидной железы, клеткам костного мозга и т.д.). Быстрота прогрессирования процесса определяется множеством факторов. Присоединение аутоиммунного компонента к хроническому ВГВ приводит к более тяжелому течению заболевания, быстрому прогрес-сированию патологического процесса. Хронический ВГВ может приводить к развитию цирроза печени, а наслоившись на уже имеющийся цирроз, усиливать деструктивные процессы в печени и таким образом ухудшать прогноз. При циррозе печень становится плотной, нередки отеки, асцит, появляются «сосудистые звездочки», пальмарная эритема. Периоды ремиссии при этом практически отсутствуют. Заболевание протекает с выраженными признаками нарушения функции печени (в том числе почти постоянно регистрируется высокая активность АлАТ), селезенки (вплоть до явлений гиперспленизма), эндокринными расстройствами, васкулитом, аллергическими реакциями, отчетливо выявляется полисистемность поражений. Такие больные умирают обычно от острой печеночной недостаточности, кровотечений, осложнений со стороны других органов (например, агранулоцитоз), сепсиса. Заболевание благоприятнее протекает у мужчин. Большая тяжесть течения у женщин обусловлена, как полагают, особенностями гормональной функции (наличием эстрогенов). Первичныйракпечени(гепатоцеллюлярная карцинома) может быть исходом ВГВ (острый ВГВ-»хронический гепатит-»цирроз-»рак), но иногда возникает, не проходя все эти стадии. Этот патологический процесс может развиваться и при легком течении ВГВ и даже у вирусоно-сителей. Наиболее высокая группа риска — дети, родившиеся от инфицированных матерей. К развитию гепатоцеллюлярной карциномы предрасполагает длительное персистирование вируса в гепатоцитах, чаще она развивается на фоне цирроза, но особая роль принадлежит Х-белку HBV, индуцирующему мутацию в ядре инфицированного гепатоцита с последующим развитием опухолевых клеток. В свою очередь, в ткани гепатоцеллюлярной карциномы происходит мутация HBV, а это затрудняет распознавание HBV-инфекции, спровоцировавшей развитие опухоли. Заболевание характеризуется быстро прогрессирующими симптомами общей интоксикации, быстрым увеличением печени, ее плотностью. Однако степень увеличения печени, наличие или отсутствие болевого синдрома, желтухи и прочих признаков, позволяющих думать о раке печени, в значительной мере определяются локализацией рака, его размерами, быстротой прогрессирования процесса. Полагают, что опухоль более 2—3 см в диаметре практически уже неоперабельна. Особым признаком гепатокарциномы является заметное повышение уровня ЩФ даже при отсутствии желтухи. Активность других ферментов может быть увеличена незначительно. Характерны быстрое похудание, диспепсические явления, тупая ноющая боль в правом подреберье. Летальность при ВГВ достигает 1—3 %, наиболее высока она при фульминантных формах и развитии ОПЭ. Специфическая диагностика ВГВ. Диагноз ВГВ подтверждают обнаружением его антигенов в сыворотке крови или антител к различным антигенам. Сроки появления и длительность циркуляции отдельных антигенов и антител, их сочетания позволяют определить остроту процесса, а в отдельных случаях прогнозировать дальнейшее течение и исход заболевания. Для выявления антигенов и антител при ВГВ наиболее широко используют РИА и РФА. HBsAg появляется в крови рано — уже через 1—2 нед после инфицирования. Однако концентрация его столь мала, что вышеназванными методами он не определяется еще очень долго, у большинства больных его удается обнаружить лишь спустя несколько месяцев после заражения. Закономерно HBsAg появляется в значительных количествах в сыворотке крови перед началом заболевания (за неделю и ранее), достигает максимальной концентрации в разгар болезни, исчезая в период реконвалесценции. При неосложненном среднетяжелом течении длительность HBs-антигенемии обычно не превышает 6—8 нед. Чем дольше выявляется у больных HBsAg, тем больше вероятность перехода острого ВГВ в хронический ВГВ, носительства. Таким образом, обнаружение у больного HBsAg не является абсолютно достоверным доказательством острого ВГВ: это может быть признаком носительства HBV и даже гепатоцеллюлярной карциномы. Но и отсутствие HBsAg не может служить основанием для снятия диагноза острого ВГВ. Причинами отрицательной реакции могут быть малая, не улавливаемая стандартными методами, концентрация HBsAg в крови, «серологический пробел», потребление HBsAg D-вирусом. Кровь при этом своей инфекционности не теряет. Не следует забывать и о pre-s-мутантах. Анти-HBs появляются на 4—12-й неделе после заражения, но быстро связываются с циркулирующим HBsAg, поэтому в крови инфицированного антитела можно обнаружить после исчезновения HBsAg. Период между исчезновением HBsAg и появлением в крови анти-HBs называется «серологическим пробелом», он может составлять 1—2 нед и более. При этом в крови не определяются ни HBsAg, ни анти-HBs. Несмотря на отсутствие HBsAg, кровь в это время своей инфекциозности не теряет. Титры антител растут медленно, достигая наиболее высоких показателей через 6—12 мес после исчезновения HBsAg. Наиболее высокие титры анти-HBs обнаруживают у лиц с кратковременной антиге-немией. Анти-HBs — долгоживущие антитела. Сохраняясь в достаточно высоких титрах у реконвалесцента до 5 лет, они защищают его от повторного заражения. Но анти-HBs в относительно невысоких титрах можно обнаружить и спустя 10 лет после перенесенного заболевания. Существуют данные о том, что у подавляющего большинства больных хроническим ВГВ анти-HBs не обнаруживаются. Наличие анти-НВс в крови — наиболее надежный показатель активной вирусной репликации. В крови их обнаруживают с первыми клиническими проявлениями болезни, хотя появляются они уже через 3—5 нед после заражения. Титры анти-НВс растут, пока в крови обна руживают HBsAg, после его исчезновения они начинают снижаться. Субклинические формы ВГВ дают низкие титры анти-НВс. В первые месяцы болезни сначала выявляют анти-НВс класса IgM, затем — анти-НВс IgG. На 4—6-м месяце болезни у некоторых больных можно обнаружить как IgM, так и IgG. Анти-НВс IgG у реконвалесцентов сохраняются годами, а при хроническом ВГВ их можно обнаружить практически постоянно. При обострении процесса в печени, сопровождающегося репликацией вируса, снова могут выявляться наряду с анти-НВс IgG и анти-НВс IgM. НВеАд — показатель интенсивной вирусной репликации. Появляется в крови обычно одновременно с HBsAg. Концентрация НВеАд определяет в значительной мере степень инфекционности крови. Определить в крови больного НВеАд можно с первых дней болезни. Если НВеАд сохраняется более 10 нед, можно думать о возможности формирования хронического гепатита. Обычно НВеАд перестает определяться раньше, чем HBsAg. Но НВеАд может не определяться при инфицировании рге-соге-мутантами. Анти-НВе появляются в крови после исчезновения НВеАд (наступает сероконверсия). Раннее появление их свидетельствует о благоприятном течении ВГВ, в крови они сохраняются до 2 лет (рис. 28). |
