ЛЕКЦИИ 50 лекций по хирургии под редакцией академика B.C. Савельева. ЛЕКЦИИ 50 лекций по хирургии под редакцией академика B.C. Савель. Media medica 2003 п од редакцией академика B. C. Савельева
 Скачать 9.44 Mb. Скачать 9.44 Mb.
|
|
Трансплантация сердца: настоящее и будущее В.И.Шумаков   Прошло уже более 35 лет после первой клинической трансплантации сердца (ТС) в мире. По данным международного регистра сердце и легкие» за 2001 г., за этот период времени выполнено около 58 000 ТС. Среди заболеваний, при которых выполняли ТС, ишемичес-кая болезнь сердца (ИБС) составила 44,3 %, дилата-ционная кардиомиопатия (ДКМП) - 43,7 %, приобретенные пороки сердца — 3,6 %, врожденные пороки сердца -1,5%, ретрансплантации сердца - 2% и другая патология - 4,9%. Выживаемость после ТС более 1 года составила 80%, 11,6 лет - 50%. При этом в 20% случаев длительность наблюдения достигла 15-17 лет. Максимальный срок наблюдения составил 23 года. Ежегодная летальность - 3-4%. С 1984 г. начато выполнение двухэтапных ТС, когда в отсутствие донорского органа у потенциального реципиента применяют либо механическую замену функции сердца (механический «мост»), либо интенсивную кардиотоническую терапию симпа-томиметическими препаратами (фармакологический «мост»). Использование медикаментозного или механического «моста» позволяет выполнить ТС вторым этапом у 62% больных, нуждающихся в немедленной ТС. Выживаемость более 1 года при таком варианте лечения составляет 70%. Первая успешная ТС в России выполнена 12 марта 1987 г. В.И.Шумаковым в НИИ трансплантологии и искусственных органов Минздрава РФ (НИИТиИО Минздрава РФ). Больная прожила с пересаженным сердцем 8,5 лет. С этого времени в России выполнено 128 ортотопических ТС (НИИТиИО Минздрава РФ - 100, Всероссийский научный центр хирургии
В клинике НИИТиИО Минздрава РФ 76 ТС были одноэтапными, 23 - двухэтапными и 1 - повторной через 4,5 года после первичной ТС. На основании обследования более 700 больных в конечной стадии застойной сердечной недостаточности, обусловленной ДКМП (70,2%) и ИБС (29,8%), установлено, что показанием к ТС является тяжелая застойная сердечная недостаточность III—IV функционального класса по шкале NYHA, рефрактерная к медикаментозной терапии. При определении показаний к ТС у больных ИБС (ишеми-ческая кардиомиопатия, постинфарктные аневризмы левого желудочка) учитывают общую и локальную сократимость левого и правого желудочков, размеры и объемы полостей сердца, наличие жизнеспособного миокарда в зоне пораженных коронарных артерий и возможность адекватного ремоделирования левого желудочка и реваскуля-ризации стенозированных коронарных артерий. К абсолютным противопоказаниям к ТС относят фиксированную легочную гипертензию с транс-пульмональным градиентом > 15 мм рт.ст. и легоч- ным сосудистым сопротивлением > 5 единиц Вуда, резистентную к фармакологическим пробам (нит-ропруссид натрия, добутамин, оксид азота ), а также полиорганную недостаточность, активные инфекционные процессы, некоторые системные болезни, алкоголизм и наркоманию. Все остальные заболевания, которые регрессируют при терапевтическом и хирургическом лечении, относят к временным (относительным) противопоказаниям к ТС. После определения показаний и противопоказаний в лист ожидания ТС включается не более 25% больных. Для объективного определения очередности выполнения трансплантаций больным, находящимся в листе ожидания, разработана рабочая классификация (United Network for Organ Sharing - UNOS), согласно которой состояние пациентов делят на три статуса. СТАТУС 1А - негликозидная инотропная или механическая поддержка (внутриаортальная баллонная контрпульсация, левожелудочковый, правоже-лудочковый или бивентрикулярный обход, искусственное сердце), продолжающаяся менее 30 дней без улучшения клинического и гемодинамическо-го состояния больного и сопровождающаяся различными осложнениями (тромбоэмболии, инфекции, нарушения в системе механической поддержки, длительная искусственная вентиляция легких, сочетанное применение нескольких негликозид-ных инотропных препаратов в дозах выше терапевтических). СТАТУС 1Б — механическая или медикаментозная поддержка более 30 дней без осложнений. СТАТУС 2 - все остальные пациенты, ожидающие ТС. Анализ состояния потенциальных реципиентов, ожидающих ТС, показал, что у 40% из них возникают тяжелые расстройства кровообращения: в 60% наблюдений - внезапная остановка сердца; в 12% -быстро прогрессирующая сердечная недостаточность с кардиогенным шоком; в 28% - медленно прогрессирующая сердечная недостаточность. У 48 больных до ТС использовали фармакологический «мост» с назначением негликозидных инотропных препаратов в терапевтических дозах (добутамин до 5 мкг/кг/мин или допамин до 3 мкг/кг/мин от 1 до 4 мес). Из них 33 (68,7%) пациента погибли, не дождавшись ТС. Пятнадцати (31,3%) больным выполнили ТС. Выписано после ТС 78,8% больных. Выживаемость более 1 года составила 72,7%. Сроки наблюдения к настоящему моменту от 3 до 6 лет. У 31 больного использовали механический «мост» - вспомогательное кровообращение или полную замену сердца (имплантация искусственного сердца). Показания к механическому «мосту» в настоящее время четко объективизированы: прогрессирующая сердечная недостаточность (систолическое артериальное давление менее 90 мм 34 сердечно-сосудистая хирургия рт.ст., сердечный индекс менее 2 л/мин/м , давление в левом предсердии более 25 мм рт.ст.), рефрактерная к максимальной инотропной поддержке (добутамин до 30 мкг/кг/мин, допамин до 10 мкг/кг/мин, адреналин до 500 нг/кг/мин). При решении вопроса о начале механического «моста» должны быть исключены абсолютные противопоказания к выполнению последующей ТС (необратимая полиорганная недостаточность, инфекционные осложнения). На первом этапе до ТС в 2 наблюдениях использовали внутриаортальную баллонную контрпульсацию, в 16 - обход левого желудочка центробежным насосом «БИОПАМП», в 6 — бивентрикуляр-ный обход сердца и в 7 - имплантацию искусственного сердца «ПОИСК ЮМ». Двухэтапные ТС выполнили 10 больным: 1 реципиенту после внутриаортальной баллонной контрпульсации в течение 5 сут, 8 больным - после обходов левого желудочка длительностью 1,5-5,5 сут и 1 - после имплантации искусственного сердца и его работы в течение 3,5 сут. В остальных наблюдениях диагностировали абсолютные противопоказания к ТС. В настоящее время сроки наблюдения реципиентов после двухэтапных ТС составляют до 60 мес. В 1995-2002 гг. у 50% реципиентов перед ТС использовали либо медикаментозный, либо механический «мост». В 57 наблюдениях забор донорского сердца выполняли в клинике института, в 43 — трансплантат забирали дистанционно. У 65% доноров выполняли мультиорганный забор (сердце, печень, почки). Для защиты трансплантата при заборе донорского сердца непосредственно в клинике использовали кристаллоидную кардиоплегию. Длительность ишемии трансплантата не превышала 80 мин. При дистанционном заборе применяли консервирующий раствор внутриклеточного действия кустади-ола. Длительность ишемии трансплантата в большинстве наблюдений не превышала 3,5 ч. Однако в 3 случаях длительность ишемии достигала от 4 ч 30 мин до 5 ч 45 мин. Все трое реципиентов выписаны из клиники. Настоящие наблюдения являются доказательством того, что донорское сердце может переносить ишемию до 6 ч. При 77 ТС использовали классическую атриаль-ную хирургическую технику; при 6 - кава-каваль-ную методику и при 17 - модификацию кава-ка-вальной методики ТС, предложенную В.И.Шумаковым. Модифицированную кава-кавальную ТС выполняли следующим образом (рис. 1). После удаления сердца реципиента по классической методике и стенки левого предсердия так, чтобы оставалась только площадка, в которую впадают левые и правые легочные вены, создавали узкий «мостик» между полыми венами реципиента. Для этого расслаивали предсердия по межпредсердной перегородке, как это выполняют при доступе к митральному клапану слева. Глубину этого расслоения доводили до овального окна межпредсердной перегородки. Затем изнутри рассекали на этом уровне заднюю стенку правого предсердия. После окончания анастомоза между левыми предсердиями донора и реципиента анастомозировали края разреза нижней полой вены донора с краями разреза «мостика» между полыми венами реципиента. В кон- це операции накладывали анастомозы между аортами и легочными артериями донора и реципиента. В настоящее время мы упростили технику операции, устранив этап формирования «мостика» между полыми венами реципиента. Для этого сшиваем латеральный край разреза нижней полой вены донора с задней стенкой правого предсердия реципиента анастомозом конец в бок латеральнее его овальной ямки, по той же линии, где производили разрез в первоначальном варианте. Противоположный край разреза нижней полой вены сшиваем с краем правого предсердия реципиента, после удаления излишков его тканей. Отказ от формирования «мостика» между полыми венами реципиент позволил упростить операцию и ускорить время ее выполнения. При выполнении пересадки сердца по данной методике отпадает необходимость создания отдельных циркулярных анастомозов между нижними и верхними полыми венами донора и реципиента. Частота дисфункции синусового узла, трикус-пидальной регургитации при данной методике достоверно не отличается от результатов при кава-ка-вальной методике ТС. Месячная летальность после ТС составила 31,6%. Основными причинами ее являлись нарушения насосной функции трансплантата (тотальная или правожелудочковая недостаточность) и инфекционные осложнения. Использование с 1996 г. ингаляционного оксида азота позволило полностью исключить летальность от правожелудочковой недостаточности, а применение нового поколения антибактериальных и противовирусных препаратов — значительно снизить частоту инфекционных осложнений. Посттрансплантационная иммуносупрессивная терапия включает циклоспорин А, азатиоприн и метилпреднизолон. С 1998 г. начато использование новой схемы трехкомпонентной терапии - циклоспорин А, метилпреднизолон и селл-септ. При использовании циклоспорина А нередко отмечается артериальная гипертензия, нефро- и ге-патоксичность. Сочетание с кетоканозолом (низо-рал) позволило снизить дозу принимаемого циклоспорина А на 70%, что в 90% случаев предупреждает его нефро- и гепатотоксический эффект, не снижая при этом концентрацию иммуносупрессо-ра в крови. После ТС с целью диагностики острого отторжения трансплантата необходимо выполнение эндо-миокардиальной биопсии. В первый месяц после ТС - еженедельно, во второй месяц - один раз в две недели, далее в течение первых двух лет - один раз в 2-3 мес. С третьего года - один раз в полгода. Всего после ТС в НИИТиИО Минздрава РФ выполнено 1096 биопсий. Только в 6% наблюдений при этом выявили умеренное или тяжелое острое отторжение. Стероидо-резистентное (персистирующее) клеточное острое отторжение наблюдали у 2 больных. Положительный эффект был достигнут в результате лечения антитимоцитарным глобулином име-тотрексатом. При гуморальном (сосудистом) отторжении с нарушением функции трансплантата, диагностированном у 2 реципиентов, лечебный эффект обеспечило сочетание гормональной пульс-терапии с 5-7 сеансами плазмафереза. 35   сердечно-сосудистая хирургия сердечно-сосудистая хирургияР  ис. 1. Методика трансплантации сердца академика В.И.Шумакова. ис. 1. Методика трансплантации сердца академика В.И.Шумакова.а. Рассечение и разделение межпредсердной перегородки на уровне межпредсердной борозды. б. Формирование «мостика» из задней стенки правого предсердия реципиента. в. Анастомоз между медиальным краем донорского сердца и медиальным краем сформированного «мостика» между полыми венами реципиента. г. Анастомоз «конец в бок» между медиальным краем донорского предсердия и задней стенкой правого предсердия. / д. Анастомоз между латеральйым краем донорского сердца и латеральным краем сформированного «мостика». е. Вид сердца после окончания подшивания трансплантата. 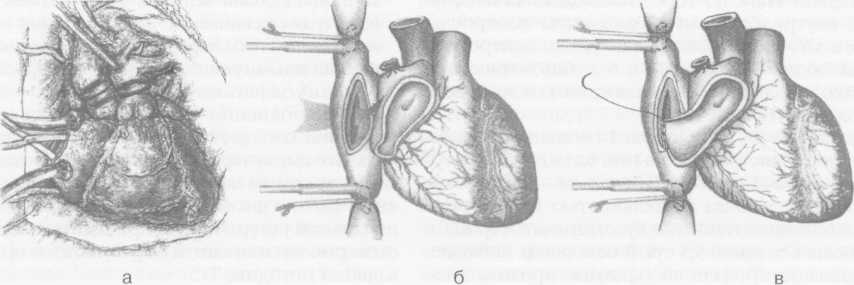 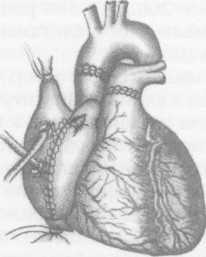 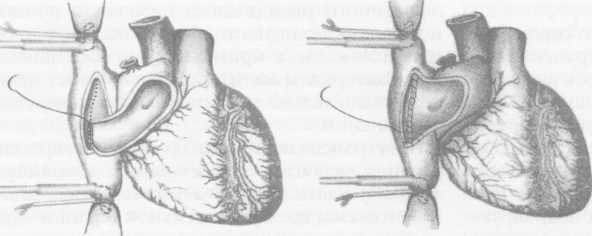 д   После ТС из клиники выписали 68 пациентов. Анализ отдаленных результатов ТС, выполненных более 10 лет назад, показал, что выживаемость более 1 года составила 84,6%, более 5 лет - 69,2% и более 10 лет - 23,9%. В настоящее время 8 реципиентов прожили более 10 лет. После ТС из клиники выписали 68 пациентов. Анализ отдаленных результатов ТС, выполненных более 10 лет назад, показал, что выживаемость более 1 года составила 84,6%, более 5 лет - 69,2% и более 10 лет - 23,9%. В настоящее время 8 реципиентов прожили более 10 лет.Степень недостаточности кровообращения в течение первого и последующих годов наблюдения после ТС у 86% пациентов соответствует 0-1 функциональному классу NYHA. Снижение толерантности к физической нагрузке, соответствующее II—III функциональному классу NYHA, отмечали только у больных с посттранспланционным поражением коронарных артерий При анализе особенностей восстановления функции синусового узла трансплантированного сердца выделено пять вариантов его функционирования: нормальную функцию синусового узла наблюдали у 71,7% пациентов, транзиторную дисфункцию синусового узла - у 14,3 %, персистирую-щую - у 5,4 %, полное отсутствие функции - у 8,6%. У 71,7% больных восстановился синусовый ритм с частотой сокращений более 90 в минуту. Частота сокращений пересаженного денервированного сердца превышала частоту сокращений иннерви- рованного органа в среднем на 25%. Проблема дисфункции синусового узла после ТС по атриальной методике достаточно значима. Почти у 14% пациентов возникает необходимость в имплантации постоянного водителя ритма, либо в ближайшем, либо в отдаленном посттрансплантационном периоде. Развитие дисфункции синусового узла связано, вероятно, с травмированием его во время операции в процессе анастомозирования правого предсердия донорского сердца с остатком предсердия реципиента. При использовании кавальной и модифицированной методики ТС эта проблема практически не возникает. При анализе электрокардиограммы у 75% реципиентов выявили частичную и полную блокаду правой ножки пучка Гиса. Причины ее развития остаются пока неясными. Наблюдаемые желудочковые и наджелудочковые нарушения ритма легко поддавались терапии и не влияли на прогноз после ТС. Мониторинг гемодинамики пересаженного сердца в постреанимационном (госпитальный) и отдаленном (постгоспитальный) периоде в покое при синусовом ритме и отсутствии острого отторжения трансплантата показал, что денервация 36 сердечно-сосудистая хирургия   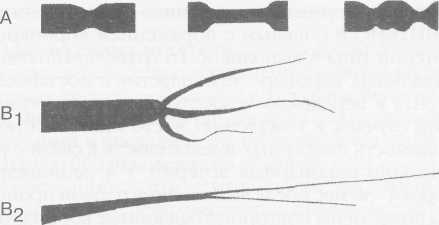 Рис. 2. Международная классификация поражения коронарных артерий пересаженного сердца. трансплантированного сердца оказывает незначительный эффект на гемодинамические показатели донорского сердца в покое. После периода гемоди-намической нестабильности в непосредственном посттрансплантационном периоде насосная функция сердца достигает нормальных или субнормальных значений уже через 2-3 нед после ТС . Венозную гипертензию легкой степени (до 15 мм рт.ст.) наблюдали у 15% реципиентов в течение первого года после ТС, умеренную (до 20 мм рт.ст.)- только в течение первых двух месяцев у 5 % больных и тяжелую (более 20 мм рт.ст.) только ин-траоперационно и в раннем посттрансплантационном периоде. Тяжелая венозная гипертензия была обратимой при использовании инотропных препаратов в сочетании с вазодилататорами либо при механической поддержке правого желудочка пересаженного сердца. Причинами развития венозной гипертензии являются трикуспидальная регургитация, предшествующая легочная гипертензия, гиперволемия, замедленная адаптация правого желудочка пересаженного сердца. В первый месяц после ТС артериальную гипертензию наблюдали у 62%. Посттрансплантационная артериальная гипертензия обусловлена вазо-констрикторным эффектом циклоспорина А, который, увеличивая продукцию тромбоксана, снижает уровень простациклина, одновременно активирует ренин-ангиотензиновую систему и повышает концентрацию норадреналина, а также ги-перволемией в результате применения стероидных гормонов. Для предупреждения артериальной гипертензии, гиперфункции и гипертрофии пересаженного сердца необходимы контроль концентрации циклоспорина А и индивидуальный подбор гипотензивных препаратов. Лучшие результаты получены от использования антагонистов кальция (нифеди-пин и др.) или ингибиторов ангиотензин-превра-щающего фермента (каптоприл, эналаприл и др.). Результаты нагрузочных тестов показали, что де-нервированный трансплантат способен адаптироваться к нагрузке и обеспечивает адекватный кровоток в организме. Однако в отличие от иннерви-рованного сердца денервированное сердце увеличивает минутный объем кровообращения прежде всего за счет прироста ударного объема на фоне увеличение венозного возврата с вторичным повышением частоты сокращений. |
