Онкогематология. Острый миелобластный лейкоз у взрослых
 Скачать 1.28 Mb. Скачать 1.28 Mb.
|
|
Схема модификации доз Иматиниба в зависимости от степени цитопении при лечении больных в хронической фазе ХМЛ. В фазе акселерации и бластного криза ХМЛ, когда у больных по жизненным показаниям требуется получить ответ на лечение ингибиторами тирозинкиназ, терапия продолжается в максимальной дозе на фоне лечения гранулоцитарным колониестимулирующим фактором (пэгфилграстим**, филграстим**, ленограстим**) при проведении адекватной заместительной терапии тромбоконцнентратом и эритроцитной массой (NB! **применять с информированного согласия родителей). При развитии жизнеугрожающих инфекционных осложнений, иматиниб следует отменить до их купирования. Развитие цитопении может возникнуть в любые сроки, однако, она наиболее часто развивается на 2-4 неделе от начало терапии. Алгоритм лечения ХМЛ в ХФ (NB! **применять с информированного согласия родителей): Хроническая фаза: 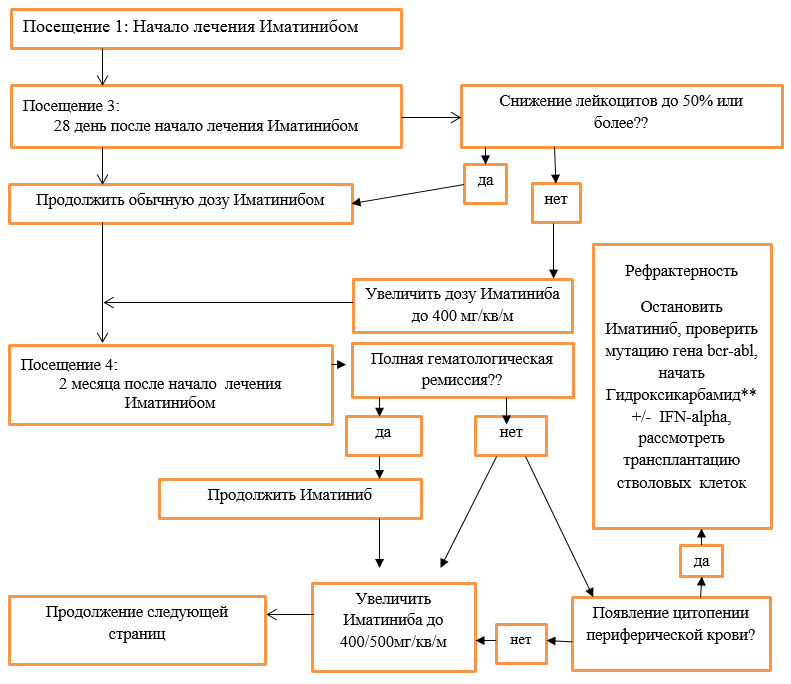 ХФ продолжение (2) (NB! **применять с информированного согласия родителей): 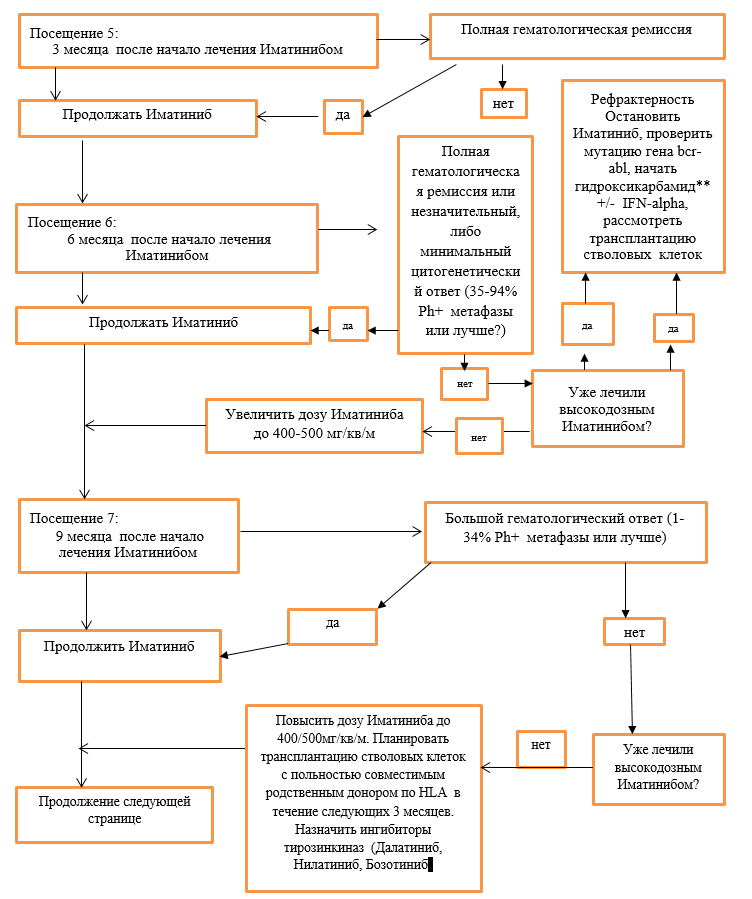 ХФ продолжение (3): 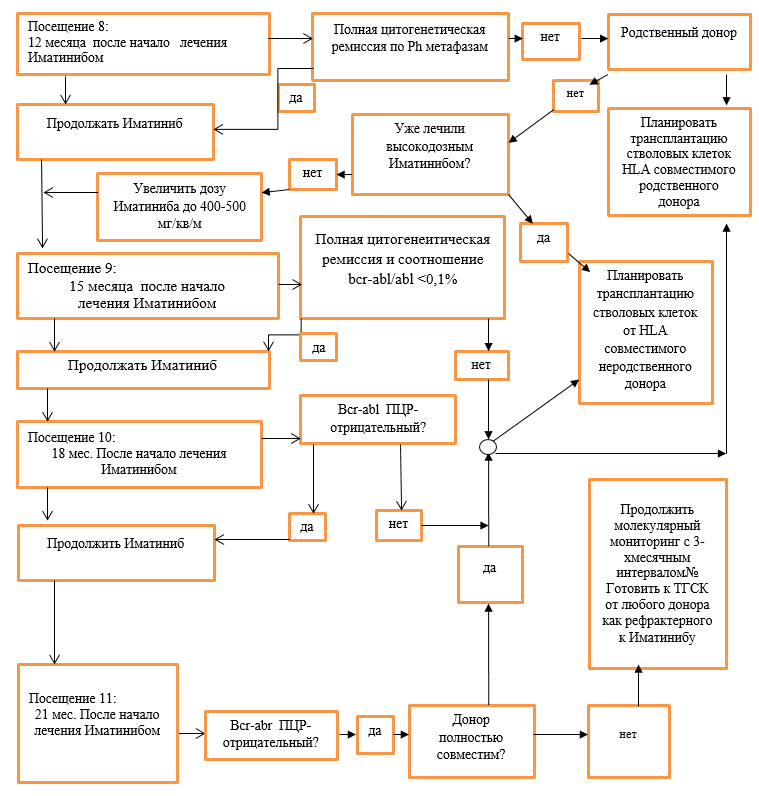 Акселерационная фаза: Посещение 1: Начало лечения иматинибом 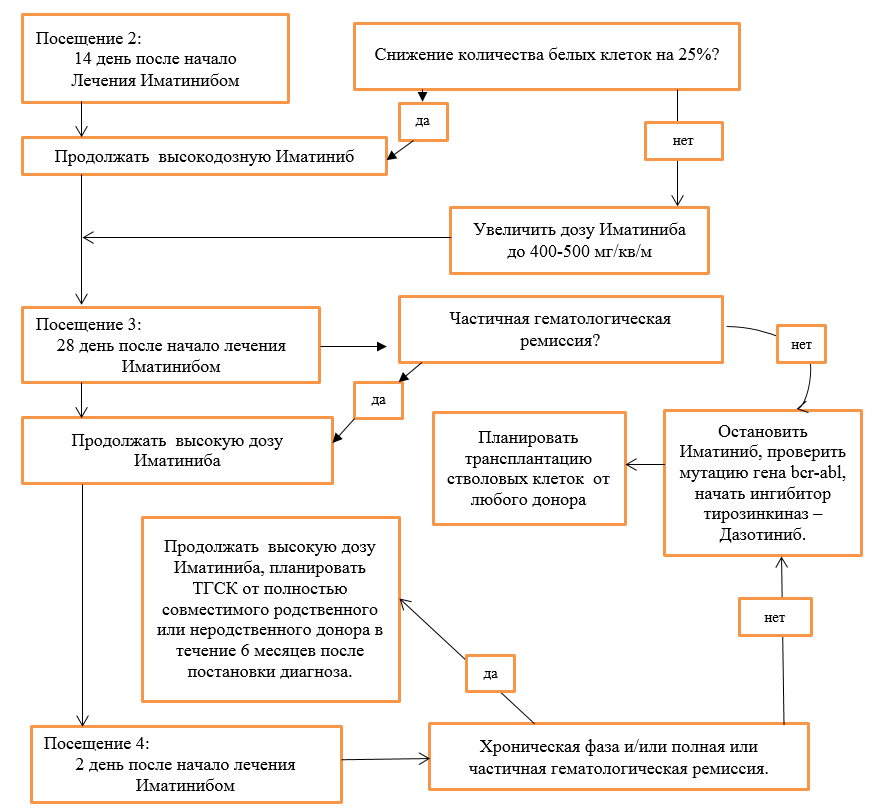 Негематологическая токсичность: При развитии негематологической токсичности 2 степени тяжести, лечение прерывают до купирования осложнений. В дальнейшем лечение возобновляют в прежней дозе, если перерыв в лечении был менее 2 недель. Если для купирования осложнения потребовался более длительный перерыв, то лечение возобновляют в сниженной дозе: 260 мг/м2 в день. При развитии негематологической токсичности 3 или 4 степени тяжести после прерывания приема Иматиниба до купирования осложнений (<1 степени), лечение возобновляют в сниженной дозе (соответственно стадии заболевания). Дополнительно к вышеописанной тактике прерывистой терапии для укорочения перерывов в лечении можно назначать: · гепатопротекторы и инфузионную терапию – при печеночной токсичности с повышением трансаминаз и/ или щелочной фосфотазы; · нестероидные противовоспалительные и обезболивающие препараты – при выраженных оссалгиях, полиартралгиях, миалгиях; · антигистаминные и глюкокортикоидные препараты – при наличии аллергических проявлений; · мочегонные препараты – при отеках; · другие лекарственные средства по показаниям. Характеристика ответа на лечение Иматинибом: Эффективность терапии оценивается на основании достижения гематологической ремиссии, цитогенетического и молекулярного ответа. I. Клинико-гематологическая ремиссия. Полная клинико-гематологическая ремиссия констатируется при отсутствии симптомов интоксикации и очагов экстрамедуллярного лейкемического роста, нормализации размеров селезенки, показателей гемограммы: число тромбоцитов <450х109/л, лейкоцитов<10х109/л, отсутствие в формуле крови промиелоцитов, миелоцитов и метамиелоцитов и базофилия <5%. Ответ считается полученным, если он сохраняется не менее 4 недель. Частичная гематологическая ремиссия – уровень лейкоцитов более 9, но менее 20х109/л, при наличии единичных миелоцитов и метамиелоцитов (в сумме не более 5%). Отсутствие гематологической ремиссии- увеличения уровня лейкоцитов более 20х109/л и выше, наличие в формуле промиелоцитов или миелоцитов и метамиелоцитов (более 5%) , тромбоцитоз более 500х109/л (для подтверждения потери ремиссии необходимо выполнить 2 повторных анализа с интервалом 2 недели). II. Цитогенетический ответ является стандартным методом оценки минимальной остаточной болезни и определяется по содержанию Ph- положительных клеток в пунктате костного мозга. При этом выделяют следующие уровни цитогенетического ответа: · полный 0% Ph – позитивных метафаз; · частичный 1-35% Ph – позитивных метафаз; · малый 36-65% Ph – позитивных метафаз; · минимальный 66-95% Ph – позитивных метафаз; · цитогенетический ответ отсутствует 96-100% Ph – позитивных метафаз; Полный и частичный цитогенетический ответ характеризуются как «большой цитогенетический ответ». III. Молекулярный ответ оценивается на основании определения количества BCR-ABL транскрипта в крови с помощью метода количественной полимеразной реакции в реальном времени (Real – timePCR, RQ-PCR). Чувствительность метода составляет 1:10000–1:100000 клеток. Преимуществом данного метода является возможность исследования периферической крови (не требуется костномозговая пункция). Наиболее целесообразен для мониторирования минимальной остаточной болезни у больных с полным цитогенетическим ответом. Отношение выявленного уровня транскрипта к стандартизированному уровню экспрессии BCR-ABL выражается в %. Полным молекулярным ответом считают случаи, когда BCR-ABL – транскрипт составляет менее 0,01%. Большой молекулярный ответ – это снижение уровня BCR-ABL на 3log и более (или 0,1-0,01%) по сравнению со стандартизированным уровнем экспрессии BCR-ABLтранскрипта до начало терапии. Критерии ответа на лечение Ответ на лечение считается оптимальным, если получены следующие результаты: · к 3 мес. – полный гематологический ответ; · к 6 мес. – большой цитогенетический ответ (Ph+ клетки< 35%); · к 12 мес. – полный цитогенетический ответ (Ph+ клетки = 0%); · к 18 мес. – большой молекулярный ответ; Больные, достигшие этого уровня ответа, относятся к группе благоприятного прогноза и продолжают лечение в прежней дозе. Субоптимальный ответ (недостаточный ответ на лечение). Терапия иматинибом по – прежнему имеет преимущество перед другими методами лечения, однако возможен менее благоприятный отдаленный прогноз. Необходимо увеличить дозу иматиниба. Характеристика субоптимального ответа: · к 3 мес. – частичный гематологический ответ; · к 6 мес. – малый или минимальный цитогенетический ответ (Ph+ клетки >35%, но< 95%); · к 12 мес. – отсутствие полного цитогенетического ответа (Ph+ клетки > 0%); · к 18 мес. – отсутствиебольшогомолекулярного ответа. Неудача терапии – высокий риск прогрессирования ХМЛ. Требует рассмотрения вопроса о проведении аллогенной ТГСК от геноидентичного или альтернативного донора и/или назначения других препаратов второй линии (нилотиниб**, дазатиниб**), (NB! **применять с информированного согласия родителей). · к 3 мес. – отсутствие гематологического ответа, прогрессирование; · к 6 мес. – отсутствие полного гематологического ответа Ph+ клетки > 95%); · к 12 мес. – отсутствиебольшого цитогенетического ответа (Ph+ клетки >35%; · к 18 мес. – отсутствие полного цитогенетического ответа (Ph+ клетки > 0%); · в любое время – развитие резистентности, что определяется как потеря полного гематологического, цитогенетического ответа (должно быть подтверждено в 2 повторных анализа) или прогрессирование и развитие фазы акселерации и бластного криза. Наиболее часто встречающиеся проявления токсичности: Проявления токсичности в большинстве случаев выражены умеренно (1-2 степени). Наиболее часто встречаются: тошнота (58%), поверхностные отеки (преимущественно периорбитальные (55%), мышечные судороги (50%), кожная сыпь (39%), диарея (37%), боли в костях и мышцах (32%), утомляемость (31%), артралгии (30%), прибавка в весе более 20% от исходного. Частота побочных явлений III-IVстепени не превышала 1-4%. Тяжелые дерматиты былы отменены в 3% случаев, в 2% - значительная задержка жидкости. Наиболее часто среди токсичности III степени встречается увеличение уровня трансаминаз (3,8%), что потребовало длительных перерывов в лечении и снижение дозы иматиниба у части больных. Следует отметить, что в большинстве случаев при развитии гепатотоксичности самочувствие больных не страдало, поэтому обязательно регулярное исследование биохимических показателей. Проявления гематологической токсичности 3-4 степени встречается чаще в фазе акселерации, чем в хронической стадии: нейтропения (47% и 14%) и тромбоцитопения (33 и 27%) соответственно. Это обусловлено как глубоким поражением гемопоэза в этой фазе заболевания, так и терапевтическим подходом, предпологающим более активное воздействие на кроветворение. При приеме Иматиниба следует обратить на возможность усиления токсичности или ослабления терапевтического эффекта препарата при совместном применении с препаратами, модифицирующими метаболизм Иматиниба. Лечение пациентов с субоптимальным ответом и резистентностью к Иматинибу (NB! **применять с информированного согласия родителей), (NB! *применять после регистрации на территории РК): При достижении субоптимального ответа следует повысить дозу Иматиниба до 520 мг/м2. При недостижении оптимального ответа через 3 месяца терапии повышенными дозами необходим переход на ингибиторы тирозинкиназ 2-го поколения (Дазотиниб, Нилотиниб**, Бозутиниб*) и планирование аллогенной ТГСК. В настоящее время строгих критериев выбора того или иного ингибитора 2-го поколения – нилотиниба**, дазатиниба** при лечении пациентов в хронической фазе ХМЛ не существует. При выполнении мутационного анализа и выявлении мутаций гена BCR/ABL1 целесообразно назначение ингибитора к которому данная мутированная форма гена является более чувствительной. При отсутствии выявления мутаций у резистентных пациентов в хронической фазе ХМЛ может быть назначен нилотиниб** или дазатиниб**, бозутиниб*. У пациентов в фазе акселерации или бластном кризе ХМЛ при отсутствии противопоказаний препаратом выбора является дазатиниб**. В любом случае у детей с ХМЛ резистентных к иматинибу главным методом лечения является ТГСК (смотреть клинический протокол по ТГСК). Лечение пациентов в фазе бластного криза. Шансы на долгосрочную выживаемость пациентов с бластным кризом ХМЛ на консервативной терапии очень низки, поэтому всем пациентам должна быть предложена аллогенная ТГСК. Целью медикаментозного лечения является достижение хронической фазы или клинико - гематологической ремиссии ХМЛ, учитывая плохие результаты трансплантации в фазе бластного криза. При развитии бластного криза на фоне приема иматиниба, лечение проводить по соответствующей форме бластного криза (миелоидный или лимфоидный), смотреть протокол ОЛЛ BFM Rh+, ОМЛ. Перечень основных препаратов, необходимых для лечения пациентов с ХМЛ
NB! **применять с информированного согласия родителей NB! *применять после регистрации на территории РК Хирургическое вмешательство: нет. Дальнейшее ведение: · ведение пациента, согласно рекомендациям выписки из стационара. Индикаторы эффективности лечения: · уменьшение размеров селезенки; · снижение уровня лейкоцитов и тромбоцитов в крови; · регрессия лимфатических узлов; · максимальное подавление Ph'-положительного опухолевого клона, снижение риска прогрессии заболевания, достижение продолжительности жизни больных, сравнимой с общей популяцией. Достижение полного цитогенетического ответа и большого молекулярного ответа – это ранние благоприятные прогностические признаки длительной выживаемости без прогрессирования при условии постоянной терапии. ОСТРЫЙ МИЕЛОБЛАСТНЫЙ ЛЕЙКОЗ У ДЕТЕЙ (ПЕРВИЧНЫЙ) Категории МКБ: Острый миелоидный лейкоз (C92.0) Разделы медицины: Онкология детская, Педиатрия Общая информация Острый миелобластный лейкоз – это клональное злокачественное новообразование, в основе которого лежит дефект, стволовых клеток различного уровня, либо поражение клеток-предшественников. Примечание*: Морфологическим субстратом заболевания являются неопластически трансформированные клетки, обладающие способностью к подавлению нормального гемопоэза и инфильтрирующие костный мозг, постепенно вытесняя и угнетая нормальные ростки кроветворения. В процессе лейкозной трансформации бласты постепенно утрачивают необходимость в стромальной поддержке (становятся строма-независимыми) и заселяют органы, которые принимали участие в гемопоэзе на различных стадиях эмбриогенеза. Дальнейшая опухолевая прогрессия приводит к тому, что бласты могут поражать практически любой орган. Соотношение кодов МКБ-10 и МКБ-9
Дата разработки/пересмотра протокола: 2016 год. Пользователи протокола: ВОП, педиатры, детские онкологи/гематологи. Категория пациентов: Дети и подростки. Шкала уровня доказательности:
Классификация Морфологическая классификация ОМЛ предложена франко-американо- британской группой FAB (French-American-Britishcooperative'group):
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
