Детская психиатрия. Психиатрия детского возраста
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
|
НАСЛЕДСТВЕННЫЕ ФОРМЫ ОЛИГОФРЕНИИ МЕТАБОЛИЧЕСКИЕ ОЛИГОФРЕНИИ Фенилкетонурия Фенилкетонурия (фенилпировиноградная олигофрения, бо* лезнь Феллинга) — наследственное заболевание обмена, характеризующееся преимущественным поражением центральной нервной системы и прогрессирующим в первые 2—3 года слабоумием. Фенилкетонурию впервые описал в 1934 г. A. Foiling. Позднее был установлен аутосомно-рецессивный тип наследования этого заболевания (L. Penrose, 1935; G. A. Jervis, 1937). В 1953 г. G. A. Jervis обнаружил, что в печени больных фенилкетонурией отсутствует фермент фе- нилаланингидроксилаза или резко снижена его активность. H. Bickel, J. Gerrard и Е. М. Hickmans в 1953 г. предложили лечить этих больных диетой с ограниченным содержанием фенилаланина. В отечественной литературе заболевание опи- сано С. А. Нейфахом и А. М. Шапошниковым (1965)* Л. А. Булаховой (1968), Б. В. Лебедевым и М. Г. Блюминой (1972) и др. Частота заболевания мальчиков и девочек одинакова и составляет 1 : 10 000 новорожденных. Фенилкетонурия наследуется по аутосомно-рецессивному типу. Фенотипически здоровые родители больного ребенка являются носителями мутантного гена. Распространенность носителей гена фенил-кетонурии в популяции составляет примерно 1 : 50. Для появления заболевания определенное значение имеет кровное родство родителей. Возникновение заболевания обусловлена наследственной неполноценностью гена, контролирующего синтез фермента фенилаланингидроксилазы, который обеспечивает реакцию превращения поступающего в организм с пищей фенилаланина в тирозин. В норме окисление фенилаланина в тирозин происходит в митохондриях печеночных клеток. Фенилаланин является незаменимой аминокислотой для построения белковой молекулы. Нарушение процессов превращения фенилаланина в тирозин приводит к резкому повышению содержания фенилаланина в сыворотке крови и спинномозговой жидкости (в норме содержание фенилаланина в сыворотке крови 1—2 мг%). Частично фенилаланин подвергается дезаминированию и превращению в фсиилпиро-виноградную, фенилмолочную и фенилуксусную кислоты, которые наряду с фенилаланином в повышенной концентрации выводятся с мочой и могут быть легко обнаружены реакцией с 10% раствором полуторахлористого железа. Другим последствием нарушения превращения фенилаланина в тирозин является дефицит тирозина и, следовательно, недостаточный синтез катехоламинов (адреналина и норад-реналина), гормона щитовидной железы (тироксина) и меланина. Недостаточный синтез последнего приводит к недостаточной пигментации кожи и волос Кроме того, нарушается обмен триптофана и синтез серотонина, который необходим для нормального функционирования нервной системы. Дети, больные фенилкетонурией, рождаются с нормально сформированным и функционально полноценным головным мозгом, так как биохимические процессы плода осуществляются за счет обмена, происходящего в организме матери. Биохимические нарушения начинают развиваться сразу после рождения. Повышение уровня фенилаланина и его дериватов в сыворотке крови сопровождается снижением уровня других незаменимых аминокислот, а также вторичным нарушением углеводного, жирового и других видов обмена. Чувствительность нервной ткани к токсическому влиянию продуктов обмена фенилаланина, к дефициту гормонов и медиаторов нервной системы, а также к другим нарушениям обмена наиболее высока в раннем возрасте в связи с незрелостью центральной нервной системы и повышенной проницаемостью гемато-энцефалического барьера. Патоморфологи-ческие изменения при фенилкетонурии проявляются нарушением процесса миелинизации, глиозом, признаками микроги-рии и уменьшением массы мозга. Признаки заболевания проявляются на 1-м году жизни. У одних детей уже в период новорожденности отмечаются вялость, сонливость, слабая реакция на окружающее или беспокойство, у других — в первые месяцы развитие происходит нормально и только в 4—6 мес постепенно снижается реакция на окружающее, появляется повышенная раздражительность, пугливость, плаксивость. Дети становятся вялыми, останавливаются в развитии.'Нередко у одних и тех же детей вялость и адинамия сменяются беспокойством и резким возбуждением. Довольно частым и ранним симптомом является рвота. Нередко первые признаки заболевания совпадают с введением прикорма и интеркуррентными заболеваниями, что иногда дает основание при ретроспективной оценке состояния ошибочно расценивать его как следствие перенесенных «стертых» менингитов и менингоэнцефалитов. Почти у всех детей наблюдается задержка физического развития: они отстают в росте, череп с признаками умеренной микроцефалии. Нередко отмечаются диспластические признаки (высокое небо, эпикант, деформация ушных раковин и др.). Около 80—90% больных блондины со светлой, лишенной пигмента кожей и голубыми глазами. Примерно у Уз детей отмечаются дерматиты и экзема, возникновение которых нередко совпадает с прикормом и неправильно расценивается как проявление экссудативиот диатеза (Б. В. Лебедев, М. Г. Блюмина, 1972). У большинства детей отмечается повышенная потливость с характерным неприятным запахом пота. В неврологическом статусе чаще обнаруживается мышечная гипертония, повышение сухожильных рефлексов, гиперкинезы, тремор пальцев, рук, атаксия; иногда — центральные парезы, патологические знаки, нарушение черепно-мозговой иннервации. Значительно реже отмечается гипотония мышц, днизорефлексия, судороги мышц и дрожание. Наблюдается также недостаточность моторики, координации и дифференциации тонких движений. Психопатологические нарушения при фенилкетонурии сложны и полиморфны. Степень интеллектуального дефекта колеблется от нормы до глубокой идиотии. Имбецильность и идиотия отмечаются примерно у 90% и дебильность — у 10% нелеченных больных. Особенностью психического недоразвития является фаза прогредиентной динамики в первые 2— 3 года жизни. Затем процесс стабилизируется и постепенна появляются признаки эволютивной динамики. Структура интеллектуального дефекта имеет ряд особенностей, выявляемых в относительно редких случаях менее глубокой умственной отсталости: .мышление инертно и недостаточно целена-правлено, отмечаются недостаточность сосредоточения и переключения внимания, плохая способность к активному запоминанию, большее недоразвитие гностических функций, основанных на анализе и синтезе пространственных представлений, при нередко несколько более сохранной формальной способности к обобщениям. У большей части больных имеется глубокое недоразвитие речи и дефекты произношения, коррелирующие с глубиной интеллектуальной недостаточности. В большей степени страдает моторная функция речи. Отмечается склонность к эха-лалии, персеверациям. При фенилкетонурии характерны нарушения в эмоционально-волевой сфере. Дети эмоционально однообразны, маловыразительны, не стремятся к эмоциональному общению с родителями и сверстниками. Их деятельность отличается недостаточной целенаправленностью, слабостью побуждений и интересов, однообразием при быстрой физической и психической истощаемости. Характерны нарушения контакта с близкими и сверстниками, безразличие к окружающему. У больных нередко отмечаются периоды психомоторного возбуждения, носящие психотический характер: с импульсивностью, стереотипными вычурными движениями, манерностью, гримасами, эхопраксией н эхо-лалией. В ряде случаев состояния возбуждения чередуются со субступорозными и ступорозными состояниями, протекающими иногда с явлениями восковой гибкости. В структуре психического недоразвития большой удельный вес занимают также астенические и неврозоподобные нарушения: повышенная чувствительность и ранимость, исто-щаемость и утомляемость, расстройства настроения типа ди-стимий, страхи, заикание, энурез и др. Более чем у 7з детей, чаще с глубоким психическим недоразвитием, отмечаются эпилептиформные приступы, которые нередко являются первыми манифестными признаками заболевания. Приступы могут быть как эпизодическими, так и систематическими, имеют тенденцию к полиморфизму, резистентны к противосудо-рожному лечению без применения специфической патогенетической терапии. Отмечается определенная зависимость между преобладающим типом пароксизмов и возрастом больных. Сложная диссоциированная структура психического дефекта при фенилкетонурии в сочетании с признаками аутизма, неврозоподобными, кататоническими расстройствами и эпилептиформными пароксизмами представляет определенные трудности при отграничении данного заболевания от злокачественной шизофрении раннего детского возраста и синдрома Каннера, от эпилепсии с грубой ранней деменци-ей от прогредиеитно-дегеиеративных заболеваний и резидуальных органических состояний с шизофреноподобным или эпилептиформным синдромом. В большинстве случаев дифференциальный диагноз возможен лишь на основании лабораторных исследований. Диагностика фенилкетонурии проводится исходя из клинической картины и биохимических исследований. Предварительный диагноз устанавливается при помощи качественных проб па содержание в моче фенилпировиноградной кислоты, которая обычно появляется на 2—3-м месяце жизни больного ребенка, в отдельных случаях — несколько позже. Для окончательной диагностики необходимо количественное определение содержания фенилаланина в сыворотке крови. Больным фенилкетонурией можно считать ребенка, у которого при положительной реакции мочи на фенилпировино-градную кислоту в крови содержится не менее 15—20 мг% фенилаланина. Наиболее доступным методом является проба Феллинга: к 2—5 мл мочи прибавляют 1—1,5 мл 10% раствора полуторохлористого железа (FeCl3) и несколько капель 5% раствора соляной кислоты. Проба считается положительной при появлении сине-зеленого или серо-зеленого окрашивания, нередко с выпадением осадка. На этой же реакции основан метод использования индикаторных бумажек. Однако проба Феллинга неспецифична и может быть положительна при других наследственных болезнях обмена, таких, как алкаптонурия, гистидинемия, тирозиноз, болезнь кленового сиропа, а также при содержании в моче высоких концентраций таких веществ, как ацетон, адреналин, норадреналин, билирубин, салицилаты, аминазин. Более специфичной и чувствительной является проба с 2,4-динитрофснил-гидразином (2,4-ДНФГ). К 1—2 мл мочи добавляют такое же количество 0,3% раствора 2,4-ДНФГ. При положительной пробе через 1—3 мин появляется ярко-желтая окраска. Данная проба также положительна у больных гистидинемией, тирозинозом, гомоцистинурией. С помощью FeCl3, 2,4-ДНФГ и с индикаторными бумажками двукратно должны обследоваться все дети в возрасте 2—3 мес. Для более раннего выявления фенилкетонурии широко применяется микробиологический тест Гатри (Guthrie) и микробиологический метод с использованием ауксотрофных штаммов В. coli, предложенный Д. М. Гольдфарбом с сотр. (1968). При положительной или сомнительной реакции необходимо проведение точных количественных исследований концентрации фенилаланина и других аминокислот в сыворотке крови и моче, для чего применяются автоматические аминокислотные анализаторы и хроматографические методы. В неясных случаях необходимо применение метода нагрузки фе-нилаланином, который может быть также использован для выявления гетерозиготных состояний, что имеет большое значение для решения вопросов прогноза потомства в условиях медико-гсистичсской консультации. Единственным методом л е ч е и и я фенилкетонурии является специфическая диетотерапия, обеспечивающая резкое ограничение приема фенилаланина с пищей. Так как все белки животного и растительного происхождения имеют высокое (5—8%) содержание фенилаланина, вместо них для восполнения необходимой потребности в незаменимых аминокислотах применяют смеси аминокислот без фенилаланина («Аминогран») или гидролизаты белка, из которых частично или полностью удален фенилаланин. В СССР наиболее широко в настоящее время применяется препарат берлофен (ГДР). В связи с тем что фенилаланин является незаменимой аминокислотой, его нельзя исключить из питания ребенка полностью. Больные дети в среднем должны получать в сутки 15—50 мг фенилаланина. Дети раннего возраста нуждаются в большем количестве фенилаланина. Потребность эта восполняется за счет овощей, фруктов и других видов безбелковых продуктов. Препарат берлофен, за счет которого покрывается потребность организма ребенка в других незаменимых аминокислотах, назначают в зависимости от массы тела ребенка (см. таблицу). Перед употреблением берлофен разводят теплой водой или соками и дают ребенку перед едой, большую часть препарата перед завтраком, оставшуюся — перед полдником. Начальные дозы должны составлять У5—Уз от суточной. Постепенно, в течение 1—2 нед, суточную дозу доводят до нор* Масса больного, кг Пжрдистшый прием берлофена, г Масса больного, кг Ежедневный прием t берлофена, г 2,5 3,0 3,5 4,0 5,0 6,0 7,0 8,0 9,0 12 14 15 17 21 24 27 30 33 10,0 11,0 12,0 14,0 16,0 18,0 20,0 2Г>,() 34 34 34 37" 37 43Г 48 61 66  мы. Одновременно уменьшают дозу натурального белка в пище. Общее количество натурального белка должно составлять не более l/$—Ve от потребности здорового ребенка соответствующего возраста. Для этого из пищи исключаются все продукты с высоким содержанием белка: мясо, рыба, печень, почки, колбасы, яйца, сыр, мороженое, изделия из пшеничной и ржаной муки, риса, изюм, орехи, шоколад, какао, крупы,, горох, фасоль. Рекомендуются для употребления: сахар,, фруктовые соки, мед, растительные масла, топленое масло, искусственное саго. Молоко, картофель, овощи, фрукты дают ребенку с учетом содержания в них фенилаланина. Ежедневная потребность в калориях должна превышать возрастную норму на 10—20% за счет углеводов и жиров. Одновременно с берлофеном необходимо давать витамины, препараты кальция и железа. Единственным критерием правильной терапии является показатель уровня фенилаланина в крови, который должен находиться в пределах от 2 до 6 мг%. Перед лечением необходимо полное биохимическое исследование крови и мочи. В первый месяц лечения содержание фенилаланина в крови следует определять еженедельно, затем, до 1 года — ежемесячно и после 1 года — 1 раз в 3—4 мес. Лечение должно проводиться до 6—8-летнего возраста при тщательном наблюдении за общим состоянием и развитием ребенка. Применяется также симптоматическая терапия по показаниям (психотропные, противосудорожные средства и др.). Рекомендуются занятия с логопедом, дефектологом. Профилактика клинических проявлений заболевания заключается в своевременном выявлении и лечении детей, страдающих фенилкетону-рией. Гаргоилизм Гаргоилизм (болезнь Гурлер — Пфаундлера — Хантера, му-кополисахаридоз, липохондродистрофия, множественный ди-зостоз) — группа заболеваний, обусловленных наследствен- кой патологией соединительной ткани, различающихся по характеру обменных нарушений, но имеющих большое клиническое сходство. Характеризуются одновременным поражением центральной нервной системы, органов зрения, опорно-двигательного аппарата и внутренних органов. Заболевание описано Thomson (1900), Hunter (1917), Hurler, Pfaundler (1919). В СССР заболевание изучалось Л. О. Бадаляном, Е. И. Гусевым (1971). Название «гаргоилизм» дано заболеванию в связи с некоторым внешним сходством больных со скульптурными изображениями химер (gargoiles). Заболевание передается по аутосомно-рецессивному типу наследования или рецессивному, сцепленному с Х-хромосомой (форма Hunter). Мальчики заболевают в 2 раза чаще, чем девочки. Для возникновения заболевания имеет значение кровное родство родителей. В основе заболевания лежат генетически обусловленные нарушения обмена кислых муко-полисахаридов, сложных белково-полисахаридных образований, которые играют важную роль в структуре и функционировании соединительной ткани. У больных обнаруживается избыточное выделение их с мочой и накопление в соединительной ткани и внутренних органах. Так как в различных органах и тканях преобладают различные типы мукополиса-харидов, нарушение их обмена, особенно кислых гликоза-мингликоиов, приводит к различным епмитомокомплексам. При патологоанатомическом исследовании обнаруживаются изменения во многих органах и системах. Высокомолекулярные липоидно-полисахаридные вещества откладываются в .виде мелкозернистой массы в нервных клетках мозга, периферических ганглиях и сетчатке глаз. Происходит значительное изменение мозга, возникают гидроцефалия, утолщение твердой мозговой оболочки. В костной системе обнаруживаются нарушения энхондрального и перихондрального окостенения, разрастание кровеносных сосудов в хряще, накопление в его клетках гликозамингликонов и липидов. Эти же вещества откладываются в паренхиматозных клетках печени, ретикулярных клетках селезенки, эпителии извитых канальцев почек, а также в сердце, аорте и других органах. В основном веществе соединительной ткани обнаруживается накопление только гликозамингликонов. В нем отмечается утолщение коллагеновых волокон и дезорганизация основного вещества. Типовые клинические признаки заболевания проявляются в первые месяцы жизни ребенка. Характерен внешний вид больных (рис. 8). Постепенно нарастают явления акромегалии, становятся грубыми черты лица. Череп увеличивается в размерах, отмечаются дисплазии: лоб нависает над лицом, нос широкий с запавшей переносицей, выражен гипертело-ризм и экзофтальм, деформированные ушные раковины рас- Рис. 8. Гаргоилизм, больной 6V2 лет, положены низко, губы сплюснуты, неправильный рост зубов, высокое небо, язык увеличен в размерах (мегалоглоссия). Постепенно эти диспластические признаки становятся более выраженными. Шея, туловище и конечности больных укорочены. Грудная клетка деформирована, реберные дуги развернуты кнаружи, позвоночник искривлен. Ладонь широкая, пальцы короткие, толстые. Отмечается тугоподвижность в суставах. При рентгенологическом исследовании выявляется уплотнение костей черепа, расхождение швов и истончение их краев, уплощение турецкого седла. В трубчатых костях обнаруживается утолщение эпифизов, нарушение энхондраль-ного и перихондрального окостенения. Со стороны внутренних органов обнаруживаются пороки сердца, диффузные изменения миокарда, явления гепатоспле-номегалии, увеличение живота, пупочные и паховые грыжи. Слух и зрение постепенно снижаются. При офтальмологиче- № ском исследовании нередко выявляются помутнение роговицы, мегакорнеа, катаракты, глаукома, застойные явления на глазном дне, атрофия дисков зрительных нервов. Со стороны центральной нервной системы отмечаются резкая диффузная мышечная гипотония, двигательная заторможенность и вялость. Психическое развитие детей резко задерживается. Психические процессы отличаются чрезвычайной вялостью и инертностью. Интеллектуальный дефект прогредиентно нарастает и чаще достигает степени идиотии. Степень выраженности, частота и сочетание различных клинических признаков при мукополисахаридозах не всегда одинаковы. По типу наследования, выраженности клинических проявлений, степени прогредиентности и особенностям биохимических нарушений различают шесть типов (синдромов) заболевания. Диагностика гаргоилизма основывается на клинических, генеалогических и биохимических данных. Биохимическое обследование включает исследование мочи больных на кислые мукополисахариды (реакция Барри с толуидиновым синим, реакция преципитации кислых мукополисахаридов с альбумином— реакция Дорфмана). Отдельные фракции мукополисахаридов исследуются с помощью методов электрофореза на бумаге и хроматографии. Специфическая патогенетическая терапия гаргоилизма не разработана. Рекомендуется назначение высоких доз ЛКТГ для угнетения синтеза кислых мукополисахаридов. В связи с недостаточностью функции щитовидной железы целесообразно назначение тиреоидина. Имеется указание на положительный терапевтический эффект применения высоких доз витамина А и рентгеновского облучения гипофиза. Синдром Марфана В 1896 г. французский педиатр В. J. A. Marfan описал у детей заболевание с врожденной мезодермальной дистрофией, которое он назвал долихостеномелией из-за наличия у больных длинных, тонких пальцев. Несколько позднее у этих больных были обнаружены аномалии развития глаз и сердечно-сосудистой системы. В дальнейшем заболевание получило название «арахнодактилия» (паукообразные пальцы). Синдром Марфана относится к числу редких аутосомно-домипапт-ных заболеваний, поражающих мальчиков и девочек с одинаковой частотой. Соматические признаки заболевания нередко в стертом виде могут обнаруживаться у родителей. Клинические симптомы в большинстве случаев обнаруживаются с рождения и в типичных случаях представлены триадой— аномалиями развития глаз, костно-мышечиоп и сер-дечно-сосудистой систем. Однако нередко отмечаются случаи с преимущественным поражением какой-либо одной си   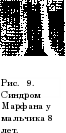 стемы. Больные с синдромом Марфана (рис. 9) высокого роста, астенического телосложения, с истонченным костным скелетом и слабо выраженной мышечной системой. Отмечаются своеобразные аномалии и дисплазии строения: узкий до-лихоцефалической структуры череп, увеличенные оттопыренные ушные» раковины, высокое небо, прогнатизм, деформации грудной клетки (нороимюиразная или килеобразная), искривление позвоночника (кифоз, сколиоз), сращение поясничных позвонков, удлинение копеч ностей и особенно пальцев (арахподак тилия), а также разболтанность суета вов. К числу частых проявлений относятся аномалии строения глаз: эктопия хрусталика, реже катаракта и колобома радужной оболочки, миопия и др. Примерно у половины больных обнаруживаются пороки и аномалии развития сердечно-сосудистой системы (дефекты перегородок и клапанов сердца, расслаивающая аневризма аорты и других сосудов), а также аномалии строения легких, почек и других внутренних органов. У больных слабо развит подкожный жировой слой, отмечается слабость связок и сухожилий. стемы. Больные с синдромом Марфана (рис. 9) высокого роста, астенического телосложения, с истонченным костным скелетом и слабо выраженной мышечной системой. Отмечаются своеобразные аномалии и дисплазии строения: узкий до-лихоцефалической структуры череп, увеличенные оттопыренные ушные» раковины, высокое небо, прогнатизм, деформации грудной клетки (нороимюиразная или килеобразная), искривление позвоночника (кифоз, сколиоз), сращение поясничных позвонков, удлинение копеч ностей и особенно пальцев (арахподак тилия), а также разболтанность суета вов. К числу частых проявлений относятся аномалии строения глаз: эктопия хрусталика, реже катаракта и колобома радужной оболочки, миопия и др. Примерно у половины больных обнаруживаются пороки и аномалии развития сердечно-сосудистой системы (дефекты перегородок и клапанов сердца, расслаивающая аневризма аорты и других сосудов), а также аномалии строения легких, почек и других внутренних органов. У больных слабо развит подкожный жировой слой, отмечается слабость связок и сухожилий.В литературе синдроме Map- Психическое недоразвитие при синдроме Марфана может достигать глубокой степени (имбецильности), но не является обязательным признаком заболевания. У многих больных наблюдается нормальное психическое развитие, особенности психических нарушений при фана почти не освещены. Наши наблюдения (Б. А. Леденев) 4 больных с типичными клиническими проявлениями в соматическом статусе и с психическим недоразвитием, достигающим у 3 больных дебильности и у одного имбецильности, позволяют отмстить неравномерность интеллектуального дефекта при этом заболевании. Интеллектуальная недостаточность в большей степени обусловлена нарушениями предпосылок познавательной деятельности и в меньшей степени —-дефектом собственно абстрактного мышления. У этих больных обнаруживается недостаточность активного внимания, памяти, пространственного восприятия, анализа и синтеза. Характерны также замедленность, тугоподвижность и инертность мыслительных процессов, недостаточность побуждений и активности в деятельности. У всех больных отмечается недостаточность моторики. В то же время эти больные послушны, легко подчиняемы и при стимуляции и коррекции могут проявлять старательность, добросовестность, что способствует приобретению несложных навыков. В основе патогенеза синдрома Марфана лежит системное поражение соединительной ткани в связи с нарушением строения коллагена и эластических волокон. Рентгенологически обнаруживаются остеопороз метафизов костей, редкая трабекулярная сеть, истончение кортикального слоя, широкие межреберные промежутки и шпорообразные пяточные кости. Специфического лечения синдрома Марфана не существует. Проводится симптоматическая и общеукрепляющая терапия. Назначаются витамины группы В, препараты аминокислот. При вторичной глаукоме вследствие эктопии хрусталика показано оперативное лечение. При выраженных деформациях грудной клетки проводится торакопластика в результате которой увеличивается жизненная емкость легких, улучшаются общее самочувствие и показатели ЭКГ. Прогноз заболевания зависит от тяжести сердечно-сосудистых нарушений и степени психического недоразвития. Синдром Лоуренса—Муна— Барде— Бидля Синдром Лоуренса — Муна — Барде — Бидля объединяет в себе сходные, но неидентичные заболевания (V. McKusick, 1970). В современной литературе данным термином чаще обозначаются клинические состояния, описанные G. Bardet (1920) и A. Biedl (1922). Для этих состояний характерно сочетание умственной отсталости, пигментной ретинопатии и гипогенитализма с ожирением и полидактилией, в то время как при описанных J. Laurence и R. Moon (1868) состояниях умственная отсталость, пигментная ретинопатия и гипогени-тализм сочетаются со спастической параплегией. Синдром наследуется по аутосомно-рецессивному типу. Патогенез заболевания неясен. Выраженные вегетативные и эндокринные нарушения свидетельствуют о недостаточности гипоталами-ческой области. Обнаруживаются разнообразные нарушения жирового, минерального, белкового и других видов обмена вещества. Характерен внешний вид больных (рис. 10): резкое ожирение по адипозогенитальному типу, выраженные явления ги-тогенитализма, дисплазии строения (гипертелоризм, эни-кант), аномалии строения скелета и дизрафические признаки. Часто встречающимися и патогномоничными признаками являются короткопалость и полидактилия (шестипалость). На глазном дне часто обнаруживается пигментный ретинит. В неврологическом статусе с наибольшим постоянством отмечаются горизонтальный нистагм, слабость лицевого нерва, общая мышечная гипотония, вегетососудистая листания. Психическое недоразвитие при синдроме Лоуренса —Муна — Барде — Бидля варьирует от дебильности до глубокой идиотии. В структуре интеллектуального дефекта постоянно обнаруживаются проявления психоэндокринного синдрома (нарушение влечений, слабость побуждений, расстройства настроения). Лечение симптоматическое. Некоторое улучшение отмечается при применении гормонов щитовидной железы. Прогерия Рис. 10. Синдром Лоуренса —Муна -Барде —Бидля у больного 15 лет. Прогерия — исключительно редкое наследственное заболевание, которое характеризуется преждевременным старением. В литературе высказывается предположение о рецессивном типе наследования (McKusick, 1970). В патогенезе заболевания определенное значение имеет нарушение липопротеинового обмена и гормональная недостаточность (Л. О. Бадалян и др„ 1971). Больные дети имеют характерный внешний вид (рис. 11): они отстают в физическом развитии, выглядят значительно старше своего возраста. Лицо старообразное, «птичий» нос, маленький рот, губы тонкие, подбородок заострен. Подкожный жировой слой почти полностью отсутствует, кожа истонченная, морщинистая, сухая, наблюдается раннее выпадение волос, бровей, ресниц, бтмечаются признаки атрофии мышечной системы, задержка полового созревания. Явления инволюции (алопеция, катаракта, атеросклероз) могут появляться еще до 10-летнего возраста. Больные часто уми- Рис. И. Прогерия, мальчики 5 и 7 лет. рают от коронарной недостаточности в детском возрасте.. Психическое недоразвитие при ирогерии выражено в различи ной степени. К особенностям психической деятельности относятся ворчливость, рассудительность, гиперсоциальность ш другие особенности психики, свойственные старческому возрасту. Лечение симптоматическое: витамины, аминокислотные и липотропные препараты, богатая белками диета. |
