РУКОВОДСТВО ПО ОБЩЕЙ ХИРУРГИИ. Руководство по общей хирургии Учебное пособие. М. Оао Издательство Медицина
 Скачать 9.28 Mb. Скачать 9.28 Mb.
|
|
Аутопластика — материал для восстановления получают у самого оперируемого больного, как правило, вдали от области основного вмешательства. Этот вид свободной пластики распространен широко, поскольку пластический материал способен к истинному приживлению в результате восстановления сосудистых связей. Недостатком метода является необходимость дополнительной операции для получения трансплантата, а в ряде случаев количественная ограниченность пластического материала. Частным видом аутопластики является реимплантация отторгнутых кожных лоскутов или кожных покровов отделенных частей тела. Аллопластика — пересаживаемая ткань имеет биологическое происхождение (от трупа), обработана специальными методами (лиофилизация, замораживание и др.). Гомопластика — пластический материал берут от другого человека (донора). Положительной чертой этого вида пластики является возможность получения материала без нанесения дополнительной травмы больному. Гетеропластика — пересадка тканей от животного к человеку. Применяется крайне редко, так как имплантация чужеродного белка приводит к более глубокой несовместимости, чем при гомопластике. В настоящее время выделяют следующие основные направления рекон-структивно-восстановительной хирургии: пластическая хирургия покровных и подлежащих тканей; реконструктивно-восстановительная хирургия органов и частей тела; эндопротезирование. В зависимости от вида пересаживаемой ткани выделяют кожную, мышечную, сухожильную, нервную, костную, хрящевую и сосудистую пластики. При необходимости различные виды пересаживаемых тканей могут сочетаться (кожно-фасциальная, кожно-фасциально-мышечная, костно-мы-шечная, костно-сухожильная пластика). Все виды кожной пластики разделяют на два принципиальных варианта: свободную и несвободную. А Свободная кожная пластика подразделяется на свободную васкуляри-зированную и неваскуляризированную.
А Несвободную кожную пластику разделяют на два вида: закрытие раны путем использования прилежащей кожи с дополнительными разрезами или без них; закрытие раны при помощи перемещения кожного лоскута на ножке, взятого поблизости от раны или с отдаленных участков тела. Последние могут быть островковые, плоские и трубчатые. 677 21.1. Свободная пересадка кожи Кожные трансплантаты классифицируют в основном по толщине: 0,25— 0,7 мм средней толщины — расщепленные; 0,8—1,1 мм — полнослойные. Принципиальная разница пересадки полнослойного и расщепленного лоскутов заключается в технике взятия трансплантата, который выполняют специальным инструментом — дерматомом (рис. 21.1). Местная кожная пластика используется при ограниченных дефектах кожного покрова, когда в окружности раны имеются запасы кожи, пригодные для перемещения или скольжения. Наиболее простым вариантом местной кожной пластики является закрытие раны путем сшивания мобилизованных краев ее без каких-либо дополнительных разрезов. Другим вариантом местной кожной пластики является перемещение лоскута по принципу встречных треугольников. При этом происходит перемещение тканей, дающее увеличение их по направлению основного разреза и соответственное уменьшение по направлению, перпендикулярному основному разрезу. Вариант местной кожной пластики, заключающийся в боковом смещении или ротации (транспозиция) заключается в выкраивании около дефекта кожи различных по форме кожно-жировых лоскутов с последующим их перемещением в область изъяна кожи с замещением донорского места местными тканями или расщепленным трансплантатом. Местная кожная Z-пластика заключается в следующем. Если из конечных точек прямого разреза под одинаковым углом провести по одному разрезу одинаковой длины, а затем после обмена полученных треугольных лоскутов вшивать их, то направление первоначальной прямой изменится и длина ее увеличится. 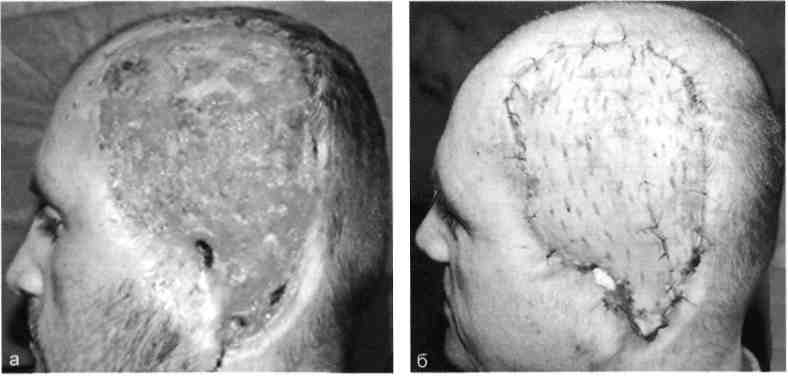 Рис. 21.1. Свободная кожная дерматомная пластика. а — гранулирующая рана после электроожога; б — пластика расщепленным трансплантатом. 678 Пластика кожным лоскутом на ножке из отдаленных частей тела, или так называемый итальянский метод, в настоящее время применяется главным образом при операциях на конечностях. Обязательным условием при выкраивании лоскутов является сохранение хорошего питания лоскута на всем его 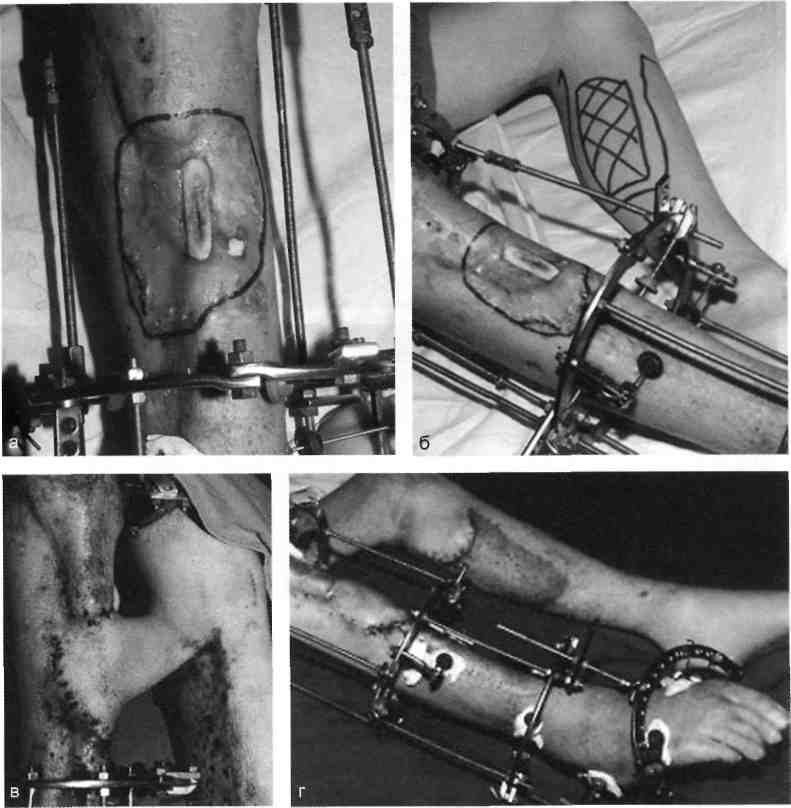 Рис. 21.2. Пластика кожным лоскутом на ножке раны голени после огнестрельного пулевого сквозного ранения. а — гранулирующая рана голени; б — выкраивание внутреннего кожно-мышечного лоскута противоположной голени; в — перемещение лоскута на рану; г — завершение операции. протяжении. Для этого нужно включать в состав лоскута жировую клетчатку, а иногда фасцию и мышцу, чтобы использовать их сосуды (рис. 21.2). Кожная пластика островковыми лоскутами. Использование островковых лоскутов на центральной сосудистой ножке является одним из классических методов пластики дефектов тканей. Развитие этого направления пластической хирургии было предопределено двумя обстоятельствами — возможностью широкого использования его при дефектах тканей в периферических отделах конечностей (кисть, стопа) и допустимостью пересадки крупных участков тканей (кожно-фасциаль-ных, мышечных, включающих кость) на значительное расстояние без наложения микрососудистых анастомозов. 679 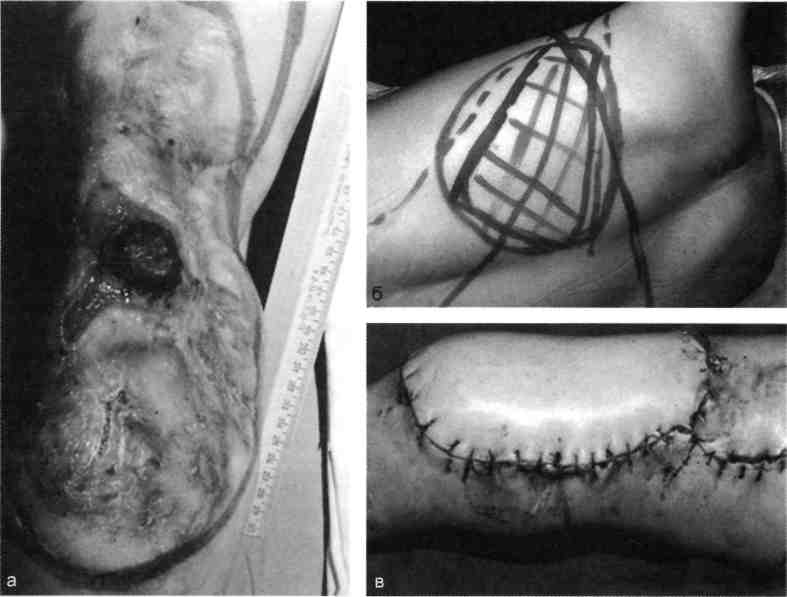 Рис. 21.3. Свободная пересадка васкуляризованных аутотрансплантатов на рану бедра после огнестрельного перелома правой бедренной кости с первичным дефектом мягких тканей. а — гнойно-некротическая рана бедра; б — выкраивание торакодорсального лоскута слева на питающих сосудах; в — окончательный вид после операции. Свободная пересадка васкуляризированных аутотрансплантатов. В настоящее время использование микрохирургической техники позволяет выполнять свободные пересадки разнообразных комплексов тканей практически в любую область человеческого тела и даст в руки специалистов принципиально новые возможности (рис. 21.3). 21.2. Пластическое замещение дефектов мышц Пластические операции, выполняемые при дефектах мышц, подразделяют 3 группы: транспозицию сухожилий мышц-синергистов или антагонистов; транспозицию (несвободную) пересадку мышц; свободную пересадку мышц. При дефектах мышечных групп допустима несвободная пересадка мышц-антагонистов. Наиболее часто такие операции осуществляют на предплечье при невосстановимых повреждениях лучевого нерва (сухожилия мышц ладонной группы предплечья перемещают к сухожилиям мышц тыльной группы), или при повреждениях малоберцового нерва. 680 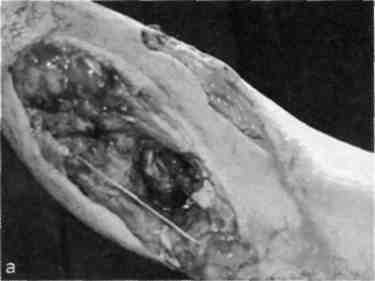 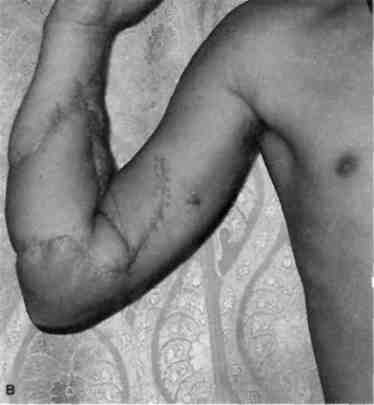 Рис. 21.4. Свободная пересадка мышц. а — огнестрельное осколочное ранение верхней трети предплечья с размозжением мышц — сгибателей кисти и пальцев, повреждением срединного и локтевого нервов; б — сосуды торакодорсального трансплантата ана-стомозированы с плечевой артерией и веной по типу конец в бок, торакодорсальный нерв сшит с двигательной ветвью срединного нерва; в — окончательный вид операции. В некоторых случаях необходимо полное выделение мышцы на сосудисто-нервном пучке с последующим перемещением точек прикрепления мышцы (например, при пересадке широчайшей мышцы спины для пластики передней группы мышц плеча). Свободная пересадка мышц. Свободная пересадка мышц с восстановлением их активной функции получила распространение преимущественно при дефектах групп мышц верхней конечности (рис. 21.4). 21.3. Пластика сухожилий Чаще всего дефект сухожилий замещают за счет сохранившихся концов. При незначительных укорочениях используют сгибание конечности в суставах, надрезы с поворотом отслоенного лоскута. Учитывая высокую нагрузку, возможность прорезывания швов, и отрицательное влияние шовного материала на скользящих поверхностях, для надежности сухожильного шва предложен целый ряд специальных способов. При выраженных дефектах сухожильной ткани используют ауто- или го-мотрансплантаты. Одноэтапная тендопластика некровоснабжаемым транс- 681 плантатом является наиболее распространенной операцией, в ходе которой сухожильную вставку вшивают в дефект сухожилия. В подавляющем большинстве случаев операцию данного типа выполняют при застарелых повреждениях сухожилий сгибателей пальцев кисти. Двухэтапная тендопластика применяется исключительно в хирургии сухожилий сгибателей пальцев кисти. Транспозиция сухожилий является одним из методов замещения дефектов сухожилий, когда для этого используют рядом расположенное сухожилие, мышца которого может быть переключена на новую функцию без значительных функциональных утрат. Наиболее часто используют одно из парных сухожилий, смежных с зоной дефекта (поверхностные и глубокие сухожилия сгибателей, общий и собственный разгибатели II и V пальцев кисти). При сочетании дефекта мягких тканей с дефектом сухожилий могут быть использованы кровоснабжаемые комплексы тканей, включающие сухожилия. 21.4. Пластика нервов Пластика нервов находит место при их дефектах и параличах. Сшивание (пластика) нерва должна выполняться без натяжения, при прецизионном сопоставлении идентифицированных (соответствующих друг другу) пучков, когда концы нерва выделяют из тканей на минимальном расстоянии, а швы накладывают тончайшим шовным материалом. Периневральные швы адаптируют с использованием операционного микроскопа, кропотливо соединяя друг с другом нервные пучки и их группы, чтобы не допустить их ступенеобразного дефектного смещения. С накоплением опыта многие хирурги пришли к заключению, что применение микрохирургической техники позволяет существенно улучшить результаты операций при травмах и последствиях повреждений периферических нервных стволов. С помощью кровоснабжаемых невральных трансплантатов удается полностью заместить дефект нерва небольшой длины, перекрыв трансплантатами его поперечное сечение. В случаях, когда дефект значительный, а кровоснабжаемый трансплантат не может обеспечить достаточное количество отрезков, которые необходимы для перекрытия всего поперечного сечения поврежденного нервного ствола, трансплантат берут вместе с дополнительным участком подкожной жировой клетчатки, через который проводят обычные некровоснабжаемые невральные трансплантаты, укрывая их уже пересаженными хорошо крово-снабжаемыми тканями. При изолированных параличах нервов практикуют передачу функций парализованного нерва, находящемуся в анатомической близости к здоровому нерву. Периферическую часть парализованного нерва подшивают к здоровому, который постепенно начинает выполнять его функции. 21.5. Пластика сосудов Пластика дефектов сосудов, по сути, является комбинацией сосудистых швов, позволяющих восстановить или реконструировать сосудистую сеть. Соединение поврежденных сосудов может осуществляться по типу конец в конец (рис. 21.5) или конец в бок (рис. 21.6). 682  Рис. 21.5. Наложение сосудистого шва вручную по типу конец в конец, а — артерия; б — вена. 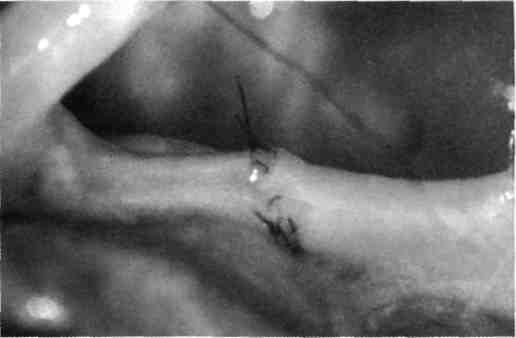 Рис. 21.6. Наложение сосудистого шва вручную на артерию по типу конец в бок. Механический шов накладывают с помощью специальных сосудосши-вающих аппаратов. Этот метод получил широкое распространение и предусматривает соединение концов артерий и вен диаметром более 1,5 мм специальными П-образными танталовыми или стальными скобками. Осуществляют восстановление магистрального кровотока и путем их временного протезирования (рис. 21.7). 21.6. Костная пластика В восстановительной хирургии костная пластика по распространенности занимает одно из ведущих мест. Она предполагает замещение костных дефектов после ранений и травм, заполнение костной тканью дефектов кости при кистах, доброкачественных опухолях или опухолях с элементами злокачественного роста, псевдоартрозах, а также после санирования хронического очага остеомиелита. В качестве аутотрансплантатов наиболее часто используют ребра, диафиз малоберцовой кости, метафизов лучевой и большеберцовой костей, подвздошной кости, суставов пальцев стопы. 683 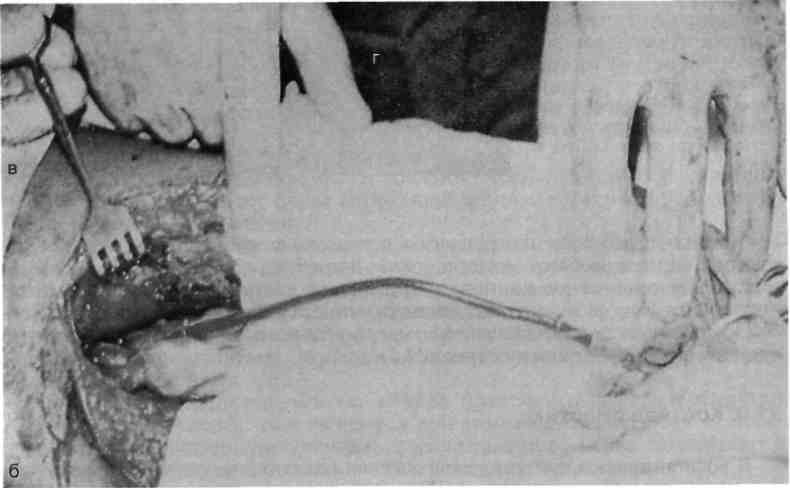 J Рис. 21.7. Огнестрельное ранение мягких тканей бедра с повреждением бедренной артерии. а, б — временное протезирование бедренной артерии пластиковой трубкой от системы для переливания растворов. 684 Используются аллотрансплантаты — участки костей, взятых у трупов, консервация которых осуществляется путем замораживания или обработки различными консервантами. Пока еще не получили широкого применения ксеногенные ткани (от животных) в связи с их высокой реактогенностью. Особое место среди ко-стно-пластических материалов занимают брефотрансплантаты (ткани мертворожденных либо умерших новорожденных). Их важной особенностью является низкая антигенная активность, но трудности забора трансплантатов и ограниченные объемы тканей сдерживают широкое применение метода. Показания к костной пластике возникают в двух случаях: 1) при краевых дефектах костей, если их образование сопровождается значительным снижением механической прочности кости; 2) при циркулярных дефектах трубчатых костей, когда остеосинтез с укорочением невозможен либо значительно нарушает функцию конечности. При краевых дефектах костей и костных полостях со значительным снижением механической прочности кости могут быть в асептических условиях использованы некровоснабжаемые губчатые ауто- и аллотрансплантаты, а также кортикальные аллотрансплантаты в виде «вязанки хвороста» или костной стружки. В инфицированных ранах предпочтение отдают кровоснабжаемым ауто-тканям (в том числе кожно-костным комплексам), которые значительно более устойчивы к развитию инфекции. Выделяют несколько видов костной пластики — свободную, несвободную и комбинированную. Пересадка свободного васкуляризированного костного аутотрансплантата в настоящее время получает все большее распространение. Все эти трансплантаты могут быть использованы как в качестве монолоскутов, так и в виде поликомплексов тканей, дополнительно включающих участки мышцы, кожи и других тканей. Несвободная пересадка участков кости на питающей ножке — один из наиболее ранних методов костно-пластической хирургии. Репаративные возможности костных лоскутов на питающей ножке соответствуют таковым кровоснабжаемым костных трансплантатов. При всех видах костной пластики успех операции и всего лечения определяется не только адекватностью восстановленного кровоснабжения тканей, но и качеством выполнения остеосинтеза. 21.7. Реплантация конечностей и их сегментов С развитием микрохирургии широкое распространение получило возвращение утраченных при травме конечностей или их сегментов на их первоначальное место. Ампутированную конечность (или ее сегмент) с места травмы как можно быстрее доставляют в специализированное лечебное учреждение с соблюдением условий консервации, которую можно выполнить, имея три разной длины и ширины полиэтиленовых пакета, вложенных один в другой. При этом их емкости изолированы друг от друга. Во внутреннюю секцию пакета помещают ампутированный сегмент конечности, между внутренним и средним пакетом необходимо обеспечить воздушную подушку путем герметизации пакетов лигатурами и вокруг среднего и наружного пакета — кусочки льда с водой. Емкости пакета герметизируют зажимами (заглушками). Таким образом, конструкция пакета позволяет 685 проводить равномерное охлаждение отчлененной конечности, предохраняя ее от недопустимого прямого контакта с водой и льдом. В реплантационной хирургии очень важны четкие и конкретные представления о микрореплантации и макрореплантации. Микрореплантация — реплантации частей конечностей, ампутированных дистальнее запястных или голеностопных суставов; макрореплантации — реплантации частей конечностей, ампутированных проксимальнее запястных или голеностопных суставов. Допустимый период гипоксии при макрореплантации на руке — максимум 6 ч; при микрореплантации для пальца — до 22 ч при условии охлаждения. При микрореплантации наиболее важным моментом является микрохирургическая техника. Микрореплантацию выполняют в основном при ампутации на кисти, а также реплантации волосистой части головы, пальцев ног, ампутации на уровне средней трети стопы или других периферических частей тела. В реплантационной хирургии основополагающее значение имеют следующие принципы:
Реплантация конечности тем успешнее, чем раньше она проведена. В этом случае отчлененная конечность тотчас же должна быть подвергнута консервации. Наиболее приемлемым вариантом консервации является методика А. Г. Лапчинского и его учеников — искусственное кровообращение с охлаждением. Прежде чем готовить конечность с длительной аноксией (свыше I ч) к реплантации, надо быть уверенным в ее пригодности для этой цели. Имеется в виду не только ее анатомическая сохранность, но главным образом жизнеспособность и способность тканей к адекватному восстановлению кровотока и обмена в ответ на «реанимационные» мероприятия. При определении пригодности конечности для подготовки к реплантации, наряду с объективной оценкой ее состояния, измерением мышечной электровозбудимости, термометрии тканей и рентгеновазографией очень важна оценка состояния ампутированной конечности методом искусственного кровообращения — изолированной перфузией. Реплантация конечности с аноксией в течение 6 ч после такой подготовки сопровождается значительными расстройствами функций жизненно важных органов, прогрессирующим ростом токсичности крови и высокой летальностью в первые сутки после операции. В связи с этим в комплексе мероприятий при подготовке длительно аноксированной конечности к реплантации используют гемоперфузию в сочетании с гемосорбцией активированным углем. 686 Перспективным направлением развития принципа регионарной перфузии ишемизированной конечности является направленный транспорт ли-пидных субстанций в аноксированные ткани в форме липосом, содержащих окислительно-восстановительные митохондриальные ферменты типа экстрактов из гепатоцитов. Основные этапы реплантации выполняют в следующей последовательности: идентификация и маркировка структур; первичная хирургическая обработка; укорочение или подравнивание костных отломков; остеосинтез; сшивание сухожилий сгибателей (обоих, если возможно); артериальные анастомозы; сшивание нервов; сшивание сухожилий разгибателей; венозные анастомозы; свободная адаптация краев раны, дренирование и кожный шов; иммобилизация конечностей. 21.8. Эндопротезирование Далеко не всегда существует возможность использования для восстановления того или иного органа собственных тканей реципиента. В этих случаях используют эндопротезы. Преимущество их заключается в возможности изготовления промышленным способом любого количества импланта-тов необходимой формы, величины и качества, что позволяет обойтись без дополнительных оперативных вмешательств у донора. Металлические имплантаты находят широкое применение в травматологии в виде гвоздей, пластин и винтов для стабилизации переломов костей. Эндопротезы служат для замещения дегенеративно, травматически и ревматически измененных суставов. К синтетическим протезам предъявляются особые требования: они должны хорошо переноситься тканями организма, быть свободными от промышленного загрязнения и химических примесей, не должны содержать свободные мономеры. В качестве исходного материала используют дакрон, диолен, тревира, тефлон, силикон, силиконовый каучук. Внедренные в организм имплантаты из искусственных материалов вступают в контакт с окружающими тканями. Порозные протезы (сетки для укрепления брюшной стенки, сосудистые протезы) прорастают соединительной тканью за счет внедрения фибробластов в поры протеза. Вокруг гладких имплантатов образуется соединительнотканная капсула с эпителиоподобной внутренней выстилкой (силиконовые протезы молочной железы, силиконовые трубки для получения ложа сухожилия сгибателя). 21.9. Трансплантация органов Выдающиеся достижения мировой трансплантологии за последние десятилетия способствовали неуклонному росту количества ежегодно выполняемых во многих странах аллотрансплантаций трупных органов — почки, сердца, сердечно-легочного комплекса, печени, поджелудочной железы. В первую очередь это потребовало решения морально-этических вопросов забора и консервации органов и тканей. Изъятие донорских органов для клинической трансплантации выполняют в соответствии с «Инструкцией о порядке изъятия органов человека у «доноров-трупов», утвержденной Приказом МЗ РФ № 189 от 10 августа 1993 г. Изъятие органов допускается только в государственных лечебно- 687 профилактических учреждениях, научно-исследовательских институтах, высших медицинских учебных заведениях, центрах, имеющих соответствующее разрешение на этот вид деятельности. При поступлении в такое учреждение потенциального донора ответственный в текущий период времени медицинский работник не позднее первого часа от поступления должен сообщить о нем бригаде специалистов по изъятию и заготовке органов, которая создается при учреждениях здравоохранения, осуществляющих трансплантацию или имеющих разрешение на изъятие органных трансплантатов. Изъятие донорских органов оформляют специальным «Актом об изъятии донорских органов и медицинской экспертизы трупа», который прилагается к истории болезни. С момента принятия решения о выполнении операции изъятия органов до завершения операции на доноре проводят его кондиционирование, т. е. интенсивную терапию, направленную на сохранение оптимальной функции жизненно важных органов до момента их изъятия. Принципиальными вопросами, определяющими возможность получения органов для трансплантации, остаются установление момента истинной смерти донора и сохранение функциональной полноценности изымаемых органов. Биологическую смерть — состояние необратимой гибели организма как целого констатируют на основании прекращения сердечной деятельности и дыхания, а также на основании смерти мозга, т. е. необратимого прекращения функций его, включая и стволовые отделы. Консервацию органов и тканей осуществляют следующими методами: биологической перфузией, предусматривающей поддержание исходного (оптимального) уровня метаболической активности в органах путем перфузии их кровью в нормотермическом режиме или близком к нему (34—39 °С); помещением в растворы, содержащие антисептические средства с последующим хранением в охлажденных растворах — гипотермическая консервация, основанная на обеспечении снижения, но адекватной метаболической активности трансплантата путем хранения его при 8—12 °С (фармакохолодовая бесперфузионная консервация); глубоким охлаждением (криоконсерва-ция) — быстрое замораживание при температуре от —183 до —273 °С с последующим хранением при температуре от —25 до —30 °С; лиофилизацией — замораживание с последующей сушкой в вакууме применяют для консервации костей; погружением в парафин. Гомо- и гетеротрансплантаты приживают плохо, и нередко уже после приживления отмирают в отторгаются. Такое положение обусловлено антигенной несовместимостью тканей донора и реципиента. Причиной отторжения является так называемый трансплантационный иммунитет — защитная иммунологическая реакция организма. В ответ на чужеродный белок трансплантата организм реципиента вырабатывает специфические антитела, которые и разрушают трансплантат, вызывая его отторжение. Проблема преодоления тканевой несовместимости решается двумя путями. Первый из них предполагает использование возможностей подбора близких по антигенным свойствам донора и реципиента. Другой путь заключается в использовании иммунодепрессивного воздействия на организм реципиента. С помощью физических, химических и биологических агентов это воздействие направлено на разрушение или элиминацию иммунокомпетент-ных клеток или на подавление их функционирования или пролиферации. С этой целью используют облучение рентгеновскими лучами, воздействие химическими препаратами (милеран, циклофосфамид, сандиммун), препаратов, подавляющих образование антител (азотиоприн, преднизолон). В первые недели после трансплантации дополнительно применяют антилимфоци- 688 тарные глобулины. Таким образом длительное время удается поддержать функциональную способность пересаженного органа во многих случаях. Трансплантация почки. В настоящее время это вмешательство стало стандартным и отличается большой технической надежностью. Примерно 60 % трансплантированных почек функционируют в течение одного года, 40 % — после пяти лет. Летальность составляет около 10 %. Показанием к трансплантации почек являются невозможность и затруднения при проведении гемодиализа, вторичный гиперпаратиреоз в детском и юношеском возрасте, ювенильный сахарный диабет. В технике трансплантации почки основными моментами являются необходимость ее правильного ретропери-тонеального расположения в подвздошной ямке и выполнение достаточно широких сосудистых анастомозов. Трансплантация печени. Принципиально существуют два хирургических подхода к трансплантации печени. Первый состоит в помещении донорской печени или ее доли в гетеротопическую позицию, собственно пораженную печень при этом не удаляют. Ортотопическая трансплантация на сегодняшний день, безусловно, является методом выбора при лечении разнообразной патологии печени. За 30 лет клинического применения ортотопической трансплантации перечень показаний к ней вырос с единичных заболеваний (опухоли печени, врожденная патология) до большого списка, включающего более 50 нозологических форм. У детей ведущим по частоте показанием является билиарная ат-резия. У взрослых основное показание — постнекротический цирроз печени, далее в порядке частоты следуют: первичный билиарный цирроз, скле-розирующий холангит, большое количество различных заболеваний, проявляющихся метаболическими нарушениями на уровне печени. Показания к такой операции при опухолевых поражениях печени неоднозначны, но в настоящее время резко сужены. Трансплантация сердца. Сердце реципиента удаляют, оставляя заднюю стенку обеих предсердий с местами впадения полых вен. Затем подшивают сердце донора. Технически для опытного хирурга такая операция представляет меньше трудностей, чем некоторые другие операции на сердце. Показаниями к пересадке сердца прежде всего являются кардиомиопатии и склероз коронарных артерий. Срок жизни больных с такой патологией составляет несколько месяцев. При успешной пересадке сердца он может быть продлен до 10 и более лет. Трансплантация легких. Технические принципы аллотрансплантации целого легкого в значительной степени разработаны. Получены обнадеживающие клинические результаты. Однако из-за высокой степени чувствительности легких прежде всего к реакции отторжения и инфекции очень быстро развивается отек трансплантата и нарастает гипоксемия. Трансплантация поджелудочной железы. Основной задачей операции является возможность обеспечения реципиента оптимальным количеством инсулина в тех случаях, когда экзогенным его введением не удается достичь желаемого результата. Кроме эффективной трансплантации поджелудочной железы (тела, хвоста, долей) с сосудистым анастомозом в подвздошной ямке, гормональный эффект удалось получить при трансплантации изолированных островков Лангерганса или мельчайших фрагментов органа в печень через воротную вену. Свободная трансплантация островко-вой ткани поджелудочной железы развивается по двум основным направлениям: трансплантация островков, выделенных из поджелудочной железы взрослых доноров; трансплантация островковых клеток поджелудочной железы плодов и новорожденных. 689 Искусственная поджелудочная железа — альтернативное решение проблемы, но пока искусственные В-клетки с успехом используются для регулирования уровня глюкозы в крови. Аллотрансплантация кисти — идеальный вариант решения проблемы после травматической ампутации, резекции опухоли или врожденного отсутствия. В 1998 г. была выполнена первая аллотрансплантация кисти человеку, а в 2000 г. — двойная трансплантация кистей по поводу травматической ампутации последних. Плечевые артерии доноров были канюлирова-ны, затем на конечности, орошаемые с специальным раствором температурой 4 °С, выделены все анатомические структуры, были препарированы и подготовлены к операции. Реципиентные конечности подготовлены, мобилизованы все доступные мышцы и нейроваскулярные структуры. Трансплантация состояла из последовательного остеосинтеза, артериального и венозного анастомозов, швов нервов, мышц и сухожилий, первичного шва кожи. Клеточная трансплантация, несмотря на некоторые нерешенные проблемы, имеет ряд преимуществ по сравнению с пересадкой целых органов, так как возможно проведение предварительной обработки ткани перед трансплантацией с целью снижения иммуногенности донорского материала, что позволяет не применять иммуносупрессию или значительно уменьшить ее интенсивность; имеется возможность криоконсервирования донорских клеток и создания таким образом банка клеток, которые могут быть использованы в любое время, что особенно важно при возникновении потребности в массовых пересадках. Основными моделями клеточной трансплантации являются пересадки костного мозга, стволовых клеток, фибробластов, миобластов, гепатоцитов, клеток эпидермиса, островков поджелудочной железы, клеток надпочечника, щитовидной, паращитовидной желез и нервной системы. Трансплантацию клеток семенников (Лейдига) осуществляют для лечения больных с гипофункцией мужских половых желез. С целью предотвращения отторжения пересаженных клеток их помещают в микрокапсулы, хорошо проницаемые для тестостерона и стимулирующих его секрецию гонадо-тропинов. Пролонгирование выживания клеток Лейдига, подвергшихся аллогенной и ксеногенной трансплантации, может быть также получено благодаря предварительному культивированию тестикулярной ткани in vitro. Кроме того, снижению иммуногенности трансплантата способствует криоконсер-вирование донорского материала. |
