Типовые патологические процессы
 Скачать 7.53 Mb. Скачать 7.53 Mb.
|
13.4. Коллатеральное кровообращениеКоллатерали (от лат. соn - вместе и lateralis - боковой) - запасные (окольные) сосуды (сосудистые ветви), которые впадают в тот же сосуд, в котором начинаются. В норме они либо не функционируют, либо функционируют слабо. В условиях нарушения кровообращения по основному кровеносному сосуду коллатерали раскрываются и расширяются. По степени развитости коллатеральное кровообращение делят на следующие три основные вида. Абсолютно достаточное коллатеральное кровообращение - сумма медленно раскрывающихся коллатералей равна или меньше просвета магистрального сосуда. Эти коллатерали компенсируют кровоснабжение ткани при его закрытии основного сосуда. Такое кровообращение развивается в скелетных мышцах, брыжейке кишечника, легких. Относительно недостаточное (достаточное) коллатеральное кровообращение - сумма медленно раскрывающихся коллатералей меньше просвета магистрального сосуда, который закрылся. Такое кровообращение развивается в коже, стенке желудка и кишок, надпочечниках, мочевом пузыре. Абсолютно недостаточное коллатеральное кровообращение - сумма коллатерали, даже при максимальном раскрытии и расширении, не способны компенсировать нарушенное (в силу закрытия магистрального сосуда) кровообращение. Оно развивается в головном мозге, миокарде, почках, селезенке. Появление и расширение коллатералей происходит быстрее и интенсивнее при ишемии, нежели при венозной гиперемии. Степень развития коллатерального кровообращения зависит также и от многих других факторов, в частности от: - индивидуальных особенностей строения коллатералей (вариации могут быть самые разнообразные); - от фактора времени (быстро или медлденно происходила закупорка сосудов); - возраста больного (у молодых коллатерали развиваются лучше, чем у пожилых). Основное звено патогенеза коллатерального кровообращения - расширение просвета коллатеральных сосудов. Основные рабочие механизмы развития коллатералей: Гидродинамический. Его основу составляет увеличение перепада между неизменяющимся давлением крови выше места закупорки магистрального сосуда и сниженным давлением крови в микрососудах (прежде всего в капиллярах) ишемизированной области. Рефлекторный. Последний может реализовываться путем либо местного рефлекса, либо истинного рефлекса (с участием различных отделов сосудодвигательного центра). Данные рефлексы начинаются с возбуждения рецепторов как сосудов, так и тканей ишемизированной области. В частности, они могут формироваться в результате раздражения: - барорецепторов (из-за снижения давления крови); - хеморецепторов (из-за накопления недоокисленных метаболитов, снижения рО2; - ноцицепторов (вследствие развития гипоксии, увеличения образования и активности гистамина, брадикинина, субстанции-Р, продуктов промежуточного обмена веществ, ацидоза и др.). Гуморально-метаболический. Его основу составляет образование и накопление сосудорасширяющих ФАВ (ацетилхолина, гистамина, аденозина, АДФ, субстанции-Р, простациклина, лактата, пирувата, кетоновых тел, Н+, NO, СО, СО2). 14.5. Стаз Термин происходит от греч. stasis – неизменное состояние, остановка. Стаз – это прижизненная остановка тока крови в кровеносных и лимфатических сосудах микроциркуляторного русла. Виды стаза. Различают ишемический, венозный и капиллярный (истинный) стаз. В основе ишемического стаза лежит резко уменьшенное или полное закрытие просвета артериального сосуда; застойного стаза - значительное нарушение (затруднение или прекращение) оттока крови по венам; истинного стаза - первичное нарушение кровотока в капиллярах. Патогенез различных видов стаза. Механизмы ишемического и венозного стаза принципиально такие же, которые вызывают саму ишемию и венозную гиперемию. Разница заключается лишь в степени перепада крови между артериальной и венозной частями капилляров. Данный перепад достигает таких значений, которые нивелируются трением крови о стенки сосудов. В итоге кровь останавливается в терминальном сосудистом русле. Механизмы истинного стаза отличаются большей сложностью и разнообразием. Выделяют три основные группы механизмов развития истинного стаза: гемоконцентрационные, агрегационные, агглютинационные. Развитие истинного стаза обусловлено: - резкими нарушениями (вследствие увеличения количества и активности различных проагрегантов и прокоагуляатов) реологических свойств крови (развития адгезии, агрегации и даже агглютинации тромбоцитов, лейкоцитов и эритроцитов, особенно скопления эритроцитов в виде монетных столбиков - сладжа), приводящих к сгущению крови, повышению ее вязкости и снижению ее текучести, а в итоге - к замедлению тока крови; - значительным повышением проницаемости стенок капилляров (сопровождающегося увеличением выхода из сосудов воды, электролитов, гемоглобина, белков, полимеров, приводящего к увеличению осмотического и онкотического давления тканей в области стаза и развивитию сгущения крови и замедления кровотока); - уменьшением резорбции тканевой жидкости в венулярной части капилляров и в венулах (возникающего в результате повышения коллоидно-осмотического давления в тканях).; - параличом прекапиллярных сфинктеров (приводящего к резкому увеличению капиллярного русла, где скапливается большое количество крови, что сопровождается замедлением кровотока), либо спазмом прекапиллярных сфинктеров, артериол и мелких артерий (приводящего к уменьшению градиента давления между артериальной и венозной частями капилляров, а значит - и к уменьшению кровотока через терминальное кровеносное русло). Стаз может быть обратимым и необратимым. Обратимый стаз при устранении причины исчезает, кровоток восстанавливается. Необратимый стаз развивается в том случае, когда клетки крови, особенно эритроциты, соединяются в нераспадающиеся конгломераты - сладжи (от англ. sludge - ил, тина, грязь). Исходы (последствия) стаза для клеточно-тканевых структур органа обычно неблагоприятные. К ним, в частности, относятся: - внутрисосудистая агрегация эритроцитов (приводит к уменьшению текучести крови, повышению вязкости и уменьшению поступления О2 в ткани); - шунтирование крови через артериально-венозные анастомозы, (кровь не проходит через нутритивные капилляры и т.о. не участвует в обмене веществ); - уменьшение количества плазматических капилляров; - увеличение образования конгломератов эритроцитов (приводит к уменьшению суммарной поверхности дыхательной функции эритроцитов, а также к снижению способности эритроцитов отдавать кислород); - микротромбоз и микроэмболии агрегатами эритроцитов (приводят к недостаточной диффузии кислорода, питательных и регуляторных веществ в клеточно-тканевые структуры; развитию в них количественных и качественных нарушений метаболизма и функций; основу последних составляют дистрофия, паранекроз, некробиоз и некроз). 13.6. Расстройства микроциркуляцииНовейшие технические разработки в телевидении и оптике позволяют наблюдать изменения микроциркуляции в миокарде, печени, почках и др. органах, а не только в брыжейке и других прозрачных тканях организма. В патогенезе многих заболеваний важное значение имеют расстройства микроциркуляции. В нашей стране в разработку этого направления исследований большой вклад внёс академик А.М.Чернух со своими учениками, сотрудниками и последователями. Микроциркуляция - это процесс направленного движения различных жидкостей организма на уровне микросистем, ориентированных вокруг кровеносных и лимфатических сосудов. Можно выделить три звена в системе микроциркуляции (МКЦ): 1-е звено или микрогемоциркуляция включает артериолы (1-го, 2-го порядка), прекапилляры, прекапиллярные сфинктеры, капилляры, посткапилляры, венулы, то есть сосудистую сеть от артериол до венул. 2-е звено или микролимфоциркуляция включает капилляры лимфатической системы, осуществляющие дренаж лимфы. 3-е звено представлено внесосудистыми путями транспорта жидкости (периваскулярным, межклеточным пространством). Несмотря на то, что эти три звена структурно разобщены, вместе с тем они между собой тесно связаны функционально. Эти звенья МКЦ не только осуществляют доставку жидкости по сосудам микроциркуляторного русла, но также являются компонентами функционального элемента органа. В состав функционального элемента по А.М. Чернуху входят: 1) кровеносные капилляры (обменные сосуды); 2) лимфатические сосуды; 3)нервные волокна и окончания; 4) элементы, образующие биологически активные вещества; 5) специализированные (паренхиматозные) клетки; 6) элементы соединительной ткани (околососудистое пространство, фибробласты и другие клетки); 7) тучные клетки (выделяют гепарин, гистамин, серотонин и играют важную роль в регуляции кровотока в микрососудах). Функциональный элемент формируется вокруг сосуда и представляет собой такую элементарную структуру, в которой выявляется специфика строения, функции и регуляции органа. Регуляция микроциркуляции осуществляется на трех уровнях: системном, органном (местном) и ауторегуляторном. Система микроциркуляции является составной частью гемодинамики. Изменение сердечного выброса, артериального давления влияют в той или иной мере на микроциркуляцию. Однако при этом может не наблюдаться прямой зависимости изменения параметров микроциркуляции и системной гемодинамики. Архитектоника микроциркуляторного русла имеет органные особенности (мозг, сердце, печень, лёгкие, матка, почки и т.д.), а также имеются различия в их иннервации и содержании ФАВ. В ауторегуляции, осуществляющейся в пределах функционального элемента, большое значение имеют вазоактивные вещества, соотношение метаболитов, образующихся в процессе обмена веществ, особенно содержание недоокисленных продуктов обмена. Причем, важную роль играют метаболизм и состав соединительной ткани, её физико-химические свойства, которые также определяют состояние микроциркуляции. Основные функции микрогемоциркуляции: - транспортная (перенос субстратов, метаболитов и регуляторных гуморов по сосудам микроциркуляторного русла); - нутритивная (обеспечение транскапиллярного поступления питательных веществ в ткани); - защитная (обеспечение защиты клеточно-тканевых структур). Под патологией МКЦ следует понимать многообразные количественные и качественные изменения морфо-функциональной системы терминального кровеносного и лимфатического сосудистого русла (от терминальных артериол до венул. включая лимфатические капилляры). Расстройства микроциркуляции являются основой расстройств периферического кровообращения и механизмом различных повреждений тканей экзогенного и эндогенного происхождения. Принято выделять 4 типа нарушений микроциркуляции: - внутрисосудистые (гемодинамические), - сосудистые (первичные нарушения стенок сосудов), - внесосудистые (изменения соединительной ткани, тучных клеток и др.), - комбинированные (различные сочетания разных типов) 13.6.1. ВНУРИТИСОСУДИСТЫЕ (ИНТРАВАСКУЛЯРНЫЕ) ПЕРВИЧНЫЕ НАРУШЕНИЯ МИКРОЦИРКУЛЯЦИИ К типовым формам интраваскулярных расстройств МКЦ относятся : 1) замедление и прекращение тока крови и/или лимфы, 2) нарушение ламикарности тока крови и/или лимфы, 3) чрезмерное ускорение тока крови, 4) чрезмерное увеличение юкстакапиллярного тока крови. Интраваскулярные расстройства МКЦ подразделяются на две большие группы, обусловленные изменением: 1) тонуса микрососудов (артериол, метартериол, прекапилляров, венул). Они называются миогенными и могут возникать либо при повышении мышечного тонуса и сужении (констрикции) сосудов, либо при понижении тонуса мышечного слоя сосуда - расслаблении (дилатации или параличе) сосудистой стенки; 2) реологических свойств крови. I группа микроциркуляторных расстройств связана с изменением тонуса сосудов, что может привести либо ишемии (при спазме стенки сосудов), либо к гиперемии (при понижении тонуса или его отсутствии, например, при параличе гладких мышц сосудистой стенки). Возможно развитие локальных диффузных ангиоспазмов. Особенностью нервной регуляции сосудов является то, что синаптические терминалии заканчиваются преимущественно на уровне артериол. В обменных капиллярах нервных окончаний нет. Нервные влияния на сосуды могут быть прямыми (синаптическое влияние) и непрямыми (несинаптическое влияние), то есть имеются два механизма изменения тонуса сосудов: 1) диффузия нейромедиаторов к сосуду, 2) распространение мышечного возбуждения. Эти воздействия могут привести к ангиоспазму. Базальный тонус сосудов обусловлен в том числе и адренергической иннервацией. Изменение сосудистого тонуса проявляется в виде локального спазма (венечные артерии сердца) или диффузного ангиоспазма (после кровотечения, при шоке, артериальной гипертензии). Ангиоспазм приводит к ряду нарушений, возникающих в микроциркуляторном русле (схема 13-3). Кроме констрикторных, возможны миогенные паралитические расстройства микроциркуляции. Сосуды микроциркуляторного русла чувствительны к вазоконстрикторам и вазодилататорам. Особенно чувствительна к вазодилататорам неиннервируемая часть. Избыток вазодилататоров приводит к резкому расширению прекапилляров и к замедлению кровотока вплоть до стаза. В этом случае приток крови постоянный, но число функционирующих капилляров резко возрастает. Такого характера нарушения микроциркуляции наблюдаются в случаях применения гипотензивных препаратов (при их действии на неиннервируемую часть сосудов). II группа микроциркуляторных расстройств связана с изменением реологических свойств крови - многокомпонентной системы, которая представляет собой суспензию преимущественно эритроцитов, взвешенных в 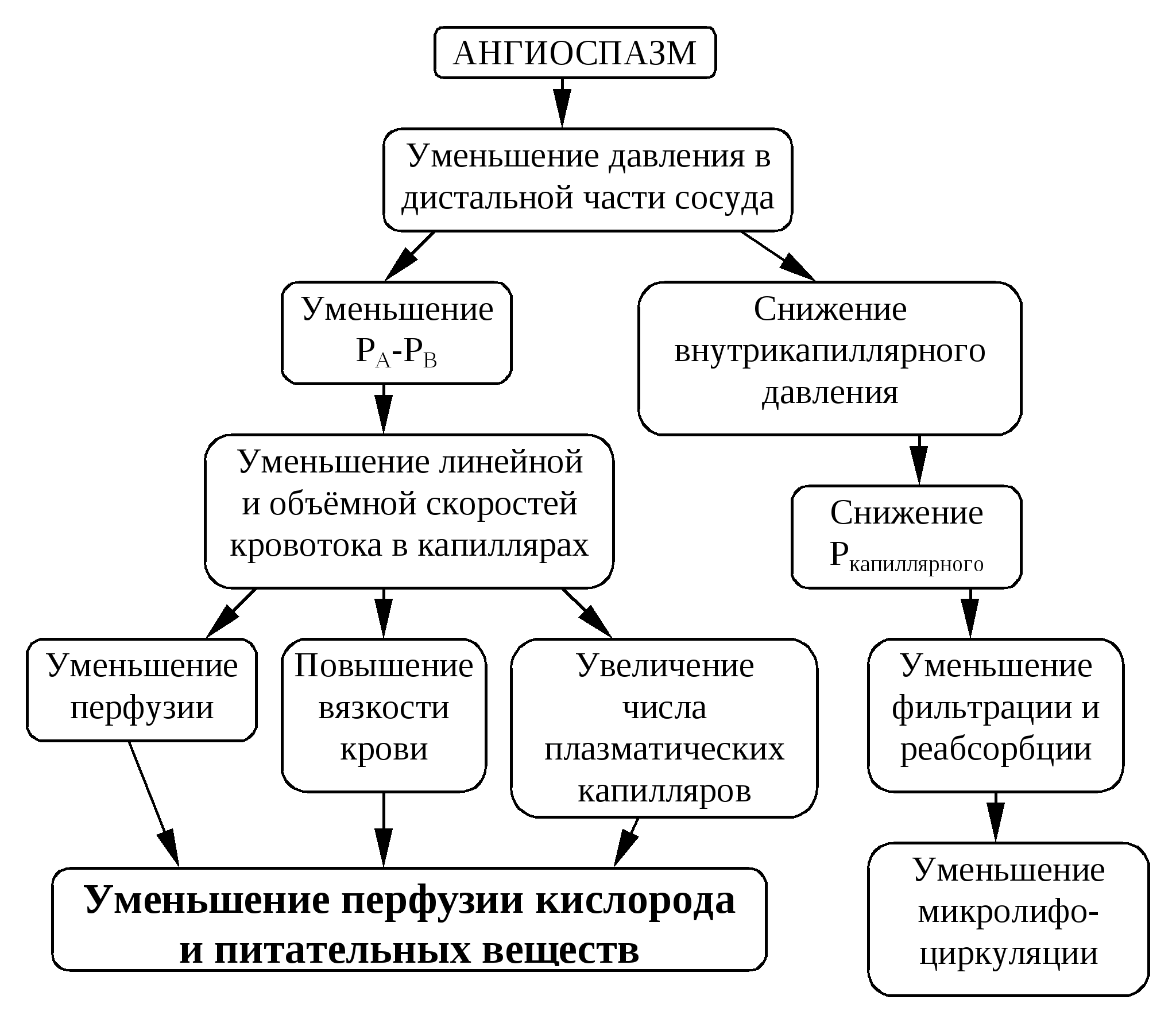 Схема 13-3. Нарушения микроциркуляции при ангиоспазме коллоидной системе белков и липидов и ориентированных параллельно оси движения. Кровь является неньютоновской жидкостью и при её движении в трубке скорость отдельных её слоёв неодинакова. Нарушение реологических свойств крови проявляется в изменении вязкости и суспензионной стабильности и может быть локальным (воспаление, венозная гиперемия) и системным (шок, сердечная недостаточность). Реологические свойства крови зависят от соотношения плазмы и форменных элементов, соотношения плазменных белков, формы эритроцитов, скорости кровотока, температуры крови и ряда других факторов. От реологических свойств крови (влияющих на текучесть плазмы и форменных элементов) зависит доставка О2, питательных и регуляторных веществ по микрососудам к клеткам. В сосудах с высокой скоростью кровотока кажущаяся вязкость крови значительно меньше, чем в области микроциркуляции. Изменение вязкости крови - одна из частых причин нарушения микроциркуляции - может возникать при замедлении кровотока и сопровождаться изменением осевого потока. Эритроциты располагаются в разных плоскостях, повышается вязкость и снижается текучесть крови. При любых явлениях сосудистой недостаточности отмечается повышение вязкости крови, которая приводит к повышению периферического сопротивления и возрастанию нагрузки на сердце. При травматическом шоке возникает более высокое сопротивление в венулах и посткапиллярных отделах, чем в прекапиллярных, повышается внутрикапиллярное давление, увеличивается концентрация эритроцитов и других форменных элементов. Увеличение вязкости крови сопровождается изменением соотношения плазмы и эритроцитов. В норме гематокритное число равно в среднем 0,45. При возрастании гематокритного числа увеличивается вязкость крови. Общее увеличение гематокритного числа наблюдается при сгущении крови, например, при обезвоживании (холера, поносы), при эритроцитозе, полицитемии, когда отмечается увеличение гематокрита до 70% (0,7) и эритроцитов - до 81012 в 1 л крови и более. Вязкость плазмы крови повышается при ревматоидном артрите, миеломной болезни, болезни иммунных комплексов, парапротеинемиях, макроглобулинемии (болезниь Вальденстрема). Локальная гемоконцентрация при воспалении, гемоконцентрационном стазе сопровождается увеличением гематокритного числа в микроциркуляторном русле данного региона. Повышение вязкости крови отмечается при уменьшении температуры тела, в т.ч. при локальном охлаждении конечностей, носа, ушей. (схема 13- 4). Так, в сосудах пальцев возможно увеличение вязкости крови в 4-5 раз вплоть до остановки кровотока. Вязкость крови увеличивается также при повышении концентрации высокомолекулярных белков (фибриногена и других глобулинов). Нарушение суспензионной стабильности крови приводит к внутрисосудистой агрегации форменных элементов крови. Кратковременная агрегация форменных элементов может возникать в норме. Однако при патологии агрегация, как правило, носит стойкий характер. 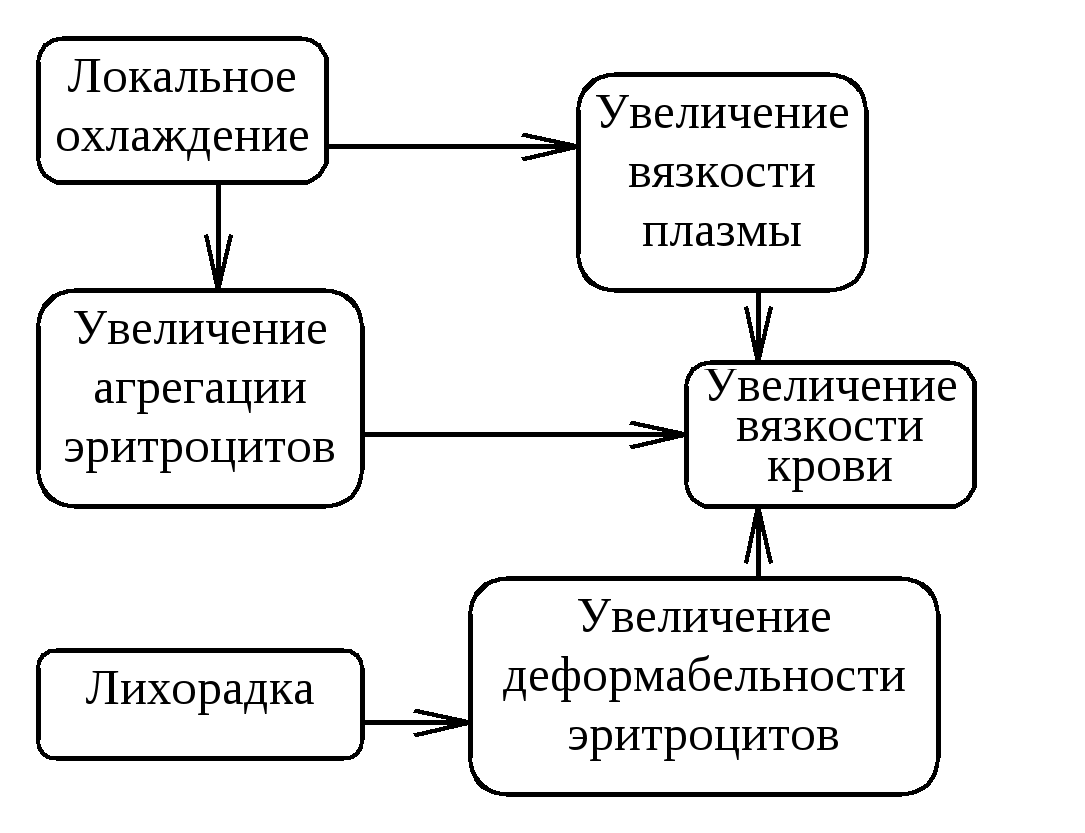 Схема 13-4. Нарушение реологических свойств крови при изменении температуры крови Причиной повышения агрегации может быть замедление тока крови. При стазе эритроциты двигаются беспорядочно, увеличивается их контакт и агрегация друг с другом, образуются монетные столбики. Эти нарушения наблюдаются при шоке и другой сердечно-сосудистой патологии. Внутрисосудистая агрегация возникает при увеличении концентрации высокомолекулярных белков, повышении уровня фибриногена, парапротеинов, глобулинов (миеломная болезнь, ретикулёзы), при этом уменьшается поверхностный заряд эритроцитов, увеличивается их взаимодействие и усиливается агрегация. Воспаление сопровождается возникновением локальной агрегациии: выходят из капилляров альбумины, увеличивается концентрация глобулинов. Трансфузия декстранов может вызвать изменение формы эритроцитов и их агрегацию. Изменение формы и деформабельности (деформируемости) эритроцитов. В норме эритроцит представляет собой дискоцит. С помощью сканирующей электронной микроскопии установлено, что форма эритроцита может меняться. Эритроцит эластичен, способен деформироваться и проходить через капилляры в 3-4 микрона. Форма эритроцита изменяется под действием простагландинов. Простагландин Е1 увеличивает пластичность эритроцита, а простагландин Е2 её уменьшает и увеличивает регидность. Под влиянием простагландина Е1 в эритроцитах увеличивается синтез цАМФ, это ведёт к повышению деформабельности эритроцитов. Следовательно, деформабельность эритроцитов регулируется и это свойство эритроцитов является важнейшим фактором определяющим текучесть крови. Деформабельность эритроцитов меняется при патологии. Анемии, возникающие вследствие энзимо- и гемоглобинопатий, сопровождаются изменением агрегационных свойства эритроцитов. Повышение агрегации эритроцитов отмечается при сфероцитарной и серповидноклеточной анемиях. Изменение свойств и формы эритроцитов наблюдается при шоке, терминальных состояниях, зависит от характера кровотока (при ламинарном токе крови эритроциты овальные). Стоматоциты, эхиноциты, шизоциты могут образовывать внутрисосудистые агрегаты. Чем региднее эритроцит, тем он быстрее и легче застревает в капиллярах. Сладж (sludgе - ил, тина, густая грязь - англ.) - феномен, характеризующийся сепарацией крови на конгломераты (состоящие, главным образом, из эритроцитов, а также лейкоцитов и тромбоцитов) и плазму в результате адгезии, агрегации и агглютанации форменных элементов. Сладж приводит к возникновению серьёзных расстройств микроциркуляции. Во взаимодействии эритроцитов и в образовании агрегатов большое значение имеют интегрины - семейство поверхностных молекул клеток, которые обеспечивают адгезию клетка-клетка и клетка-матрикс. В настоящее время описано более 20 представителей интегринов. Интегрины являются гетеродимерами гликопротеинов, состоящими из различных комбинаций - и -цепей. Важную роль в агрегации эритроцитов могут играть адгезины. Экспрессия адгезивной молекулы Е-селектина на поверхности мембраны происходит под действием тромбина, гистамина или активированной системой комплемента. Роль стимулятора выполняют различные оксиданты. Адгезины могут существовать в виде растворимых молекул. Е- и Р-селектины после слущивания с поверхности клеток циркулируют в крови. Растворимые адгезионные молекулы при взаимодействии связываются со своими рецепторами на поверхности форменных элементов крови и участвуют в образовании сладжей. При затруднении продвижения крови (ее текучести) по капиллярам раскрываются артериоло-венульные анастомозы, кровь сбрасывается из артериол в венулы, что уменьшает снабжение тканей кислородом, питательными и регуляторными веществами. Увеличивается количество плазматических капилляров, происходит сепарация крови (рис. 13-1) уменьшается суммарная поверхность эритроцитов, развивается микроэмболизация сосудов. Причинами сладжа являются: 1) нарушения центральной и периферической гемодинамики (сердечная недостаточность, венозный застой, ишемия и др.), 2) повышение вязкости и снижение текучести крови (гемоконцептрация, полицитемия, гипериротеикемия), 3) повреждение стенок микрососудов (воспаление, аллергические реакции, опухоли и др.).  Рис. 13-1. Сепарация крови и её последствия Механизмами развития адгезии, агрегации и агглютанации форменных элементов крови с высвобождением из них ФАВ, обладающих сильным проагрегантным действием (АДФ, тромбоксан А2, кинины, гистамин и др.); 2) «Снятие» характерного для нормы отрицательного поверхностного заряда клеток крови и/или «перезарядка» его на положительный заряд избытком катионов, выходящих из поврежденных клеток (К+, Са+2, Мg+2, Na+ и др.); 3) уменьшение величины поверхностного заряда клеточных элементов крови при контакте с ними положительно заряженных аминогрупп макромолекул), особенно при гиперпротеинемии; 4) адсорбирование на поверхности клеток крови мицелл белка, способствующие их гравитационному оседанию и последующей их адгезии, агрегации и агглютинации. Последствия сладжа могут быть самыми разными, в частности, следующими: 1) нарушение скорости и характера тока крови внутри сосуда (замедление, вплоть до стаза; турбулентный ток крови; «включение» артериоло-венулярных шунтов) в результате образования большого числа агре гатов клеток крови, упакованных в конгломераты; 2) расстройства транспорта жидкости, газов, субстратов,ФАВ, форменных элементов крови через стенку микрососудов, 3) развитие гипоксии и ацидоза, дистрофий, расстройств пластических процессов и функций тканей и органов в результате нарушений в 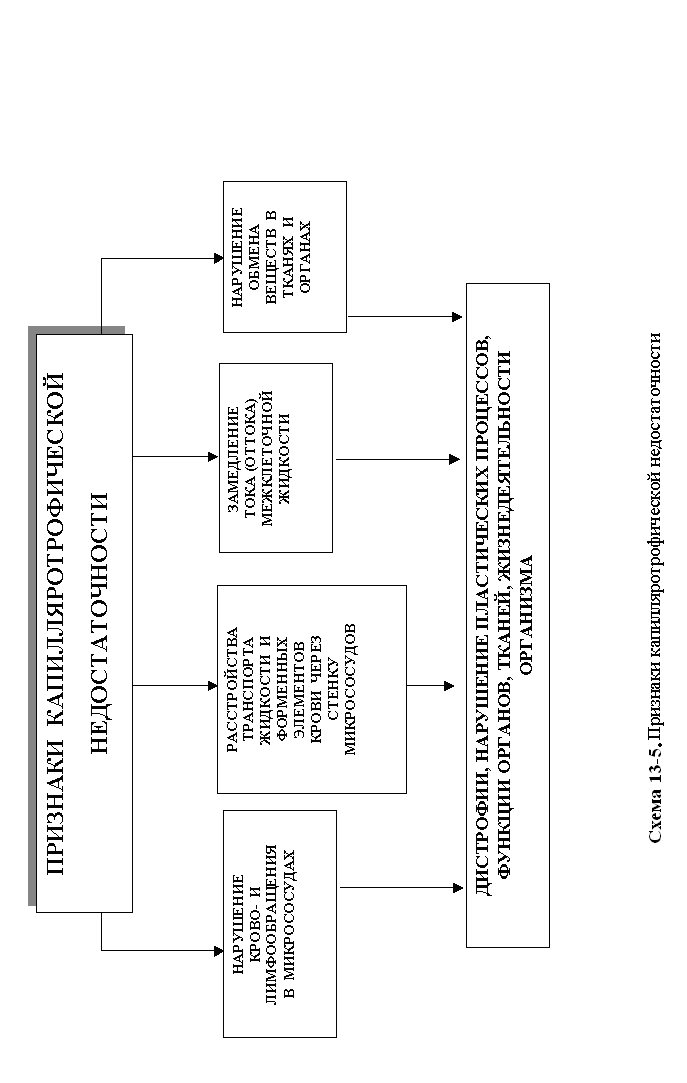 них обмена О2, СО2, субстратов, ФАВ, а также развития васкулопатий из-за растройств ангиотрофической функции клеток крови, особенно, тромбоцитов. Сладж, с одной стороны, является причиной различных расстройств МКЦ (если он развивается первично), с другой , - следствием внутрисосудистых нарушений МКЦ (при их первичном развитии). Основу разнообразных нарушений МКЦ составляет развитие и прогрессирование капилляротрофической недостаточности, признаки которой представлены на схеме 13-5. Имеются определённые предпосылки для патофизиологического обоснования лечения внутрисосудистых изменений МКЦ. Введение полиглюкина и реополиглюкина (мол. вес 45000) стимулируют дезагрегацию эритроцитов. Другие препараты (например, трентал, повышающий содержание цАМФ) уменьшают агрегабельность эритроцитов. Показано, что текучесть и вязкость крови зависит также от содержания линейных и синтетических полимеров. 13.6.2. СОСУДИСТЫЕ (ЧРЕЗСТЕНОЧНЫЕ, ТРАНСМУРАЛЬНЫЕ) ПЕРВИЧНЫЕ РАССТРОЙСТВА МИКРОЦИРКУЛЯЦИИ Расстройства микроциркуляции, связанные с повреждением стенки сосуда, приводят к нарушению траскапиллярного обмена, усилению адгезии клеток к эндотелию, развитию тромбоза, тромбоэмболий, возникновению кровоизлияний. Любое повреждение стенки сосуда сопровождается активацией механизмов не только сосудисто-тромбоцитарного, но и коагуляционного гемостаза, главным образом, за счет повышения свертывания крови. Сначала образуются рыхлые тромбы, которые отрываются током крови, в результате чего образуются эмболы, обтурирующие различные микрососуды. Если на фоне активизации свертывающей системы крови отмечается снижение противосвертывающей и фибринолитической систем крови, то это способствует скорейшему образованию коагуляционного тромба. Последний плотно закрывает повреждение в стенке сосуда, т.е. является локальным защитным механизмом, предупреждающим кровопотерю. Генерализация же тромбоза и тромбоэмболии явление патологическое, приводящее к множественным расстройствам МКЦ, а затем – метаболизма, структуры и функций, органов. Это еще больше усиливает реологические расстройства, не только из-за развития сладжей, осаждения эритроцитарных, лейкоцитарных и тромбоцитарных агрегатов, но и активации коагулянтной системы крови с развитием тромбозов и тромбоэмболий. Все это ведет к сгущению крови, повышению ее вязкости и замедлению кровотока, а значит к усилению расстройств микроциркуляции. Нарушения проницаемости сосудов (транскапиллярного обмена) определяются расстройствами самой сосудистой стенки (главным образом, эндотемия и базальной мембраны капиляров и венул) пропускать воду и содержащиеся в ней вещества благодоря процессам ультрафильтрации, диффузии, пиноцитоза, активности внутриклеточных переносчиков как без затраты энергии, так и с затратой энергии. В патологических условиях нарушение сосудистой проницаемости чаще характеризуется её увеличением. Усиление транспортного обмена может быть связано как со структурными изменениями стенки сосудов микроциркуляторного русла, так и нарушениями динамики кровообращения. Причинами повышения проницаемости микрососудов (транскаппллярного обмена) чаще всего являются воспалительные процессы в тканях, аллергические реакции, шок, гипоксия тканей, ожоги, сердечная недостаточность, тромбоз и сдавление вен, гипопротеинемия, трансфузия белковых и солевых растворов. Факторами, приводящими к повреждению стенки сосуда в тканях в очаге воспаления, являются токсины, кинины, гистамин. Последние деформируют эндотелий, базальную мембрану, увеличивают межэндотелиальное пространство. Аллергические реакции, гипоксия также сопровождаются ультраструктурными изменениями эндотелия. Поврежденные эндотелиальные клетки изменяют свою форму, размеры и локализацию. В результате микротравм стенок сосудов происходит развитие ацидоза и активация гидролаз (приводящие соответственно к неферментному и ферментному гидролизу основного вещества базальной мембраны сосудов) и округление набухание (отечность) эндотелиальных клеток, появление и увеличение шероховатости (бахромчатости) их оболочек, (приводящие к расширению межэндотелиальных щелей, отделению эндотелиоцитов друг от друга и выпячивание их в просвет сосуда), перерастяжение стенок микрососудов (приводящие к растяжению фенестр и образованию микроразрывов в стенках микрососудов). Кроме того, может развиться межклеточный отек (особую роль в котором играет избыточно образовующийся гистамин). Повреждение сосудистой стенки приводит к нарушению, как правило, увеличению, транскапиллярного обмена за счет возрастания либо: - пассивного транспорта веществ через поры (каналы) эндотелиальных клеток и через межэндотелиальные щели посредством возрастания простой, облегченной и ионообменной диффузиии и фильтрации (в силу увеличения концентрационного, электрохимического и гидродинамического градиентов); - активного транспорта веществ через эндотелиальную клетку (против электрохимического и концентрационного градиента), которая осуществляется за счет энергии метаболических процессов (т.е. с затратой энергии макроэргов.). Активный транспорт веществ может осуществляться при помощи внутриклеточных переносчиков, пиноцитоза, фагоцитоза а также комбинированным путем в результате образования различных ФАВ. Фильтрация значительно увеличивается не столько от повышенного гидростатического давления крови, сколько от степени повреждения стенки сосуда и межклеточных структур (истончения эндотелиальных клеток, повышения шероховатости их внутрисосудистой поверхности, размеров пор и межэндотелиальных щелей). Так, в эксперименте на брыжейке лягушки Lendis (1927), используя в качестве повреждающего фактора 10% алкоголь, наблюдал повышение коэффициента фильтрации в 7 раз. Известно, что возрастание проницаемости капиллярной стенки зависит от снижения в ней рО2, рН и увеличения рСО2 (сопровождающихся развитием и прогрессированием ацидоза, накоплением недоокисленных продуктов обмена, в частности молочной кислоты, кетоновых тел и других ФАВ.) При увеличении фильтрации (вследствие резко повышенной проницаемости стенок артериальной части капилляров) и ослабления реабсорбции (в результате возрастания как гидростатического давления в венулярной части капилляра, так и коллоидно-осмотического давления межклеточных пространств) и затруднений лимфооттока, наблюдается максимальный отек межклеточных структур, сдавливающий стенки капилляров, сужающий их просвет и резко затрудняющий в них кровоток, вплоть до развития стаза. Нарушения транскапиллярного обмена могут быть как с развитием отёка, так и без отёка (безотёчная форма). Развитие отёка наблюдается при: - увеличении в сосудах гидростатического давления, которое приводит к усилению фильтрации; - уменьшении коллоидно-осмотического давления в сосудах; -увеличении проницаемости стенки сосуда в результате увеличения межэндотелиального пространства, увеличения числа микропор (отмечается при увеличении выброса серотонина, кининов, гистамина и других ФАВ). Безотёчные формы нарушения транскапиллярного обмена встречаются реже, менее изучены, возникают при хронических нейродистрофических процессах. При этом наблюдается увеличение проницаемости капилляров для белков и других частиц, но не происходит развития отёка, что связано с изменением при нарушении транскапиллярного обмена состояния свободной воды в межклеточном пространстве, структур соединительной ткани, их гидрофильности (превращение из геля в золь). Прилипание (адгезия) форменных элементов крови и инородных частиц к эндотелию. Этот эффект наблюдается в первые 5-15 минут после механического или химического повреждения эндотелия микрососудов. Увеличение адгезивных свойств эндотелия обычно отмечается при гипоксии и воспалении. Чаще происходит адгезия лейкоцитов и тромбоцитов. Лейкоциты регидны и с трудом деформируются, при воспалении происходит нарушение микроциркуляции. Адгезивность клеток повышается и в опухоли. С процессами адгезии связано и тромбообразование. Эмиграция лейкоцитов и тромбоцитов является важным патогенетическим звеном сосудистых нарушений микроциркуляции. Миграция гранулоцитов и моноцитов происходит через межэндотелиальные щели путем образования этими лейкоцитами псевдоподобий и усиления их активности, что особенно наблюдается при ацидозе. Позже мигрируют лимфоциты, но не через межклеточные щели, а трансцеллюлярно посредством больших везикул. Это происходит и при ацидозе (больше) и при алкалозе (меньше). Далее в результате резко увеличенной проницаемости стенок капилляров через межэндотелиальные щели начинают проходить и эритроциты. Микрокровоизлияния возникают при сильном повреждении стенок сосудов. Они могут быть в виде разрыва капилляров и диапедеза большого количества эритроцитов. Разрыв капилляров происходит при увеличении гидростатического давления в сосудах, воспалении, гиперемии, особенно в результате активизации протеаз лейкоцитов и клеток эндотелия, а также действия ФАВ, избыточно образующихся при повреждении клеточных структур. Диапедез эритроцитов возникает в случаях уменьшения резистентности стенки капилляров. Уменьшение прочности капилляров может быть связано с действием токсинов, при эндогенной интоксикации (механическая желтуха), тромбоцитопения сопровождается снижением резистентности капилляров. Незначительное изменение давления может привести либо к микроскопическому разрыву стенки сосуда, либо к выходу эритроцитов через стенку сосудов (диапедезу эритроцитов). 13.6.3. Внесосудистые (экстраваскулярные) первичные расстройства микроциркуляции Они также как и предыдущие нарушения могут быть нескольких видов. Альтеративные, дисметаболические и экссудативные изменения окружающих микрососуды тканей формируются в результате развития в них, главным образом, воспаления. В возникновении посттравматических нарушений циркуляции как в кровеносных, так и в лимфатических сосудах, особое значение имеют активация гидролитических ферментных систем, а также протеаз системы комплемента, повышенного образования кининов, гистамина, серотонина и других ФАВ. Расстройства метаболизма соединительной ткани (коллагеназы и т.д.) также сопровождаются нарушениями микроциркуляции. К избыточному образованию ФАВ (серотонина, гистамина, простагландинов) и возникновению расстройств микроциркуляции приводят воспаление, аллергические реакции, гипоксия, а также изменения тонуса нервной системы, нервные терминали которой примыкают к тучным клеткам. Реакция тучных клеток. Возникает при действии на них этиологических и патогенетических факторов и проявляется в виде их дегрануляции. Этот феномен был открыт Эрлихом (1877). При различных повреждающих воздействиях, как правило, отмечается дегрануляция тучных клеток с выходом значительного количества гистамина (10 мкг в1 мм3 клеток) и серотонина (до 700 мкг в 1 мм3 клеток), существенно повышающих проницаемость микрососудов, что является важным патогенетическим звеном воспаления, а также гепарина (до 1-2 мг в 1 мл плазмы), повышающего активность противосвёртывающей системы крови, улучшающего микроциркуляцию и способствующего ускорению восстановления поврежденного эндотелия. Нарушения лимфоообразования и лимфоотока. В условиях повреждения тканей и развития воспаления сначала наблюдается расширение лимфатических капилляров, элиминация ими микробов, инородных тел, белков, продуктов распада тканей. Позже, по мере нарастания межтканевого отека, а также нарушения системных и местных механизмов регуляции дренажной функции лимфангионов лимфатических сосудов отмечается затруднение лимфообразования и лимфоотока. Это еще больше усиливает расстройства МКЦ. Развитие и активизация дистрофического (в том числе нейродистрофического) процесса в очаге повреждения и вокруг него усиливают расстройства МКЦ и нарушения нервнорефлекторных и гуморальных механизмов регуляции метаболических, морфологических и физиологических процессов. Комбинированные расстройства микроциркуляции. Представляют собой сочетания нескольких видов нарушений микроциркуляции. 13.6.4. Принципы коррекции расстройств мИКРОЦИРКУЛЯЦИИВ целях нормализации нарушенных как регионарного крово-и лимфотока, так и микроциркуляции используются этиотропный, патогенетический, саногенетический и симптоматический принципы лечения. Этиотропный имеет целью устранение или уменьшение степени патогенного действия причинных факторов и неблагоприятных условий, вызывающих расстройства центрального, регионарного и микроциркуляторного крово-и лимфообращения Патогенетический направлен на разрыв основных звеньев патогенеза, устранение или ослабление ведущих и второстепенных звеньев патогенеза. Саногенетический направлен на усиление и ускорение защитно-компенсаторно-приспособительных и восстановительных реакций и механизмов. Симптоматический имеет целью устранение или ослабление тягостных субъективных ощущений. Для этого используются пути, методы и средства, которые:
13.7. КРАТКАЯ ХАРАКТЕРИСТИКА ТРОМБОЗОВ И ЭМБОЛИЙ Наиболее частыми причинами развития венозной гиперемии, ишемии, стаза и нарушений микроциркуляции являются тромбозы и эмболии. 13.7.1. тромбоз Тромбоз - это процесс прижизненного образования на внутренней поверхности стенки сосудов или в их просвете сгустков, состоящих из элементов крови и препятствующих движению крови по сосудам. 13.7.1.1. Виды тромбов. Их характеристика Различают пристеночные (частично уменьшающие просвет сосудов) и закупоривающие тромбы. В зависимости от преобладания в структуре сгустков тех или иных элементов различают разные их видыю. Белый (агглютинационный) тромб. В его образовании ведущее значение имеет активизация процессов адгезии, агрегации и агглютинации форменных элементов (преимущественно тромбоцитов и лейкоцитов). Красный (коагуляционный) тромб. В основе его образования главную роль отводят активации процессов свертывания (коагуляции) крови, элементы которой (тромбоциты, лейкоциты и, главным образом эритроциты, так как их больше всего в крови) запутываются в нитях фибрина. Следует отметить, что красный тромб образуется быстрее белого, обычно после значительного повреждения стенки сосуда. Смешанный тромб. Он встречается наиболее часто. В его образовании важною роль играет активация процессов как свертывания, так адгезии, агрегации и склеивания форменных элементов крови (чередование белых и красных тромбов). Причиной образования тромбов является нарушение (повреждение) целостности стенки сосудов, вызванное различными патогенными факторами внешней среды (физическими, химическими, биологическими), в том числе теми, которые вызывают воспаление (флогогенами), аллергию (аллергенами) или которые приводят к развитию различных заболеваний (атеросклероза, ишемическая и гипертоническая болезни и др.). В механизмах развития тромбов принимают участие следующие патогенетические факторы (триада Вирхова): Повреждение сосудистой стенки (нарушения ее физико-химических свойств, питания, метаболизма, приводящие к дистрофии и расстройствам структуры). В частности, поврежденная сосудистая стенка становится смачиваемой, теряет электрический заряд и выделяет в кровь активный тромбопластин. В результате этого элементы крови прилипают к ней. Повышение активности свертывающей и/или снижение активности противосвертывающей и фибринолитической систем крови (увеличение образования тромбопластина, протромбина, тромбина, фибриногена, фибрина, уменьшение образования гепарина); Замедление тока крови и его нарушения в виде завихрений (в области тромба, агрегатов эритроцитов, атероматозных бляшек, аневризмы сосуда и др.). В процессе гемостаза выделяют две фазы: 1 фаза – сосудисто-тромбоцитарная (клеточная), 2 фаза – коагуляционная (плазменная). Эти фазы охарактеризованы в главе «Патология гемостаза». Исходы (последствия) тромбоза могут быть следующими:
13.7.2. ЭмболияЭмболия (от греч. emballein – бросить внутрь) – это процесс перенесения током крови или лимфы тел (эмболов), которые в норме в сосудистом русле не встречаются и закупорка ими кровеносных или лимфатических сосудов. 13.7.2.1. Виды эмболий. Их характеристика Эмболии классифицируют по характеру эмбола и по его локализации в сосудистом русле. В зависимости от характера эмболов различают экзогенную и эндогенную эмболии. При экзогенной эмболии эмбол попадает в сосудистое русло извне. К ней относятся следующие эмболии: газовая, воздушная, паразитарная, плотными инородными телами. Газовая эмболия может возникать при декомпрессионной (кессонной) болезни у водолазов, рабочих кессонов. В случае быстрого подъема с больших глубин, где имеет место повышенное атмосферное давление (а значит повышенная растворимость газов, в частности, азота в жидкостях организма), на меньшие глубины, где отмечается более низкое атмосферное давление (а значит более низкая растворимость газов, в том числе и азота в крови). В этой связи в крови появляется большое количество пузырьков кислорода, углекислого газа и, особенно газообразного азота (кровь как бы «закипает»). Образовавшиеся газовые пузырьки - эмболы переносятся кровью по кровеносным сосудамтех или иных органов большого и малого кругов кровообращения. Для предупреждения возможности развития "кессонной болезни" подъем с глубин необходимо осуществлять медленно с остановками, чтобы высвобождающиеся из крови газы медленнее образовывались и успевали выводится из организма с выдыхаемым воздухом. Газовая эмболия возможна и при развитии анаэробной (газовой) гангрены. Воздушная эмболия развивается при попадании воздуха в просвет сосудов. Она может возникать при нарушении правил внутрисосудистых инъекций или катетеризаций (когда с раствором в сосудистое русло попадают пузырьки воздуха), при повреждениях крупных не спадающихся вен шеи и грудной полости, при разрыве стенки грудной клетки и альвеол легких осколками снарядов и взрывной ударной волной или при быстром подъеме человека на высоту на летательных аппаратах и в результатеих разгерметизации. Попавшие в просвет сосудов воздушные пузырьки различных размеров закупоривают соответствующие по размерам сосуды и вызывают избыточную афферентацию с обширного сосудистого рецепторного поля, приводя к выраженным расстройствам местного кровообращения в различных органах малого и большого кругов кровообращения. Чувствительность и устойчивость различных видов организмов к воздушной эмболии неодинаковая. Например, у кроликов смерть вызывает воздушная эмболия уже в объеме 2-3 см3 на 1 кг массы тела, у собак - только 50 см3 на 1 кг массы тела, у человека значительно большими, чем у кроликов, но существенно меньшими, чем у собак, объемами. Микробная эмболия может возникать при попадании в сосудистое русло больших количеств микроорганизмов. Последние приводят к разнообразным расстройствам местного кровообращения и микроциркуляции в тех или иных органах, а также к развитию в них очагов инфекции. Паразитарная эмболия часто встречается в условиях жаркого влажного климата при попадании различных гельминтов через кожу в сосудистое русло, особенно - лимфатическое. Последнее затрудняет лимфоотток, нарушает процессы микроциркуляции и нередко приводит к развитию «слоновой болезни». Эмболия плотными инородными телами встречается наиболее редко, в частности, при попадании мелких осколков снарядов, камней, а также пуль, иголок и др. предметов через поврежденные ткани в сосудистое русло. Последнее приводит к разнообразным расстройствам регионарного кровообращения и микроциркуляции. При эндогенной эмболииэмболы в виде оторвавшихся клеточно-тканевых структур организма (тромбов, кусочков тканей, групп клеток или околоплодной жидкости) по тем или иным причинам попадают в кровь или лимфоток и вызывают соответствующие многообразные как неспецифические, так и специфические расстройства. Тромбоэмболия - это эмболия всем оторвавшимся тромбом или его частью. Встречается данный вид эмболии наиболее часто. Причиной отрыва тромба является его неполноценность, возникающая вследствие нарушения фазы ретракции сгустка, асептического или гнойного расплавления тромба. Тканевая эмболия - это эмболия клеточно-тканевыми структурами, возникающими при массивной травме тканей, особенно жировой, а также клетками злокачественных опухолей. Жировая эмболия развивается при попадании капелек жира преимущественно в венозные сосуды большого круга кровообращения, в результате повреждения либо костного мозга, либо подкожной жировой клетчатки. Эмболия может развиваться в сосудах малого круга кровообращения, хотя отсюда эмболы могут вновь попасть в большой круг (вследствие хорошо развитых артерио-венозных анастамозов малого круга кровообращения и обилия широких, хорошо растягивающихся капилляров). В зависимости от вида млекопитающих смерть может наступить при количестве жировых эмболов от 0,9 до 3 см3 на I кг массы тела. Клеточная эмболия вызывается преимущественно оторвавшимися клетками злокачественных опухолей и попавшими в крово- и лимфоток. Эмболия околоплодными водами возникает в результате попадания околоплодных вод в поврежденные сосуды матки на участке отделившейся плаценты. Обычно эмболия развивается в сосудах малого круга кровообращения. Для нее характерна выраженная активация фибринолитической системы крови, приводящая нередко к массивным кровотечениям. В зависимости от локализации эмбола различают эмболию лимфатической системы и эмболию кровеносной системы. Последняя подразделяется на три основные вида: 1) большого круга кровообращения, 2) малого круга кровообращения, 3) системы воротной вены. Эмболия лимфатической системы возникает наиболее часто при метастазировании злокачественных опухолей, при попадании и размножении паразитарных червей филярий, приводящих к развитию слоновой болезни. Эмболия большого круга кровообращения возникает при патологических процессах в легочных венах (при флебитах, тромбоэмболиях) и образовании эмболов в камерах левой половины сердца (при образовании тромбов на клапанах и эндокарде), аорте и артериях большого круга кровообращения (при изъявлениях артеросклеротических бляшек, дистрофических процессах). С током крови эмболы попадают и застревают в меньших по диаметру сосудах (коронарных, мозговых, почечных и др.), Эмболия малого круга кровообращения возникает в результате развития патологических процессов и образования эмболов в камерах правой половины сердца, в артериях малого круга и в венах большого круга кровообращения, либо вследствие эмболии легочных сосудов личинками аскарид (проходящих аэробный цикл своего развития в легких). Для возникновения гемодинамических расстройств необходимо, во-первых, чтобы мелкие эмболы закупорили не менее 3/4 легочных сосудов, во-вторых, чтобы крупные эмболы попали в область бифуркации легочной артерии и вызвали плевропульмональный рефлекс (который может привести к спазму коронарных артерий, ишемии и даже остановке сердца). Эмболия системы воротной вены возникает в результате патологических процессов, развивающихся в бассейне воротной вены. Чаще всего она образуется вследствие тромбоэмболии при воспалительных процессах стенок как вен, так и кишок, особенно при кишечной непроходимости. В итоге развиваются венозная гиперемия, стаз, дистрофические изменения, паранекроз, некробиоз и некроз различных отделов кишечника, Кроме названных видов выделяют также ретроградную и парадоксальную эмболии. При ретроградной эмболии крупные тромбоэмболы движутся в больших венах нижней половины тела, особенно нижних конечностей, не в соответствии с законами гемодинамики, а в силу тяжести эмболов и земного притяжения. Последнее обнаруживается чаще при замедлении тока венозной крови и ослаблении присасывающего действия грудной клетки. При парадоксальной эмболии эмболы из левой половины сердца могут попадать в правую и очень редко наоборот. Это происходит при незаращении межпредсердной или межжелудочковой перегородок, а также боталлова протока сердца. Проявления и исходы эмболии, также как и тромбозов, могут быть самыми различными. Ониопределяются: - локализацией, видом, объемом, количеством эмболов и тромбов; - размерами, строением и функциональной значимостью закупоривающихся сосудов; - состоянием коллатерального кровообращения; - соотношением активности свертывающей, антисвертывающей и фибринолитической систем крови; - скоростью и интенсивностью нарушения регионарного кровотока; - реактивностью и резистентностью вовлекшихся в патологический процесс тканей, органов, систем и организма в целом. ГЛАВА 14. ВОСПАЛЕНИЕ 14.1. Введение Термин воспаление происходит от латинского слова inflammatio и греческого слова phlogosis, что условно означает воспламенение, жар. Известный русский патофизиолог В.В. Воронин, глубоко и всесторонне изучавший воспаление, писал: «Изучать литературу о воспалении – значило бы писать историю всей медицины». Воспаление – одна из наиболее часто встречающихся типовых форм реакций организма на действие разнообразных патогенных факторов. Аналоги воспаления встречаются на различных ступенях развития животного мира, но особой сложности и совершенства воспаление достигло у высших животных и человека. Воспаление представляет основное проявление многих заболеваний, а локализация и характер воспалительного процесса в том или ином органе нередко определяет нозологическую форму и специфику болезни. Для обозначения воспаления ткани или органа принято добавлять окончание «ит» (itis) к греко-латинскому названию данной ткани или конкретного органа (например, гепатит, миокардит, нефрит, колит, энцефалит, менингит, ринит, конъюнктивит, дерматит и т.д.). Реже воспалению дают специальное название (например, пневмония, абсцесс, флегмона и т.д.). Важно отметить, что при воспалении организм жертвует местным (частью своих поврежденных клеточно-тканевых структур в очаге воспаления ради сохранения целого (всего организма). |
