Типовые патологические процессы
 Скачать 7.53 Mb. Скачать 7.53 Mb.
|
|
Основные патогенетические факторы экссудации В образовании воспалительной жидкости (экссудата) участвуют следующие основные патогенетические факторы: Тканевой фактор – повышение коллоидно-осмотического давления тканей (то есть увеличение онкотического и осмотического давления тканей, возникающего в результате распада крупных молекул белков на мелкие, диссоциации органических кислот и слабых оснований, увеличения дисперсности ткани, ацидоза, увеличения количества и активности протеаз и других гидролитических ферментов). Мембранный (сосудистый) фактор – повышение проницаемости мембран микрососудов (обусловленного истончением и повреждением базальной мембраны и клеток эндотелия, увеличение межэндотелиальных щелей и каналов эндотелиоцитов) за счет увеличения вазоактивных ФАВ (гистамина, серотонина, кининов, глобулинов проницаемости и др.). Наблюдается увеличение как пассивного, так и активного транспортирования различных веществ через стенку сосудов. Гемодинамический фактор – повышение гидростатического давления сначала в артериальной, а затем в венозной части капилляров. Увеличение фильтрации начинается при артериальной гиперемии и нарастает при венозной гиперемии. Следует отметить, что кровяной фактор (снижение онкотического давления крови) в генезе экссудации практического значения не имеет. Основные пути экссудации. Среди них выделяют следующие виды транспорта экссудата: 1) межэндотелиальный, пассивный (в связи с изменением формы и размеров эндотелиоцитов и увеличением межэндотелиальной щели); 2) трансцеллюлярный пассивный (в связи с расширением клеточных пор); 3) трансцеллюлярный активный (с участием как переносчиков без затраты энергии, так и насосов, работающих с затратой энергии АТФ, АДФ, КРФ). Значение экссудации может быть адаптивным и патологическим. Адаптивное значение экссудации заключается в:
Важно отметить, что противоотечный эффект от применения различных противоспалительных лекарственных средств в первые часы с момента повреждения и развития воспаления часто не удается получить. Это является подтверждением положительного биологического значения воспалительного отека. Патологическое значение экссудации определяется:
14.8.4. ЭМИГРАЦИЯ В ОЧАГЕ ВОСПАЛЕНИЯ Эмиграция - процесс выхода лейкоцитов из просветов сосудов в ткани, главным образом, в очаг воспаления. Первыми (в течении 4-6 часов) выходят гранулоциты (нейтрофилы, эозинофилы, базофилы), позднее, (через 5-12 часов) - моноциты, еще позже (через 12-24 часа) - лимфоциты. Гранулоциты и моноциты эмигрируют межэдотелиально, лимфоциты – трансцеллюлярно (через эндотелиоциты путем пиноцитоза). В процессе эмиграции лейкоцитов, выделяют несколько стадий: 1) краевое стояние (которое увеличивается особенно в сосудах, прилегающих к зоне повреждения), 2) адгезия (прилипание лейкоцитов к внутренней поверхности эндотелиоцитов), сначала адгезия слабая (отмечается rolling – роллинг – прокатывание лейкоцитов по поверхности эндотелиоцитов), затем прочная (лейкоцит не движется); 3) проникновение лейкоцита через стенку микрососуда; 4) направленное движение лейкоцитов в сторону очага воспаления. Развитию первых двух стадий эмиграции способствует образование на внутренней поверхности эндотелиоцитов бахромчатых образований в виде хлопьевидных нитей, сгущение и повышение вязкости крови, снижение кровотока в микрососудах и, особенно, образование и активизация молекул адгезии, селектинов, интегринов и других ФАВ. Развитие третьей стадии эмиграции, совершающейся за 3-6 мин, происходит под влиянием следующих хемоаттрактантов:
Эмиграции способствует также движение экссудата из сосудов в интерстиций в сторону повреждения, имеющего более высокое осмотическое и онкотическое давление. Развитие четвертой стадии эмиграции лейкоцитов (микро – и макрофагов) в очаг повреждения клеточно-тканевых структур обеспечивается активным, с затратой энергии, амебоидным движением лейкоцитов. Последний осуществляется благодаря: 1) переходу их гиалоплазмы из состояния геля в золь; 2) снижению поверхностного натяжения цитолеммы «головного» полюса клеток; 3) сокращению актомиозина «хвостового» полюса лейкоцитов. Этот процесс осуществляется с участием следующих хемоаттрактантов :
Немаловажное значение в усилении миграции лейкоцитов, имеющих отрицательный заряд, придают высокоположительному заряду объектов фагоцитоза, особенно раздраженным клеточно-тканевым структурам (из-за накопления в них ионов, особенно, Н+, К+, Са+2). Следует отметить, что сдвиг рН в тканях в щелочную сторону (алкалоз), а также гепарин снижают эмиграцию лейкоцитов. Значение эмиграции лейкоцитов в развитии воспаления крайне велико. Показано, что эмиграция лейкоцитов способствует:
14.8.5. ФАГОЦИТОЗ Фагоцитоз - жизненно важная местная реакция организма, сформированная в процессе эволюции и осуществляемая с помощью макро - и микрофагов. Последние обеспечивают элиминацию из места внедрения (попадания) различных чужеродных (антигенных) агентов путем эндоцитоза с помощью фаголизосом, образовавшихся в результате слияния фагосом (больших эндоцитозных пузырьков) с лизососмами (содержащими различные гидролитические ферменты). Благодаря фагоцитозу ограничивается дальнейшее местное повреждение тканей флогогенными агентами для защиты целостного организма. Термины фагоцитоз и фагоциты впервые были предложены И.И. Мечниковым. Последний был удостоен Нобелевской премией в 1908 году за разработку процесса фагоцитоза разными лейкоцитами (моноцитами и гранулоцитами) и его важной защитной роли для организма. В процессе фагоцитоза И.И.Мечников выделил 4 стадии (рис. 14-2): 1 стадия - приближение фагоцита к объекту фагоцитоза (антигену). 2 стадия - прилипание (адгезия) фагоцита к чужеродному объекту (после распознавания последнего). 3 стадия - поглощение чужеродного объекта фагоцитом (с помощью образовавшейся фаголизосомы и при участии протеинкиназы С инов Са+2) 4 стадия - внутриклеточное переваривание чужеродного объекта (с полным или неполным разрушением последнего с помощью кислородзависимой и кислороднезависимой цитотоксичности фагоцитов). 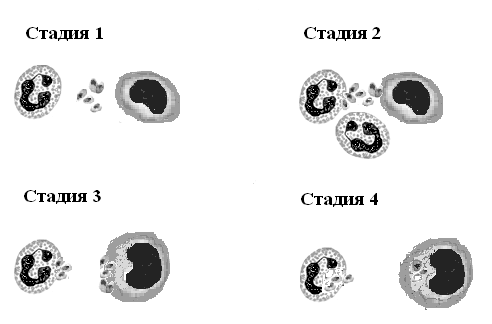 Рис. 14-2. Стадии фагоцитоза лейкоцитами эритроцитов птиц. В кислородзависимой цитотоксичности фагоцитов по отношению к объектам фагоцитоза принимают участие образующиеся анион супероксида (О2-), синглетный кислород (1О2), гидроксильный радикал (ОН-), пероксид водорода (Н2О2), ион НСIО-. В то же время сам фагоцит ими не повреждается в результате защиты образующимися и поступающими ферментными и неферментными антиоксидантами. В кислороднезависимой цитотоксичности фагоцитов участвуют лизоцим, лактоферрин, катионные белки, катепсины, протеиназы (эластаза, коллагеназа и др.), дефензины и др. Показано, что развитие той или иной стадии фагоцитоза обусловлены действием на фагоциты различных (перечисленных выше) хемоаттрактантов, опсонинов (фрагментов антител, и, главным образом, IgG и IgM, компонентов системы комплемента и лектинов, связывающихся с клеточной мембраной микроорганизма и существенно повышающих эффективность фагоцитоза), а также рецепторов на поверхности лейкоцитов (фагоцитов). 14.8.6. ПРОЛИФЕРАТИВНЫЕ ПРОЦЕССЫ В ОЧАГЕ ВОСПАЛЕНИЯ Пролиферация - процесс новообразования клеток путем их размножения (деления). Основу пролиферации в очаге воспаления составляет репаративная регенерация (лат. regeneration - возрождение, обновление и лат. reparatio - восстановление, возобновление) – процесс восстановления поврежденных клеточно-тканевых структур. При воспалении процесс репаративной регенерации активизируется за счет эпителиальных и особенно, соединительно-тканных структур, в частности, фибробластов. Так, миграция фибробластов в очаг воспаления начинается в 1-2 сутки от момента альтерации, которые в последующие дни начинают активно формировать коллагеновые волокна и другие составляющие экстраклеточного матрикса. Пролиферация возникает с самого начала воспаления (вскоре после альтерации), далее нарастает, а после достижения максимума (через 1-2-3 недели) снижается. В регуляции пролиферации важную роль играют:
Следует отметить, что в очаге воспаления моноциты и лимфоциты могут претерпевать различные превращения. Так, мигрировавшие в очаг воспаления моноциты дифференцируются в «воспалительные» макрофаги, которые через 1-2 суток становятся доминирующими клеточными элементами. Последние, совместно с другими фагоцитами и ФАВ, обеспечивают не только стерилизацию очага воспаления, но и активизацию репаративных процессов. Из одних лимфоцитов образуются плазмоциты – основные антителообразующие клетки. Другие переходят в прегистиоциты и гистиоциты. Последние могут превращаться в гистиофаги, способные уменьшать количество фибробластов и коллагена, а также увеличивать содержание простагладинов типа Е, стимулирующих размножение и рост клеток и сосудов. Показано, что в превращении гистоцитов принимают участие холин, продукты распада нуклеиновых кислот, кислые мукополисахариды и др. Гистоциты способны также превращаться в фибробласты, которые, во-первых, выделяя фибронектин детерминируют процессы миграции и адгезии лейкоцитов и процесс пролиферации соединительно-тканевых структур, во-вторых, участвуют в синтезе преколлагена и образовании коллагеназы, а значит участвуют в образовании коллагена основного вещества соединительной ткани. Активность пролиферации зависит от вида флогогенного фактора, от площади и глубины повреждения, от структурных, метаболических и функциональных особенностей поврежденных структур, от своевременности и правильности выбранного метода лечения. При незначительных по площади (до 1,0 см) и глубине (0,1-0,2 мм) повреждениях кожи и слизистых происходит полная ликвидация дефекта и восстановление нормального эпителиального слоя. При несколько больших по площади и глубине повреждениях заживление осуществляется под струпом (с сухой корочкой) либо первичным натяжением с образованием нежного соединительно-тканного рубчика, либо вторичным натяжением с образованием плотного соединительного рубца. Увеличение числа соединительно-тканных клеток, фибробластов, коллагеновых, ретикулярных и эластических волокон начинается уже через 6-12-24 ч. с момента альтерации и далее прогрессивно нарастает. Через 2-3 суток происходит новообразование кровеносных капилляров, в ране появляется грануляционная ткань. После 5-7 суток васкуляаризация быстро прогрессирует и происходит отторжение некротических масс. Фибробласты активно синтезируют коллаген. Рана очищается. Через 9-15 суток грануляционная ткань, состоящая из 6 слоев (лейкоцитарно-некротического, сосудистых петель, вертикальных сосудов, созревающего слоя, горизонтально расположенных фибробластов, фиброзного слоя) быстро разрастается и созревает. Часть грануляций эпителизируется (т.е. завершается полной эпителизацией), а часть превращается в плотный рубец (т.е. завершается рубцеванием поврежденной ткани). Продолжительность, выраженность, универсальность и индивидуальные особенности основных процессов (компонентов) воспаления существенно зависят от вида и интенсивности действия флогогенного раздражителя, локализации и характер повреждения, сопутствующих ему внешних и внутренних (генотипических и фенотипических свойств макроорганизма) условий. По степени задействования различных провоспалительных и противовоспалительных механизмов, в развитии воспаления выделяют два альтернативных варианта: во первых, экссудативно-деструктивное или гнойное воспаление, во вторых, продуктивное или пролиферативно-клеточное воспаление. Главной движущей силой воспаления в первом случае являются обладающие выраженным флогогенным потенциалом нейтрофилы, а также система комплемента и иммуноглобулины (Ig), особенно IgG. Во втором случае отмечается гораздо менее выраженная экссудативно-сосудистая реакция, а преобладающим клеточным элементом инфильтрата является мононуклеары, а в некоторых случаях (например, при гельминтозах) – эозинофилы. В воспалительном процессе, возникшем в ответ на действие генетически чужеродных агентов (как экзогенного, так и эндогенного происхождения) принимают участие различные регуляторные, исполнительные физиологические и метаболические системы, а также клетки и межклеточные структуры. 14.8.7. МЕДИАТОРЫ ВОСПАЛЕНИЯ Обязательными участниками воспаления являются стенки микроциркуляторного русла (артериол, прекапилляров, капилляров, посткапилляров, венул), особенно их эндотелиоциты, межклеточное вещество с различными стромальными клетками (особенно фибробластами) поврежденных тканей и органов, мигрирующие в очаг воспаления лейкоциты (особенно нейтрофилы, моноциты и лимфоциты), белки поврежденных тканей и плазмы, и, особенно, разнообразного происхождения медиаторы воспаления (лат. mediator – посредник). Именно медиаторам воспаления принадлежит особо значимая роль в развитии многообразных процессов в очаге воспаления (характере и выраженности вторичной альтерации, сосудистых реакций, экссудации, эмиграции лейкоцитов, фагоцитоза, расстройств метаболических процессов, взаимодействия между собой клеток и субклеточных структур, пролиферации и репаративной регенерации и др.). К медиаторам воспаления относятся различные по химическому строению, интенсивности, длительности действия и месту образования ФАВ. Эти ФАВ опосредуют многообразное действие на организм как самих флогогенных факторов, так и патогенетических факторов, формирующихся в динамике воспаления. Следует отметить, что все медиаторы синтезируются в тех или иных клетках. Причем одни (клеточные) медиаторы образуются и выделяются в очаг воспаления в функционально активном состоянии (гистамин, серотонин, ацетилхолин, норадреналин, простагландины Е и I, тромбоксан В2, лейкотриены, продукты ПОЛ и др. Другие медиаторы - в функционально неактивном состоянии, в виде предшественников, которые под влиянием соответствующих промоторов в гуморальных средах (преимущественно в плазме) становятся физиологически активными и затем уже поступают в очаг воспаления или какие-либо другие структуры организма (кинины, компоненты системы комплемента, факторы системы гемостаза). Третьи образуются в лейкоцитах (гранулоцитах, моноцитах, лимфоцитах) как, циркулирующих в крови, так и усиленно мигрирующих в очаг повреждения клеточно-тканевых структур (интерлейкины - ИЛ, интерфероны - ИФ, хемо- и лейкокины, гидролазы, катионные белки, кейлоны, фибронектин, оксид озота и др.). С учетом сказанного, по месту приобретения физиологически активного состояния медиаторы воспаления делят на 3 группы: 1) клеточные (локальные, образующиеся в месте повреждения), 2) плазменные, 3) лейкоцитарные (промежуточные). Клеточные медиаторы воспаления преимущественно образуются :
К клеточным медиаторам воспаления относятся:
- оксида азот эндотелиоцитов и др. К плазменным медиаторам воспаления относятся:
К промежуточным медиаторам воспаления относятся цитокины (ранее именовавшиеся монокинами и лимфокинами); в частности:
14.8.8. Биологические эффекты МЕДИАТОРОВ ВОСПАЛЕНИЯ Локальные (клеточные) медиаторы воспаления К ним относятся различные ФАВ, в частности, гистамин, серотонин, ацетилхолин, норадреналин (НА), простагландины (ПГ), простациклин, тромбоксан, фактор активации тромбоцитов (ФАТ), лейкотриены (ЛТ), продукты свободнорадикального перекисного окисления (ПОЛ) и др. Гистамин накапливается в поврежденных тканях преимущественно в результате дегрануляции тучных клеток, базофилов и тромбоцитов. Гистамин, активируя в малых концентрациях Н1 – рецепторы, а в больших концентрациях Н2 – рецепторы, вызывает многообразные местные нарушения (вазодилатацию в большинстве органов и тканей и вазоконстрикцию в легких; повышение проницаемости микрососудов, особенно венул, в различных органах; активацию миграции гранулоцитов и моноцитов из крови в очаг воспаления; увеличение образования простагландинов и циклических нуклеотидов). С действием гистамина связаны в организме и общие расстройства (жжение, зуд, боль и др.). Серотонин накапливается в поврежденных тканях в результате дегрануляции тромбоцитов, базофилов и тучных клеток. Серотонин сначала вызывает сужение, а потом - расширение микрососудов, особенно, венул, сопровождающемся еще большим (в 10-50-100 раз), чем у гистамина, повышением их проницаемости, а также активацией процесса тромбообразования и возникновением ощущения боли и жжения. Нейромедиаторы (АХ и НА), и гормоны (А и НА) всегда обнаруживаются в биосредах в повышенных количествах в начале воспаления. Первые выделяются соответствнно окончаниями парасимпатических и симпатических нервных волокон, вторые - хромаффинной надпочечниковой и вненадпочечниковой тканью. АЦХ через активизацию соответствующих М- и Н – холинорецепторов, НА и А через возбуждение – и – адренорецепторов вызывают в очаге воспаления и за его пределами самые разнообразные изменения. Катехоламины (НА, А) через – адренорецепторы повышают тонус гладко-мышечных клеток микрососудов, преимущественно артериол, что приводит к развитию ишемии, вплоть до ишемического стаза. Через 2 - и 1 - адренорецепторы НА и А активизируют процессы гликогенолиза, гликолиза, липолиза, липопероксидации и т.д. Ацетилхолин, во-первых, снижает тонус миоцитов микрососудов, главным образом, артериол, что приводит к развитию артериальной гиперемии; во-вторых, активизирует процесс эмиграции лейкоцитов и их фагоцитарную активность; в-третьих, стимулирует процесс пролиферации, а значит – заживление поврежденных структур. Простагландины, простациклин, тромбоксаны, фактор активации тромбоцитов и лейкотриены, именуемые липидными медиаторами воспаления, образуются из высших ненасыщенных жирных кислот (арахидоновой, линолевой, леноленовой). Эти кислоты, являющиеся составной частью фосфолипидов мембран различных клеток (особенно эндотелиоцитов и тучных клеток) образуется в результате активизации фермента фосфолипазы. Образование простагландинов, простациклина, тромбоксана А2 идет по циклоксигеназному пути, а лейкотриенов – по липооксигеназному пути. В очаге воспаления особенно увеличивается количество простагландинов (ПГ) типа Е и I, которые не только являются важными внутри – и межклеточными передатчиками информации, но и способны расширять микрососуды, усиливать экссудацию, стимулировать эмиграцию лейкоцитов и их фагоцитарную активность. При повышении продукции других простагландинов, особенно ПГF2, отмечается спазм гладкомышечных клеток микрососудов, торможение развития экссудации, уменьшение вторичной альтерации и активизация заживления раны. Фактор активации тромбоцитов, усиленно образующийся в очаге воспаления, помимо повышения функциональной активности этих клеток, сопровождается усилением процесса тромбообразования в сосудах и развитием сильного спазма микрососудов. Лейкотриены, образующиеся в очаге воспаления, обладают резко выраженной способностью вызывать спазм микрососудов (особенно, артериол), а также гладких мышц бронхиол и пищеварительного тракта. Одновременно они повышают проницаемость мембран и активизируют процессы хемотаксиса лейкоцитов. Продукты свободнорадикального перекисного окисления липидов (радикалы, перекиси, гидроперекиси липидов, альдегиды, Шиффовы основания и др.) также занимают важное место в патогенезе воспалительного процесса. В зависимости от степени повышения количества этих липидных продуктов могут наблюдаться как обратимые, так и необратимые расстройства в очаге воспаления. При умеренном увеличении их количества наблюдается и умеренное повышение активности различных ферментов, проницаемости микрососудов, фагоцитоза, пролиферации. При резко выраженном увеличении их количества, отмечается резкое повышение проницаемости мембран клеток вплоть до их разрывов, выраженные повреждения мембранных рецепторов, угнетение и извращение метаболических процессов из-за развития дисферментемии, торможение фагоцитоза, ослабление и извращение процесса пролиферации. Кейлоны (англ. кеу - ключ и long – единственный) - низкомолекулярные белки и гликопротеиды, являющиеся медиаторами межклеточного взаимодействия в пределах отдельных тканей. Выделяясь делящимися клетками кейлоны тормозят в окружающих (соседних) клетках реакции митоза, скорость синтеза нуклеиновых кислот и белков. При воспалении они играют наибольшую роль в регуляции процесса пролиферации. Активность кейлонов регулируется (тормозится) антикейлонами. Гидролазы различных поврежденных в очаге воспаления клеточно-тканевых структур организма представлены различными гидролитическими ферментами, участвующими в развитии альтерации, нарушений местного кровообращения (артериальной и венозной гиперемии, а также, ишемии и стаза), экссудации, эмиграции лейкоцитов, фагоцитоза, очищения очага воспаления от поврежденных и погибших клеточно-тканевых структур и замещения их пролиферирующими клетками. Оксида азот - важный медиатор воспаления, образующийся, главным образом, эндотелиоцитами кровеносных сосудов и оказывающий сильное вазодилататорное действие. Плазменные медиаторы воспаления Они представлены кининами; компонентами системы комплемента; факторами системы гемостаза (изменяющими свертывание, антисвертывание и фибринолиз крови). Кинины – различные ФАВ (брадикинин, каллидин и др.), которые образуются в плазме из кининогенов, синтезирующихся в печени и других органах под влиянием протеаз (калликреинов или кининогеназ), и одновременно разрушаются под действием карбоксипептидазных ферментов (кининаз). В очаге воспаления калликреины образуются из прекалликреинов под влиянием активаторов (ацидоз, катехоламины, фактор Хагемана, трипсин, плазмин, катепсины, урокиназа и др.). Кинины оказывают мощное влияние на состояние микроциркуляторного русла. В частности, они резко (более чем в 10 раз, по сравнению с гистамином) повышают проницаемость стенок микрососудов (иногда до развития микрогеморрагий), стимулируют образование экссудата, расширяют артериолы (вызывая развитие артериальной гиперемии), активизируют процесс эмиграции лейкоцитов из крови в поврежденные ткани. Под влиянием повышенного количества кининов активизируется ноцицептивная система, формирующая болевые ощущения и различные реакции организма на него. Компоненты системы комплемента либо поступают в очаг воспаления из синтезировавших их органов (главным образом, печени), либо из поступивших сюда мононуклеаров. Активизированные в поврежденных тканях компоненты данной системы (особенно С3а и С5а), повышают проницаемость микрососудов, активируют процессы хемотаксиса лейкоцитов и опсонизации объектов фагоцитоза, обладают бактерицидным и цитолитическим действием и т.д. Факторы системы гемостаза в виде прокоагулянтов и коагулянтов, проантикоагулянтов и антикоагулянтов, плазминогена и плазмина, усиленно образуются в очаге повреждения различных клеток, тканей, в том числе эндотелия сосудов и клеток крови. Они занимают важное место в характере и степени развития местных и системных нарушений в организме. Активизация системы коагуляции сопровождается образованием тромбов и тромбоэмболов, вызывающих расстройства местного кровообращения (ишемию, венозную гиперемию, стаз), нарушения процессов метаболизма, развитие дистрофических, некробиотических и некротических процессов. Активизация антисвертывающей системы и системы фибринолиза предупреждает образование тромбов, способствует геморрагиям, приводит к гипоксии и также к развитию деструктивно-дистрофических процессов в очаге воспаления. Среди различных факторов гемостаза важное место занимает образующийся в очаге повреждения активизированный фактор Хагемана, который способен усиливать коагуляционный гемостаз и активизировать также кининовую и фибринолитическую системы. Промежуточные медиаторы воспаления Источником их образования являются, главным образом, лейкоциты (нейтрофилы, эозинофилы, моноциты, лимфоциты), часть из которых трансформируется в тканевые клетки (гистиофаги). К медиаторам, образующимися лейкоцитами, внедренными в очаг повреждения тканей, относятся различные по строению и действию ФАВ, главным образом, групп цитокинов и лейкокинов. Цитокины - это большая группа местных медиаторов, которые, взаимодействуя друг с другом и с разнообразными поврежденными и неповрежденными клеточно-тканевыми структурами организма, во 1-х, проявляют самые многообразные виды биологической активности; во 2-х, играют разную роль в развитии острого и хронического воспаления, его местных и системных реакций; в 3-х, участвуют в развитии не только воспаления, но и иммунитета, аллергии и аутоиммунных заболеваний и т.д. Общие закономерности действия цитокинов Зависимость биосинтеза цитокинов от функционального состояния клеток. Цитокины являются маркерами тканевого повреждения, особенно связанного с воздействием на организм АГ. В нормальных условиях секреция отдельных типов цитокинов осуществляется только в небольших количествах. Локальность действия. У цитокинов доминируют паракринные и аутокринные эффекты, реализующиеся преимущественно на территории реагирующих лимфоидных органов и в очаге воспаления. Однако при выраженном воспалении происходит накопление некоторых цитокинов в крови, достаточное для реализации их дистантных эффектов. Тотальность действия на различные виды клеток. Отдельные (ключевые) цитокины вовлекают в процесс воспаления и поствоспалительной регенерации различные типы и неиммунокомпетентных клеток. Подавляющие большинство клеток организма могут в норме или после преактивизации экспрессировать рецепторы к тем или иным цитокинам. Например, рецепторы к ФНОα выявляются практически на всех ядросодержащих клетках человека. Полифункциональность действия цитокинов определяется локализацией их рецепторов на различных типах клеток, а в некоторых случаях и несколькими типами рецепторов у одного цитокина. Поэтому в зависимости от локализации клеток-мишеней, изменений экспрессии рецепторов и сопутствующего влияния других регуляторных факторов действие отдельных цитокинов может отличаться не только разнообразием регуляторных эффектов, но и их неоднозначностью, вплоть до противоположности их эффектов в различных средовых ситуациях. Условность действия цитокинов на клетки-мишени. Рецепция тех или иных типов цитокинов определяется характером активации клетки. Поэтому действие одного и того же цитокина на один и тот же тип клеток, но находящихся в ином функциональном состоянии, может быть неоднозначным. Таким образом, цитокины образуются активированными клетками для оказания влияния в основном на предварительно активированные клетки. Кооперативность действия. Для осуществления регуляторных эффектов на свои клетки-мишени цитокины действуют комплексно, последовательно, поэтапно и при обязательном взаимодействии с другими регуляторными факторами АГ-специфичной или АГ-неспецифичной природы. Избыточность действия. Действие большинства цитокинов дублируется друг другом через наличие общих рецепторов или систем внутриклеточных регуляторных посредников у разных типов рецепторов. Поэтому «выпадение» действия отдельных цитокинов, например, вследствие генетических аномалий, как правило, не приводит к фатальным последствиям. Тотальность и избирательность продукции. Продуцировать те или иные типы цитокинов способен очень широкий круг активированных клеток организма. Однако с наибольшей интенсивностью и широтой спектра их представителей цитокины продуцируют Т-хелперы (Тх) и «воспалительные» макрофаги, а также другие типы лейкоцитов, эндотелиоциты 2-го типа (выстилающие посткапиллярные венулы), активированные мастоциты, кератиноциты и даже другие типы эпителиоцитов, клетки макроглии, фибробласты, дендроциты и некоторые другие клетки. Необходимо учитывать, что различные цитокины, обладая широким спектром функциональной активности, могут дублировать свои эффекты по одним позициям и конкурировать по другим. Причем многие цитокины проявляют конкретные регуляторные эффекты только в определенной дозовой зависимости и комбинации с другими регуляторными факторами (и не только цитокиновыми). Краткая характеристика основных цитокинов Ведущими лейкоцитарными цитокинами считаются: интерлейкины, интерфероны, хемокины, белки, фибронектины, оксида азот. Интерлейкины (ИЛ) – большая группа, различных белковых веществ (ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-!0, ИЛ-12, ИЛ-13, ИЛ-16, ИЛ-18, ИЛ-22 и др.), способных:
Большинство интерлейкинов являются провоспалительным факторами. У ИЛ-10, ИЛ-4, ИЛ-22 и ИЛ-18 (без присутствия ИЛ-12 и ИЛ-ра – рецепторного антагониста ИЛ-1) выявлены отчетливые противовоспалительные свойства. Показано, что в синтезе и индукции противовоспалительных ИЛ принимают участие преимущественно нейтрофильные гранулоциты. Особое участие в формировании гнойных очагов при воспалении принимает ИЛ- 8, а в индукции белков острой фазы - ИЛ- 6. Маркером поспаления, а не только и не столько наличия опухоли, является ФНО. Последний вместе с ИЛ-1 наиболее ответственен за развитие характерных для шока нарушений: артериальной гипотензии, некроза почечных канальцев, метаболического ацидоза и др. Развитие СПИДа также характерезуется значительным увеличением ФНО. ФНО принадлежит важная роль в развитии различных видов хронического воспаления, особенно на фоне повышенной температуры тела. К центрогенным эффектам ФНО относятся: энцефалопатия, усиление сонливости, снижение аппетита и массы тела, активация остеопороза, прогрессирующая анемия (как результат угнетения гемопоэтинов) и др. В развитии аутоиммунных процессов, характерных для различных хронических воспалительных заболеваний также большое значение отводят цитокинам, особенно ИЛ-1 и ФНО. Важно отметить, что ряд цитокинов, особенно интерлейкинов, обладает полифункциональностью действия не только на процессы альтерации, экссудации, хемотаксиса и эмиграции лейкоцитов, тромбообразования и других отмеченных выше биологических эффектов, характерных для воспаления, но и на процессы репарации поврежденных тканей. В частности, ИЛ-1 стимулирует пролиферацию эндотелиоцитов, гладкомышечных клеток, кератиноцитов, астроцитов, а также пролиферацию и дифференцировку фибробластов и синтез ими коллагена. ИЛ-6, ИЛ-8, ФНОα, трансформирующий фактор роста бета (ТФРβ) также оказались способными активизировать пролиферацию эндотелиоцитов, кератиноцитов, фибробластов и синтез ими коллагена. Помимо этого ИЛ-6 стимулирует пролиферацию гепатоцитов, пролиферацию и дифференцировку остеобластов, рост нервов (через активацию фактора роста нервов); ИЛ-8 – также стимулирует пролиферацию гладкомышечных клеток, а ТФРβ – способствует дифференцировке кератиноцитов и моноцитов в гистиомакрофаге, но угнетению пролиферации кератиноцитов. Интерфероны (ИФ) – различные гликопротеины, вырабатываемые разными лейкоцитами (– и – ИФ) и фибробластами (–ИФ), особенно, при инфицировании организма вирусами. ИФ, наряду с мощной противовирусной активностью, активируют функции макрофагов, стимулируют фагоцитоз, и цитотоксическую активность лейкоцитов, усиливают прокоагуляционную активность эндотелия микрососудов, участвуют в развитии аллергических и иммунных реакций организма. Хемокины - различные низкомолекулярные секреторные пептиды, в наибольшей степени регулирующие эмиграцию и передвижение лейкоцитов в очаге воспаления. Краткая характеристика основных лейкоцитов Лейкокины – группа синтезируемых лейкоцитами медиаторов, не относящихся ни к иммуноглобулинам, ни к цитокинам. К ним относятся разные лизосомальные гидролазы (протеазы, липазы, гликозидазы, эластазы, коллагеназы), белки острой фазы (С – реактивный белок, факторы С3а и С5а системы комплемента, гаптоглобин, церулоплазмин), катионные белки, фибронектин и др. Гидролазы – кислые, нейтральные и щелочные гидролитические ферменты, выделяемые преимущественно нейтрофилами, которые в процессе воспаления:
Известно, что азурофильные гранулы нейтрофилов содержат кислые и нейтральные гидролазы (протеазу, эластазу, коллагеназу, миелопероксидазу), способные разрушать как внутриклеточные, так и внеклеточные структуры. Специфические гранулы нейтрофилов, главным образом, содержат щелочную фасфатазу, лизоцим, лактоферрин и неферментные вещества. Показано, что кислые гидролазы разрушают в фаголизосоме нейтрофила только те микроорганизмы, которые предварительно были убиты миелопероксидазой, лизоцимом, лактоферрином и катионными белками. Белки острой фазы (С- реактивный белок, гаптоглобин, церулоплазмин, фибриноген, С3а и С5а компоненты системы комплемента и др.) имеют клеточное (поврежденные ткани, лейкоциты) и плазменное происхождение. Эти белки являются маркерами воспаления и обладают выраженным провоспалительным, цитолитическим и бактерицидным действием. Они повышают хемотаксическую и фагоцитарную активность лейкоцитов, способность стимулировать выход клеток крови из костного мозга и др. Катионные белки вырабатываются, главным образом, нейтрофилами и эозинофилами. Играют важную роль в повышении неспецифического иммунитета. Усиливают проницаемость микрососудов и хемотаксис нейтрофилов; стимулируют микротромбообразование, дегрануляцию тучных клеток и тромбоцитов; обладают бактерицидной активностью. Фибронектины образуются мононуклеарами, тучными клетками и фибробластами. Участвуют в опсонизации объектов фагоцитоза, стимулируют их адгезию на поверхности фагоцитов, обладают высокой хемотаксической активностью. Оксида азот - важный медиатор межклеточных взаимоотношений, регулируемый ферментом оксида азота синтетазой, которая образуется в клетках макрофагов, нейтрофилов, тромбоцитов и, особенно, как указывалось выше, в эндотелиоцитах микрососудов. Оксида азот, являясь мощным вазодилататором, обладает также многими другими функциями. 14.9. ВЛИЯНИЕ ВОСПАЛЕНИЯ НА ОРГАНИЗМ Действие флогогенного раздражителя вызывает в целостном организме следующие различные виды изменений: местные и общие, разрушительные и приспособительные, структурные и функциональные, специфические и неспецифические. Степень выраженности и многообразность воспаления тем больше, чем совершеннее в эволюционном плане организм, чем интенсивнее (до определенного предела) повреждение клеточно-тканевых структур и чем выше как общая, так и локальная (тканевая) реактивность. Воспаление развивается, главным образом, как защитно-приспособительная реакция организма, направленная на ликвидацию не только патогенного агента, но и на устранение неблагоприятных последствий его действия. К местным приспособительным изменениям при воспалении относятся:
К общим приспособительным изменениям при воспалении относятся:
При воспалении, наряду с приспособительными, всегда развиваются явления повреждения. К местным разрушительным изменениям при воспалении относятся:
К общим разрушительным изменениям при воспалении относятся:
Эти разрушительного характера изменения оказывают на организм прямое повреждающие действие, а также существенно снижают устойчивость организма к действию различных, особенно патогенных, факторов. В зависимости от условий выраженность и длительность того или иного перечисленного местного или общего изменения при воспалении может играть либо приспособительную, либо разрушительную роль. Так, в лаборатории проф. Ойвина И.А. в опытах на кроликах с выраженным воспалительным очагом в коже блестяще показано, что воспаление играет защитную роль (введение смертельный дозы KCN в очаг воспаления, в отличие от контроля, сопровождается не гибелью, а сохранением жизни животного). Подавление же воспаления введением АКТГ (как и глюкокортикоидов), также как и в контроле, сопровождалось гибелью животных после введения KCN в очаг воспаления. Воспаление, являясь в целом преимущественно локальным защитно-приспособительным процессом, в ряде случаев, с участием резко возросшего (в 5-10 и более раз) уровня в крови разнообразных. Особенно, противовоспалительных цитокинов, может привести к системному, преимущественно патологическому ответу (Systemic inflammatory response syndrome, SIRS). Последний, в частности, может проявляться развитием выраженных дисстресса (регуляторного, оксидантного, ацидотического, гиповолемического, токсического, метаболического), гипертермии (более 38˚С) или гипотермии (менее 36˚С), лейкоцитоза (более 12·109 л) или лейкопении (менее 4·109 л), тахикардии (более 90-100 ударов в 1 мин), тахипноэ (более 20 дыханий в 1 мин) и даже сепсиса. Для системного воспаления, как правило, характерно развитие системной альтерации клеточно-типовых структур организма, системных расстройств микроциркуляции, системной экссудации, системного вовлечения в ответную реакцию организма эндотелиоцитов, плазменных факторов крови (системы комплемента, системы гемостаза с развитием ДВС-синдрома и др.), клеток крови (особенно макрофагов и нейтрофилов), а также мастоцитов и других стромальных клеток периваскулярной соединительной ткани. Финалом развития системного воспаления обычно является развитие сначала органной, а затем и полиорганной недостаточности, приводящей в итоге к гибели организма. 14.10. Влияние реативности организма на развитие воспаления |
