биофапмация. БИОФАРМАЦИЯ УЧЕБНИК (1). Учебник для студентов фармацевтических вузов и факультетов Под редакцией академика
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
Глава 4. Методыоценкираспадаемости, растворенияивысвобожденияЛВ Прибор для проверки растворимости свечей PTS WO работает в нормальной бане для растворения, ячейка помещается в обычный сосуд для растворения, привод мешалки соединяется с горизонтально вращающейся диализной ячейкой. Действующие составляющие диффундируют через мембрану ячейки и могут быть измерены обычным способом.  Рис. 4.11. Приборы для определения распадаемости суппозиториев фирмы PharmaTest (Германия): a— модель PTS 3E для определения распадоемкости суппозиториев; б — модель PTS WO для определения растворимости суппозиториев Для испытания суппозиториев на растворимость ГФУ регламентирует использование проточного прибора для твердых лекарственных форм, но со специальной кюветой. Проточная кювета, представленная на рис. 4.12, предназ* начена для липофильных твердых дозированных форм, таких как суппозитории и мягкие капсулы. Она состоит из трех прозрачных частей, которые вставляются друг в друга. Нижняя часть IIIсделана из двух сообщающихся камер, присоединенных к устройству переполнения. Среда растворения проходит через камеру А и поднимается вверх. Движение потока в камере Б направлено вниз 4.5. Высвобождениелекарственныхвеществ из РЛФ 133 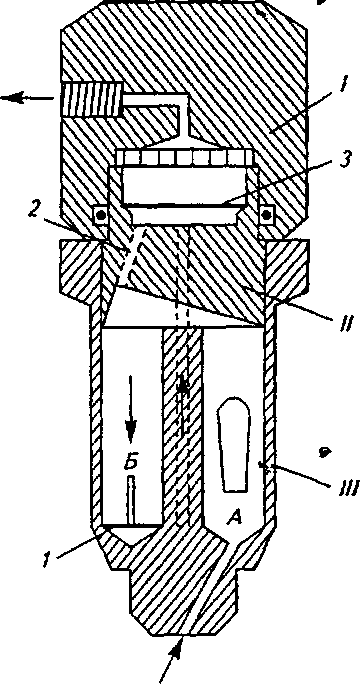 к маленькому отверстию, которое ведет вверх к фильтрующему устройству. Средняя часть // кюветы имеет полость, предназначенную для сбора липофильных вспомогательных веществ, которые всплывают в среде растворения. Металлическая решетка служит в качестве грубого фильтра. В верхней части / есть место, куда помещается фильтр из бумаги, стекловолокна или целлюлозы. Рис. 4.12. Проточная кювета для липофильных твердых дозированных форм (по ГФУ): 1 — сито с острием; 2 — капиллярная трубка; 3 — металлическая решетка Методика. Помещают одну единицу исследуемого препарата в камеру А Закрывают кювету вместе с подготовленным фильтрующим устройством. В начале испытания в камере Л удаляют воздух через маленькое отверстие, соединенное с фильтрующим устройством. Нагревают среду растворения до подходящей температуры, учитывая температуру плавления препарата. Используя подходящий насос, пропускают с указанной скоростью (±5%) нагретую среду растворения через дно кюветы, получая непрерывный поток. Когда среда растворения начнет переливатьсй через край, воздух будет выходить через капилляр, и камеру Б заполняют средой растворения. Препарат распространяется через среду растворения в соответствии со своими физико-химическими свойствами. В обоснованных и разрешенных случаях испытанию могут подвергаться представительные части суппозиториев большого размера. Отбор проб и оценка результатов (см. в подразделе 4.2 о проточном методе). 9   ГЛАВА БИОФАРМАЦИЯ -ТЕОРЕТИЧЕСКАЯ ОСНОВА ТЕХНОЛОГИИ ЛЕКАРСТВ Биологическая доступность (БД) лекарственных форм — один из важных критериев оценки терапевтической эффективности лекарств в процессе разработки их состава и технологии. Тщательное изучение биофармацевтических характеристик лекарств необходимо в тех лекарственных формах, которые содержат системно действующие лекарственные вещества и в которых процессу абсорбции должен предшествовать процесс высвобождения. Это прежде sBcefb пероральные, оральные, ректальные, перкутанные (мази, кремы, пасты и другие) лекарственные формы, а также лекарства нового поколения — терапевтические лекарственные системы (ТЛС), используемые как для местного, так и для системного лечения. Не менее важным является биофармацевтическое изучение лекарственных форм, предназначенных для локального (местного) применения (глазные, назальные, ушные, ингаляционные, вагинальные препараты). Например, поскольку слизистая оболочка носа, а также легкие способны абсорбировать лекарственные вещества, действующие системно, то с терапевтической точки зрения эти органы могут использоваться значительно шире для лечения различных заболеваний; в связи с этим возрастают"многочисленные данные о биофармацевтических характеристиках таких лекарственных форм. Биофармацевтические исследования малоактуальны при разработке инъекционных лекарственных форм, так как при их введении отсутствуют процессы высвобождения и абсорбции, то есть лекарственное вещество поступает непосредственно в кровь, а с ней — к нужному органу. Исключение в данном случае составляют парентеральные лекарственные формы, обладающие пролонгированным действием и обеспечиваю- »сi » 135 щие равномерную или контролируемую подачу лекарственных веществ в кровоток. Совершенствование традиционных лекарственных форм, создание и производство современных лекарств с контролируемым высвобождением и направленной доставкой лекарственных веществ — серьезное достижение технологии лекарств, которое стало возможным только на основе комплексных химико-технологических и биофармацевтических экспериментальных исследований. Наукоемкий процесс разработки и внедрения нового лекарственного препарата включает в себя несколько этапов, а его продолжительность составляет от 10 до 15 лет. Кроме того, реализация данного процесса возможна при участии различных специалистов — химиков, технологов, фармакологов и др. Структура исследований по технологии и биофармацевтическому изучению лекарственных препаратов (на этапе доклинического изучения) в упрощенном виде представлена на рис. 5.1, из которого следует, что организация исследований по созданию новых составов и разработке технологии лекарственных препаратов заключается в последовательном изучении отбираемых композиций. На каждом из этапов исследований перед разработчиками стоят определенные задачи. Знания, накопленные какими зарубежными и отечественными учеными, как J. G. Wagner, G. Levy, В. П. Георгиевский, А. И. Гризодуб, В. П. Черных, Д. П. Сало, А. И. Тихонов, М. В. Штейнгарт, Ф. А. Конев, Е. Е. Борзунов, А. И. Тенцова, И. С. Ажгихин, И. М. Перцев, В. А. Головкин, Г. В. Цагарейшвили, Т. А. Грошовый и другие, позволяют выделить четыре основных направления развития биофармации: исследование механизмов моделирования биодоступности лекарственных веществ; изучение физико-химического взаимодействия компонентов состава и стабильности лекарственной формы; анализ и стандартизация лекарственных препаратов; установление оптимального вида и состава лекарственной формы для обеспечения терапевтической эффективности и безопасности. Содержание приведенных направлений исследовательской работы указывает на то, что биофармацевтические 136 Глава 5. Биофармация — теоретическая основа технологии лекарств 1.1. Обобщение и анализ современной инфор-мацииопредполагаемойлекарственнойфорце 1        . Предварительное изучение объектов исследования . Предварительное изучение объектов исследования1.2. Изучение физико-химических, технологических свойств лекарственного вещества (субстанции). Теоретическое обоснование вида лекарственной формы 1.3. Проведение экспериментальных исследований по установлению совместимости лекарственного средства и вспомогательных веществ, целенаправленному изучению их физико-химических и технологических свойств. Выбор вида лекарственной формы 2        . Установление значимых фармацевтических факторов. Разработка оптимального состава и технологии лекарственной формы . Установление значимых фармацевтических факторов. Разработка оптимального состава и технологии лекарственной формы2.1. Выбор вида основы, ПАВ, структурирующих веществ, растворителей,методики приготовления и др. ч. * 2.2.* Выбор количественных параметров: соотношения компонентов состава (композиций), степени дисперсности порошков, температуры и продолжительности технологических операций (скорости перемешивания, времени перемешивания) и т. д. 3. Изучение влияния фармацевтических факторов на высво бождение и степень всасывания лекарственных веществ из отобранных составов (композиций). Изучение их стабильности при хранении г 3.1. Изучение физико-химических свойств отобранных композиций в процессе хранения при различных условиях. Установление параметров их качества и стабильности. Разработка методик качественного и количественного анализа действующего вещества 3.2. Определение динамики высвобождения препарата из составленных композиций в сравнении с известными лекарственными формами этих же препаратов в опытах in vitro. Уточнение состава композиции 3.3. Сравнительная оценка степени всасывания препаратов из отобранной композиции в опытах in vivo. Проведение корреляционного анализа результатов опытов in vitro и in vivo L 3.4. Установлениемоделифармакокинетики и расчет основных параметров: постоянной скорости всасывания, выделения, распределения и др. 9 137
* Требования МЗ Украины см. в приложении 1. Рис. 5.1. Структура исследований по созданию и биофармацевтическому скринингу лекарственных препаратов (доклиническое изучение) и химико-технологические исследования в области создания и внедрения в медицинскую практику лекарственных препаратов рассматриваются в настоящее время значительно шире и занимают определенное место в системе LADMER (рис. 5.2). По результатам предварительного изучения лекарственного вещества и с учетом всей известной информации о лекарственной форме осуществляют собственно поиск оптимальных значений фармацевтических факторов с обязательным изучением биофармацевтических аспектов, структурно-механических, физико-химических и других свойств получаемых композиций будущего лекарственного препарата. При этом исследования должны быть спланированы таким образом, чтобы вести направленный поиск с рациональном числом опытов и минимальной ошибкой эксперимента. На всех стадиях поиска необходимыми являются анализ и стандартизация лекарственных средств. Последующее проведение фармакокинетических и фармакологических исследований дает возможность достоверно оценить биологическую значимость выбранных в результате эксперимента фармацевтических факторов и установить оптимальный состав лекарственной формы. 138 Глава 5. Биофармация — теоретическая основа технологии лекарств с L       ADMER ADMERБиофармацевтические проблемы Подходы, устраняющие нежелательные явления Л      екарственный препарат екарственный препаратПлохая растворимость     Высвобождение Химическая модификация Химическая деградация Ф      ерментная деградация ерментная деградацияИспользование ингибиторов ферментов Химическаямодификация Н     изкая проницаемость изкая проницаемостьСорбционные промоторы Химическая модификация     Всасывание Эффект первичного прохождения Смена пути введения Пролекарства Распределение »   Метаболизм  JL Выведение Эффект Рис. 5.2. Проблемы, возникающие в системе LADMER, и пути их устранения в процессе внедрения лекарственного препарата в медицинскую практику (по М. Головенко, 2002 г.) Ниже представлены краткие характеристики некохорьйс лекарственных форм с учетом значимых фармацевтических факторов, оперируя которыми, можно направленно оптимизировать состав и технологию лекарственных препаратов. 5.1. Пероральныелекарственныеформы 139 5.1. ПЕРОРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ » Перорально применяют растворы, эмульсии, суспензии и различные виды дозированных лекарственных форм (таблетки, гранулы, капсулы, пилюли и др.). Лекарственное вещество, содержащееся в них, может быть абсорбировано в любой части желудочно-кишечного тракта (ЖКТ), поскольку строение его мембраны это позволяет. Однако основным абсорбционным органом служит верхний отдел тонкой кишки. В определенной степени при растворимости вещества в кислой среде и оптимальном коэффициенте распределения проявляется также абсорбционная способность желудка. Анатомические и физиологические свойства этих двух частей ЖКТ, которые особенно важны для абсорбции перорально принятых лекарственных веществ, изложены в курсах физиологии и фармакологии. 5.1.1. ЖИДКИЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ Растворы. Растворы, с биофармацевтической точки зрения, наиболее физиологичны и эффективны по сравнению с другими лекарственными формами. Лекарственные вещества, принимаемые в виде растворов, обладают хорошей биологической доступностью, то есть быстрее всасываются и скорее оказывают лечебное действие. Залогом высокой эффективности лекарственного вещества является введение его в лекарственную форму в растворенном состоянии. Поэтому главное условие качества приготовляемых жидких лекарственных форм — это наличие в распоряжении фармацевта параметра растворимости лекарственных веществ. Они устанавливаются, как правило, одновременно с изучением их фармакологической активности в различных растворителях и в определенном интервале используемых концентраций. Растворимость представляет собой обобщенную характеристику химической структуры вещества и меру его взаимодействия с растворяющей системой. В технологии лекарств она позволяет отработать принцип введения лекарственных веществ в лекарственные формы. 140 | |||||||||||||||||
