биофапмация. БИОФАРМАЦИЯ УЧЕБНИК (1). Учебник для студентов фармацевтических вузов и факультетов Под редакцией академика
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
ч л 1ЮГлава4. Методыоценкираспадаемости, растворенияивысвобожденияЛВ В данном методе критически оценивается способ размещения образца (взаиморасположения образца и мешалки). Чтобы предотвратить изменение положения образца, было предложено использовать цилиндрическую посуду с полусферическим дном. Тем самым удалось зафиксировать положение образца, но изменение геометрической формы посуды повлекло за собой изменение процесса растворения. Модификацией, которая разрешила ту же проблему, является вкладывание образца в рукоять или в корзинку. Неизменность положения корзинки, закрепленной на металлической подставке, обеспечивается магнитом, находящимся под дном опытной корзинки. В другом исполнении этих устройств фиксация образца осуществляется пластинками, приспособленными для крепления таблетки или капсулы. Пластинки изготавливаются из органического стекла или тефлона и позволяют крепить множество (как правило, шесть) капсул или таблеток. При использовании такого устройства исчезают трудности, связанные с оценкой капсул, которые имеют тенденцию плавать на растворителе или. прилипать к стенке. Циркуляция растворителя возле образцов также становится более регулярной. Метод вращающейся корзины. Определение растворения проводят в устройстве, состоящем из опытной емкости и корзинки из нержавеющей стали. В литературе часто обосновываются преимущества этого метода, но следует отметить и некоторые его недостатки: частицы распавшегося образца закупоривают отверстия корзинки и искажают условия растворения, в основном это происходит с капсулами; частицы скапливаются в различных частях емкости и неравномерно попадают в поток растворителя, то есть растворенное вещество распределено неравномерно в общем объеме растворителя; на корзинке остаются пузырьки воздуха, которые мешают процессу растворения; ^, 9 неправильное расположение рукояти корзинки или ее небольшая деформация вызывают неправильные колебания, а тем самым меняется общий характер циркуляции вокруг образца; 4.2. Растворение и его кинетика 111 кислота хлористоводородная вызывает коррозию сетки корзинки и ограничивает срок ее эксплуатации; ч, 9 метод не регистрирует изменения во вспомогательных веществах; скорость и интенсивность перемешивания велики, и поэтому время, предназначенное для определения растворения, существенно сокращается в сравнении с временем, установленным при абсорбции in vivo. Данный метод был неоднократно модифицирован и автоматизирован. Простой модификацией являлась переделка корзинки, которая заключалась в фиксации плечиков мешалки ко дну корзинки, чтобы препятствовать образованию неподвижного слоя распавшихся частиц, осажденных на дне емкости под корзинкой. В результате улучшалось распределение растворенного вещества в растворителе, но одновременно увеличивалась интенсивность циркуляции. Другая переделка заключалась в замене частого сита редким, что позволило улучшить циркуляцию растворителя. Корзину предлагалось установить на горизонтальную ось, поскольку таким образом таблетка находилась на одинаковом расстоянии от центра вращения, вне зависимости от скорости вращения корзинки. Перемешивание также стало более равномерным. Отдаленной модификацией корзиночного метода можно считать устройство, в котором корзина находится в горизонтальном положении, с низкой частотой вращения, приближенной к перистальтическому движению ЖКТ. Ввятие пробы на определение лекарственного вещества происходит в заданные интервалы автоматически. Преимущество устройства заключается в том, что оно пригодно для оценки препаратов с управляемым высвобождением лекарственного вещества. Тест на растворимость с описанием внешнего вида емкости и корзинки приведен в ГФУ (ст. 2.9.3, с. 153). Для проведения теста на растворимость может использоваться прибор с лопастью-мешалкой, корзинкой или, в специальных случаях, с проточной кюветой, если нет других указаний в АНД. В каждом конкретном случае применения теста «Растворение» должно быть указано следующее: 112 Глава 4. Методы оценки распадаемости, растворения и высвобождения ЛВ используемый прибор, а в тех случаях, когда применяется прибор с проточной кюветой, должен быть указан также тип проточной кюветы; состав, объем и температура растворяющей среды; скорость вращения или скорость протекания с^редвы растворения; время, метод и объем отбираемого испытуемого раствора или условия для непрерывного контроля; метод анализа; количество или количества действующих веществ, которые должны раствориться за указанное время. Выбор используемого прибора зависит от физико-химических характеристик лекарственной формы. Прибор с корзинкой (рис. 4.3) включает в себя: — цилиндрический сосуд / из боросиликатного стекла или другого подходящего прозрачного материала с полусферическим дном и номинальной вместимостью 1000 мл с крышкой 2, замедляющей испарение; в крышке должно 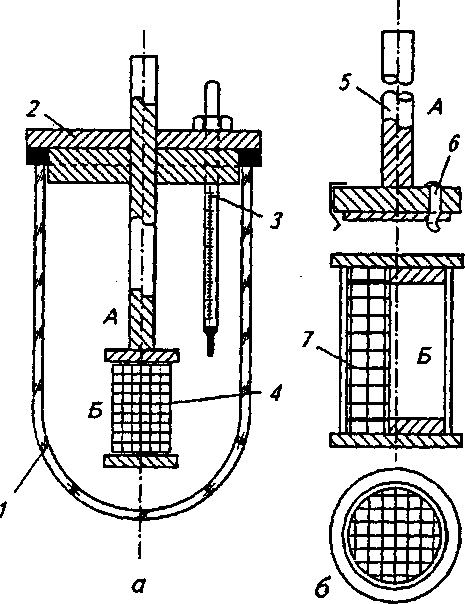 быть центральное отверстие для оси мешалки и другие отверстия для термометра 3 и устройств, используемых для извлечения жидкости; Рис. 4.3. Оборудование с корзинкой (по ГФУ): a— схема общего вида прибора в сборе; б — элементы корзинки (внизу — вид сверху) — мешалку 4, состоящую из вертикального вала 5, к нижней части которого прикреплена цилиндрическая корзинка. Корзинка (рис. 4.3, 0 се-стоит из двух частей: верхняя часть А с отверстием 2 мм приварена к валу и снабжена тремя упругими зажимами #, позволяющими удалять нижнюю часть корзинки для введения исследуемого препарата и прочно удерживающими ее концентрически 4.2. Растворение и его кинетика 113 с осью сосуда во время вращения; нижняя часть Б корзинки, представляющая собой сваренную в виде цилиндра оболочку 7 из проволоки диаметром 0,254 мм и ш.о-щадью отверстий 0,381 мм2; корзинка с золотым покрытием толщиной 2,5 мкм может использоваться для . проведения испытаний в разбавленной кислотной среде; -дно корзинки должно находиться на высоте 25±2 мм от внутренней поверхности дна сосуда; верхняя часть вал>а должна подсоединяться к мотору, снабженному регулятором скорости; мешалка должна вращаться плавно, без заметных качаний; — водяную баню, которая поддерживает постоянную тем пературу среды растворения 37,0±0,5 °С. Прибор с лопастью (рис. 4.4) включает в себя: 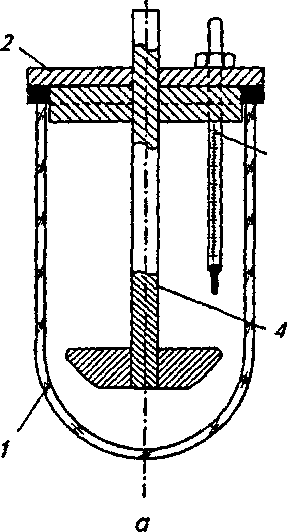 с 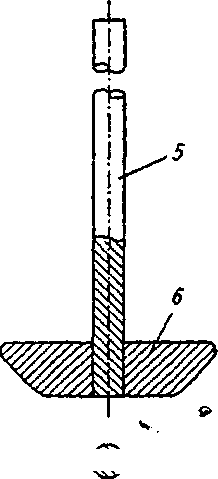 осуд 1 с крышкой 2 идентичны описанному выше для прибора с корзинкой; осуд 1 с крышкой 2 идентичны описанному выше для прибора с корзинкой;мешалку 4, состоящую из вертикального вала 5, к концу которого прикреплена лопасть 6, имеющая форму части круга, отрезанного двумя параллельными хордами; мешалка должна вращаться плавно, без заметного качания; водяную баню, v. которая поддерживает постоянную температуру среды растворения 37,0±0,5 °С. У///////Ш//////Ш Среда растворения. Если средой растворения является буферный раствор, то его рН устанавливается с точностью до 0,05 от указанного значения. Перед проведением испытания из среды растворения удаляются растворенные газы, поскольку они могут вызвать образование пу- рис 44 Оборудование с лопастью-мешалкой зырьков, которые су- (п0 ГФУ): щественНО ВЛИЯЮТ на а— схема общего вида прибора; б — лопасть-ме- результаты. шалка (внизу — вид сверху в разрезе) 114 Глава 4. Методыоценкираспадаемости, растворенияивысвобожденияЛВ 9 ц.. Методика (по ГФУ, с. 155). Помещают указанный объем среды растворения в сосуд, собирают прибор, нагревают среду растворения до температуры 37,0±0,5 °С и удаляют термометр. Помещают одну единицу исследуемого препарата в прибор. Для прибора с лопастью перед началом вращения лопасти помещают препарат на дно сосуда; твердые дозированные формы, которые при этом могут всплывать, помещают на дно сосуда горизонтально с помощью подходящего устройства, например проволоки или стеклянной спирали. Для прибора с корзинкой препарат помещают в сухую корзинку, которую опускают в соответствующее положение перед началом вращения. Следует принять меры для недопущения присутствия пузырьков воздуха на поверхности препарата. Вращение лопасти или корзинки с указанной скоростью (±4 %) начинают немедленно. Отбор проб и оценка результатов. В указанное время или через указанные интервалы, или непрерывно осуществляют отбор проб по 1 мл указанного объема или объемов из области посредине между поверхностью среды растворения и верхней частью корзинки или лопасти на расстоянии не ближе 10 мм от стенки сосуда. Исключая те случаи, когда используются непрерывные измерения (отобранная жидкость при этом возвращается обратно в сосуд) или когда отбирается только одна порция жидкости, следует компенсировать отобранный объем жидкости прибавлением равного объема среды растворения или соответствующими изменениями в расчетах. Отобранную жидкость фильтруют, используя инертный фильтр с соответствующим размером пор, который не вызывает значительной адсорбции активного компонента из раствора и не содержит таких веществ, экстрагируемых средой растворения, которые влияли бы на результаты указанного аналитического метода. Анализ фильтрата проводят методом, указанным в частных статьях. Количество действующего вещества, растворившегося за указанное время, выражается в процентах от содержания, указанного в разделе «Состав». Для проведения данного испытания производители выпускают современное оборудование. Например, PharmaTest (Германия) производит более 20 видов установок для тестирования на растворение таблеток и капсул. На рис. 4.5 приведена семипозиционная модель PTWS ЗСЕ, которая содержит семь круглодонных сосудов с крышками, плексигласовую водяную баню с крышкой, электроподъемное 4.2. Растворение и его кинетика 115  Рис. 4.5. Установка для тестирования на растворение таблеток и капсул производства PharmaTest (Германия), модель PTWS ЗСЕ устройство, покрытые тефлоном лопастные мешалки и корзинки. В комплекте предусмотрен набор приспособлений для установки глубины и центрирования мешалок. Электронный контроллер скорости вращения мешалок позволяет регулировать частоту вращения от 20 до 250 об/мин. Встроенный термостат-циркуля-тор поддерживает температуру в диапазоне от 25 до 45 °С с точностью ±0,2 °С. Некоторые модели комщгект'у- с ются съемным термодатчиком с возможностью определения температуры в каждом из сосудов. В современных приборах для тестирования на растворимость предусмотрены удобные электронные или жидкокристаллические дисплеи для отражения заданной и текущей скорости перемешивания и температуры, времени тестирования, величины рН и т. п. Существуют полностью автоматические высокопроизводительные системы испытания на растворимость, позволяющие не останавливать эксперимент даже в ночное время и в выходные дни. В них автоматизированы заполнение сосудов средой для испытания, введение образцов, выбор cge-ды и измерения, а также мойка сосудов после проведения тестирования. Анализ концентрации может осуществляться с помощью подключенного спектрофотометра. Проточный метод. Недостатки корзиночного метода и метода с использованием лабораторного стакана подтолкнули исследователей на разработку проточного метода, при этом они стремились усовершенствовать циркуляцию при перемешивании, которая зависит от размеров и вида емкости, объема растворителя, положения и вида мешалки и т. д. Эти влияния трудно поддаются стандартизации, большой объем растворителя (почти 2000 мл), используемый в данных методах, не пригоден в условиях in vivo. Кроме того, во 116 Глава 4. Методыоценкираг.падаемости, растворенияивысвобожденияЛВ всех методах со стаканом концентрация лекарственного вещества растет от нуля до предела насыщения или до концентрации, соответствующей полному растворению. Этот рост концентрации не соответствует росту концентрации in vivo, поскольку в последнем случае растворенное и абсорбированное вещество выводится с места абсорбции. В проточном устройстве материал вкладывается в*тл> бу, расположенную вертикально, на сито, через которое проходит растворитель. Прохождением через сито образуется равномерно распределенное ламинарное течение. На определенной высоте колба перекрыта другим ситом, препятствующим прохождению растворенных частиц. Профильтрованная им жидкость пригодна для аналитического определения растворенного лекарственного вещества. Растворитель в устройстве движется перекачкой; при прохождении через теплообменник он нагревается до заданной температуры. Усовершенствованием течения растворителя можно имитировать условия прохождения растворенного лекарства через биологическую мембрану. В других устрой» ствах этого вида перемешивание обеспечивается потоком жидкости, создаваемым перистальтическим насосом. Образовавшийся поток является серией однонаправленных импульсов без перемешивания жидкости раствора, проходящей к колбе около образца. Колба имеет вид делительной воронки, способствующей тому, что скорость потока падает по мере увеличения расстояния от зоны перемешивания. Жидкость подается в ровной горизонтальной плоскости, и в колбе не образуется никаких мертвых точек, что экспериментально подтвердилось с помощью окрашенных растворов. При разработке проточных методов, помимо вертикальной колбы, использовалась и колба, ориентированная гюри1^ зонтально. Можно сказать, что у всех проточных методов много общего. Устройства имеют одинаковые основные части, такие как резервуар, насос, теплообменник, колбу (колонну), рукоять для таблетки, фильтровальную систему для определения растворенного вещества. Растворитель хранится в резервуаре и либо циркулирует в системе, либо проходит через нее. Движение раствори- 4.2. Растворениеиегокинетика ч fl7 ' теля осуществляется насосом: колебательным, пульсацион-ным или центробежным. Колба, как правило, цилиндрическая, расположенная вертикально или горизонтально. Горизонтально расположенные колбы не оправдали себя, поток растворителя в них не-ламинарен, и вокруг образца возникает турбуленция. При опыте с таблетками, содержащими краситель, обнаружилось, что в горизонтальной колбе раствор вещества удерживается на дне^ в верхних слоях практически находится один растворитель. Поток растворителя может быть восходящим или нисходящим. Нисходящий поток выгоден тем, что нет обратного притока под влиянием разделения плотности раствора и растворителя, но трудности возникают, когда опыт начинается. Преимущественнее метод с восходящим потоком. Течение жидкости должно быть ламинарным. Образованию этого типа течения способствуют вкладываемые в колбу шарики из стеклянной ваты или фильтр из спекшегося стекла, марля. Вкладывание образца является критическим моментом этих опытов. Таблетка не должна в процессе опыта менять свое положение, она должна оставаться в центре потока растворителя. Как правило, таблетка фиксируется в марле, стеклянной вате или стеклянными шариками. Стеклянные ша- с рики — это не самый удачный способ, поскольку они воздействуют на таблетку механически. Проточный метод с точки зрения последующего развития считается перспективным. В сравнении с методом вращающейся корзинки он имеет преимущество в менее интенсивном перемешивании, что приближает его к условиям in vivo. Проточный прибор (по ГФУ, рис. 4.6) включает в себя: резервуар 1 для среды растворения; насос 2, который прокачивает среду растворения вверх через проточную кювету; проточную кювету 3 (рис. 4.7) из прозрачного материала, установленную вертикально, которая состоит из фильтрующей системы, предотвращающей потерю нераст^орив-шихся частиц и водяной бани, поддерживающей постоянную температуру среды растворения 37,0±0,5 °С; емкость 4 для сбора анализируемой пробы. 118 Глава 4. Методы оценки распадаемости, растворения и высвобождения ЛВ 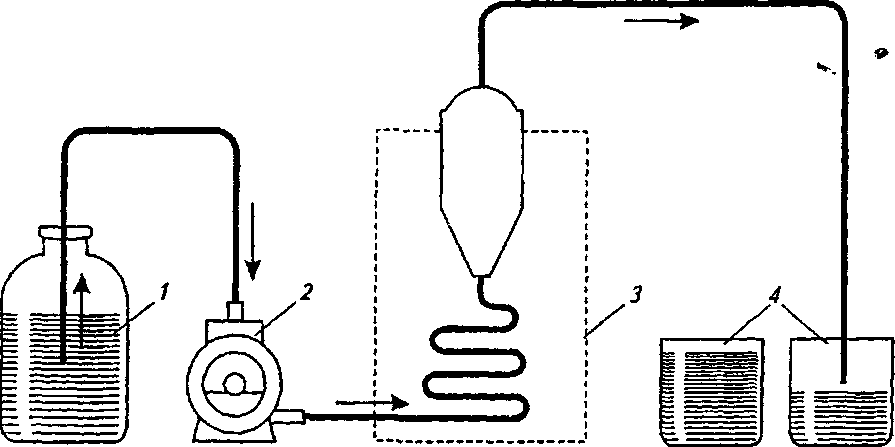 Рис. 4.6. Проточный прибор (по ГФУ) » Среда растворения (см. «Метод вращающейся корзинки»). 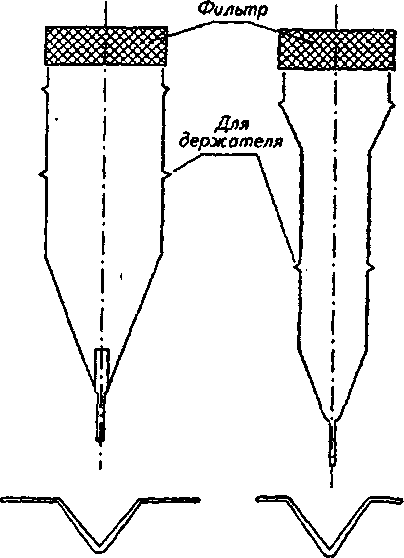 Методика (по ГФУ, с. 155). Чтобы предохранить вход в камеру, предназначенный для жидкости, на дно конуса помещают один шарик диаметром 5±0,5 мм, затем стеклянные шарики подходящего размера, предпочтительнее диаметром 1±0,1 мм. Посредством специального держателя помещают одну единицу исследуемого препарата в кювету на поверхность (или внутрь) полученного слоя стеклянных шариков. Собираю* фильтрующую головку. 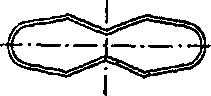 Рис. 4.7. Проточные кюветы по (ГФУ): а — ячейка 22,6 мм; б— ячейка 12,0 мм Нагревают среду растворения до температуры 37,0±0,5 °С. Используя подходящий насос, пропускают с указанной скоростью (±5 %) среду растворения через дно кюветы для получения подходящего непрерывного потока. Отбор проб и оценка результатов. Отбор проб всегда проводят у выходного отверстия кюветы независимо От того, открыта цепь или закрыта. Исключая те случаи, когда используют- 4.3. Прохождениелекарственныхвеществчерезмембраны 119 ся непрерывные измерения (отобранная жидкость при этом возвращается обратно в сосуд) или когда отбирается только одна порция жидкости, следует компенсировать отобранный объем жидкости прибавлением равного объема среды растворения или соответствующими изменениями в расчетах. Отобранную жидкость фильтруют, используя инертный (Зшльдар с с соответствующим размером пор, который не вызывает значительной адсорбции активного компонента из раствора и не содержит таких веществ, экстрагируемых средой растворения, которые влияли бы на результаты указанного аналитического метода. Анализ фильтрата проводят методом, указанным в АНД. Количество действующего вещества, растворившегося за указанное время, выражается в процентах от содержания, указанного в разделе «Состав». 4.3. ПРОХОЖДЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ЧЕРЕЗ МЕМБРАНЫ В то время как в однокамерных моделях исследуется скорость растворения твердого вещества в воде. ил% г в буферных растворах, имитирующих соки желудочно-кишечного тракта, при измерении прохождения лекарственных веществ в двух- и трехкамерных моделях определяется растворение вместе с переходом растворенного вещества в жировую среду (отношение равновесия и переноса), что соответствует прохождению лекарственного вещества через липоидный кишечный барьер или прохождению лекарственного вещества из водной среды пищеварительного тракта через кишечную мембрану в водную среду плазмы крови. С физической точки зрения суть данного метода заклю чается в определении распределительного коэффициента между водой и жировой средой и определении константы скорости проникания. ч Образование равновесия в системе двух несмешивающих-ся жидкостей зависит от скорости перемешивания, поверхности, вязкости растворителя, растворимости вещества в неводной фазе и от рН. Мембранные системы используются с целью получения систем, транспортировочные характеристики которых соотносились бы с пассивной абсорбцией в организме человека. Такие системы позволяют проводить исследование многих переменных, действующих в условиях in vivo, а также ис- & с 120 Глава 4. Методыоценкираспадаемости, растворенияивысвобожденияЛВ пользуются для оценки способности новых лекарственных веществ проходить через пищеварительные мембраны. Мембраны моделей для изучения проникания лекарственных веществ должны обладать следующими свойствами: а) мембрана должна быть тонкой, чтобы количество остав шихся в ней лекарственных веществ было минимальным; б) транспортировка лекарственного вещества через мем-. брану должна быть основана на растворимости лекарствен ного вещества в мембране (мембраны, в которых возможно прохождение через поры, не пригодны для данной це^ш)р с в) мембрана должна быть достаточно стойкой к механи ческим нагрузкам, чтобы во время эксперимента не нару шалась ее чувствительность; г) мембрана должна позволять доказывать корреляцию между скоростью проникания и абсорбцией in vivo. Мембраны моделей делятся на две группы: первую составляют мембраны биоэкспериментальных моделей, которые служат для биохимического и биофизического исследований роли и функции мембраны и сконструированы на молекулярном уровне; вторую группу составляют быст-ротранспорширобочные мембраны, которые служат для исследования транспортировки. Речь идет о проникании, при котором с одной стороны мембраны возникает сорбция, а с другой — десорбция лекарственного вещества. Искусственные липоидные мембраны можно получить тремя способами. Первый способ заключается в высушивании разбавленного раствора, содержащего липоид и соответствующий носитель. Стабильность образованной таким образом мембраны зависит от профильтрованного вещества (носителя), которым, как правило, могут быть коллодий, альгинаны или синтетические полимеры. Образовать этим способом мембрану, с одинаковой величиной пор нелегко, поскольку присутствует множество воздействующих факторов: состав исходного вещества и его концентрация, содержание воды в ислользуе- с мом веществе, качество и свойство поверхности, на которой образуется мембрана, температура и время сушки, влажность, способность набухания высушенной мембраны и др. Примером мембран этого типа служит мембрана, состоящая из этилцеллюлозы, жидкого парафина и биологическо- 4.3. Прохождениелекарственныхвеществчерезмембраны 121 го элемента (лецитина и холестерола), которая очень^хоро- с шо имитирует условия in vivo. Необходимой составной частью мембраны выступает лецитин, поскольку он является основным элементом биологических мембран. Своими гидрофильными группами лецитин воздействует на растворимость лекарственного вещества в мембране. Важно отметить, что растворимость лекарственного вещества в лецитине существенно отличается от растворимости в других липоидных веществах, например в жидком парафине, маслах, жирных кислотах и т. п. Второй способ состоит в пропитке (импрегнации) соответствующего носителя (ткани, пленки) липоидом. В качестве носителя использовалась льняная, шелковая ткань, цр- с лиамид, фильтровальная бумага, пленка из ацетилцеллюло-зы, полиэтилена, поливинилхлорида и тому подобное, в качестве пропиточных липоидных веществ — жидкий парафин, натуральные и синтетические фосфолипиды, растительные масла, жирные кислоты и их эфиры, изоамилаце-тат, диизопропиладипат, трибутилфосфат и др. При изготовлении этих мембран важно, чтобы в их состав входило пропиточное вещество, потому что поры самого носителя должны быть больше величины молекул проникающего вещества. Недостаток данного способа заключается в том, что для пропитки чаще всего применяются вещества, чуждые организму (жидкий парафин, растительные масла, трибутилфосфат). Известный пример таких мембран — мембраны с в ресорбционной модели фирмы Sartorius. Третьим способом является использование пленки, которая самостоятельно выполняет функцию липоидного барьера. Неполярной мембраной этого типа служит диме-тилполисиликон. Скорость проникания зависит от свойств диффузионного слоя на поверхности мембраны, от условия медленного перемешивания, которое соответствует медленному перемешиванию желудочного и кишечного содержимого. Существенное влияние диффузионного слоя на проникание частично опровергает теорию распределения вещества в зависимости от рН, поскольку в диффузионном слое движутся также ионизированная и неионизированная формы лекарственного вещества. 122 Глава 4. Методыоценкираспадаемости, растворенияивысвобожденияЛВ Методы и устройства (двух- и трехкамерные). Методы и устройства для определения высвобождения лекарственных веществ из лекарственных препаратов делятся на две группы. Первую образуют двух- и трехкамерные модели без твердой мембраны, вторую — устройства и методы, использующие одну из вышеописанных твердых мембран. Методы и устройства без твердой мембраны. Главный представитель двухкамерной модели — устройство, которое изготавливается под названием ресомат. Конструкция устройства основана на сведении, что абсорбция лекарственного вещества зависит от растворения в пищеварительных соках и от распределительного коэффициента данного вещества между липоидной и водной фазой. В двухкамерном устройстве вещество, растворенное в водной среде, приходит в соприкосновение с липоидной фазой. Благодаря перемешиванию растворенное веществр относительно быстро распределяется между водой и липоидной фазой. Содержание лекарственного вещества в липоидной фазе дискретно анализируется. Эта модель позволяет исследовать влияние вспомогательных веществ, структуры лекарственного препарата, рН, вязкости. К наиболее известным представителям трехкамерных моделей без твердой мембраны относится трубочка в форме перевернутой буквы эпсилон с водными фазами в обоих плечах и липоидной фазой, соединяющей обе фазы. Когда лекарственное вещество растворимо в одной из фаз, то при медленном перемешивании колебательным движением устройства лекарственное вещество распределяется во все три фазы. Процесс транспортировки лекарственного вещества можно определить количественно в любой из трех фаз. Методы и устройства с твердой мембраной. Ядром всех устройств, в которых используются твердые мембраны, являются проницаемые ячейки, которые должны обеспечивать, целостность мембраны, константную температуру, позволять осуществлять перемешивание и взятие пробы. Было описано и сконструировано множество проницаемых ячеек, которые достаточно отличаются друг от друга. Основными отличительными признаками можно назвать их величину и форму. 9 ч 4.3. Прохождениелекарственныхвеществчерезмембраны 123 Различаются три основных типа проницаемых ячеек. Относительно простой системой является горизонтальная, в которой мембрана расположена между двумя камерами. Верхняя камера бывает открыта или закрыта. Нижняя камера снабжена магнитными мешалками. Второй тип проницаемых ячеек имеет мембрану, укреп ленную на конце цилиндра, погруженного в емкость с боль шой вместимостью. v Третий тип проницаемых ячеек имеет вертикальную мембрану. Среди устройств этой группы наиболее известна так называемая ресорбционная модель фирмы Sartorius, изготовляемая в промышленных условиях. Растворение лекарственного вещества и абсорбция — это два взаимосвязанных шага, зависящих друг от друга в большей или меньшей степени и воздействующих друг на друга: с одной стороны, прибавляется количество абсорбированного вещества пропорционально количеству лекарственного вещества, находящегося в растворе; с другой стороны, растворение, особенно в труднорастворимых веществах, может зависеть, помимо прочего, от скорости транспортировки в биосреду. Оба процесса определяют скорость вторжения лекарственного вещества в биосреду, и только один из них носит решающий характер, что следует из соотношения скорости растворения и скорости абсорбции. В отличие от растворения, которое на основании комплексных зависимостей (например, переменных данных от формы применения) только изредка следует простым закономерностям. Диффузия растворенных веществ в пищеварительном тракте в большей или меньшей степени тормозится пищей. При полном голоде этот эмпирический фактор имеет величину, равную 1, после легкого завтрака — приблизительно 0,8, после обеда — около 0,3. Для упомянутого устройства фирмы Sartorius было подготовлено несколько видов мембран, причем в большинстве случаев мембранный фильтр из нитроцеллюлозы пропитывали лауриловым спиртом, ламиновым маслом, каприло-вой,- линоловой кислотой или смесью этих веществ в различных объемных соотношениях. Проникания через эти мембраны сравнивали с результатами, полученными в опы- 1  24 Глава 4. Методаоценкираспадаемости, растворенияивысвобожденияЛВ 24 Глава 4. Методаоценкираспадаемости, растворенияивысвобожденияЛВте in vivo. Наиболее приемлемых результатов добились с мембранным фильтром, пропитанным смесью кислоты каприловой с лауриловым спиртом. Для измерений были исцользованы две проницаемые ячейки. В первой из них водный раствор лекарственного вещества находится в одной камере, вторая камера заполнена искусственной плазмой. Во время опыта ячейка вращается вокруг оси лекарственного вещества в плоскости мембраны, что обеспечивается движением металлического диска, перемешивающего их содержание. В другой — обе водные фазы (раствор лекарственного с вещества и искусственная плазма) находятся в двух подогретых емкостях, содержимое которых перемешивается. С помощью насоса обе эти камеры попадают в проницаемую ячейку, и наступает проникание. Количество лекарственного вещества, прошедшего через мембрану, фиксируется через определенные промежутки времени. Упомянутые ячейки и мембраны использовались при конструировании ресорбционной модели Sartorius, которая служит для определения констант скорости лекарственных веществ. Полученные результаты находятся в корреляции с величинами, полученными in vivo. »с 4.4. ВЫСВОБОЖДЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ИЗ МЯГКИХ ЛЕКАРСТВЕННЫХ ФОРМ Оценка высвобождения лекарственных веществ из мягких лекарственных форм (МЛФ), например мазей, определяется способностью основы высвобождать лекарственные вещества. В настоящее время разработано и предложено много раз личных методов по определению высвобождения лекарствен ных веществ мазевыми основами. Все эти методы можно разделить: ч » сi на модельные опыты in vitro, основанные на физико- химических и микробиологических исследованиях; , биологические методы in vivo, проводимые на живых . j организмах или изолированных органах. 4.4. ВысвобождениелекарственныхвеществизМЛФ 125 Результаты биологических методов не всегда воспроизводимы, поэтому для сравнительных исследований применяют опыты in vitro. Для получения сравнимых результатов необходимо поддерживать постоянную температуру, одинаковый состав опытной среды, одинаковые концентрации лекарственного вещества, использовать образцы аналогичной величины с одинаковой степенью дисперсности суспендированного или эмульгированного вещества. 4.4.1. ФИЗИКО-ХИМИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ К этой группе методов следует отнести метод агаровых пластинок. Суть метода состоит в том, что небольшое количество испытуемой мази наносят на агаровый гель, содержащий реактив, который образует окрашенные соединения с лекарственным веществом. По мере диффузии лекарственного вещества из мази окрашенная зона геля увеличивается. Линейными размерами этой зоны и может быть измерена степень диффузии вещества из мази. Техника проведения метода упрощается при использовании красителя в качестве диффундирующего вещества. Если вещество способно флюоресцировать, то для его идентификации применяют аппарат для флюоресцентного анализа. В том случае, если действующие вещества обладают антисептическими или бактерицидными свойствами, прайме* няют микробиологический тест, который отличается от предыдущих методов способом идентификации. Определенное количество мази вносят в цилиндрическое отверстие, сделанное в агаре, содержащем стандартную культуру микроорганизма. Микроорганизмы на питательной среде не растут там, где для них образуется минимальное тормозящее или губительное действие диффундирующего из мази вещества. Таким образом, вокруг мази образуется зона торможения, которая отсутствует при применении неподходящей мазевой основы. Диаметр или ширина зоны торможения, характеризующая степень диффузии лекарственного вещества из мазевой основы, измеряется через 24 или 48 ч инкубации чашек Петри с агаром в термостате (ЗЪ°С). 1  26 Глава 4. Meтoдbloцшкиpacпaдаe^юcти,pac^Бopeнияивыcвoбo)кдeнияЛB 26 Глава 4. Meтoдbloцшкиpacпaдаe^юcти,pac^Бopeнияивыcвoбo)кдeнияЛBВремя измерения зон зависит от скорости диффузии вещества. Наиболее часто используются методы прямой диффузии, когда мазевая основа находится в непосредственном контакте со средой (раствором, гелем и др.)» в которую дол- с жно диффундировать лекарственное вещество. При применении хроматографического метода необходима фильтровальная бумага, увлажненная раствором индикатора. Мазь помещается в центре фильтровальной бумаги в небольшом цилиндре, открытом с обоих концов. Скорость диффузии определяется путем измерения расстояния от наружного края мази до наружного края окрашенной зоны на фильтровальной бумаге. Сравнительно широко распространенным тестом для определения высвобождения лекарственных веществ из мазей является метод диффузии через мембрану, когда изучаемая мазь отделяется от диффузионной среды какой- с либо полупроницаемой мембраной. В качестве мембраны используют различный материал (наиболее часто — целлофан). Толщина целлофановой пленки оказывает незначительное влияние на диффузию, а материал не вступает во взаимодействие с лекарственными веществами. Процесс исследования заключается в том, что определенное количество мази помещается в камеру для диализа, которая погружается в физиологический раствор. Исследование проводится при температуре 37 °С. Диффундированное лекарственное вещество определяют обычными химическими или физико-химическими методами. Чтобы приблизить условия опыта к условиям намазывания мази на кожу, использовали устройство, в котором в процессе определения диффузии веществ предусматривается перемешивание мази. Для приближения опыта к биологическим условиям применялись мембраны животного происхождения (например яичная оболочка, слепая кишка ягненка, брюшина рогатого скота, кожа с затылка кролика и другие) и соответствующая среда. В процессе разработки методик с микробиологической детекцией было предложено множество вариантов усовершенствований, которые можно объединить в три типа в со- 9 С 4.4. ВысвобождениелекарственныхвеществизМЛФ 127 ответствии с тем, как вносится образец в культуру микроба, находящегося в питательной среде. Часто используемым методом является метод, при котором на полотне с культурой микроба (обычно пептоновый агар) делается небольшое круглое отверстие и заполняется пробой мази. Важно, чтобы образец находился в тесном контакте с питательной средой на всей поверхности отверстия, что надежнее достигается нанесением подогретого образца в полутвердом состоянии. При сравнении результатов надо следить за тем, чтобы высота питательной среды в чашке Петри была одинаковой, среда имела всегда одинаковый рН и не наблюдалось разницы в содержании других веществ,, внесенных в питательную среду. Другой возможностью усовершенствования опытов мо жет быть размещение образца мази в металлическом (алю миниевом) цилиндре на питательной среде. ч Третья возможность — это нанесение образца на бумагу (диск в диаметре до 1 см), которая кладется на твердую питательную среду. 4.4.2. МЕТОДЫ С ХИМИЧЕСКОЙ (ФИЗИКО-ХИМИЧЕСКОЙ) ДЕТЕКЦИЕЙ При этих методах для оценки высвобождения лекарственного вещества можно наблюдать или диффузию в жировой среде, или диффузию в водной среде в форме гидрогеля, или проникание в жидкую среду. Диффузия в жировой среде (без перехода через полу$ проницаемую мембрану) может исследоваться следующим образом: образец мази наносится на площадь, обозначенную на фильтровальной бумаге, которая кладется на раствор, представляющий рецепторную фазу. Закрытая чашка оставляется на 4 ч в термостате при температуре 25 °С. Степень диффузии вещества определяется количественно в рецеп-торной фазе. Другая разновидность этого же метода такова: образец наносится на фильтровальную бумагу, помещается на дно чашки Петри, заливается, например, вазелином и оставляется на 12 ч при температуре 30 °С. В вазелине определяется количество высвобожденного лекарства. Аналогичный под- 9 ч 128 Глава 4. Методыоценкираспадаемости, растворенияивысвобожденияЛВ ход существует и для веществ гидрофильного характера. В этом случае образец заливается водой. Если речь идет о гидрофобной мази, то ее можно исследовать прямой диффузией: мазь в растопленном виде наносится на водную рецелторную фазу. Диффузия в водной среде. Техника диффузии в среде в форме гидрогеля аналогична технике опытов с микробиологической индикацией на полотнах питательной среды. Гидрогель выбирается по консистенции, преимущество отдается желатиновым гидрогелям, а не агаровым. Нужно следить, чтобы образец мази имел очень тесный контакт с гелем, поскольку фазовая реакция должна быть выразительной, а граница цветовой зоны — четкой. Недостатком этих методов является тот факт, что измерение диаметра окрашенной зоны сопряжено с довольно большой экспериментальной погрешностью. Воспроизводимость результатов зависит от способа подготовки геля и полотна, от химического состава показателя детекции, от постоянства окраски образующегося соединения, продолжительности выдержки и температуры. Рецепторная фаза может быть водной (вода, физиологический раствор, раствор Рингера, буферные растворы) или    ь."_шм^- в. Рис. 4.8. Устройство для исследования проникания лекарственного вещества из мази в жидкую среду: А — трубочка с образцом мази; В — рецепторная фаза; С — целлофан. Опыт проводится при температуре 37 °С. Рецепторная фаза — раствор Рингера, мазь содержит красящее вещество, например метиленовый синий Рис. 4.9. Устройство для исследования проникания лекарственного вещества из мази в жидкую среду: А — камера, заполненная образцом мази; В — рецепторная фаза; С — целлофан. Камера может быть снабжена мешалкой 9 ч 4.5. ВысвобождениелекарственныхвеществизРЛФ 129 безводной. Лекарственное вещество, которое в нее переходит, определяется химическими или физико-химическими, а в настоящее время, как правило, спектральными методами. Приспособления для этих опытов просты. Наиболее распространенные из них схемы представлены на рис. 4.8 и 4.9. 4.5. ВЫСВОБОЖДЕНИЕ ч * ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ИЗ РЕКТАЛЬНЫХ ЛЕКАРСТВЕННЫХ ФОРМ Оценка высвобождения лекарственных веществ из ректальных лекарственных форм (РЛФ) определяется способностью основы высвобождать лекарственные вещества. Существуют два основных подхода к определению высвобождения: инструментальный (in vitro) и биологический (in vivo). Для сравнительных исследований применяют опыты in vitro, которые базируются на физико-химических и микробиологических методах. Широко применяется метод агаровых пластинок, кото^ рый отличается от такового для мазей способом нанесения суппозиторной массы на агаровый гель. Для лучшего контакта с рецепторной фазой суппозитории необходимо расплавить. Степени диффузии лекарственного вещества оценивают линейными замерами окрашенной зоны. Если действующие вещества обладают антисептическими или бактерицидными свойствами, применяют микробиологический тест. Также применимыми для суппозиториев являются методы прямой диффузии, диффузии через мембрану и хро-матографический метод (см. подраздел 4.4). Фармакопея бывшего СССР (изд. XI) предлагает метод Крувчинского — метод равновесного диализа через полупроницаемую мембрану из природных или синтетических^ ма» териалов. Фармако-технологические исследования, принятые Государственной фармакопеей Украины, приближены к требованиям фармакопеи США, Германии, Европейского Союза, Японии. Они регламентируют для суппозиториев проведение испытаний на распадаемость и растворимость. 130 Глава 4. Методыоценкираспадаемости, растворенияивысвобожденияЛВ Испытание на распадаемость позволяет определить, размягчаются или распадаются ректальные или вагинальные суппозитории в течение установленного времени, если они помещены в жидкую среду в экспериментальных условиях, указанных ниже. Считается, что образцы распались, если: а) наблюдается полное растворение; б) компоненты суппозитория разделились — расплавлен ные жировые вещества собрались на поверхности жидко сти, нерастворимые частицы осели на дно, а растворимые компоненты растворились; в) размягчение образца сопровождается заметной сме ной формы, без полного разделения компонентов или отсут ствием у суппозитория твердого ядра, оказывающего сопро тивление давлению стеклянной палочки. Прибор (ГФУ, ст. 2.9.2, с. 152) (рис. 4.10) состоит из прозрачного стеклянного или пластмассового пустого цилиндра 1 с соответствующей толщиной стенок. Внутри цилиндра с помощью трех зажимов 2 закреплено металлическое приспособление, которое представляет собой два перфорированных диска 3 из нержавеющего металла, закрепленных на расстоянии приблизительно 30 мм друг от друга. Диаметр дисков почти равняется внутреннему диаметру цилиндра, и в каждом диске имеется 39 отверстий диаметром 4 мм. Испытания проводят, используя три таких приспособления, каждое из которых содержит отдельный образец4^. Каждое приспособление помещают в резервуар 6 с тер-морегулирующим устройством объемом не менее 4 л, заполненный водой 7 с температурой от 36 до 37 °С, если нет других указаний в частной статье, и прикрывают стеклянной крышкой 4. Резервуар снабжен свободно вращающейся мешалкой и механизмом, который поддерживает его в вертикальном положении не менее чем на 90 мм ниже поверхности воды и дает возможность переворачивать его на 180°, не вынимая из воды. Три приспособления можно также поместить одновременно в один резервуар вместимостью 12 л. Методика. Испытывают три суппозитория. Каждый о§раз£ц помещают на нижний диск приспособления, устанавливают при- 4.5. Высвобождение лекарственных веществ из РЛФ 131 способление в цилиндр прибора и закрепляют его. Прибор опускают в резервуар с водой и начинают испытание. Прибор переворачивают каждые 10 мин. После окончания времени, указанного в общей или отдельной статье, исследуют образцы. Препарат выдерживает испытание, если все образцы распались.  Рис. 4.10. Прибор для определения распадаемости суппозиториев и пессариев (по ГФУ) Различные модели приборов для определения распадаемости и растворимости суппозиториев выпускаются производителями аналитического оборудования. Например, приборы фирмы PharmaTest (Германия), модель PTS ЗЕ и PTS WO представлены на рис. 4.11. Прибор проверки распадаемости свечей PTS ЗЕ позволяет проводить тестирование трех образцов. Время тестирования может быть установлено от 1 мин до 10 ч, при этом точка распадаемости фиксируется вручную. Во время работы контейнер поворачивается на 180°. Прибор имеет съемные баню и держатель. 132 |
