биофапмация. БИОФАРМАЦИЯ УЧЕБНИК (1). Учебник для студентов фармацевтических вузов и факультетов Под редакцией академика
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
V. 5,4. Офтальмологическиелекарственныеформы 203 По сравнению с традиционными офтальмологическими препаратами растворимые, нерастворимые и биорастворимые глазные вставки («inserts») обладают лучшей биодоступностью благодаря увеличению времени контакта препарата с поверхностью глаза, а также возможности обеспечения пролонгированного высвобождения лекарства. На растворимость биополимерных пленок значительное влияние оказывают механические и температурные факторы. Так, например, скорость растворения глазных лекарственных пленок с фенольным гидрофильным препаратом прополиса увеличивается в 2 раза при использовании указанных факторов (табл. 5.5). Таблица 5.5 Растворимость глазных лекарственных пленок с фенольным гидрофильным препаратом прополиса (А. И. Тихонов, 1983)
Максимальное высвобождение фенольного гидрофильного препарата прополиса наблюдается из пленок, приготовленных на основе биополимера растворимого, по сравнению с ПВП и NaKMIJ (рис. 5.10). Высвобождение лекарств из диффузионных «inserts» контролируется слезной жидкостью, проникающей через мембрану, и способствует достижению необходимого внут реннего давления, что позволяет управлять высвобождени ем лекарства из резервуара. ч Скорость высвобождения лекарства из диффузионных систем характеризуется тремя периодами. Начальная скорость высвобождения обычно высокая, что соответствует достижению состояния равновесия между резервуаром и поверхностью глаза. Затем скорость уменьшается до некоторого постоянного значения, что соответствует равномерной »с 210 Глава 5. Биофармация—теоретическаяосноватехнологиилекарств 5.6. УШНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА Ушные лекарственные средства представляют собой жидкие, мягкие или твердые лекарственные формы, предназначенные для закапывания, распыления, вдувания или прикладывания к слуховому каналу и для промывок при его очистке. К ним относятся ушные капли и аэрозоли, ушные промывки, ушные мази, ушные тампоны, порошки с для вдувания или сухие аэрозоли. Как известно, ухо подразделяют на наружное, среднее и внутреннее. Наружное ухо состоит из ушной раковины и наружного слухового канала. Местное применение ушных препаратов на неповрежденное ухо охватывает лишь наружный слуховой канал, и только при перфорировании барабанной перепонки возможно их проникание в полость среднего уха. Лекарства, применяемые для лечения ушных заболева ний, имеют локальное действие. Поскольку концентрация лекарственного вещества, а также используемые его коли чества невелики, то воздействие на систему можно исклю чить полностью. v * г Эпителий наружного уха в меньшей степени, чем эпителий носа, подвержен раздражению, поэтому к ушным препаратам не предъявляется требование соответствия физиологическим показателям организма. Препараты, вводимые в среднее ухо, должны отвечать требованиям стерильности и изотоничности. Если такие препараты применяются для лечения травмированного или прооперированного уха, они также не должны содержать консервантов и должны быть помещены в одноразовую упаковку. Стерильные ушные препараты готовят, используя материалы и методы, предназначенные для обеспечения стерильности, предотвращения внесения контаминации и роста микроорганнз- с мо в. Ушные препараты должны оказывать необходимое терапевтическое действие, быть нетоксичными и не проявлять чрезмерного раздражающего эффекта. При некоторых заболеваниях гиперосмотический эффект является частью терапии. Он достигается как растворителями (спиртом, гли- 5.6. Ушныелекарственныесредства 211 церином, пропиленгликолем), так и другими вспомогатель- . ными веществами, входящими в состав ушных препаратов, которые с точки зрения биофармации оказывают существенное влияние на высвобождение и фармакокинетику л^екар- с ственных веществ. Все эти вещества не должны ухудшать фармакологическое действие препарата и должны обеспечивать его стабильность при хранении. Некоторые ушные препараты применяют в теплом виде, вследствие этого они должны быть термостабильными. К ушным препаратам, помещенным в многоразовую упаковку, добавляют антимикробный консервант в необходимой концентрации. Если действующие вещества сами обладают антимикробным действием, усиливающимся в некоторых случаях гиперосмотическим эффектом, то дополнительное введение консервантов нецелесообразно. Водно-спиртовые и водно-гликолевьге (смеси из спирта, пропиленгликоля, глицерина, воды), а также спиртовые и гликолевые растворы очень часто используют для улучшения растворимости действующих веществ. Эти растворы проявляют подсушивающий эффект, в отдельных случаях оказывая смягчающее действие. Растворители и их смеси в данных составах могут также применяться для повышения стабильности некоторых веществ. Ушные суспензии и эмульсии готовят с применением методов и оборудования, аналогичных при производстве всех суспензий и эмульсий, и к ним предъявляются те же требования: при взбалтывании суспензий и эмульсий в результате нарушения агрега-тивной устойчивости должно восстанавливаться равномерное распределение частиц по всему объему и обеспечивать- с ся требуемое дозирование при применении. Масляные растворы для отологии малоактуальны из-за отсутствия осмотического эффекта. Ушные мази предназначены для аппликации на наружный слуховой канал. Технология их получения не отличается от дерматологических мазей. Для достижения желаемого осмотического эффекта, такого, как в каплях, при приготовлении мазей часто применяют современные этиленгликоле-вые основы. Для интенсификации терапии и продления действия лекарств широко используют тампоны, пропитанные раство- фС 212 Глава 5. Биофармация—теоретическаяосноватехнологиилекарств i рами или мазями. Менее болезненны для восприимчивого j к боли эпителия ушные порошки для вдувания или сухие аэрозоли. При вдувании они проникают достаточно глубо ко,, достигая барабанной перепонки, а при ее перфорирова нии — среднего уха. Мелко измельченное вещество хорошо прилипает и обеспечивает быстрое терапевтическое действие. Таким образом, в ушных лекарственных формах на биодос тупность лекарственных веществ оказывают влияние те же • фармацевтические факторы (растворимость, вспомогатель ные вещества, технологический процесс и тому подобное), что и в других лекарственных формах. ч * r | 5.7. ЛЕКАРСТВЕННЫЕ СРЕДСТВА | НА ОСНОВЕ НАНОЧАСТИЦ Успехи в фармакологии в значительной степени связаны с новыми лекарственными формами и химическими технологиями их получения. В связи с этим необходимо отметить особую актуальность биофармацевтических исследований по созданию лекарств нового поколения. Лекарства нового поколения принято называть терапев тическими системами. От традиционных лекарственных форм они отличаются пролонгированным действием* кон- ] тролируемым высвобождением действующих веществ и их целевым транспортом к мишени. | Проникание действующего вещества в классических • лекарственных формах обеспечивается через эндотелиаль-ные ткани, а лекарств нового поколения — на уровне лизо-сомального транспорта. Общая характеристика, классификация и технология данных лекарственных форм приведены в учебниках под редакцией профессоров И. М. Перцева и И. А. Зупанца (1999), . В. И. Чуешова (1999), А. И. Тихонова (2002), а также в научной литературе. В данной главе с биофармацевтической точки зрения с, рассматриваются лекарственные средства на основе нано- ' частиц. Они предназначены для направленного транспорта . лекарственных веществ и являются представителями чет- j вертого поколения лекарств. 5.7. Лекарственныесредстванаосновенаночастиц 213 Наночастицы получают полимеризацией мицелл. В наиболее общей схеме их получения имеет место солюбилизация биологически активного вещества, при которой оно включается в мицеллы. При определенных условиях (температура, рН среды, скорость перемешивания) солюбилизи£юван-ный раствор взаимодействует с раствором полимеризующе- с го агента. Процесс полимеризации индуцируют с помощью у-лучей, УФ-облучения. Размеры частиц полученного легкого порошка составляют от 10 до 1000 нм, удельная поверхность — 10 м2/г. Наночастицы, диспергированные в воде, могут давать прозрачные или опалесцирующие растворы, вводимые парентерально. Различные лекарственные вещества включаются в частицы в процессе полимеризации или адсорбируются на осажденных частицах, причем адсорбция представляет собой наиболее распространенный механизм . связывания. Скорость высвобождения лекарственных веществ из наночастиц тесно связана со скоростью разрушения этих частиц и в некоторой степени может контролирв- с ваться выбором мономера. В зависимости от агрегатного состояния и морфологических особенностей выделяют такие наночастицы: нанокрис-таллы, нанокапсулы, наносферы и полимерные мицеллы. Нанокапсулы — липосомы (контейнеры для доставки лекарственных средств) нетоксичны, при определенных условиях могут поглощаться клетками. Мембрана липосомы может сливаться с клеточной мембраной, что приводит к внутриклеточной доставке их содержимого (рис. 5.11). Липосомы могут использоваться для транспортировки как гидрофильных, так и гидрофобных лекарственных веществ. В зависимости от липидного состава, поверхностного заряда и размеров изменяются физико-химические нсвои- с ства липосом и их биофармацевтические характеристики — такие, как скорость клиренса с участка инъекции и из плазмы крови, доставка к органу-мишени. Липосомы различного липидного состава включают в себя разное количество лекарственного вещества. Степень включения лекарственных веществ в липосомы зависит от строения, размеров, заряда, липидного состава липосом, а также от физико-химических свойств самих лекарственных веществ. Попав в организм, липосомы под воз- е 214 Глава 5. Биофармация — теоретическая основа технологии лекарств 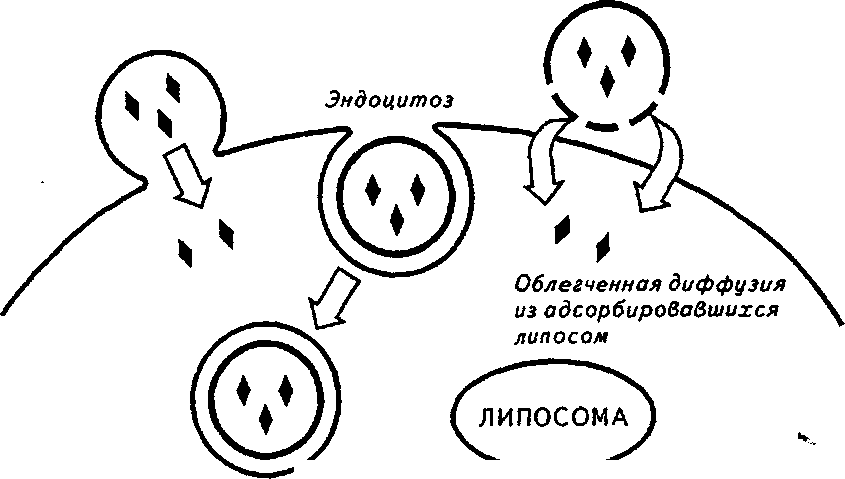 Слияние  Ъ Я Рис. 5.11. Способы проникания содержимого липосом в клетку действием различных систем разрушаются, высвобождая содержимое. В связи с этим возможность использования липосом в качестве носителей лекарств в значительной степени определяется быстротой разрушения липосом в организме. На терапевтическую активность липосом как средства доставки лекарственного вещества большое влияние оказывают ее размер, строение липидного слоя и соотношение лекарственное вещество — липид. От размеров липосом и продолжительности их обработки ультразвуком зависят концентрация лекарственных веществ, включенных в них, и их распределение в организме. Вещество, заключенное в липосомы, защищено от воздействия ферментов, что увеличивает эффективность препаратов, подверженных биодеструкции в биологических жидкостях. В Государственной академии тонкой химический технологии им. М. В. Ломоносова (Москва) разрабатывается липосомальная форма антипаркинсонического препарата — 5.7. Лекарственныесредстванаосновенаночастиц 215 ДОФА. При использовании традиционных лекарственных форм ДОФА на 80 % декарбоксилируется в кровотоке, что снижает его эффективность и приводит к серьезным побочным явлениям. В липосомах же ДОФА не доступен для, ферментативной деструкции. Преимуществом наночастиц как лекарственной формы является постепенное высвобождение лекарственного веще- с ства, инкорпорированного в них, что увеличивает время его действия. Этот эффект наблюдался у препаратов ДОФА, инулина, цефазолина. Степень же фармакологического действия лекарственных веществ зависит от химического состава липосом. Одно из важных свойств липосом (как и других наночастиц) — соотношение размеров наночастиц и диаметра пор капилляров — стало основой для создания эффективных антираковых препаратов. Так как размер наночастиц больше диаметра пор капилляров, их объем распределения ограничивается областью введения. Например, при внутривенном введении они не выходят за пределы кровотока, то есть плохо проникают с в органы и ткани. В результате резко понижается токсическое действие субстанции, ассоциированной с наночастица-ми. Это свойство послужило основой для направленной доставки химиотерапевтических препаратов в опухоли и очаги воспаления. Так как капилляры, снабжающие эти области кровью, как правило, сильно перфорированы, то наночастицы будут накапливаться в опухоли. Данное явление получило название — пассивное нацеливание. Таким образом, существуют две причины, вследствие которых липосомальные. препараты антиканцерогенных субстанций очень эффективны: уменьшение токсичности и пассивное нацеливание. Доказано, что липосомальные препараты обладают бодее fпролонгированным действием, они менее токсичны, чем растворы, так как в меньшей степени накапливаются в органах, тогда как в крови их концентрация выше. Липосомы в незначительном количестве проникают в миокард и скелетные мышцы, вероятно, вследствие особенностей строения эндотелия этих органов. Они не поступают в систему органов выделения и поэтому не подвергаются гломерулярной фильтрации. 216 Глава 5. Биофармация—теоретическаяосноватехнологиилекарств ■ Использование липосом позволяет изменять фармако-кинетику включенных в них веществ — скорость удаления с из зоны введения и из крови, распределение и перераспределение в органах и тканях, эффективность доставки к определенным тканям и органам. Уменьшение токсичности в случае использования липо-сомальных препаратов дает возможность повысить дозу без заметных токсических эффектов. В результате получают качественно новые результаты при лечении липосомальны-ми препаратами. В настоящее время на мировом фармацевтическом рынке появилось несколько липосомальных противораковых препаратов — таких, как антрациклины: дауномицин и доксорубицин, а также винкристин, аннами-цин и третиноин. Доказана лучшая доступность мозга для липосомальных препаратов ДОФА и цитостатиков. Уменьшением объема распределения и, следовательно, увеличением концентрации ДОФА в кровотоке объясняется существенное увеличение проникания его через гематоэнцефалический барьер. Но липосомы, как и другие наночастицы, довольно быстро захватываются ретикулоэндотелиальной системой (РЭС). Это происходит вследствие взаимодействия липосом с белками плазмы — опсонинами (в основном компонентами комплемента). Опсонины «метят» лекарственные средства и де- . лают их мишенями для клеток РЭС. С увеличением времени их циркуляции еще больше повышается эффективность липосомальных препаратов. Было предложено модифици- fровать их поверхность полимерами с гибкой гидрофильной цепью, например полиэтиленгликолем (ПЭГ). Для этого используются специальные модифицированные липиды, например фосфатидилэтаноламин (ФЭА), конъюгированный с ПЭГ. Очень эффективны липосомы для препаратов, мишенью которых являются клетки РЭС, так как именно эти клетки интенсивно поглощают наночастицы. Такая ситуация скла дывается при внутриклеточной микробной инфекции и при у вакцинации. Доказано, что доставка амфотерцина В непо средственно в зараженные клетки приводит к прекрасным результатам при системных грибковых инфекциях, висце ральном лейшманиозе. С этой целью применяют такие пре параты, как AmBiosome, ABLC, Amphocil. ч. * с » с 5.7. Лекарственныесредстванаосновенаночастиц 217 В случае использования липосомальных вакцин иммунный ответ усиливается вследствие того, что антигены, ассоциированные с липосомами, попадают непосредственно в антигенпредставляющие клетки. Кроме антигена (вирусный капсид), в липосому включают белки, способствующие слиянию мембран липосом и клеток, например гемагглюти- . нин вируса гриппа. Для таких препаратов часто применяют термин «виросомы». Использование липосом дает возможность констр^ирв- с вать поливалентные вакцины: например, против нескольких штаммов гриппа (сингапурский, пекинский и Йамага-та), гепатита А и В, дифтерии, столбняка. В Швейцарии одобрено несколько таких вакцин. Еще одной областью применения липосом становится генная терапия, при которой важна адресная доставка в нужный тип клеток. Липосомы в данном случае не только защищают генетический материал от нуклеаз, но и выступают как инициаторы эндоцитоза. Известно, что основным процессом механизма действия виросом является слияние ее мембраны с мембраной эндосомы, происходящее под действием гемагглютинина. При этом содержимое липосомы попадает в цитозоль, то есть избегает липосомальных ферментов. Именно этот путь считается предпочтительным для липосом, нагруженных генетическим материалом. В качестве «молекулярного адреса» наиболее часто выбирают иммуноглобулины, имеющие соответствующие мишени на целевых клетках. Таким образом, постепенно складывается модель «иде- v альной» липосомы как средства направленной доставки лекарственного вещества в клетку. Использование липосом для органо- и органеллоизбирательной или преимуществен- . ной доставки лекарственных веществ и субстратов клеточного обмена может в значительной степени изменить фар-макокинетику и эффективность терапевтического действия, с Липосомы хмогут быть весьма полезны для солюбилиза-ции веществ, плохо растворимых как в воде, так и в масле, например таксола, кислоты бетулиновой. Основной недостаток липосом как лекарственной формы — относительно небольшая стабильность при хранении. Такого недостатка лишены полимерные наночастицы, име- 218 Глава 5. Биофармация — теоретическая основа технологии лекарств ю  щие практически те же области возможного применения. Но в отличие от липосом полимерные наночастицы состоят из менее безопасного материала, чем фосфолипиды. Этим в основном сдерживается их продвижение в качестве Лекарственной формы. щие практически те же области возможного применения. Но в отличие от липосом полимерные наночастицы состоят из менее безопасного материала, чем фосфолипиды. Этим в основном сдерживается их продвижение в качестве Лекарственной формы.В последнее время получают распостранение нанокрис-таллы. Такая форма очень полезна для увеличения биодоступности плохо растворимых лекарств. Биодоступность такого рода субстанций возрастает в несколько раз при переходе от обычных порошков к нанокристаллам (наносуспензиям). Очень перспективным представляется использование в виде нанокристаллов рентгеноконтрастных веществ. Например, при коронарографии изображение сосудов сердца сохраняется не более нескольких десятков секунд. Затем вслед- Заключение лекарственных и вспомогательных веществ в оболочку или гранулу для защиты от преждевременного всасывания v. Инкапсулирование белков,вакцин и других средств в липосомы, при I расположении их между двумя фосфолипидными слоями системы Связывание субстанции с моноклинальными антителами, получаемыми методами генной инженерии Использование интраназальной системы доставки путем введения белков в кровяное русло через слизистую оболочку носа Введение в организм предшественников лекарственных веществ, спосрбных превращаться в биологически активные субстанции под действием ферментов Использование биодеградируемых систем доставки, состоящих 9 из комплекса лекарственных и полимерных вспомогательных веществ, способных к биодеградации с заданной скоростью Применение трансдермальных систем доставки, действие которых основано на всасывании лекарственных веществ через кожу Включение лекарственных веществ в природные и синтетические эритроциты Разработка электротранспортных и оральных осмотических систем доставки лекарственных веществ Рис. 5.12. Основные пути технологических исследований по разработке терапевтических систем направленного действия 9 ч с 5.7. Лекарственныесредстванаосновенаночастиц ч 2l9 c ствие выхода вещества из сосудистого русла картина быстро теряет контрастность. Введение же нанокристалличе- . ских рентгеноконтрастных веществ позволяет наблюдать сосудистую систему в течение нескольких десятков минут. Более широко данная проблема освещена в отечественной и зарубежной научной литературе. Сегодня биофармацевтические исследования по созданию лекарственных препаратов перешли на качественно другой уровень — уровень конструирования целенаправленных систем доставки лекарственного вещества к органу-мишени. Основные пути технологических исследовании почразра-ботке терапевтических систем направленного действия представлены на рис. 5.12. Таким образом, анализ вышеизложенного позволяет определить биофармацию как экспериментально-теоретическую базу для разработки лекарственных препаратов оптимального состава. Учитывая физико-химические свойства вспомогательных веществ, используя специальные технологические приемы, можно корректировать скорость и степень процессов всасывания лекарственного вещества, скорость его распределения в тканях и выведения, добиваться пролонгации действия, регулировать в заданном направлении биодоступность препарата. Все это дает возможность начосн»ве с одной и той же субстанции создавать более эффективные и менее токсичные лекарственные формы. Приложение 1 ЗАТВЕРДЖЕНО наказом МОЗ Украши в1д 16 серпня 1996 р. № 259 ЗАРЕ6СТРОВАНО в MiHicTepcTBi юстици Украши* 31 жовтня 1996 р. за № 640/1665 ПОРЯДОК проведения докш'шчного вивчення лшарських засоб|'в, вимоги до умов проведения окремих дослщжень Порядок проведения доклш1чного вивчення лшарських засоб1в, вимоги до умов проведения окремих досл1джень розроблеш в1дпов!дно до статт1 6 Закону Украши «Про лшарсьш заеоби». 1. ЗАГАЛЫП ПОЛОЖЕНИЯ Доклш1чне вивчення лшарських засоб1в передбачае xiMi4Hi, ф1зичш, бюлопчш, мшробюлопчш, фармаколопчш, токсиколопчт та iHBii науков1 досл1дження з метою вивчення i'x специф1чно1 активное™ та без-печност1. Доклхшчне вивчення лшарських засоб1в передбачае здшснення х1м1чних, ф1зичних, бюлопчних, мшробюлопчних, фармаколопчних, ток-сиколопчних та шших наукових досл1джень з метою встановлення спе-циф1чно1 та загально!' фармаколопчно1 активности а також нешшдли-вост1 для оргашзму дшчих речовин та готових лшарських препарат1в. Доклш1чне вивчення е нев1д'емною частиною процесу створення лшарського засобу. Встановлет за результатами доклш1чного вивчення характеристики специф1чно'1 фармаколопчно!" активност1 та нешк1дли-вост1 шд час застосування та щодо його можливих в1ддалених насл1дк1в е принциповими факторами, якх визначають можлив1сть передач! лшарського засобу до промислового випуску та дощльшсть його медичного застосування. Регламентуюч! та контрольш функци щодо порядку оргашзацп та проведения, а також визначення необхщних обсяпв доклш1чного вявчен-ня лшарських засоб1в виконуе Фармаколопчний ком1тет МОЗ Украши. Доюпшчне вивчення лшарських засоб1в проводиться спещал1зо-ваними досл1дними базами (установами, оргашзацдями та шдприемства-ми), перелш яких визначаеться на шдстав1 сертифшацц з урахуванням норм, що застосовуються в м1жнароднш практищ. Сертифшащю баз доклШчного вивчення лшарських засоб1в та контроль за i'x д1яльшстю з метою сприяння додержанню вимог до пла-нування та проведения досл1джень, порядку реестрацп одержаних результатов здШснюе Фармаколопчний комитет МОЗ Украши через Центр доклШчного вивчення лшарських засоб1в i в1дпов1дт експертт групи. Контроль матер1ал1в (зв1ту) доклш1чного вивчення лшарського засобу щодо додержання методичних вимог, необх1дних обсяпв та досто- ПорядокпроведениядоклУчноговивченняллорськихзасобв 221 BipHOCTi здШснюеться спещал1зованими експертними ком^ями^Фарма-колопчного ком1тету МОЗ Украши. У випадках проведения докл1н1чно-го вивчення лжарських засобав на несертифшованих досладних базах або за умови виконання докл1н1чних дослщжень спещал1зованими установа-ми 1нших Kpai'H, як1 не сертифжоваю за стандартами GLP одержат ре-' зультати тдлягають контролю з боку Центру доклш1чного вивчення лшарських засоб1в Фармаколопчного комггету МОЗ Украши щодо ix в1дпов1дност1 встановленим вимогам. 1.7. Докл1шчне вивчення лшарських засоб1в може виконуватися на догов1рних засадах. Авторсыи, майнов1 й немайнов1 права, пов'язаш з доюитчним вивченням лжарських засоб1в, регулюються в1дпов1дно до законодавства. 2. ПОРЯДОК ДОКЛ1Н1ЧНИХ ДОСЛЩЖЕНЬ ЛШАРСЬКИХ ЗАСОБ1В9 ч.. 2.1. Порядок доклтчних дослщжень визначаеться в1дпов1дно до рубрикаци лЬсарських засоб1в у наступних трупах: I. Л1карськ1 засоби з нових фармаколопчних субстанщй. II. В1дом1 лшарськ1 засоби з новим шляхом введения. В1дом1 лшарсьш засоби з принципово новими шдходами до дозу-вання. Шкарськх засоби 3i змшеною технолопею одержання в!домих фармаколопчних субстанщй без змши типу та складу лжарсько! форми. V. Л1карськ1 засоби на ochobI ресинтезованих фармаколопчних суб станщй (за вЦомою технолопею). VI. Л1карськ1 засоби комбшоваш, яю вмпцують дв1 та б1лыне в1дом1 фармакологачш субстанци. VII. Лшарсыи засоби комбшоваш, як\ поряд з в1домими вм1щують нов! фармаколопчш речовини. VIII. JliKapcbKi засоби 3i змшою в склад! допом1жних фармацевтцч- них речовин на основ1 вщомих фармаколопчних субстанщй у ЫдомШ лжарсьшй форм!. IX. JliKapcbKi засоби, рекомендован! за новими показаниями без змши типу, складу лшарсько!" форми та режиму вживання. X. JliKapcbKi засоби, зареестрован! в колишньому СРСР до 01.12.91 р., НТД на aKi розроблет в Украшь XL JliKapcbKi засоби, виготовлеш за в1тчизняною технолопею з вико-ристанням !мпортних фармаколопчних субстанц!й i (чи) !мпортних фар-мацевтичних речовин, вцшовэдт лжарсью форми яких зареестрован! в УкраМ чи в колишньому СРСР. JliKapcbKi засоби, як1 виготовлеш за лщензШною технолопею з використанням фармаколопчних i фармацевтичних субстанщй, лжар-ськ! форми яких вщпов!дають зареестрованим в Укра"!ш чи в колишньому СРСР. Гомеопатичт лшарсыа засоби. JliKapcbKi засоби, виготовлеш за новою технолопею з використанням iMnopTHoi" таблетмаси, грануляту, в1дпов1дш лжарсьш форми яких зареестрован! в Укралтчи в колишньому СРСР. 222 Приложение 1 XV. JliKapcbKi засоби, виготовлеш за новою технолопею з викорис- танням 1мпортних фармаколопчних субстанщй i (чи) 1мпортних фарма- цевтичних речовин, в1дпов1дш л1карськ1 форми яких зареестроваш в Украла чи в колишньому СРСР. XVI. JliKapcbKi засоби, виготовлеш з "in bulk" (фасування готово* лшарсько!' форми), що зареестроваш у форм1 "in bulk". 2.2. Обсяг доклШ1чних дослщжень, яш необх1дно провести для подан-ня матер1ал1в до Фармаколопчного комдату МОЗ Украши з метою подальше* експертизи, визначаеться зпдно i3 зазначеними I—XVI трупами лжарських засоб1в i e однаковим для в1тчизняних i заруб1жних "Зпкар-ських 3aco6iB (досл!дження проводяться за необхэдшстю). 2.2.1. JliKapcbKi засоби з нових фармаколопчних субстанций: Нештдливмть Гостра токсичшсть на трьох видах тварин; Шдгостра токсичшсть; 3.. Хрон1чна токсичшсть; Шсцевоподразнювальна та (чи) ульцерогенна ддя; Можлива кумулятивна д1я; Можлив1 алергенш властивоста; Токсична д1я на 1мунну систему; Тератогеншсть; ембрюлетальшсть; фетотоксичшсть; гонадоток-сичшсть; Можлив1 мутагенш властивост^ Можлива канцерогенна flin; Лжарська залежшсть: при необхщноеп; обов'язково - для^рин-ципово нових л1карських засоб1в; 12. Л1кування отруень при передозуванш в експерименть ФармакологЬчна активтсть Специф1чна актившсть за юлькома критер1ями; Загальна фармакология. Фармакоктетика 2:2.2. В1дом1 лшарськ1 засоби з новим шляхом введения: НешкгдливЬстъ Гостра токсичшсть на одному вид1 тварин; Шдгостра токсичшсть; М1сцевоподразнювальна та (чи) ульцерогенна д1я. Фармакологгчна активШсть 1. Специф1чна актившсть за шлькома критер1ями. Фармакоктетика 2.2.3. В1дом1 лжарсьш засоби з принципово новими шдходами дв дозування: НештдливЬсть Гостра токсичн1сть на трьох видах тварин; Шдгостра токсичшсть; Хрошчна токсичшсть; Мкцевоподразнювальна та (чи) ульцерогенна д1я; Можлива кумулятивна д\я\ Можлив1 алергенш властивоси; Токсична д1я на 1мунну систему; Порядокпроведениядошн)чноговивченнялкарськихзасоб'ю 223 Тератогеншсть; ембрюлетальтсть; фетотоксичшсть; гонадоток-сичшсть; ф Можлив1 мутагент властивост1; ч 10. .Шкарська залежшсть. ФармокологЬта актившсть Специф1чна актившсть за юлькома критер!ями; Загальна фармаколопя. Фармакокшетика Динамша всмоктування та виведення; Бюдоступшсть. 2.2.4. Л1карськ1 засоби 3i змшеною технолопею одержання в1домих фармаколопчних субстанщи без змши типу та складу лшарсько! форми: Нештдливгсть Гостра токсичшсть на одному вид1 тварин при введенш. препарату в лшарськш форм!; Шдгостра токсичшсть; М1сцевоподразнювальна та (чи) ульцерогенна Д1я; 4. Можлив1 алергенш властивость ч • Фармакологьчна актившсть 1. Специф1чна актившсть. Фармакокшетика 2.2.5. Л1карськ1 засоби на основ1 ресинтезованих фармаколопчних субстанщи (за в1домою технолопею): НешкЬдливЬсть Гостра токсичшсть на одному вид1 тварин при введенш препарату в лжарськш форм1 в пор1внянш з л1карською формою на ochobI оригинально! субстанцп; Шдгостра токсичшсть; М1сцевоподразнювальна та (чи) ульцерогенна д1я; 4. Можлив1 алергенш властивост1. Фармаколог1чка актившсть 1. Специф1чна актившсть. Фармакокшетика 2.2.6. Л1карськ1 засоби комбшоваш, hkiвмщують дв1 та больше «адом! фармаколопчш субстанцп': Нештдливьстъ Гостра токсичшсть на трьох видах тварин; Шдгостра токсичшсть; Хрошчна токсичшсть; М1сцевоподразнювальна та (чи) ульцерогенна ддя; 5: Можлива кумулятивна ддя; Можлив1 алергенш властивост1; Токсична Д1я на 1мунну систему; Тератогеншсть; ембрюлетальтсть; фетотоксичшсть; гонадоток-сичшсть; Можлив1 мутагент властивоеп; 10. Л1карська залежтсть: при необх1дность Фармакологьчна актившсть Специф1чна актившсть за тлькома критер1ями; Загальна фармаколопя. ч 9 | |||||||||||||||||
