Практикум Люта. В. Л. Люта о. В. Кононов в а. Люта о. В. Кононов
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
6. Вивчення морфологічних і тинкторіальних властивостей мікобактерій туберкульозу у мікропрспаратах Завдання 9. Розгляньте під мікроскопом препарати, виготовлені з мокротиння і пофарбовані за Цілем—Нільсеном. Зверніть увагу на форму клітин, їх відносний розмір, взаємне розміщення, а також на інші елементи, що виявляються у полі зору (лейкоцити, еластичні волокна, клітини миготливого епітелію, інші бактерії). 7. Ознайомлення з препаратами для профілактики і лікування повітряно-краплинних бактеріальних інфекцій Завдання 10. Ознайомтеся з препаратами для профілактики і лікування дифтерії, коклюшу і туберкульозу. Уважно прочитайте інструкції до вакцин АКДП, БЦЖ, АДП, АД, продивіться ампули з вакцинами, прочитайте, що зазначено на етикетці, зверніть увагу на цілість ампул, фізичні властивості препарату (колір, агрегатний стан). Визначте, чи придатний препарат для використання. Визначте за календарем профілактичних щеплень терміни вакцинації і ревакцинації вакцинами АКДП, БЦЖ. Ознайомтеся з інструкцією до протидифтерійної сироватки, принципом її використання. Прочитайте інструкції до лікарських препаратів, зверніть увагу на їх форму випуску. Визначте придатність їх до використання. Контрольні запитання
Тести 1. Під пас профілактичного обстеження на дифтерію матеріал підбирають із: а) задньої стінки глотки; б) носоглотки та носа; в) ротоглотки та носа; г) методом "кашльових пластипок". 2. Середовище для первинного посіву на дифтерію: а) КТА; б) КВА; в) сироватковий агар; г) середовище Левенгатейна—Ієнсена. 3. Матеріал, що містить В. pertussis, транспортують за темпе- ратури: а) 4—37 °С; б) 37—40 "С; в) 2—25 °С; г) 25—40 °С. 4. Середовище для первинного посіву на коклюш: а) КТА; б) КВА; в) сироватковий агар; г) середовище Левенштейна—Ієнсена. 5. Ріст колоній В. pertussis з'являється через: а) Ідобу; б) 1—2 доби; в) 3-7 діб; г) 3—6 міс. 6. Для профілактики туберкульозу використовують препарат: а) АКДП; б) туберкулін; в) БЦЖ; г) ЖБВ. Ситуаційні задачі 1. Особа була проімупізована проти дифтерії згідно з календарем щеплень за віком. Чи підлягає вона позаплановій ревакцинації в разі виникнення спалаху інфекції?
Домашнє завдання Підготуйтесь до практичного заняття 12. Рекомендації щодо самопідготовки до практичного заняття 12
Практичне заняття 12 ЛАБОРАТОРНА ДІАГНОСТИКА ХВОРОБ, СПРИЧИНЕНИХ ОБЛІГАТНИМИ АНАЕРОБАМИ Мета заняття:
Оснащення: анаеростат, ексикатор, культура анаеробів у напіврідкому середовищі у трубках Віньяля—Вейона, на середовищах МПА, КА у чашках Петрі, на середовищах Вільсона—Блера і Кітта—Тароцці, мікропрепарати промислового виробництва, мікроскопи, імерсійне масло, препарати для специфічної профілактики і лікування. План
Хід заняття 1. Ознайомлення з правилами взяття матеріалу для дослідження з метою виявлення анаеробів. Оформлення супровідної документації Завдання 1. Ознайомтеся з правилами взяття матеріалу для дослідження з метою виявлення анаеробів. Оформіть супровідну документацію. Мікробіологічні дослідження при всіх захворюваннях, спричинених клостридіями і бактероїдами, проводять у двох напрямах: виділення із патологічного матеріалу збудника і виявлення у патологічному матеріалі токсину. Для виявлення збудника патологічний матеріал висівають на поживні середовища, виділяють чисту культуру й ідентифікують її. Наявність токсину в патологічному матеріалі виявляють у біопробі, тип токсину визначають у реакції нейтралізації на білих мишах. При ранових анаеробних інфекціях досліджують такий матеріал: кірочки, виділення з рани або тканина рубця, тканини, що були видалені під час хірургічного оброблення рани, сторонні тіла (кулі, колючки, обривки одягу тощо), кров хворого. У жінок, хворих на правець унаслідок пологів або абортів, па аналіз відбирають виділення з матки, у новонароджених — виділення з пупка. І рунт досліджують з метою визначення його забрудненості анаеробами та їх токсинами. Матеріал із рани відбирають до початку оброблення її антисептиками й антибіотиками. Виділення з рани і рідину з набряку відбирають стерильним ватним тампоном або стерильною піпеткою. Шматочки тканин беруть за можливості з глибоких ділянок рани, карманів, роздавлених тканин. Одночасно з різних ділянок рани роблять мазки, які відправляють до лабораторії разом із відібраним матеріалом. Кров відбирають із вени стерильним шприцом у стерильну пробірку до введення антитоксичної сироватки з метою виявлення в ній токсину (слід враховувати, що токсин у крові хворого на правець виявляється тільки в продромальний період; в інкубаційний період та період розпалу інфекції токсин у крові не виявляється). Основними правилами під час взяття і транспортування патологічного матеріалу є оберігання відібраного зразка від контакту з атмосферним повітрям. Тому матеріал краще відбирати і транспортувати у шприцах, мазки — у спеціальних контейнерах. Після взяття матеріалу заповнюють направлення. Матеріал транспортують в анаеробних умовах. 2. Ознайомлення з методами культивування анаеробів Завдання 2. Вивчіть методи культивування облігатних анаеробів. Особливість облігатних анаеробів полягає в тому, що вони можуть існувати і розмножуватися за умов майже повної відсутності кисню (хоча серед них також є мікроорганізми, що більше і менше чутливі до кисню). Для їх культивування потрібно створити умови, за яких молекулярний кисень видаляється з поживного середовища і навколишнього простору, де перебуває культура облігатних анаеробів. Залежно від способу видалення кисню розрізняють такі методи їх культивування: фізичні, хімічний і біологічний. Фізичні методи Грунтуються на механічному видаленні або запобіганні проникненню кисню в поживне середовище або в навколишній простір. 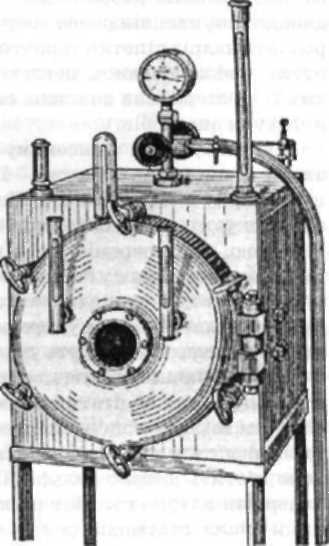 Вирощування в аиаерос- таті. Анаеростати бувають стаціонарні і портативні. Анаеростат — це товстостін- ний металевий апарат пря- мокутної або циліндричної форми з дверцятами або кришкою, які герметично закриваються (мал. 8). Ат- мосферний тиск у робочій камері апарату вимірюється вакуумметром, шкала яко- го розрахована від "0" (що означає нормальний атмос- ферний тиск — 1 атм) до "-1" (що означає повний вакуум). Видалення повітря прово- дять через кран, який потім щільно закривають. Посуд з посівом (частіше чашки Пе- трі) вміщують у робочу ка- меру апарата, апарат щільно закривають, повітря з каме- ри видаляють за допомогою Мал. 8. Анаеростат вакуум-насоса. Культивують мікроорганізми у вакуумі або в атмосфері газу, що не містить кисню. В останньому випадку у робочу камеру анаеростата подають азот, суміш азоту і вуглекислого газу, водень, пропан з бутаном. Стаціонарний анаерос-тат підключають до електромережі, а портативний ставлять у термостат. Анаероби ростуть повільно, тому анаеростат відкривають через 4—5 діб. Метод Віньяля—Всйона. У пробірку з розплавленим і охолодженим до 43—45 "С напіврідким агаром піпеткою вносять досліджуваний матеріал і добре перемішують. Потім агаром з посівом заповнюють стерильну пастерівську пінетку, яка з одного кінця щільно закрита ватною пробкою. Піпетку заповнюють до кінця, не допускаючи попадання повітря. Нижній кінець піпетки запаюють у полум'ї спиртівки. Засіяні піпетки вміщують у велику пробірку, на дні якої накладена вата, або загортають у щільний папір і поміщають у термостат. Колонії мікроорганізмів добре видно через скло. Вони мають вигляд двояковипуклої лінзи або жмутика вати. Після культивування роблять надріз піпетки терпугом поряд з колонією, ламають піпетку, зафламбованою петлею відбирають колонію і пересівають її на стерильне поживне середовище для виділення чистої культури анаеробів. Культивування у високому стовпчику агару. Щільне середовище (наприклад, Вільсона—Блера) наливають у велику хімічну пробірку на 2/3 її висоти. Перед посівом його розплавляють і охолоджують до температури 43—45 °С. Швидко роблять посів піпеткою, добре перемішують (прокручують пробірку між долонями рук) і ставлять у банку з холодною водою, щоб не відбулося насичення середовища киснем з повітря. Після ущільнення агару пробірки поміщають у термостат для культивування мікроорганізмів. Анаероби ростуть у нижній частині середовища. Застосування поживного середовища Вільсона—Блера для культивування облігатних анаеробів ґрунтується на тому, що воно має щільну консистенцію, наливається високим стовпчиком, містить у собі глюкозу (редукуюча речовина). Крім того, воно містить натрію сульфіт і заліза хлорид(ІІ). Під впливом анаеробів натрію сульфіт відновлюється до натрію сульфіду, який після взаємодії із заліза хлоридом(П) утворює заліза сульфід — речовину чорного кольору. Тому анаероби у середовищі Вільсона—Блера утворюють колонії чорного кольору. Метод Перетца. Посівний матеріал наносять бактеріологічною петлею чи пастерівською піпеткою на середовище МПЛ в чашку Петрі, рівномірно розсівають шпателем. На поверхню посіву кладуть зафламбоване стерильне предметне скло так, щоб під склом не залишилося кульок повітря. Чашки Петрі ставлять у термостат донизу дном. Анаероби виростають під склом, поряд зі склом ростуть аероби. Враховують ті колонії, які ростуть під склом па відстані, не ближчій ніж 0,5 см від краю скла. Під час культивування облігатних анаеробів у рідких поживних середовищах спочатку проводять їх регенерацію (кип'ятять середовища на водяній бані 20—ЗО хв для видалення повітря). Потім середовище різко охолоджують і роблять посів (регенеровані середовища мають бути використані протягом 20—30 хв, в іншому разі їх повторно регенерують). Після посіву середовище заливають стерильним вазеліновим маслом шаром 1—1,5 см. До таких поживних середовищ належить середовище Кітта—Тароцці. На ньому анаероби утворюють дифузний ріст, унаслідок чого воно мутніє. Хімічний метод ґрунтується на видаленні кисню хімічними речовинами. Для поглинання кисню з навколишнього простору використовують метод Арістовського. На дно ексикатора поміщають хімічні речовини, які легко поглинають кисень із повітря (натрію гідросульфіт або багатоатомний фенол — пірга-лол). У розширену частину ексикатора поміщають чашки Петрі з посівами і щільпо закривають кришкою. Ексикатор ставлять в термостат. Для поглинання кисню з поживного середовища до нього додають редукційні речовини: глюкозу, тіогліколеву кислоту, аскорбінову кислоту, натрію гідрокарбонат, натрію гідросульфіт, натрію форміат тощо, а також шматочки варених паренхіматозних органів тварин (печінки, серця), для адсорбції кисню використовують кульки вати, пемзу. Біологічний метод ґрунтується на культивуванні анаеробів і аеробів в одному середовищі. До нього належить метод Форт-нера. Поживне середовище МПА з кров'ю (агар Цейсслера) наливають у чашку Петрі. Зафламбованим скальпелем вирізають по діаметру чашки вузеньку смужку агару (завширшки 1—1,5 см) і видаляють її з чашки. На одну половину середовища засівають аероби (кишкову паличку), па інші — досліджуваний матеріал. Чашку закривають і заклеюють клейкою стрічкою, лейкошіастиром або пластиліном. Чашки поміщають у термостат догори дном. Аероби ростуть швидко і поглинають кисень, створюючи умови для росту анаеробів. Па кров'яному агарі визначають гемолітичні властивості анаеробів. Усі ці дослідження проводять у спеціалізованих анаеробних лабораторіях. 3. Визначення клостридій і бактеріоїдів у мікропренаратах Завдання 3. Розгляньте під мікроскопом мікропрепара-ти, виготовлені з культури клостридій і бактеріоїдів. Зверніть увагу па відносний розмір бактерій, їх взаємне розміщення, наявність спори, її розташування в клітині, форму бактеріальної клітини із спорою (діаметр спори більший за діаметр бактеріальної клітини чи ні), наявність капсули, колір бактеріальних клітин (залежно від методу фарбування). 4. Вивчення імунологічпих препаратів, які використовують для профілактики і лікування захворювань, спричинених анаеробами Завдання 4. Вивчіть імунологічні препарати, які використовують для профілактики і лікування захворювань, спричинених анаеробами. Розгляньте препарати: вакцини АКДП, АДП, протиправцевий, протигангренозний і протиботулінічний анатоксини, протиправцеву, протиботулінічну, протигангренозну сироватки, прочитайте інструкції, визначте придатність препаратів до використання, зверніть увагу, з якою метою використовують ці препарати. Контрольні запитання
Які с способи створення анаеробних умов для культивування бактерій? Які поживні середовища використовують для культивування апаеробів? Яких правил слід дотримуватися підчас посіву матеріалу, що містить анаеробні бактерії? Який вигляд мають клостридії під мікроскопом? Який матеріал відбирають і якими методами досліджують за підозри на правець? Який матеріал відбирають і якими методами досліджують за підозри на ботулізм? Який матеріал відбирають і якими методами досліджують за підозри на газову гангрену? За якими ознаками ідентифікують культуру клостридій? Який метод використовують для виявлення і визначення типу токсину? Тести 1. Причиною нервово-м'язової патології при правці с: а) руйнування нейронів; б) руйнування м'язових клітин; в) блокування передачі нервового імпульсу. 2. Спорогенні палички, у яких діаметр спори більший за діа- метр палички: а) клостридії; б) бацили; в) бактероїди; г) фузобактерії. 3. Зараження тварин екстрактом з уражених тканин — це: а) біопроба; б) реакція нейтралізації. 4. Перший симптом правця у немовляти: а) неспроможність ссати; б) судоми мімічних м'язів; в) судоми м'язів тулуба; г) всі відповіді правильні. 5. Зараження дорослих ботулізмом відбувається під час спо- живання продуктів, у яких містяться: а) спори збудника ботулізму; б) екзотоксин збудника ботулізму. |
