Билет 1 Предмет, задачи и методы патофизиологии. Ее место и значение в системе медицинских наук. Связь патофизиологии с другими науками
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Задача К врачу обратился больной И., 47 лет, с жалобами на мучительный кашель с отделяемой слизистой мокротой, одышку, боль в правом легком, субфебрильную температуру. В анамнезе: курит ежедневно (по 2 пачки), в последние полгода значительно похудел. При осмотре: больной пониженного питания. При рентгенологическом исследовании – небольшое затемнение правого легочного поля. Бронхоскопия позволила выявить опухоль бронха, гистологическое исследование показало наличие атипических клеток. Больному поставлен диагноз: бронхогенный рак легкого. Вопросы: 1. Какие причины, вызывающие опухоли, Вам известны? 2. Какова последовательность развития опухолевого процесса? 3. Механизмы онкогенеза. 4. Каковы особенности обмена веществ в опухоли? 5. Чем обусловлена раковая кахексия? Задача Химические канцерогены, канцерогенные вирусы, ионизирующее излучение, ультрафиолет Стадийность опухолевого процесса. Предполагается, что опухоль развивается из единичной клетки, которая в процессе роста опухоли проходит ряд стадий. На I стадии (стадия инициации) под влиянием канцерогенных факторов из одной нормальной исходной клетки в результате стойкого необратимого нарушения генетического материала образуется одна трансформированная клетка. Этот процесс называется опухолевой трансформацией. Канцерогены взаимодействуют с локусами ДНК, содержащими гены, которые регулируют пролиферацию (протоонкогены и антионкогены). Происходит экспрессия протоонкогенов, преобразующихся в онкогены, и инактивация антионкогенов. Вследствие этого клетка становится иммортализованной и потенциально способной к неограниченному делению, но для этого требуется ряд дополнительных условий. На II стадии (стадия промоции, или активации) происходит активация транформированной клетки под влиянием промотора и последующее превращение ее в активную, пролиферирующую опухолевую клетку. Промоторы - это вещества, которые не являются канцерогенами, не повреждают ДНК, но их воздействие стимулирует пролиферацию уже имеющихся трансформированных клеток. Главное в промоции - стимуляция клеточного деления, вследствие чего создается критическая масса инициированных клеток. К промоторам относятся фенол, скипидар, карболовый эфир и др. На III стадии (стадия прогрессии опухоли) идет естественный отбор сильнейших клонов - клональная селекция. В основе онкогенеза лежат изменения особых генов: протоонкогенов и/или антионкогенов. Протоонкогены - специфические гены нормальных клеток, которые осуществляют позитивный контроль процессов пролиферации и мембранного транспорта. Под влиянием мутаций протоонкогены претерпевают так называемую активацию, что способствует их превращению в онкогены, экспрессия которых вызывает возникновение и прогрессию опухолей. Выделяют несколько механизмов трансформации протоонкогена в онкоген: 1) инсерционная активация - активация протоонкогена клетки при включении в ее геном вирусного промотора; 2) амплификация - в результате умножения (копирования) числа одинаковых протоонкогенов, которые, как и в первом случае, приводят к усилению синтеза онкобелков (так называемый эффект дозы), при этом могут появляться добавочные участки хромосомы; 3) активация протоонкогена при транслокации участка хромосомы в другое место той же или другой хромосомы; 4) точечная мутация протоонкогена, приводящая к синтезу онкобелков, которые нарушают регуляцию клеточного деления. Биохимическая анаплазия - это особенности обмена веществ в опухолевых клетках. В опухоли постоянно обнаруживается 10-30-кратное усиление анаэробного гликолиза. В опухолевой ткани в отличие от нормальной кислород и тканевое дыхание не ослабляют гликолиз (отрицательный эффект Пастера). Усиление гликолиза и ослабление тканевого дыхания прогрессивно нарастают по мере увеличения степени злокачественности опухоли. Кроме того, в опухолевой ткани усилен пентозомонофосфатный шунт и использование в нем глюкозы, что приводит к повышенному образованию рибозы и НАДФ2Н, которые необходимы для синтеза нуклеиновых кислот и размножения клеток. Вследствие атипизма энергетического и углеводного обмена потребность опухоли в глюкозе резко увеличивается, и опухоль становится «ловушкой» глюкозы. Механизм кахексии. Опухоль - «ловушка глюкозы» . Поэтому компенсаторно усиливается продукция контринсулярных гормонов. Это приводит к усиленному распаду гликогена в печени и в мышцах, к распаду белков и жиров в тканях и органах организма для усиления процессов глюконеогенеза. Все это обеспечивает сохранение нормогликемии в течение достаточно длительного времени. Указанная компенсация так называемого «гипогликемического давления опухоли на организм» Билет № 25 Диабетические комы, их виды, механизмы обменных и функциональных нарушений. Основные звенья патогенеза атеросклероза, их механизмы. Укажите нарушение кислотно-основного состояния: рН 7,47, рСО2 60 мм.рт.ст., SB 33 ммоль/л. Диабетическая кома. Критическая дегидратация тканей организма с поражением функций головного мозга ведет к развитию диабетической (гипергликемической) комы. Кома развивается при достижении концентрации глюкозы в крови от 19,4 до 33,3 ммоль/л и более. Различают следующие виды диабетической комы: 1. Гипергликемическая кетоацидотическая кома. Развивается чаще всего у больных СД 1 типа вследствие гипергликемии, гиперкетонемии и метаболического ацидоза. Глюкоза и кетоновые тела выводятся с мочой (глюкозурия и кетонурия), что способствует увеличению осмотического давления в первичной моче, потере ионов Na и сопровождается полиурией. При этом возникает обезвоживание, которое ведет к недостаточности периферического кровообращения и гипоксии тканей. Ацидоз вызывает дыхание Куссмауля, при котором теряется СО2 и как следствие усугубляются нарушения водно-электролитного баланса, кислотно-щелочного равновесия, возникает резкое нарушение метаболизма и функций клеток ЦНС, что приводит к расстройству высшей нервной деятельности. 2. Гипергликемическая гиперосмолярная кома. Развивается у больных СД 2 типа старше 50 лет при дополнительном воздействии обезвоживающих факторов (рвота, понос, ограничение приема жидкости..). Основными звеньями патогенеза этого вида комы являются дегидратация организма и развитие гиперосмолярности плазмы, нарастает уровень глюкозы в крови до крайне высокой степени, что способствует усилению диуреза (глюкозурический осмотический диурез). Возникающее обезвоживание приводит к гиповолемии, стимуляции секреции альдостерона и задержке ионов Na и Cl. Показатель осмолярности плазмы повышается в 1,5-2 раза, что приводит к резко выраженной внутриклеточной дегидратации, нарушению водного и электролитного равновесия в клетках мозга, гипоксии ЦНС с выраженной неврологической симптоматикой и потере сознания. 3. Гипергликемическая кома с лактат-ацидозом (лактацидотическая). Это относительно редкое, но опасное осложнение СД. В механизме ее развития важную роль играют следующие факторы: а) снижение превращения пирувата в ацетил-КоА. Пируват превращается в молочную кислоту; б) применение лекарственных препаратов, стимулирующих анаэробный гликолиз и тем самым повышающих содержание лактата и пирувата в организме; в) гипоксическое состояние, вызванное физическим переутомлением, сердечной или дыхательной недостаточностью. Наиболее популярной точкой зрения относительно патогенеза атеросклероза остается признание ключевой роли холестерина и атерогенных липопротеинов. ЛПНП и ЛПОНП осуществляют транспорт холестерина в клетки, участвуя в формировании атеросклеротических бляшек, поэтому их называют атерогенными. ЛПВП способны транспортировать холестерин из клеток эндотелия сосудов в печень, содействуя регрессии бляшек, в связи с чем их называют антиатерогенными. Эти различия в свойствах липопротеинов определяются их химическим составом. Так, в структуре ЛПНП находится основное (около 2/3) количество холестерина плазмы, в ЛПОНП - только 1/3 циркулирующего холестерина, а в ЛПВП - лишь следовые его количества. Кроме того, атерогенность липопротеинов во многом зависит от содержания в их структуре триацилглицеролов (они в основном содержатся в ЛПОНП), а также апопротеинов и фосфолипидов (последних очень много в составе ЛПВП). Транспорт холестерина из плазмы в сосудистую стенку осуществляется, главным образом, в виде ЛПНП, более половины которых попадает внутрь клеток эндотелия при помощи мембранных рецепторов, остальные - нерецепторным путем. Установлено, что указанные рецепторы взаимодействуют с апопротеинами, расположенными на поверхности ЛПНП. Когда активность рецепторов ЛПНП снижается, концентрация ЛПНП в плазме возрастает, а вероятность формирования атеросклеротических бляшек увеличивается. В отличие от липопротеинов низкой и очень низкой плотности ЛПВП выполняют в организме антиатерогенную функцию. Согласно транспортной гипотезе В.Н. Титова, они осуществляют обратный транспорт холестерина из сосудов, органов и тканей, переводя его в другие липопротеины или транспортируя прямо в печень, с последующим выведением с желчью в кишечник. В организме холестерин окисляется только в клетках печени. Следовательно, если содержание ЛПВП увеличивается, то одновременно усиливается окисление холестерина. Таким образом, чем больше в крови ЛПВП и холестерина в их составе, тем меньше вероятность развития атеросклероза и выше вероятность регресса атеросклеротических бляшек. Таким образом, ключевое значение в патогенезе атеросклероза играет дислипопротеинемия. Метаболический (негазовый) алкалоз. Задача Больной П., 37 лет, доставлен в клинику с выраженными болями в верхней половине живота опоясывающего характера, мучительной, неукратимой рвотой. Больной беспокоен. При осмотре кожа и слизистые оболочки бледные с цианотичным оттенком. Черты лица заострены. Живот вздут. Температура тела 37,2оС. Пульс 140 уд в мин. АД – 90/50 мм.рт.ст. В анализе крови: лейкоциты – 10/109/л. В крови и моче повышено содержание диастазы. Больному поставлен диагноз: Острый панкреатит. Вопросы: 1. Острый панкреатит. Причины, механизмы, проявления. 2. Какие алиментарные факторы вызывают развитие острого панкреатита? 3. С чем связано повышение диастазы в крови и моче? 4. Объясните механизм развития гипотензии у больных острым панкреатитом. 5. Какие осложнения острого панкреатита? Задача Причины острого панкреатита: желчекаменная болезнь, прием алкоголя. Механизмы: теория самопереваривание железы, теория «общего канала», обструкция панкреатического протока и гиперсекреция. Проявления: синдром «острого живота», нарушение полостного пищеварения, всасывания в полости тонкой кишки, стеаторея, полифекалия, гипокальциемия, гипомагниемия, креаторея, диспепсия, диарея, прогрессирующая потеря массы тела. Прием алкоголя. С воспалением в тканях поджелудочной железы, нарушение углеводного обмена. Поджелудочный сок вызывает снижение тонуса сосудов. Летальный исход, переход в хроническую форму. Билет № 26 Отеки, определение. Причины. Классификация. Механизмы развития. Роль тромбоцитов в нарушениях свертывания. Тромбоцитопении, тромбоцитопатии. Какое нарушение сердечного ритма представлено на электрокардиограмме? 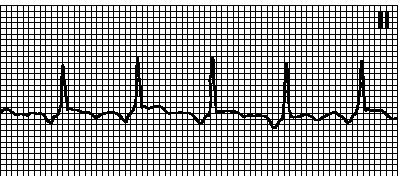 Отеком называется патологическое скопление жидкости в тканях и межтканевых пространствах вследствие нарушения обмена воды между кровью и тканями. Отек - типовой патологический процесс, встречающийся при многих заболеваниях. Отеки различаются: по распространенности: местный и общий (генерализованный); по скорости развития: молниеносные (развиваются в течение нескольких секунд, например, после укуса насекомых, змей), острые (развиваются в течение часа, например, при острой сердечной недостаточности отек легких), хронические (в течение нескольких суток, недель, например, при голодании); по патогенезу: гидростатические (застойные), онкотические, мембраногенные, лимфатические (лимфогенные), осмотические; по этиологии: сердечные, почечные (нефротические и нефритические), печеночные, токсические, нейрогенные, аллергические, воспалительные, кахектические, голодные. В развитии отеков играют роль следующие патогенетические факторы: 1. Гидростатический (гидродинамический) фактор. При возрастании гидростатического давления в сосудах увеличивается сила фильтрации, а также поверхность сосуда, через которую происходит фильтрация жидкости из сосуда в ткань. Поверхность же, через которую осуществляется обратный ток жидкости, уменьшается. Происходит накопление и задержка жидкости в тканях. 2. Онкотический фактор. При уменьшении величины онкотического давления крови возникают отеки, механизм развития которых связан с падением величины эффективной онкотической всасывающей силы. Существенное уменьшение величины онкотического давления крови (не менее чем на 1/3) сопровождается выходом жидкости из сосудов в ткани в таких количествах, которые не успевают транспортироваться обратно в общий кровоток, даже несмотря на компенсаторное усиление лимфообращения. Происходит задержка жидкости в тканях и формирование отека. 3. Проницаемость сосудистой стенки. Увеличение проницаемости сосудистой стенки способствует возникновению и развитию отеков. Такие отеки по механизму развития называются мембраногенными. 4. Лимфообращение (лимфатический фактор). Затруднение транспорта жидкости и белков по лимфатической системе из интерстициального пространства в общий кровоток создает благоприятные условия для задержки воды в тканях и развития отеков. К нарушениям тромбоцитарного гемостаза относятся тромбоцитопении - уменьшение количества тромбоцитов менее 150-109/л, и тромбоцитопатии - качественные дефекты тромбоцитов, связанные с нарушением их структуры и функций. Тромбоцитопении по патогенезу классифицируются на 4 основные группы: 1. Тромбоцитопении вследствие патологии тромбоцитопоэза. К этой группе относятся наследственные тромбоцитопении (аутосомно-доминантная тромбоцитопения, Х-сцепленные синдромы Вискотта-Олдрича, Фанкони и др.) и приобретенные формы тромбоцитопений, которые обнаруживаются при аплазии костного мозга. 2. Тромбоцитопении вследствие повышения разрушения тромбоцитов. В данную группу включены иммунные тромбоцитопении (аутоиммунные, аллергические). 3. Тромбоцитопении вследствие повышения потребления тромбоцитов. К тромбоцитопениям потребления относят ДВС-синдром. 4. Перераспределительные тромбоцитопении. Тромбоцитопатии могут быть наследственными (первичными) и симптоматическими (вторичными). В основе первичной дисфункции тромбоцитов, обусловливающей развитие геморрагических диатезов, лежат следующие основные патогенетические факторы: 1) дефекты поверхностной мембраны, связанные с отсутствием или блокадой на мембране тромбоцитов рецепторов, взаимодействующих со стимуляторами (агонистами) их адгезии и агрегации; 2) нарушение дегрануляции (реакции освобождения) тромбоцитов; 3) дефицит стимуляторов агрегации в гранулах тромбоцитов. Предсердная тахикардия. Задача Больная А., 16 лет, обратилась к врачу с жалобами на головную боль, озноб, "ломоту" в теле и икроножных мышцах, высокую температуру в утреннее и вечернее время. При осмотре: кожные покровы бледные, сухие, температура тела – 390С, озноб, пульс - 100 ударов в минуту, АД 140/95 мм рт.ст. Больной поставлен диагноз: грипп. Вопросы: 1. Какая стадия лихорадочной реакции была у больной во время осмотра. 2. Чем обусловлены изменения со стороны сердечно – сосудистой системы? 3. Как изменяется теплоотдача и теплообразование при повышении температуры тела? 4. Какой вид лихорадочной реакции наблюдается у больной? Типы лихорадочных кривых. 5. В какой стадии лихорадочной реакции баланс терморегулирующих процессов устанавливается на уровне, обеспечивающем сохранение повышенной температуры? Задача Стадия подъема температуры. Активация симапато-адреналовой системы. Теплообразование увеличивается, теплоотдача снижается. Типы лихорадочных кривых: постоянный, ремитирующий, перемежающийся, изнуряющий, возвратный, атипичный. У больной, скорее всего, ремитирующий тип. Во второй стадии – стояния температуры. Билет № 27 Ацидозы. Определение понятия. Виды. Причины и механизмы развития. Механизмы компенсации. Показатели КЩР. Хронические гепатиты. Причины, патогенез Поставьте диагноз по клиническому анализу крови. Эритроциты 4,5x1012/л Гемоглобин 140 г/л Цветовой показатель 0,93 Ретикулоциты10°/оо Объём эр. 100 фл Тромбоциты 200х109/л Лейкоциты 15,6х109/л Формула - Нейтрофилы: Миелобласты 0% Промиелоциты 0% Миелоциты 0% Юные 10% Палочкоядерные 14% Сегментоядерные 61 Эозинофилы 1% Базофилы 0% Лимфобласты 0% Лимфоциты 12% Моноциты 2% СОЭ 25 мм/ч Гематокрит 0,45 л/л В мазке: нейтрофилы с токсигенной зернистостью. В зависимости от механизмов развития нарушений КОС выделяют газовые (дыхательные, респираторные) и негазовые (метаболические, обменные) ацидозы. Газовый (дыхательный, респираторный) ацидоз характеризуется накоплением в крови углекислоты. Причинами острого дыхательного ацидоза могут стать: 1) высокая концентрация СО2 во вдыхаемом воздухе; 2) повышение сопротивления дыхательных путей (бронхоспазм, ларингоспазм, аспирация); 3) нарушения дыхательной функции легких (тяжелая пневмония, пневмоторакс, гемоторакс, отек легких); 4) угнетение дыхательного центра (анестетики, седативные препараты, черепно-мозговая травма, инфаркт головного мозга); 5) нервно-мышечные расстройства (приступ миастении, курареподобные вещества, токсины); 6) системные нарушения кровообращения (сердечная недостаточность, массивная тромбоэмболия); 7) ятрогенные воздействия: неадекватная механическая вентиляция легких, избыточное введение в организм СО2 (карбонаркоз) и др. Хронический дыхательный ацидоз может быть обусловлен: 1) угнетением дыхательного центра (опухоль мозга, хроническая передозировка седативных препаратов); 2) нарушениями нервно-мышечной передачи (рассеянный склероз, полиомиелит, мышечная дистрофия, повреждения спинного мозга); 3) хроническими обструктивными заболеваниями легких (эмфизема, хронический бронхит); 4) ограничением движений, вызывающим снижение вентиляции (кифосколиоз, ожирение). Возрастание парциального давления СО2 ведет к повышению возбудимости дыхательного центра, развитию одышки и выведению из организма избытка углекислого газа в более или менее достаточной степени. Особенностью функционирования буферных систем в условиях газового ацидоза является повышенная емкость бикарбонатного буфера, обусловленная высокой концентрацией в крови СО2. Негазовый (метаболический) ацидоз - наиболее часто встречающееся в клинической практике изменение КОС, которое может быть вызвано следующими причинами: 1) нарушениями обмена веществ, приводящими к накоплению кислых продуктов (ацетоуксусная, молочная, β-гидроксимасляная и другие кислоты): кетоацидоз при сахарном диабете, нарушении функций печени, голодании, гипоксии и пр.; лактатацидоз при гипоксии, инфекциях, нарушениях функций печени; накопление органических и неорганических кислот при катаболических состояниях: травмах, ожогах, воспалительных процессах; 2) задержкой кислот или повышенным выведением щелочей при заболеваниях почек (почечный канальцевый ацидоз тип II, диффузный нефрит, обессоливающий нефрит, уремия, интоксикация сульфаниламидами); 3) потерей бикарбоната через фистулы, при диарее, дренировании поджелудочной железы; 4) длительным приемом кислот с пищей или отравлением кислотами, а также приемом некоторых лекарственных препаратов. Хронический гепатит - диффузное воспалительно-дистрофическое хроническое поражение печени различной этиологии, морфологически характеризующееся дистрофией печеночных клеток, гистиолимфоплазмоцитарной инфильтрацией и умеренным фиброзом портальных трактов, гиперплазией звездчатых эндотелиоцитов при сохранении дольковой структуры печени. Выделяют 8 типов хронического гепатита: 1. Вирусный гепатит (В, С, D). 2. Лекарственный гепатит. 3. Токсический гепатит. 4. Алкогольный гепатит. 5. Генетически детерминированный или метаболический гепатит (при болезни Вильсона-Коновалова, гемохроматозе). 6. Идиопатический (аутоиммунный и др.). 7. Неспецифический реактивный гепатит. 8. Вторичный билиарный гепатит при внепеченочном холестазе. Степень активности процесса устанавливают на основании лабораторных ферментных тестов и морфологического исследования биоптата печени. Среди лабораторных тестов наиболее информативно определение активности аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ). Кроме того, определяется индекс гистологической активности (ИГА), известный так же, как «индекс Knodell», который учитывает в баллах морфологические компоненты хронического гепатита - некрозы внутридольковые или перипортальные, дистрофию, воспалительные инфильтраты, фиброз. При определении степени активности процесса необходимо учитывать внепеченочные проявления. У больных могут наблюдаться гломерулонефрит, узелковый периартериит, артралгии и др. Это может маскировать наличие патологии печени. Стадия хронизации определяется по выраженности и характеру фиброза. Лейкоцитоз с дегенеративным сдвигом лейкоцитарной формулы влево. |
