Билет 1 Предмет, задачи и методы патофизиологии. Ее место и значение в системе медицинских наук. Связь патофизиологии с другими науками
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Задача Больной З.,64 г., поступил с жалобами на общую слабость, носовые кровотечения, боли в левом боку, кашель, температуру. При осмотре: выраженная бледность, геморрагии на коже, прослушиваются хрипы в лёгких. Лабораторные показатели:Hb-50г/л, Э-1,5*10,ретикулоциты-2%, в мазке преобладают макроциты, L-1,2*10 /л,Тр-50*10/л,СОЭ-50 мм/ч. Время кровотечения(ВК) из мелких сосудов резко удлинено. Биопсия костного мозга- резкое снижение числа миелокариоцитов, отмечается преобладание жировой ткани, отмечается относительное преобладание лимфоцитов. Вопросы: 1. Объясните механизм развития анемии у больного. 2. Объясните механизм развития кровоточивости. 3. Объясните причину появлений геморрагий на коже. 4. Чем вызвано воспаление лёгких и высокое СОЭ? 5. Апластические анемии. Причины, механизмы. Роль стволовых клеток, микроокружения в механизмах развития апластических анемий, гематологические показатели, принципы терапии. Задача Замещение кроветворной ткани костного мозга жировой, угнетение эритропоэза. Угнетение тромбоцитопоэза в костном мозге. Нарушение тромбоцитарно-сосудистого гемостаза, тромбоцитопения, развитие геморрагического диатеза. Нарушение реактивности организма. Апластические анемии – анемии, развивающиеся вследствие нарушения гемопоэза на ранних стадиях. Причины - врожденные (анемия Фанкони), действие ионизирующего излучения, химических веществ, лекарственных препаратов, вирусных инфекций, метастазы в костный мозг. Механизм – дозозависимая гибель стволовых клеток, панмиелофтиз – замещение кроветворной ткани костного мозга жирвой. Гематологические проявления: панцитопения, нормохромия, снижение гематокрита, резкое снижение ретикулоцитов, анизоцитоз, пойкилоцитоз. Принципы терапии – трансплантация костного мозга, заместительная терапия. Билет № 14 Основные плазменные медиаторы воспаления. Их характеристика (образование, активация, действие). Обструктивная легочная патология, этиология, патогенез. Изменения вентиляционных показателей. Какое нарушение представлено на иммунограмме? CD3 37(норма 50-70%), CD4 28 (норма 35-45), CD8 9 (норма 15-25), CD20 14 (норма 10-15%), IgA 1,2 (норма 0,8-2,8), IgG 11,6 (норма 5,4-16,1), IgM 0,8 (норма 0,5-1,9) Все гуморальные медиаторы воспаления являются предсуществующими, т.е. имеются в виде предшественников до активации последних или их концентрация при воспалении резко увеличивается; к ним относятся комплемент, кинины, С-реактивный протеин, лизоцим. Система комплемента. Это сложная система из 11 сывороточных белков, представляющих из себя каскадно действующие протеазы. При банальном воспалении комплемент активируется по «альтернативному пути». Активация начинается с расщепления С3 на С3а (анафилотоксин) и С3b. Активаторами могут быть эндотоксины бактерий, ИК, протеазы и сам С3b. Расщепление С3 вызывают фермент –конвертаза [C3bBb(P)]. Далее С3b расщепляет С5 на С5а (анафилотоксин) и С5b, который, в свою очередь связывается с С6 и С7 с образованием комплекса [C5b67]. Этот комплекс с одной стороны является фактором хемотаксиса для фагоцитов, с другой стороны он фиксируется на мембране атакуемой клетки и вызывает присоединение (и активацию) С8 и С9. В результате образуется мембраноатакующий комплекс [C5b6789], который вызывает перфорацию мембраны. Анафилотоксины (С3а, С5а) обладают следующими функциями: способствуют высвобождению содержимого гранул тучных клеток (например, гистамин), активируют фагоциты, их секреторную активность, способны индуцировать хемотаксис фагоцитов (особенно НФ). Таким образом, действие комплемента приводит к лизису клеток бактерий, поврежденных собственных клеток, способствует усилению фагоцитоза иммунных комплексов. Кинины. При повреждении активируется XII фактор (фактор Хагемана), обракзующий активатор плазминогена из преактиватора. Активатор плазминогена, в свою очередь, действует на плазминоген с образованием активного плазмина (который активно участвует в процессах активации комплемента по альтернативному пути и фибринолиза). В то же время XII фактор и плазмин способны преобразовывать прекалликреин плазмы в калликреин. В тканях каллекриин секретируется под воздействием клеточных протеаз. Калликреин отщепляет от кининогена (синтезируемого в печени и присутствующего в плазме в больших количествах) активные кинины – каллидин, брадикинин, кинин С. Кинины способны вызывать следующие эффекты: расширяют сосуды, вызывая сосудистую реакцию, увеличивают проницаемость капилляров, стимулируют миграцию макрофагов, воздействуя на нервные окончания вызывают боль, освобождают цитокины, такие как ИЛ-1, фактор некроза опухоли ( TNFa ), простагландины и лейкотриены , образуемые в результате активации фосфолипазы А2 кининами. Обструктивный тип альвеолярной гиповентиляции. Этот вид альвеолярной гиповентиляции связан со снижением проходимости (обструкцией) дыхательных путей. При этом препятствие движению воздуха может быть как в верхних, так и в нижних дыхательных путях. Причинами обструкции дыхательных путей являются: 1) Обтурация просвета дыхательных путей инородными твердыми предметами, жидкостями и запавшим языком при бессознательном состоянии больного (например, при коме); 2) Нарушение дренажной функции бронхов и легких (при гиперкринии - гиперсекреции слизи бронхиальными железами, дискринии - повышении вязкости секрета); 3) Утолщение стенок верхних и нижних дыхательных путей (при аллергии, воспалении, при росте опухолей); 4) Спазм мускулатуры бронхов и бронхиол при действии аллергенов, лекарств (холиномиметиков, -адреноблокаторов), раздражающих веществ (фосфорорганических соединений, сернистого газа); 5) Ларингоспазм (спазм мышц гортани); 6) Сдавление (компрессия) верхних дыхательных путей извне (заглоточный абсцесс, опухоль щитовидной железы). Обструктивная гиповентиляция легких характеризуется следующими показателями: 1. При уменьшении просвета дыхательных путей увеличивается сопротивление движению воздуха по ним ; 2. Увеличивается работа дыхательных мышц по преодолению возросшего сопротивления движению воздуха, особенно во время выдоха. Дыхательный акт при бронхиальной обструкции проявляется экспираторной одышкой; 3. Увеличивается ООЛ, так как поступление воздуха в альвеолы начинает превышать изгнание его из альвеол. Отмечается увеличение отношения ООЛ/ОЕЛ; 4. ЖЕЛ долгое время остается нормальной. Снижаются МОД, МВЛ, ОФВ1 (объем форсированного выдоха за 1 с), индекс Тиффно; 5. В крови развиваются гипоксемия (так как при гиповентиляции уменьшается оксигенация крови в легких), гиперкапния (при гиповентиляции уменьшается выведение СО2 из организма), газовый ацидоз; 6. Кривая диссоциации оксигемоглобина смещается вправо (снижаются сродство гемоглобина к кислороду и оксигенация крови), и поэтому явления гипоксии в организме становятся еще более выраженными. Иммунодефицит по Т-клеточному звену иммунитета. Задача Больной 58 лет, страдающий атеросклерозом коронарных сосудов, в течение нескольких лет отмечал появление стенокардии ежедневно 1-2 раза при ходьбе. В течение последней недели число приступов постепенно увеличивалось и достигло 10-15 в день. Тяжесть приступов не изменилась, они прекращались после снятия нагрузки, иногда – после приема нитроглицерина. К врачам не обращался, антиангинальных препаратов не принимал. В день госпитализации на улице развился тяжелый ангинозный приступ, не купировавшийся нитроглицерином. При поступлении: больной бледен, испуган, жалуется на сильные боли за грудиной. АД - 90/60 мм рт. ст., пульс - 100 уд. в мин. На ЭКГ – в отведениях I, aVL, V1- V4 - высокий подъем ST, "ишемический" Т в V1- V6. На ЭХО-грамме - истончение стенки левого желудочка, там же выявляется участок акинезии. В крови увеличен уровень миоглобина и тропонина, нейтрофильный лейкоцитоз. Температура тела-38,2°С. Вопросы: 1. Каковы причины необратимой ишемии миокарда передней стенки левого желудочка у больного? 2. Какие проявления ответа острой фазы имеют место у больного, их механизм? 3. Каковы проявления резорбтивно-некротического синдрома и его механизм? 4. Каков патогенез болевого синдрома при необратимой ишемии миокарда? 5. Механизмы нарушений электрогенеза миокарда при инфаркте. ЭКГ-проявления. Задача Атеросклероз, тромбоз, длительный ангиоспазм коронарных артерий. Повышение температуры тела – связано с образованием эндогенных пирогенов в очаге ишемии. Увеличение в крови тропонина и миоглобина – связано с некрозом сердечной мышцы. Переход в зоне ишемии аэробного типа обмена веществ на анаэробный, накопление кислых продуктов – раздражение нервных окончаний. Зона некроза – патологический (глубокий) зубец Q, зона паранекроза – подъем сегмента ST, зона ишемии – инверсия зубца T. Проявления на ЭКГ связаны с нарушением проводимости импульса, сократимости сердечной мышцы в зоне инфаркта, развитием синдрома незавершенной диастолы. Билет № 15 Основные клеточные медиаторы воспаления. Их характеристика (образование и действие). Рестриктивная легочная патология. Этиология, патогенез. Изменения вентиляционных показателей. Поставьте диагноз по клиническому анализу крови. Эритроциты 2,8х 1012/л Гемоглобин 90 г/л Цветовой показатель 0,96 Ретикулоциты 1°/оо Объём эр. 100фл Тромбоциты 90х109 /л Лейкоциты 12х109 /л Формула - Нейтрофилы: Миелобласты 0% Промиелоциты 0% Миелоциты 0% Юные 0% Палочкоядерные 1% Сегментоядерные 20% Эозинофилы 0% Базофилы 0% Лимфобласты 38% Лимфоциты 40% Моноциты 1% СОЭ 28 мм/ч Гематокрит 0,28 л/л В мазке: анизоцитоз+-; пойкилоцитоз+. Основными источниками клеточных медиаторов являются: 1) Нейтрофилы, которые выделяют активные формы кислорода, катионные белки, Нейтрофилы образуют простагландины и другие эйкозаноиды. 2. Макрофаги синтезируют простогландины, а также тромбоксаны и лейкотриены (LT). Поскольку PGE2 препятствует высвобождению клеточных медиаторов воспаления и подавляет агрегацию тромбоцитов, макрофаги, помимо провоспалительной, обладают и противовоспалительной функцией. Макрофаги синтезируют различные компоненты комплемента, обладают свертывающей и фибринолитической активностью.3. Эозинофилы служат отрицательными модуляторами воспаления. Они содержат гистаминазу, кининазу, ферменты, расщепляющие лейкотриены С и D (лизофосфалипазу, арилсульфатазу В, фосфолипазу D), главный щелочной белок, осуществляющий цитотоксическую функцию и нейтрализующий гепарин. 4. Тучные клетки и базофилы выделяют гистамин и серотонин, гепарин, факторы хемотаксиса нейтрофилов и эозинофилов, фактор активации тромбоцитов, протеолитические ферменты, они продуцируют пероксидазу, супероксид и пероксид водорода, а также протеазу, превращающую кининоген в кинин. 5.Тромбоциты секретируют факторы роста и свертывания, вазоактивные амины и липиды, нейтральные и кислые гидролазы. В основе рестриктивных нарушений вентиляции легких лежит ограничение их расправления в результате действия внутрилегочных и внелегочных причин. а) Внутрилегочные причины рестриктивного типа альвеолярной гиповентиляции обеспечивают снижение дыхательной поверхности или (и) снижение растяжимости легких. Такими причинами являются: пневмонии, доброкачественные и злокачественные опухоли легкого, туберкулез легкого, резекция легкого, ателектазы, альвеолиты, пневмосклерозы, отек легкого (альвеолярный или интерстициальный), нарушение образования сурфактанта в легких, повреждение эластина легочного интерстиция (например, при действии табачного дыма). Снижение сурфактанта уменьшает способность легких растягиваться во время вдоха. Это сопровождается увеличением эластического сопротивления легких. В результате глубина вдохов уменьшается, а частота дыхания увеличивается. Возникает поверхностное частое дыхание. б) Внелегочные причины рестриктивного типа альвеолярной гиповентиляции приводят к ограничению величины экскурсий грудной клетки и к снижению дыхательного объема (ДО). Такими причинами являются: патология плевры, нарушение подвижности грудной клетки, диафрагмальные нарушения, патология и нарушение иннервации дыхательной мускулатуры. Рестриктивная гиповентиляция характеризуется следующими показателями: 1. Снижаются ОЕЛ и ЖЕЛ. Индекс Тиффно остается в пределах нормы или превышает нормальные значения. 2. Рестрикция уменьшает ДО и РОвд. 3. Отмечается затруднение вдоха, возникает инспираторная одышка. 4. Ограничение способности легких расправляться и увеличение эластического сопротивления легких приводят к увеличению работы дыхательных мышц, повышаются энергозатраты на работу дыхательной мускулатуры и возникает ее усталость. 5. Снижается МОД, в крови развиваются гипоксемия и гиперкапния. 6. Кривая диссоциации оксигемоглобина смещается вправо. Лимфолейкоз. Нормохромная анемия Задача Больной Н.,36 лет, шахтер, во время планового медицинского осмотра предъявил жалобу на одышку при значительной физической нагрузке. Из медицинской книжки установлено, что он страдает врожденным пороком сердца. До этого времени никаких жалоб не предъявлял. Объективно: больной высокого роста, астенического телосложения. Кожные покровы и видимые слизистые оболочки чистые, розовые. Границы сердца расширены влево и книзу. Сердечный толчок хорошо выражен. При аускультации на грудине выслушивается систолический шум, который распространяется по всей грудной клетке. Второй тон на аорте ослаблен. АД 110/85 мм рт.ст. Пульс 60 в мин. Патологии других внутренних органов не обнаружено. Вопросы: 1. Чем можно объяснить расширение границ сердца у больного? 2. Какие механизмы обеспечивают гипертрофию миокарда? 3. Какая причина вызвала гипертрофию миокарда у больного? 4. Опишите кардиальные и экстракардиальные механизмы компенсации перегрузочной формы сердечной недостаточности. 5. Сердечная недостаточность. Виды, механизмы, проявления. Задача Сердечная недостаточность, врожденный порок сердца. Увеличение интенсивности функционирования структур миокарда, активация энергообразования, синтеза нуклеиновых кислот и белка. Врожденный порок сердца. Кардиальные механизмы: механизм Франка-Старлинга, гомеометрическая гиперфункция. Экстракардиальные механизмы: разгрузочные рефлексы Бейнбриджа, Парина, Китаева, активация выделительной функции почек, депонирование крови в печени и селезенке, потоотделение, активация эритропоэза и др. Сердечная недостаточность - неспособность сердца выполнять насосную функцию вследствие существенного снижения сократительной способности миокарда, а также поражения клапанов сердца или пороков развития системы кровообращения. Причины: 1) первичное поражение миокарда, приводящее к нарушению его сократимости. (при ИБС, дилатационной кардиомиопатии, миокардитах, миокардиодистрофиях); 2) перегрузка давлением в фазу систолы. (при артериальной гипертензии или аортальном стенозе); 3) перегрузка объемом в фазу диастолы (при аортальной или митральной недостаточности, дефекте межжелудочковой перегородки); 4) снижение наполнения желудочков (при гипертрофической кардиомиопатии, изолированном митральном стенозе, экссудативном перикардите); 5) высокий сердечный выброс (при тиреотоксикозе). Классификация сердечной недостаточности: выделяют левожелудочковую и правожелудочковую сердечную недостаточность, острую и хроническую сердечную недостаточность. Кроме того, мердечная недостаточность бывает: 1) миокардиальная, которая обусловлена первичным поражением мышцы сердца физическими, химическими, биологическими факторами или дефицитом субстратов метаболизма; 2) перегрузочная, которая развивается на фоне повышенной работы миокарда по преодолению избыточного давления на путях изгнания крови из камер сердца; в связи с перегрузкой сердца увеличенным объемом крови или при сочетании этих двух факторов. Билет № 16 Определение аллергии. Аллергены. Определение. Классификация аллергенов. Стадии развития аллергической реакции. Классификация аллергических реакций по Джеллу и Кумбсу, модификация классификации Ройта. Острый гастрит. Причины, патогенез. Укажите тип лихорадочной кривой. 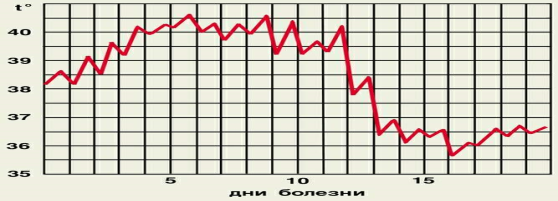 Аллергия - это типовой иммунопатологический процесс, развивающийся при контакте с антигеном (гаптеном) и сопровождающийся повреждением структуры и функции собственных клеток, тканей и органов. Вещества, вызывающие аллергию, называют аллергенами. Наиболее частыми этиологическими факторами, приводящими к развитию аллергии, являются: 1. Инфекционные 2. Пыльца растений. 3. Домашняя пыль. 4. Яды кровососущих насекомых. 5. Химические вещества, металлы. 6. Лекарственные препараты. В развитии аллергии три стадии. I. Стадия иммунных реакций (иммунологическая). Характеризуется образованием иммунного комплекса. II. Стадия биохимических реакций (патохимическая). Суть ее состоит в выделении готовых и образовании новых биологически активных веществ (медиаторов аллергии) III. Стадия клинических проявлений (патофизиологическая). Представляет собой ответную реакцию клеток, органов и тканей организма на образовавшиеся в предыдущей стадии медиаторы. Наиболее распространена классификация аллергии по Gell и Coombs, согласно которой выделяют аллергические реакции, развивающиеся по I (реагиновому, анафилактическому), II (цитотоксическому), III (иммунокомплексному) и IV (клеточно-опосредованному) типам иммунного повреждения. Ройт внес модификацию в эту классификацию, добавив V тип аллергии. I тип (анафилактический, реагиновый). Эти реакции характеризуются выработкой антител классов IgE, IgG4, называемых реагинами, которые фиксируются на тучных клетках и базофилах. При повторном попадании аллергена происходит образование иммунного комплекса прямо на поверхности тучных клеток, результатом чего является их активация и дегрануляция. По этому механизму развиваются: атопическая бронхиальная астма, поллиноз, крапивница, отек Квинке, анафилактический шок. II тип (цитотоксический). При этом типе реакции синтезируемые плазмоцитами антитела относятся к классу IgG и IgM/ Они образуют иммунный комплекс с клеточно –ассоциированными антигенами. А клетки–мишени, экспрессирующие эти антигены становятся объектом цитолиза с участием комплемента и клеток-эффекторов. По этому механизму развиваются лекарственная аллергия, аллергическая цитопения и т.д. III тип (тип Артюса, иммуннокомплексный). В данном случае реакция образования иммунного комплекса протекает с участием тех же антител, но вне связи с клетками. Решающее значение имеет активация комплемента. Пример – сывороточная болезнь, феномен Артюса. IV тип (замедленная гиперчувствительность). Эта реакция происходит между эффекторными Т-лимфоцитами и антигеном, при основными медиаторами являются лимфокины. К реакциям этого типа можно отнести многие инфекционно-аллергические и аутоиммунные болезни. Острый гастрит - полиэтиологическое заболевание, обусловленное химическими, механическими, термическими и бактериальными причинами. Патогенез сводится к дистрофически-некробиотическому повреждению поверхностного эпителия и железистого аппарата слизистой оболочки желудка и развитию в ней воспалительных изменений. Воспалительный процесс может ограничиваться поверхностным эпителием слизистой оболочки или распространяться на всю толщу слизистой оболочки, интерстициальную ткань и даже мышечный слой стенки желудка. Острый гастрит часто протекает как острый гастроэнтерит или острый гастроэнтероколит. Различают простой (банальный, катаральный), коррозийный и флегмонозный гастрит. Гастрит простой встречается наиболее часто. Причиной экзогенного гастрита являются погрешности в питании, пищевые токсикоинфекции, раздражающее действие некоторых лекарств, пищевая аллергия (на землянику, грибы и др.) и т. д. Эндогенный острый гастрит возникает при острых инфекциях, нарушениях обмена веществ и массивном распаде белков (при ожогах). Острое раздражение желудка может развиваться при тяжелых радиационных поражениях. При катаральном гастрите имеют место инфильтрация лейкоцитами поверхностного, местами дистрофически, некробиотически измененного эпителия, а также признаки воспалительной гиперемии. Постоянный тип лихорадки. |
