Патфиз ч.2. Патфиз ч. Гл. 11 Нарушения водного обмена Гл. 12 Нарушения ионного обмена
 Скачать 7.84 Mb. Скачать 7.84 Mb.
|
|
ФАГОЦИТИРУЮЩИЕ КЛЕТКИ Фагоциты выполняют не только защитные (поглощают и разрушают чужеродные агенты), но и дренажные функции (удаляют погибшие и деградировавшие структуры организма). Фагоциты представлены клетками миелопоэтического ряда (полиморфноядерные лейкоциты) и макрофагально-моноцитарной системы (моноциты, тканевые макрофаги). Основные свойства фагоцитирующих клеток представлены в табл. 16–5. Таблица 16–5. Характеристики фагоцитирующих клеток
Фагоциты непосредственно участвуют в осуществлении важных процессов: • Инициации иммунных реакций. Поглощая чужеродные агенты, макрофаги «перерабатывают» их (процессинг) и «представляют» (презентация) иммунокомпетентным клеткам. При этом макрофаги выделяют цитокины, активирующие лимфоциты. • Выполнении антителозависимого цитолиза. Это происходит благодаря экспрессии на поверхности фагоцита рецептора Fc-фрагмента IgG (CD16). ДРУГИЕ ФАКТОРЫ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ИНТЕРФЕРОНЫ Система интерферона (ИФН) — важнейший фактор неспецифической резистентности организма человека. Интерфероны выполняют антивирусную, противоопухолевую, иммуномодулирующую и радиопротективную функции. Различают три класса ИФН: По способу образования различают ИФН типа I (образуется в ответ на обработку клеток вирусами, молекулами двухцепочечной РНК, полинуклеотидами и рядом низкомолекулярных природных и синтетических соединений) и ИФН типа II (продуцируется лимфоцитами и макрофагами, активированными различными индукторами; действует как цитокин). ИФН видоспецифичны. Каждый биологический вид, способный к их образованию, продуцирует свои уникальные продукты, похожие по структуре и свойствам, но не способные проявлять перекрёстный антивирусный эффект (то есть действовать в условиях организма другого вида). Механизм антивирусного действия. ИФН блокирут процессы проникновения и/или репродукции вирусов. Блокада репродуктивных процессов при проникновении вируса в клетку обусловлена угнетением трансляции вирусной мРНК. При этом противовирусный эффект ИФН не направлен против конкретных вирусов, то есть ИФН не обладают вирусоспецифичностью. ИФН I. Основной биологический эффект — подавление синтеза вирусных белков; способны воздействовать на другие этапы репродукции вирусных частиц, включая отпочковывание дочерних популяций. «Антивирусное состояние» клетки развивается в течение нескольких часов после введения интерферонов или индукции их синтеза. При этом интерфероны не влияют на ранние этапы репликативного цикла (адсорбцию, пенетрацию и «раздевание» вирусов) — противовирусное действие проявляется даже при заражении клеток инфекционными РНК. ИФН не проникают в клетки, а взаимодействуют со специфическими мембранными рецепторами (ганглиозиды или аналогичные структуры, содержащие олигосахара). По связыванию ИФН с рецептором и реализации его эффектов механизм активности напоминает действие некоторых гликопептидных гормонов. ИФН активирует гены, некоторые из которых кодируют образование продуктов с прямым антивирусным действием — протеинкиназы и олигоаденилат синтетазы. ИФН II ( ЕСТЕСТВЕННЫЕ АТ Естественные АТ («антигеннезависимые», «неспецифические» АТ) составляют до 7% общего количества иммуноглобулинов в сыворотке крови неиммунизированных людей и животных. Их происхождение связывают с ответом иммунной системы на Аг нормальной микрофлоры. В эту же группу входят АТ, длительно циркулирующие после выздоровления от инфекционного заболевания. Часть пула подобных АТ синтезируется параллельно с образованием специфических АТ. Эти АТ низкоспецифичны, но способны перекрёстно реагировать с широким спектром Аг. Вызывают агглютинацию микробов, их разрушение (в присутствии комплемента), нейтрализуют вирусы и токсины, стимулируют фагоцитарные реакции (через опсонизацию возбудителей). ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ Помимо фагоцитирующих клеток, важную роль в быстром реагировании организма на чужеродные Аг играют естественные киллеры (NK-клетки). Эту популяцию составляют большие зернистые лимфоциты, элиминирующие ауто-, алло- и ксеногенные опухолевые клетки; клетки, инфицированные вирусами и бактериями, а также простейшими. NK-клетки не имеют основных маркёров лимфоцитов (поэтому их также называют нулевые лимфоциты), но экспрессируют дифференцировочные CD2, CD56 и CD16 (рецептор Fc-фрагмента АТ) Аг. ИММУНОПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ И РЕАКЦИИ Расстройства механизмов ИБН за индивидуальным и однородным составом организма проявляются разнообразными иммунопатологическими состояниями и реакциями (рис. 16–6). 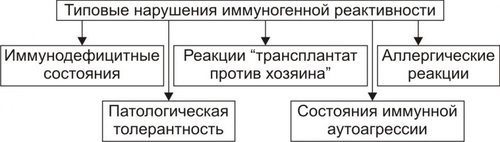 Рис. 16–6. Типовые нарушения иммуногенной реактивности. Иммунодефицитные состояния, патологическая толерантность, реакции «трансплантат против хозяина» являются следствием дефекта или нарушения деятельности одного или нескольких звеньев системы ИБН, обеспечивающих в норме эффективный иммунный ответ. ЭТИОЛОГИЯ Иммунопатологические состояния могут быть первичными или вторичными. • Причиной первичных нарушений является наследуемый или врождённый дефект генетической программы иммунокомпетентных клеток, а также клеток, обеспечивающих неспецифическую защиту организма. • Причиной вторичных нарушений являются расстройства, возникающие после рождения на разных этапах онтогенеза индивида. Они развиваются в результате повреждения клеток системы ИБН, имевших нормальную генетическую программу под влиянием факторов различной природы: † Физической (например, высокой дозы рентгеновского излучения или свободных радикалов). † Химической (в частности, цитостатических агентов или перекисных соединений). † Биологической (например, значительного повышения уровня в крови глюкокортикоидов, повреждения клеток иммунной системы вирусами, бактериями, чужеродными клетками и АТ). ПАТОГЕНЕЗ Патогенез иммунопатологических состояний сложен и имеет несколько вариантов развития. • Гипорегенераторный. Этот механизм (например, иммунодефицита и патологической толерантности) заключается в торможении пролиферации стволовых гемопоэтических и/или полипотентных, а также других пролиферирующих предшественников клеток иммунной системы. В результате в организме происходит делеция (удаление) какоголибо клона клеток системы ИБН, а также выраженное в большей или меньшей мере уменьшение общего число иммуноцитов и других факторов системы ИБН. • Дисрегуляторный. Данный механизм нарушений иммунитета обусловлен расстройствами дифференцировки антигенпредставляющих клеток и/или T и/или B-лимфоцитов, а также кооперации этих клеток. Причины двух вышеназванных механизмов: † Изменение соотношения количества и/или эффектов разных категорий иммунокомпетентных клеток (например, увеличение числа супрессоров или уменьшение количества хелперов и индукторов). † Нарушение содержания БАВ (цитокинов различных классов, кортикостероидов, анаболических стероидов и др.) либо числа или чувствительности рецепторов к ним на мембранах иммуноцитов, приводящее к иммунодефициту и патологической толерантности. • Деструктивный (цитолитический). Этот вариант патогенеза состоит в массированном разрушении иммуноцитов. Причины: † Дефект самих иммуноцитов (как следствие мембрано и/или энзимопатий). † Действие на иммунокомпетентные клетки цитолитических агентов (например, АТ, мембраноатакующего комплекса комплемента, больших доз цитостатиков, глюкокортикоидов и др.). При массированном разрушении иммуноцитов развивается лейкопения и различные иммунопатологические состояния. ИММУНОДЕФИЦИТЫ И ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ В основе развития иммунодефицитных состояний и иммунодефицитов, как правило, находятся отсутствие или дефицит клеток иммунной системы и/или расстройства их функций. Это обусловливает высокую частоту развития при иммунодефицитах различных инфекционных, паразитарных, опухолевых и аллергических заболеваний. С другой стороны, при истощающих заболеваниях часто развиваются иммунодефицитные состояния. Иммунодефицитные состояния и иммунодефициты — типовые формы патологии системы ИБН, характеризующиеся снижением эффективности или неспособностью иммунной системы организма к осуществлению реакций деструкции и элиминации чужеродного антигена. ЧАСТОТА ИММУНОДЕФИЦИТОВ И ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЙ • Один из 500 младенцев рождается с дефектом иммунной системы. • Значительно большее количество лиц приобретают преходящий или постоянный иммунодефицит в течение жизни. ФАКТОРЫ РИСКА • Отягощённый семейный анамнез. • Почти все вредные привычки. • Старение. ТЕРМИНОЛОГИЯ Термины «Иммунодефицитное состояние» и «Иммунодефицит» применяют либо как синонимы, либо подразумевают разные патологии. Так, в клинической практике принято различать: • собственно иммунодефициты, или первичные иммунодефициты (развиваются при наличии генетического дефекта). • иммунодефицитные состояния (вторичные иммунодефициты), сопровождающие другие заболевания (в том числе генетические) или развивающиеся при длительных, тяжёлых и хронических заболеваниях различной природы. Иммунодефициты — самостоятельные заболевания (нозологические формы) и сопутствующие синдромы, характеризующиеся недостаточностью иммунной системы. ВИДЫ • Первичные — наследуемые и врождённые (генетические) дефекты иммунной системы. • Вторичные — иммунная недостаточность развивается вследствие эндо- и экзогенных воздействий на нормальную иммунную систему (например, около 90% всех вирусных инфекций сопровождается транзиторной иммунодепрессией). • Избирательные — вызваны селективным поражением различных популяций иммунокомпетентных клеток. • Неспецифические — дефект(ы) механизмов неспецифической резистентности организма (неспецифического иммунитета), фагоцитов и комплемента. • Комбинированные — сочетанное поражение клеточных и гуморальных механизмов иммунитета (например, B- и T-лимфоцитов). В зависимости от преобладания дефекта иммуноцитов того или иного класса, иммунодефициты и иммунодефицитные состояния подразделяют на В, T, Азависимые (относящиеся к антигенпредставляющим клеткам) и смешанные (рис. 16–7). 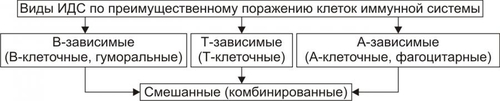 Рис. 16–7. Виды иммунодефицитных состояний (ИДС) и иммунодефицитов по преимущественному поражению клеток иммунной системы. ЭТИОЛОГИЯ • Первичные иммунодефициты проявляются развитием инфекционных поражений организма вскоре после рождения, но могут не иметь клинических проявлений и до более позднего возраста. Причина Генные и хромосомные дефекты (они приводят к многочисленным иммунодефицитам разных классов) • Вторичные иммунодефициты, или иммунодефицитные состояния Причины иммунодефицитных состояний многообразны: † Лекарственные средства с иммуносупрессивным действием (включая фенитоин [дифенин], пеницилламины, глюкокортикоиды). † Недостаточность питания, полостного и мембранного пищеварения, а также кишечного всасывания. † Наркотики и токсические вещества. † Лучевые воздействия, химиопрепараты. † Рост злокачественных опухолей. † Вирусы (например, ВИЧ). † Состояния, приводящие к потере белка (например, нефротический синдром). † Гипоксия. † Гипотиреоз. † Уремия. † Отсутствие селезенки (аспления). ПРИМЕРЫ ИММУНОДЕФИЦИТОВ Существует множество отдельных нозологических единиц иммунодефицитов. Некоторые, наиболее клинически значимые, иммунодефициты представлены на рис. 16–8. 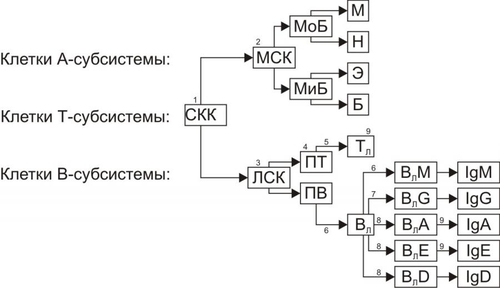 Рис. 16–8. Иммунодефициты, обусловленных блокадой созревания клеток иммунной системы (цифрами обозначены наиболее частые места блокады). Условные обозначения: 1 — ретикулярная дисгенезия; 2 — моноцитопения, фагоцитарная недостаточность (синдром ШедьякаХигаси); 3 — агаммаглобулинемия швейцарского типа; 4 — синдром ДиДжорджи; 5 — синдром ВискоттаОлдрича; 6 — болезнь Брутона (агаммаглобулинемия); 7 — селективный дефицит IgG; 8 — селективный дефицит IgA, IgE, IgD; 9 — синдром ЛуиБар. СКК — стволовая кроветворная клетка; МСК — миелостволовая клетка; ЛСК — лимфостволовая клетка; МоБ — монобласт; МиБ — миелобласт; М — моноцит; Н — нейтрофил; Э — эозинофил; Б — базофил; ПТ — клеткапредшественница T-лимфоцитов; Тл — T-лимфоцит; ПВ — клеткапредшественница B-лимфоцитов; ВЛ — B-лимфоцит; ВЛМ, BЛG, ВЛА, ВЛЕ, ВЛD — соответственно B-лимфоцит, продуцирующий IgМ, IgG, IgА, IgЕ, IgD. СИНДРОМ РЕТИКУЛЯРНОЙ ДИСГЕНЕЗИИ При врождённой алейкии (ретикулярный дисгенез, *267500, СИНДРОМ ШЕДЬЯКАХИГАСИ При аномалии ШедьякаШтайнбринкаХигаси ( |
